
Analizując roztwór jodku kadmu(II) ustalono między innymi, że z 12,1063 g tego
roztworu wytrącono 1,0492 g tlenku kadmu(II). Roztwór ten poddano następnie
elektrolizie w aparacie Hittorfa wyposażonym anodę wykonaną z czystego kadmu
oraz katodę sporządzoną ze srebra. Aparat Hittorfa połączono szeregowo z
kulometrem srebrowym. Po zakończeniu elektrolizy stwierdzono, że w kulometrze
wydzieliło się 671,2 mg srebra. Następnie analizie poddano zawartość przestrzeni
anodowej. Analiza polegała na tym, że do roztworu wprowadzono azotan srebra
wytrącając w sposób jodek srebra, który następnie odsączono, przemyto wodą,
wysuszono i zważono. Masa anolitu wynosiła 17,0938 g, a masa wytrąconego jodku
srebra 6,722. Wyznacz liczbę przenoszenia jonów kadmu oraz jonów jodkowych.
Punktem wyjścia do rozwiązania zadania jest bilans zmian zachodzących w
przestrzeni anodowej związanych z reakcją elektrodową oraz migracją jonów.
Reakcją anodową jest roztwarzanie się materiału elektrodowego, w tym przypadku
kadmu:
−
+
+
→
e
2
Cd
.)
st
(
Cd
2
W przestrzeni anodowej przybywa więc pewna ilość jonów kadmowych. Ilość ta jest
proporcjonalna do ładunku który przepłynął przez elektrolizer, a który warto wyrazić w
w faradajach (F), czyli w jednostkach ładunku równych ładunkowi jednego mola
elektronów. Ze względu na to, że liczba ładunkowa jonu kadmowego wynosi 2+ to
przyrost ilości jonów kadmowych w przestrzeni anodowej równy jest
+
2
Cd
jonów
mola
F
Q
2
1
Jednocześnie do przestrzeni anodowej w wyniki migracji w polu elektrycznym
przybywają jony jodkowe, a ich ilość jest proporcjonalna do ładunku oraz liczby
przenoszenia anionów
−
−
+
I
jonów
mola
F
Q
t
Towarzyszy temu ubytek odpowiedniej ilości kationów
+
+
−
2
Cd
jonów
mola
F
Q
t
2
1
Razem więc
−
−
+
+
+
+
−
I
jonów
mola
F
Q
t
Cd
jonów
mola
F
Q
t
2
1
Cd
jonów
mola
F
Q
2
1
2
2
co można sprowadzić do postaci
−
−
+
−
+
I
jonów
mola
F
Q
t
Cd
jonów
mola
F
Q
t
2
1
2

Równoważny zapis ma postać
mola
F
Q
t
2
1
n
2
CdI
−
=
∆
Ładunek, który przepłynął przez elektrolizer i kulometr srebrowy łatwo
obliczyć. Znana jest masa srebra wydzielonego w kulometrze. Można więc obliczyć
ile to moli
mola
10
2223
,
6
87
,
107
6712
,
0
M
m
n
3
Ag
Ag
Ag
−
⋅
=
=
=
a ładunek wyrazić w faradajach
F
10
2223
,
6
Q
3
−
⋅
=
co można również przedstawić jako
mol
10
2223
,
6
F
Q
3
−
⋅
=
Kolejnym etapem jest wyznaczenie składu roztworu wyjściowego. Trzeba
przecież obliczyć początkową ilość moli soli w anolicie.
Znana jest masa tlenku kadmu wytrąconego z danej ilości roztworu. Ilość
tlenku kadmu równoważna jest ilości jodku kadmu.
CdO
CdI
n
n
3
=
Łatwo obliczyć ilość moli tlenku kadmu
mola
10
171
,
8
40
,
128
0492
,
1
M
m
n
3
CdO
CdO
CdO
−
⋅
=
=
=
masę jodku kadmu
g
9924
,
2
21
,
366
10
171
,
8
M
n
m
3
CdI
CdI
CdI
2
2
2
=
⋅
⋅
=
⋅
=
−
oraz masę wody w analizowanej próbce roztworu
g
1139
,
9
9924
,
2
1063
,
12
m
m
m
2
2
CdI
1
O
H
=
−
=
−
=
Skład roztworu można więc wyrazić jako molalność, czyli ilość moli soli przypadającą
na 1 kg wody
1
1
3
O
H
CdI
kg
mol
89658
,
0
g
1139
,
9
kg
g
1000
mol
10
171
,
8
m
n
m
2
2
−
−
−
⋅
=
⋅
⋅
⋅
=
=
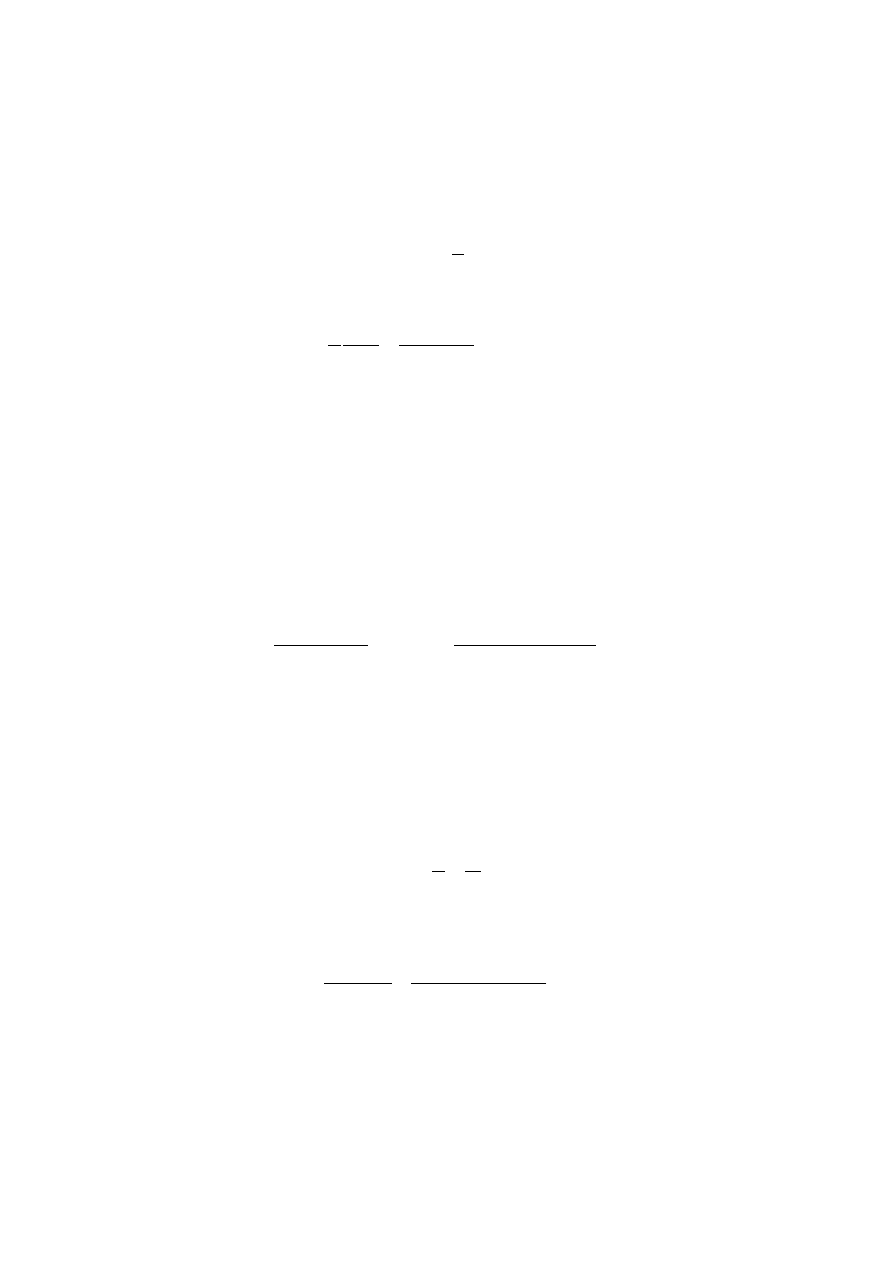
Znając masę wody w roztworze anodowym będzie można obliczyć wyjściową
ilość soli.
Znając masę AgI wytrąconego z roztworu anodowego po zakończeniu
elektrolizy należy obliczyć równoważną ilość moli CdI
2
. Trzeba tylko pamiętać, że
jeden mol CdI
2
równoważny jest dwóm molom AgI, czyli
AgI
CdI
n
2
1
n
2
=
Można więc obliczyć ilość moli
mol
10
4316
,
1
77
,
234
2
722
,
6
M
m
2
1
n
2
AgI
AgI
CdI
2
−
⋅
=
⋅
=
=
następnie masę jodku kadmu
g
2427
,
5
21
,
366
10
4316
,
1
M
n
m
2
CdI
CdI
CdI
2
2
2
=
⋅
⋅
=
⋅
=
−
i masę wody
g
8511
,
11
2427
,
5
0938
,
17
m
m
m
2
2
CdI
2
O
H
=
−
=
−
=
w roztworze anodowym po zakończeniu elektrolizy.
Należy teraz odpowiedzieć na pytanie: ile moli jodku kadmu znajdowało w tej
ilości wody przed rozpoczęciem elektrolizy?
mol
010625
,
0
kg
g
1000
kg
mol
89658
,
0
8511
,
11
kg
g
1000
m
m
n
1
1
1
O
H
CdI
2
2
=
⋅
⋅
⋅
=
⋅
⋅
=
−
−
−
Można więc obliczyć ile moli CdI
2
przybyło podczas elektrolizy
mol
10
691
,
3
010625
,
0
014316
,
0
n
3
CdI
2
−
⋅
=
−
=
∆
i wykorzystując ostatnie równanie wynikające z bilansu
mola
F
Q
t
2
1
n
2
CdI
−
=
∆
obliczyć liczbę przenoszenia anionu
186
,
1
mol
10
2223
,
6
mol
10
691
,
3
2
F
/
Q
n
2
t
3
3
CdI
2
=
⋅
⋅
⋅
=
∆
⋅
=
−
−
−
Jak wytłumaczyć ten niezwykły na pozór wynik? Przecież liczba przenoszenia
winna być mniejsza od jedności. Co więcej, każdy wie, że
1
t
t
=
+
−
+

a wynika z tego, że liczba przenoszenia kationu kadmowego jest ujemna
186
,
0
t
1
t
−
=
−
=
−
+
Jon kadmowy tworzy z jonami trwałe jony kompleksowe i w roztworze w
którym znajdują się obok siebie oba te jony powstają kolejno kompleksy CdI
+
, CdI
2
,
−
−
2
4
3
CdI
oraz
CdI
. Tylko pierwszy z nich jest kationem i porusza się w kierunku katody.
Dwa ostatnie są posiadają ładunek ujemny – są więc anionami - i poruszają się w
kierunku anody. Co więcej, trwałość kompleksów tetrajodkowych jest na tyle duża, że
przy odpowiednim stężeniu soli zachodzi zjawisko znane jako dysproporcjonacja
koordynacyjna, które można opisać reakcją
−
+
+
→
2
4
2
2
CdI
Cd
CdI
2
Jak widać, 50% jonów kadmowych może istnieć w postaci kompleksów
tetrajodkowych o ładunku ujemnym poruszających się w kierunku anody. Formalnie
poprawna analiza procesów zachodzących podczas elektrolizy musi prowadzić do
„dziwacznych” wartości liczb przenoszenia. Takie właśnie wartości liczb przenosze-
nia doprowadziły swego czasu badaczy do odkrycia zjawiska „dysproporcjonacji
koordynacyjnej”.
© W.Grzybkowski, 2003
Wyszukiwarka
Podobne podstrony:
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
obliczenia i wnioski, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
więcej podobnych podstron