1
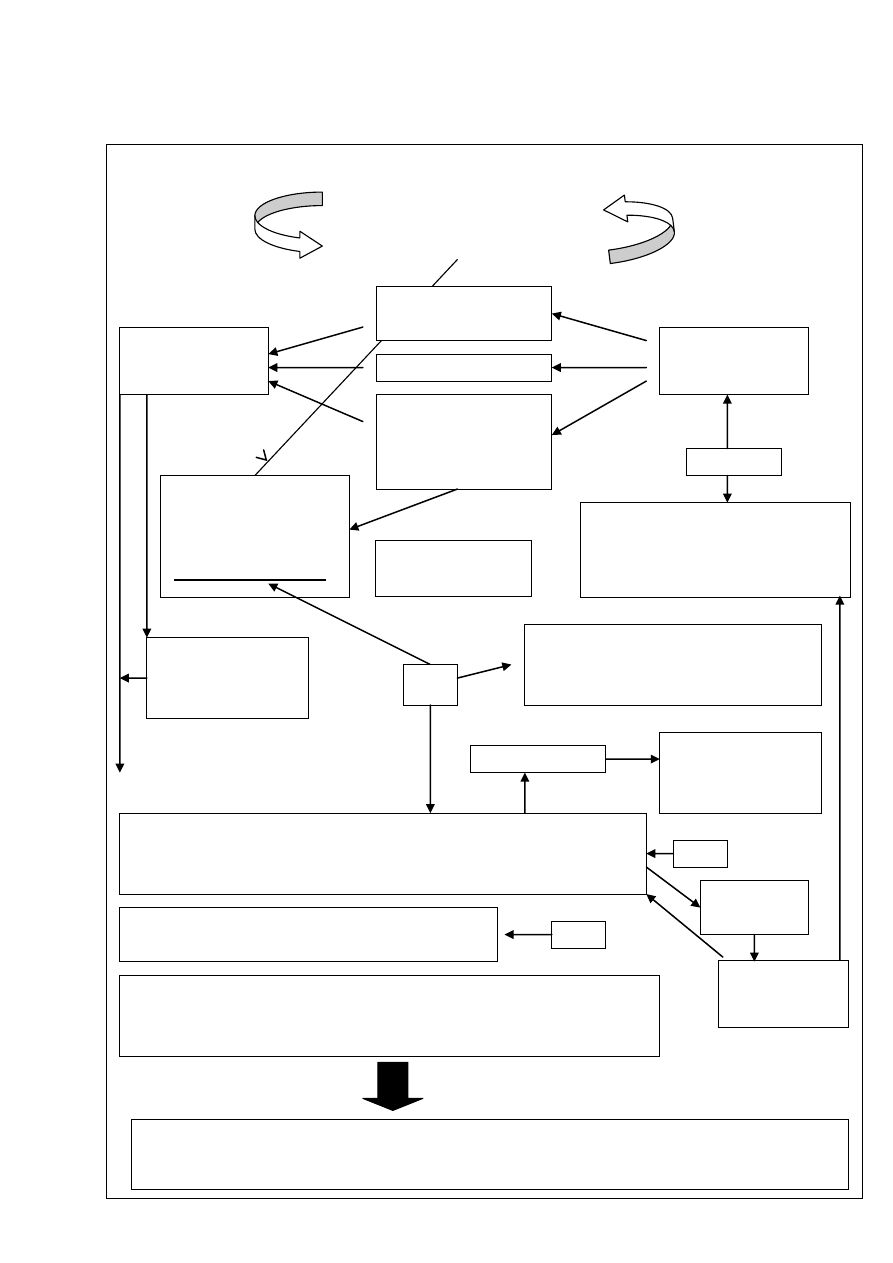
Rycina 1. Patobiochemia procesu zapalnego.
TOKSYNY,
ENZYMY
LIZOSOMALNE
INFEKCJA
i/lub
USZKODZENIE TKANEK
WROTA
INFEKCJI
wzrost
przepuszczalności
ścian naczyń
- komórki tuczne
- bazocyty
- płytki krwi
układ kinin
kaskada kwasu
arachidonowego:
→prostaglandyny
→leukotrieny
C3a, C5a
Objawy zapalenia:
- obrzęk,
- ból,
- zaczerwienienie,
- wzrost temperatury
- leukotrieny,
- C5a, C3a,
- chemokiny
→ ułatwienie fagocytozy,
→ liza bakterii,
→ neutralizacja wirusów i toksyn,
→ cytotoksyczność
zmiany w śródbłonku naczyniowym
→ migracja leukocytów (w tym
limfocytów T→ INFγ), Ab
IL-1
NAPŁYW DO TKANEK:
IL-1, IL-6, TNFα
wątroba:
wytwarzanie białek
ostrej fazy
monocytów, prekursorów makrofagów
→ fagocytoza drobnoustrojów i własnych uszkodzonych komórek
→ wydzielanie cytokin prozapalnych, gł. IL-1, IL-6 i TNFα
neutrofilów, najliczniejszych komórek żernych
→ usuwanie bakterii chorobotwórczych
komórek tucznych, osiadłych w tkankach
→ degranulacja ziarnistości (heparyna i aminy wazoaktywne)
w odpowiedzi na uszkodzenie tkanek i w przebiegu reakcji alergicznej
- usunięcie patogenów,
- procesy naprawcze i/lub gojenie ran (płytki krwi, ukł. krzepnięcia → fibryna;
wit.C
,
fibroblasty → kolagen)
IL-17
prezentacja
antygenu
limfocyty B
→ plazmocyty
→ Ab
skutkiem
powyższych procesów
uwalnianie amin
naczynioruchowych
IL-10: ogranicza
zapalenie
INFγ
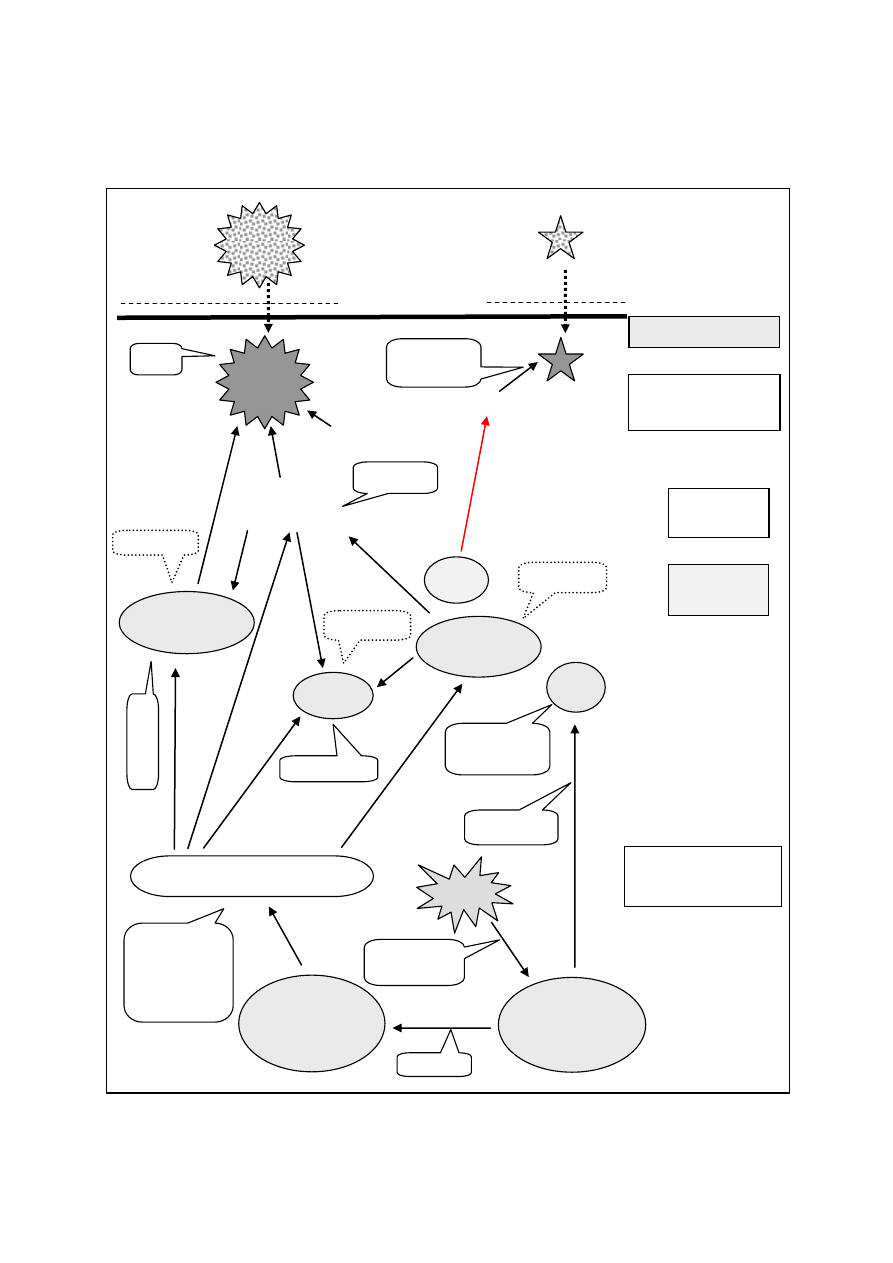
2
Rycina 2. Podstawowe mechanizmy odpowiedzi wrodzonej i nabytej, ściśle
współpracujących w walce z patogenami. IgA – immunoglobulina A, Neu – neutrofil, NK –
komórka natural killer, PDC- plazmocytoidalna komórka dendrytyczna, MDC - mieloidalna
komórka dendrytyczna.
ORGANIZM
DEFENSYNY, IgA
ODPOWIEDŹ
NIESWOISTA
Składowe
humoralne
Składowe
komórkowe
INTERFERON
SKŁADOWE
DOPEŁNIACZA
Hamowanie
replikacji
Liza
LIZOZYM
Aktywacja
MAKROFAG
NEU
KOMÓRKA
TUCZNA
NK
Neutralizacja
toksyn,
wirusów
(np.grypy)
LIMFOCYT
B
LIMFOCYT
T
ODPOWIEDŹ
SWOISTA
Pomoc
Cyto-
toksyczność
Aktywacja
Zapalenie
F
agoc
ytoza
Fagocytoza
PRZECIWCIAŁA
Zapalenie
Zapalenie
.
BAKTERIE
WIRUSY
PDC
MDC
Prezentacja
antygenu

3
Biochemiczne i komórkowe markery procesu zapalnego
.
CYTOKINY
to małe, antygenowo nieswoiste, cząsteczki białkowe odpowiedzialne
zarówno za korzystne, jak i za szkodliwe skutki procesów zapalnych. Wyróżniamy wśród
nich:
interleukiny (m.in. IL-1, IL-6, IL-8, IL-10);
interferony (m.in. INF-α, INF-γ i INF λ);
czynniki stymulujące tworzenie kolonii (GM-CSF, G-CSF, M-CSF, EPO);
czynniki martwicy nowotworów (TNF-α, TNF-β);
chemokiny (m.in. IL-8, GRO).
Komórkami najbardziej wydajnymi w produkcji cytokin są makrofagi i limfocyty T.
Dzięki cytokinom i ich swoistym receptorom powierzchniowym komórki wzajemnie
przekazują sobie informacje. Znanych jest 29 INTERLEUKIN (IL), spośród nich kluczowe
i mające największą szansę na szersze zastosowanie kliniczne, to stymulujące procesy
zapalne: IL-1, IL-6 , IL-8 i IL-17 oraz IL-10 o działaniu przeciwzapalnym.
IL-6
jest jednym z pierwszych mediatorów zapalenia,
potencjalna użyteczność kliniczna IL-6 związana jest z dynamiką zmian jej stężenia w
osoczu - szybkiego wzrostu i krótkiego T
1/2
. Maksymalne stężenie osiągane w ciągu
2 godzin od początku procesu zapalnego,
wyprzedza objawy kliniczne i istotne zmiany we krwi innych markerów procesu
zapalnego, jak prokalcytonina czy CRP,
IL-6 uważana jest za kluczową w patobiochemii stanów zapalnych zagrażających
życiu - zespół uogólnionej reakcji zapalnej (SIRS) i wstrząs septyczny,
IL-6 może wspomóc diagnostykę różnicową i monitorowanie w stanach nagłych, w
ciężkich stanach klinicznych zwłaszcza u noworodków,
wysoka czułość diagnostyczna przy niskiej swoistości (względem przyczyny stanu
zapalnego) wymaga stosowania IL-6 wraz z innymi markerami reakcji ostrej fazy, np.
prokalcytoniną, CRP, liczbą leukocytów z rozmazem.
4
BIAKA OSTREJ FAZY
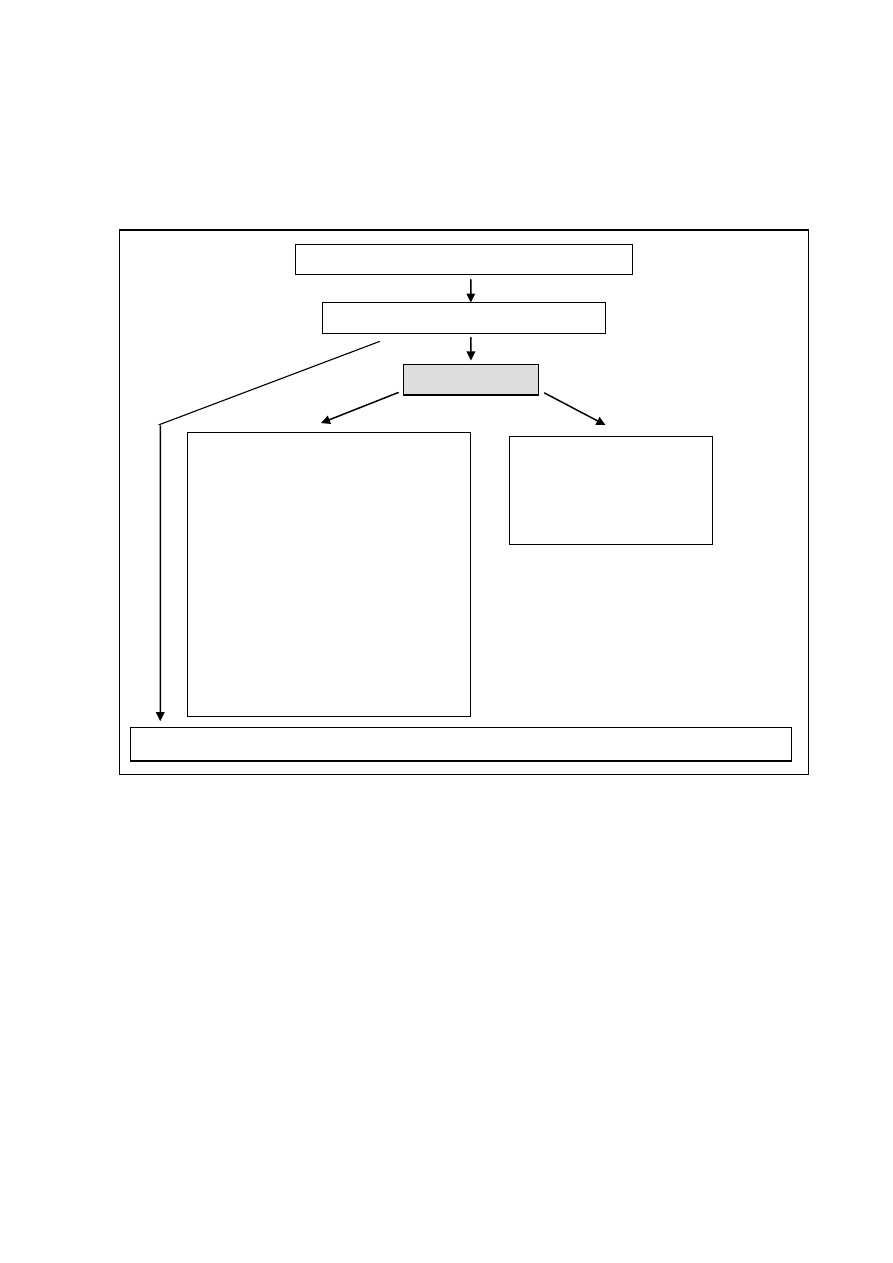
W ciągu 6-10 godzin od zainicjowania procesu zapalnego, rozpoczynają się zmiany stężeń
białek ostrej fazy (b.o.f.) we krwi (Ryc.5).
Ryc.3. Mechanizm powstawania zmian w stężeniach białek ostrej fazy.
INFEKCJA / USZKODZENIE TKANEK
IL-1, IL-6, TNF-α, INF-γ, TGF- α
HEPATOCYT
wzrost produkcji dodatnich b.o.f.:
→ CRP
→ Fibrynogen
→ α2-makroglobulina
→ ferrytyna
→ ceruloplazmina
→ α1-antytrypsyna
→ α1-antychymotrypsyna
→ haptoglobina
→ α1-kwaśna glikoproteina
→ surowiczy amyloid A (SAA)
→ amyloid P (AAP)
→ białka układu dopełniacza i inne
hamowanie produkcji
ujemnych b.o.f.:
→ albumina
→ transferyna
LIMFOCYT B / KOMÓRKA PLAZMATYCZNA – wzrost produkcji immunoglobulin
+
-
+

5
Elektroforeza białek surowicy krwi.
Białka specyficzne. Alb – albumina; α1At -
α1-antytrypsyna; α1Ag - α1 kwaśna glikoproteina; α LP- α-lipoproteiny; α1Ac- α1-
antychymotrypsyna; Cer – ceruloplazmina; Hpt – haptoglobina; α 2-M - α 2-
makroglobulina; βLP - β-lipoproteiny; Tf – transferyna; C3, C4, C5 - składowe
dopełniacza; IgA, IgM, IgD(E)-klasy immunoglobulin; CRP - białko C-reaktywne.
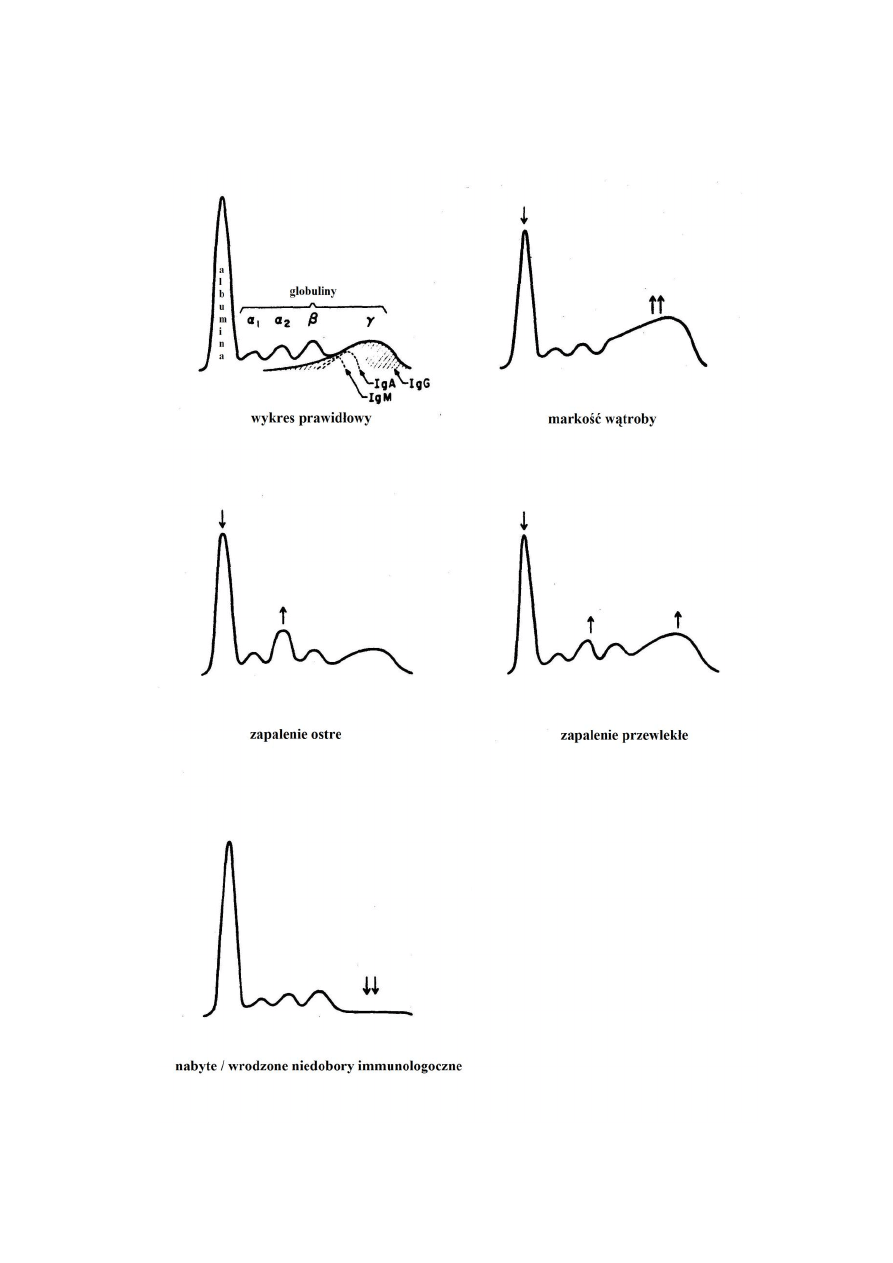
6
Typowe zmiany w elektroforezie białek surowicy w zapaleniach, marskości wątroby i
hipogammaglobulinemii:

7
Białko C-reaktywne
aktywuje układ dopełniacza, a powstająca składowa C5a pobudza
chemotaksję komórek żernych oraz fagocytozę - CRP ułatwia usuwanie patogenów oraz
uszkodzonych komórek własnych. Pobudza makrofagi do produkcji cytokin
przeciwzapalnych.
Wartości referencyjne: do 5 lub 10 mg/l w przypadku tzw. CRP „zapalnego” (zależnie od
laboratorium i metody).
Wartość diagnostyczna: CRP jest b.o.f. o najszybciej (początek po 4-6 godz.) i najbardziej
wzrastającym stężeniu (wzrost: co 8 godz. dwukrotny, maksymalny 10-20-krotny a w
sytuacjach skrajnych nawet 1000-krotny) oraz szybko powracającym do normy (4-5 dni).
CRP służy do wczesnej diagnostyki i monitorowania przebiegu zakażenia, niezależnie
od etiologii, w tym skuteczności antybiotykoterapii. Obserwuje się znacznie większy
wzrost stężenia CRP w ostrych infekcjach bakteryjnych (w zakażeniach ciężkich
zwykle > 50-100 mg/l) niż wirusowej (zwykle < 50 mg/l);
wzrost stężenia CRP nie zawsze koreluje z ciężkością zakażenia, szczególnie w
posocznicy i nie ma wartości rokownicznej;
CRP w zakresie wartości referencyjnych nie wyklucza zapalenia miejscowego lub
infekcji wirusowej o lekkim przebiegu, ale pozwala na wykluczenie ciężkiego
zapalenia o etiologii bakteryjnej;
w przewlekłych procesach zapalnych stężenie CRP może mieścić się w granicach
normy lub nieznacznie ją przekraczać;
u chorych immunoniekompetentnych, np. po przeszczepie szpiku lub w przebiegu
AIDS, wzrost CRP w okresie bezobjawowym sugeruje rozwój infekcji lub odrzucenie
przeszczepu, jeśli brak innych przyczyn reakcji ostrej fazy, jak niedokrwienie, uraz,
itp.;
w posocznicy noworodków podwyższone stężenie CRP w pierwszych 4 godz. życia
przemawia za zakażeniem nabytym wewnątrzmacicznie na min.12-24 godz. przed
porodem, ze względu na fakt, iż CRP nie przenika przez łożysko;
u pacjentów w stanie krytycznym CRP wzrasta również z powodów nieinfekcyjnych,
np. zabiegi operacyjne, urazy, oparzenia, ostre zapalenie trzustki, różne choroby
zapalne.

8
Odczyn Biernackiego (OB.)
Stosowany w medycynie od 1897 roku, jest miarą szybkości opadania krwinek w
niekrzepnącej krwi in vitro. OB jest wprost proporcjonalny do lepkości osocza zależnej od
białek ostrej fazy, szczególnie ↑fibrynogenu i ↑globulin oraz ↓albumin; przyspieszone
opadanie in vitro jest zjawiskiem przejściowym, stąd powinno być ocenione do 4 godzin od
momentu pobrania krwi. Kliniczne przyczyny wzrostu wartości OB obejmują: stany zapalne
(ostre i przewlekłe), chorobę reumatyczną, chorobę nowotworową, ciężkie niedokrwistości,
martwicę tkanek (zawał, uraz, zabieg operacyjny), stany fizjologiczne (ciąża, połóg,
miesiączka, podeszły wiek).
Wartości referencyjne Odczynu Biernackiego OB.
Kobiety
Mężczyźni
noworodki
0 -2 mm/godz
niemowlęta (< 6 m.ż.)
12 - 17 mm/godz
Dorośli ≤ 60 r.ż. 12 mm/godz
8 mm/godz
Dorośli > 60 r.ż. 20 mm/godz 15 mm/godz
Wartość diagnostyczna OB:
wzrasta i obniża się znacznie wolniej niż stężenie CRP - z powodu innej dynamiki zmian
stężeń b.o.f., od których najbardziej zależy;
zwykle wzrasta w stanach zapalnych, w tym infekcyjnych, szczególnie bakteryjnych
(najczęściej do 50 mm/godz, w ciężkich zakażeniach nawet powyżej 50 mm/godz), o
cięższym przebiegu z towarzyszącą gammapatią poliklonalną;
OB ma niewielką wartość diagnostyczną: może być przyspieszone w bezobjawowym
okresie choroby i sprowokować dalszą diagnostykę, w normie - nie wyklucza patologii;
OB jest tanią i czułą analizą do monitorowania aktywności choroby i skuteczności terapii
przy ustalonym rozpoznaniu;
w przypadku niezgodności wartości OB ze stanem klinicznym chorego, zaleca się ocenę
stężenia
białek ostrej fazy oraz morfologii krwi obwodowej.
OB ≥ 100 mm/godz. spotyka się w chorobach rozrostowych, zwłaszcza gammapatiach
monoklonalnych (szpiczak mnogi, makroglobulinemia Waldenströma) oraz w aktywnych
przewlekłych chorobach tkanki łącznej;
PROKALCYTONINA (PCT)
Podczas ciężkiego układowego zapalenia, szczególnie o etiologii bakteryjnej, dochodzi do
stymulacji pozatarczycowej produkcji i uwalniania PCT i N-PCT przez wszystkie

9
zróżnicowane komórki tkanek parenchymalnych, bez wzrostu stężenia kalcytoniny. Wzrost
stężenia PCT jest związany z obecnością endotoksyn bakteryjnych (Gram ujemnych –
lipopolisacharydy LPS, Gram dodatnich - kwas lipotechowy LTA i inne) i/lub mediatorów
procesu zapalnego (TNF-α, IL-1, IL-6, IL-8), które osiągają najwyższe stężenia przed
pojawieniem się PCT w osoczu. INF-γ, wydzielany w odpowiedzi na zakażenie wirusowe,
hamuje produkcję PCT. Prokalcytonina jest nazywana hormokiną, czyli substancją
hormonalną zachowującą się jak cytokina w przebiegu procesu zapalnego.
Znaczenie diagnostyczne wypływa z dynamiki zmian PCT we krwi - wzrost stężenia już
w 3 godzinie od zaistnienia czynnika stymulującego, maksimum w ciągu 24-48 godz. i
następnie obniżanie, gdy następuje eliminacja czynników wywołujących zapalenie (przy
prawidłowej funkcji nerek) innych niż wirusy:
czuły marker rozpoczynającej się infekcji, szczególnie ciężkiej i obarczonej ryzykiem
powikłań – dynamika zmian stężenia większa niż w przypadku CRP;
w infekcjach dolnych dróg oddechowych, również u dzieci oraz gdy gorączka u
niemowląt, PCT ułatwia szybkie różnicowanie (pomiędzy etiologią bakteryjną i inną niż
bakteryjna) oraz podjęcie decyzji o antybiotykoterapii i o ew. hospitalizacji przy zakażeniach
pozaszpitalnych;
istotny wzrost stężenia PCT stwierdza się w układowych infekcjach bakteryjnych
(najwyższe wartości), grzybiczych i pasożytniczych - wzrost PCT koreluje z ciężkością
procesu chorobowego ;
najwyższe stężenia PCT obserwuje się w ciężkich ostrych zakażeniach bakteryjnych
oraz w posocznicy,
wysokie stężenia PCT w posocznicy i SIRS mogą się przejściowo nakładać, jednak
najwyższe wartości PCT osiąga w posocznicy (nawet 1000-krotnie przewyższające wartości u
osób zdrowych);
wtórna infekcja bakteryjna daje nagły, istotny wzrost PCT w porównaniu z oznaczeniem z
dnia poprzedniego;
różnicowanie objawów zapalenia u pacjentów poddawanych immunosupresji, np. w
chorobach układowych – zaostrzenie choroby podstawowej czy nakładająca się infekcja;
w transplantologii – odróżnienie ostrej infekcji (↑ PCT) od reakcji odrzucenia przeszczepu
(PCT bez zmian);
w każdym przypadku stężenie PCT należy odnieść do objawów klinicznych oraz wyników
innych testów, w tym mikrobiologicznych;
10
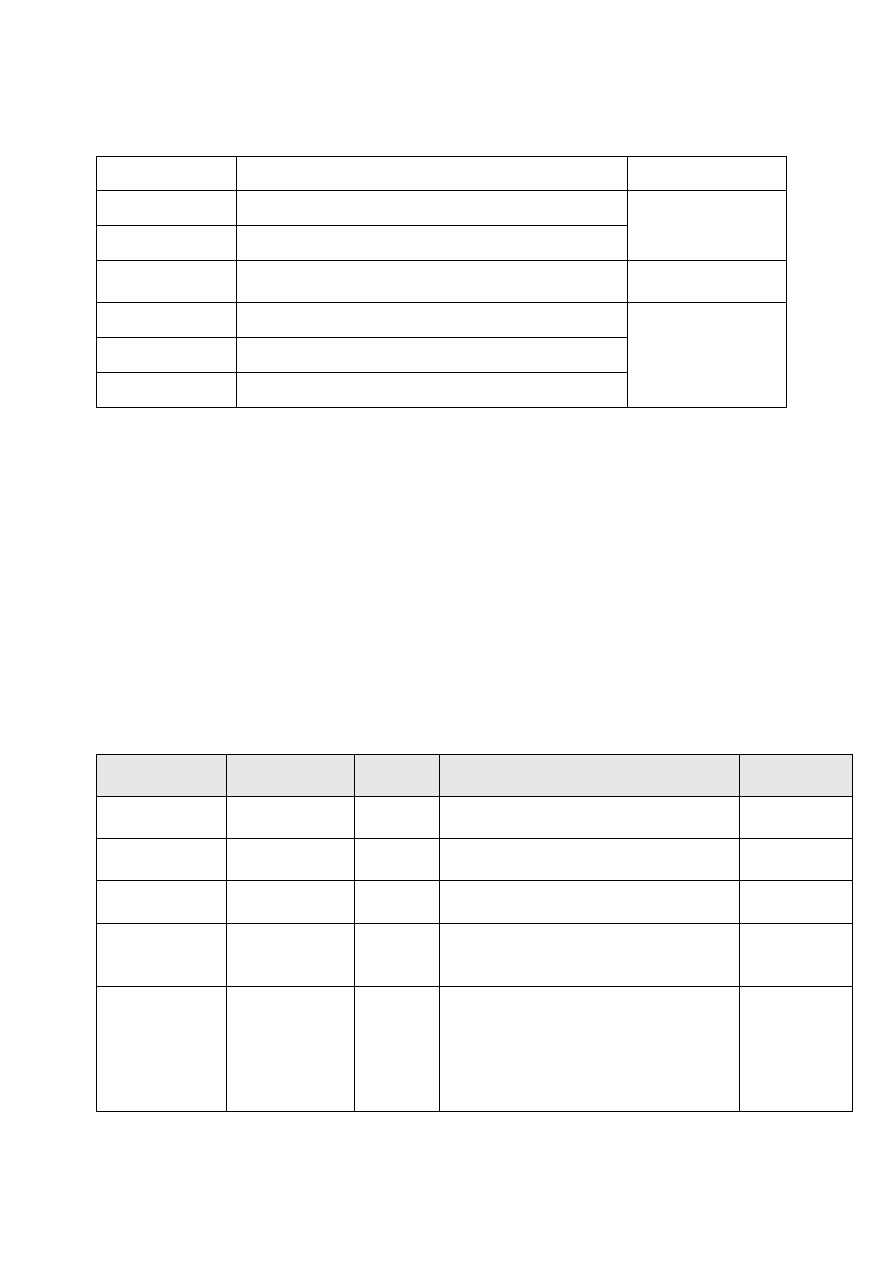
Wskazówki dotyczące różnicowania ciężkich stanów infekcyjnych w zależności od
stężenia prokalcytoniny (PCT) w osoczu oraz stosowania antybiotykoterapii.
PCT w osoczu
Stan kliniczny
Antybiotykoterapia
< 0,1 ng/ml zakażenie bardzo mało prawdopodobne
brak wskazań do
antybiotykoterapii
0,1 - 0,25 ng/ml zakażenie mało prawdopodobne
0,25 - 0,5 ng/ml zakażenie możliwe, prawdopodobnie zlokalizowane
rozważyć
antybiotykoterapię
0,5 - 2 ng/ml należy podejrzewać ciężkie zakażenie
zdecydowanie
antybiotykoterapia
2 - 10 ng/ml posocznica
≥ 10 ng/ml wstrząs septyczny
NEOPTERYNA.
Jest produkowana w aktywowanych monocytach/ makrofagach, a bezpośrednim modulatorem
jej syntezy jest INF-γ. Stężenie neopteryny odzwierciedla aktualny stan aktywacji
odpowiedzi komórkowej, wskazując na etiologię infekcyjną (zarówno wirusową jak i
bakteryjną wewnątrzkomórkową oraz pierwotniakową i grzybiczą).
Neopteryna jest powszechnie akceptowanym parametrem stosowanym w celu
śledzenia przebiegu choroby retrowirusowej. Wartość rokownicza neopteryny jest
porównywalna z liczbą komórek CD4(+).
Kliniczne zastosowanie wykładników ostrej fazy.
(
SIRS- zespół ogólnoustrojowej reakcji
zapalnej; POZ- Podstawowa Opieka Zdrowotna)
Marker
Wzrost/zmiany
diagnostyczne
Spadek
Przydatność
Dostępność
WBC
dni
dni do
tygodnia
diagnostyka i monitorowanie
zapaleń/zakażeń
wszędzie
(w tym POZ)
OB
dni
dni-
tygodnie
diagnostyka i monitorowanie
zapaleń/zakażeń, stany nieciężkie
wszędzie
(w tym POZ)
elektroforeza
białek surowicy
dni-tygodnie
tygodnie
diagnostyka i monitorowanie
zapaleń/zakażeń, stany nieciężkie
wszędzie
(w tym POZ)
CRP
pierwsze
12-48 h
dni
diagnostyka reakcji zapalnej,
w różnicowaniu zakażeń bakteryjnych i
wirusowych
wszędzie
(w tym POZ)
PCT
pierwsze
3-6 h
24-48 h
stany ciężkie:
różnicowanie zakażeń bakt. od wir. np.
meningitis;
różnicowanie posocznicy (↑↑) od SIRS
(↑), monitorowanie, rokowanie -
koreluje z ciężkością zakażenia
szpitale,
szczególnie
jednostki IOM
Morfologia krwi obwodowej – wartości referencyjne.
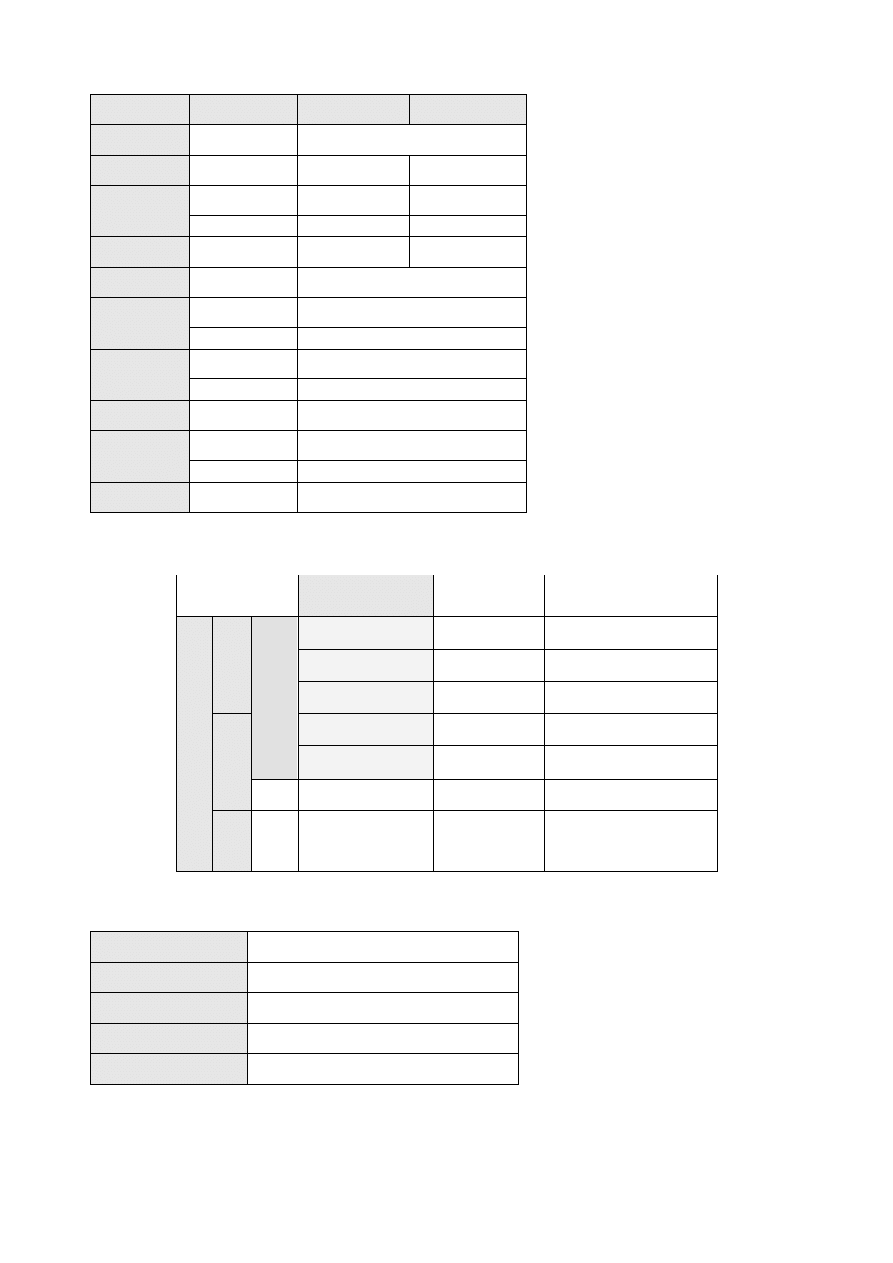
11
Parametr
Jednostka
Kobiety
Mężczyźni
WBC x 10
9
/l (G/l)
4,0-10,0
RBC x 10
12
/l (T/l)
4,0–5,5
4,5–6,0
HGB
g/l
120-160
140-180
mmol[Fe]/l
7,45-9,93
8,96-11,52
HCT
l/l
0,37-0,47
0,40-0,54
MCV
fl
80-100
MCH
pg
27,0-32,0
fmol[Fe]
1,67 – 1,98
MCHC
g/l
320-370
mmol[Fe]/l
19,86 – 22,97
RDW
%
11,5-14,5
RET
%
0,5-1,5
x 10
9
/l (G/l)
20-120
PLT
x 10
9
/l
140-400
Leukocytogram krwi obwodowej u osób dorosłych-wartości referencyjne.
Leukocyty
Odsetek
%
Liczba bezwzględna
x 10
9
/l krwi (G/l)
L
E
UKOCYTY
d
u
że
gr
an
u
locyt
y
neutrocyty:
45-70
1,8-7,0
pałeczkowate
3 – 5
0,12 – 0,5
segmentowane
śr
ed
n
ie
eozynocyty
2 – 4
0,08– 0,4
bazocyty
0 – 1
0,0 – 0,1
monocyty
2 – 8
0,08 – 0,8
m
ałe
limfocyty
20 – 45
0,8– 4,5
Liczba leukocytów we krwi obwodowej w zależności od wieku.
Noworodki
9,0 – 30,0 x 10
9
/l
12 miesięcy
6,0 – 20,0 x 10
9
/l
4 - 6 lat
5,0 – 15,5 x 10
9
/l
10 lat
4,5–13,5 x 10
9
/l
Dorośli
4,0– 10,0 x 10
9
/l
Za infekcją o etiologii bakteryjnej przemawia: wzrost całkowitej liczby krwinek białych
≥ 14000/μl lub/i przesunięcie w lewo wzoru odsetkowego neutrofilów (większy odsetek

12
komórek pałeczkowatych lub pojawienie się we krwi obwodowej komórek niedojrzałych -
metamielocytów > 6%) lub bezwzględna liczba neutrofilów pałeczkowatych ≥ 1500/μl.
NIEDOKRWISTOŚĆ W PRZEWLEKŁYCH ZAPALENIACH.
Przewlekłym stanom patologicznym (nowotwory i przewlekłe procesy zapalne, w tym
zakażenia) towarzyszy niedokrwistość chorób przewlekłych (anaemia of chronic disease -
ACD). Pobudzenie układu immunologicznego i tkankowe efekty działania cytokin (interferon
γ, TNF-α, IL-1, IL-6) powodują rozwój ACD w następujących mechanizmach:
1˚. Bezpośrednie zaburzenie różnicowania i proliferacji komórek linii erytropoetycznej.
2˚. Upośledzone wytwarzanie erytropoetyny w nerkach i zmniejszona ekspresja receptorów
dla erytropoetyny
3˚. Nieprawidłowy metabolizm żelaza (Fe) – mniejsza dostępności Fe dla erytropoezy np.:
zwiększona produkcja białek wiążących żelazo, apoferrytyny (białko ostrej fazy) i
laktoferryny (pobudzone granulocyty), oraz nasilenie wychwytu jonów żelaza przez
makrofagi, wiodące do zatrzymania żelaza w układzie komórek fagocytujących;
zwiększona ekspresja hepcydyny hamującej uwalnianie jonów żelaza z makrofagów i
wchłanianie żelaza w dwunastnicy.
4˚. Umiarkowane skrócenie czasu przeżycia erytrocytów – przedwczesna hemoliza w
układzie pobudzonych monocytów i makrofagów.
W zależności od dominacji w.w. mechanizmów, w morfologii krwi obwodowej obserwujemy
obraz niedokrwistości normocytarnej (ok. 80% przypadków) bądź mikrocytarnej. W praktyce
klinicznej dla różnicowania ACD z niedokrwistością z niedoboru żelaza, posługujemy się
oceną metabolizmu Fe (Tab.): stężeniem ferrytyny stężeniem ferrytyny: 10-200μg/l (śr.35
μg/l) u kobiet i 15-400μg/l (śr.90 μg/l) u mężczyzn, stężeniem transferryny: 200-400 mg/dl
lub całkowitą zdolnością wiązania żelaza (total iron-binding capacity - TIBC) 250-420 μg/dl,
stężeniem rozpuszczalnych receptorów dla transferyny (sTfR): 1,9-4,4 mg/l u kobiet i 2,2-5,0
mg/l u mężczyzn, które jest niezależne od stanów ostrej fazy, niedożywienia czy
niewydolności wątroby i cechuje się niewielką zmiennością osobniczą;
stężeniem jonów żelaza (Fe): 60-180 μg/dl (u kobiet średnio mniej o 20 μg/dl).
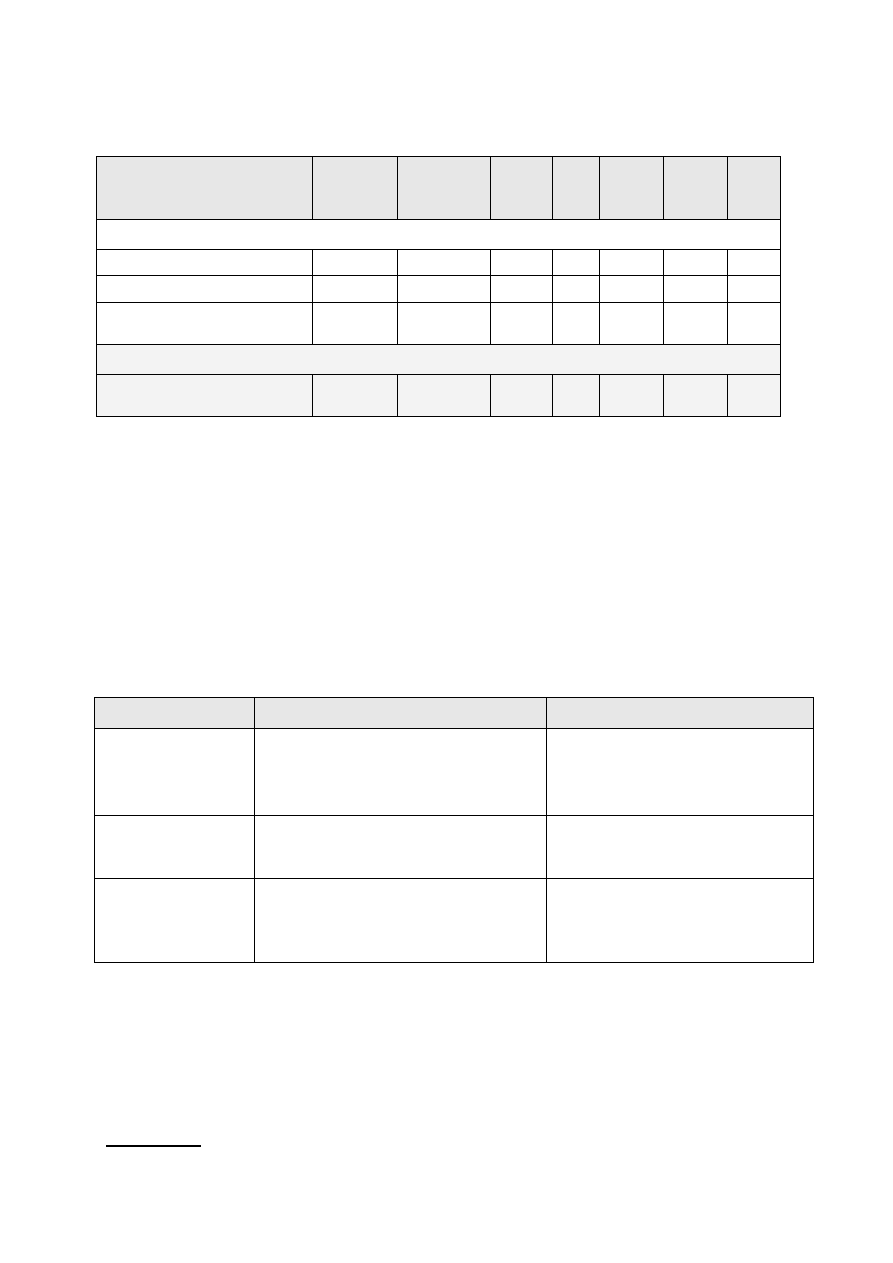
13
Ocena metabolizmu żelaza w diagnostyce różnicowej niedokrwistości chorób
przewlekłych.
Faza niedoboru
Ferrytyna
Transferyn
a
(TIBC)
sTfR
Fe
MCV,
MCH,
MCHC
RDW
HGB
RBC
HCT
RZECZYWISTY NIEDOBÓR ŻELAZA
zubożenie magazynów Fe
↓
N
N
N
N
N
N
utajony niedobór Fe
↓↓
↑
↑
↓
N
N lub ↑ N
niedokrwistość z niedoboru
Fe
↓↓↓
↑↑
↑↑
↓↓↓ ↓
↑
↓
NIEPRAWIDŁOWY METABOLIZM ŻELAZA
niedokrwistość chorób
przewl.
N lub ↑
↓
N
↓
N lub ↓ N lub ↑ ↓
TROMBOCYTOZA I TROMBOPENIA.
Trombocytoza (nadpłytkowość) > 450 G/l - odczynowy wzrost liczby płytek krwi możemy
obserwować w przewlekłych chorobach infekcyjnych i zapalnych, np. w gruźlicy.
Trombopenia (małopłytkowość) < 100 G/l. Odwołując się do ogólnie przyjętej klasyfikacji
małopłytkowości, udział czynników infekcyjnych w obniżaniu liczby płytek we krwi
obwodowej przedstawiono w tab.
Przyczyny małopłytkowości w chorobach zakaźnych.
Klasyfikacja
Proponowany mechanizm
Czynnik etiologiczny
Trombopenie
„centralne”
nabyte
- ↓ wytwarzania PLT,
- Replikacja wirusów w megakario-
cytach indukuje zmiany zwyro-
dnieniowe i obumieranie krwinek
- Wirusy: różyczki, świnki, CMV,
mononukleozy zakaźnej,
parwowirusy, wzw, HIV,
- Bakterie: gruźlica
Trombopenie
„obwodowe”
immunologiczne
- Uszkodzenie krążących PLT i zmiana
ich antygenowości → tworzenie
przeciwciał → eliminacja PLT
- Toksyny bakteryjne
- W posocznicy o etiologii bakte-
ryjnej w 20-90% przypadków
Trombopenie
„obwodowe”
nieimmunologiczne
- Ze zużycia
- Toksyny bakteryjne
(werotoksyna)
- Zakażenie wywołujące zespół
hemolityczno-mocznicowy.
Zakażenie HIV może obniżać liczbę PLT w dwóch mechanizmach: w centralnym –
uszkodzenie megakariocytów przez wirusy oraz obwodowym – nasilone niszczenie
trombocytów we krwi. U około 50% osób zakażonych HIV po około 10 latach rozwija się
małopłytkowość.
Zapamiętaj!

14
WBC - za infekcją o etiologii bakteryjnej przemawia: wzrost całkowitej liczby krwinek
białych ≥ 14000/μl, przesunięcie w lewo wzoru odsetkowego neutrofilów (większy odsetek
komórek pałeczkowatych lub pojawienie się we krwi obwodowej komórek niedojrzałych -
metamielocytów > 6%), bezwzględna liczba neutrofilów pałeczkowatych ≥ 1500/μl.
OB - kliniczne przyczyny wzrostu wartości OB obejmują: stany zapalne (ostre i
przewlekłe), chorobę reumatyczną, chorobę nowotworową, ciężkie niedokrwistości, martwicę
tkanek (zawał, uraz, zabieg operacyjny), stany fizjologiczne: ciążę i połóg, miesiączka,
podeszły wiek.
Dodatnie białka ostrej fazy obecne w surowicy w stosunkowo wysokim stężeniu dążą
głównie z α2-globulinami, w mniejszym stopniu z α1-globulinami, a wzrost γ-globulin w
zapaleniach (widoczny w elektroforezie zwykle po 2-3 tygodniach) ma charakter
poliklonalny.
CRP służy do wczesnej diagnostyki i monitorowania przebiegu zakażeń, niezależnie od
ich etiologii, w tym skuteczności antybiotykoterapii. Znacznie większy wzrost stężenia CRP
w ostrych zakażeniach o etiologii bakteryjnej (w ciężkich zakażeniach > 50-100 mg/l) niż
wirusowej (zwykle, nawet w cięższych infekcjach < 50 mg/l).
Prokalcytonina - wzrost stężenia PCT już w 3 godzinie od zaistnienia czynnika
stymulującego, maksymalne stężenie osiąga w ciągu 24-48 godz. i następnie stopniowo
spada, gdy brak czynników wywołujących zapalenie; dotyczy to zakażeń, których przyczyną
nie są wirusy.
Przypadek:
Pacjent lat 47 przyjęty do Oddziału Chorób Wewnętrznychh z powodu stanów
gorączkowych od kilku dni, uogólnionych bólów mięśniowych i narastającego
osłabienia. Obecne odleżyny okolicy krzyżowej i uda prawego. W wywiadzie ZZSK
(zesztywniające zapalenie stawów kręgosłupa) leczone od 15 lat, głównie NLPZ.
Badania laboratoryjne:
Morfologia krwi obwodowej: HGB: 4,6 mmol/l, Ht: 23 l/l, RBC: 3,08 T/l, MCV: 73 fl,
WBC: 14,5 G/l, PLT: 301 G/l.
OB: 103 (w następnych oznaczeniach: 103 i 80) mm/po 1 godz.
Badania biochemiczne:
Żelazo: 12,1 µg/dl, TIBC: 26 µg/dl, sTfR: 5,9 mg/l
CRP: 337 (w następnych oznaczeniach: 337, 110 i 65) mg/l, PCT: >10 (w następnych
oznaczeniach: <5) ng/ml.

15
Posiew krwi dodatni: Streptoccocus haemoliticus gr. A pyogenes +++ (posiew kontrolny
ujemny).
Posiew z odleżyny dodatni: Streptoccocus haemoliticus gr. A pyogenes +++ ,
Staphylococcus aureus++.
Rozwiązanie przypadku: w badaniach dodatkowych dotyczących stanu
zapalnego/zakażenia stwierdzono: nieznaczne podwyższenie liczby leukocytów ale
znaczny wzrost stężenia OB, CRP oraz PCT przemawiające za ciężkim zakażeniem
układowym, najprawdopodobniej o etiologii bakteryjnej. Zanim jeszcze uzyskano
dodatni wynik posiewu krwi, konieczne było wdrożenie antybiotykoterapii. Obraz
nasilonego, stanu zapalnego wywołanego posocznicą, nakłada się na obraz przewlekłego
zapalenia wynikającego z ZZSK. Jednak tak wysokie stężenie CRP oraz PCT wraz z
objawami klinicznymi jasno przemawiają za ciężkim ostrym zakażeniem układowym,
wymagającym natychmiastowej antybiotykoterapii.
Niskie wartości parametrów czerwonokrwinkowych oraz stężenie jonów żelaza
wskazują zarówno na niedokrwistość chorób przewlekłych, jak i na niedobór żelaza,
najprawdopodobniej będący powikłaniem leczenia ZZSK. Zwraca również uwagę
bardzo niskie stężenie TIBC, choć w niedoborze żelaza powinno osiągać wartości
powyżej, lub bliskie górnej granicy normy, jednak jest ujemnym białkiem ostrej fazy.
Podejrzenie niedoboru żelaza potwierdza podwyższone stężenie rozpuszczalnych
receptorów transferryny sTfR
Opracowała dr med. Miłosława Zowczak-Drabarczyk
Piśmiennictwo:
Becker KL, Snider R, Nylen ES: Procalcitonin in sepsis and systemic inflammation: a
harmful biomarker and a therapeutic target. Br J Pharmacol. 2010; 159: 253-264.
Celik IH, Demirel FG, Uras N i wsp. What are the cut-off levels for IL-6 and CRP in
neonatal sepsis? J Clin Lab Anal, 2010; 24: 407-412.
Chazan R: Współczesna diagnostyka kliniczna zakażeń układu oddechowego. Pol Merk Lek.
2011; 179:316-319.
Henry JB: Clinical diagnosis and management by laboratory methods. W.B. Saunders
Company, Philadelphia, 2006 (22
th
edition).

16
High KP, Bradley SF, Gravenstein S i wsp.: Clinical Practice Guideline for the Evaluation
of fever and infection in older adult residents of ling-term care facilities: 2008 update by the
Infectious Diseases Society of America. Clin Infect Dis. 2009; 48: 149-171.
O’Grady NP, Barie PS, Bartlett JG i wsp.: Guidelines for evaluation of new fever in
critically ill adult patients: 2008 update from the American College of Critical Care Medicine
and the Infectious Diseases Society of America. Crit Care Med. 2008; 36: 1330-1349.
Płusa T.: Zakażenia i możliwości ich kontrolowania. Pol Merk Lek. 2011; 179: 310-312.
Schuetz P, Albrich W, Mueller B.: Procalcytonin for diagnosis of infection and guide to
antibiotic decisions: past, present and future. BMC Med. 2011; 9:107.
Tavares E, Minano FJ: Immunoneutralization of the aminoprocalcitonin peptide of
procalcitonin protects rats from lethal endotoxaemia: neuroendocrine and systemic studies.
Clin Sci. 2010; 119: 519-534.
Wietlicka I, Korzeniowska K, Jabłecka A: Neopteryna. Farmacja Współczesna, 2008; 1:
241-247.
Wyszukiwarka
Podobne podstrony:
3 W LEPKO CIECZY, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
Rat. Med W - zaburzenia rytmu serca, ratownicto 2012 2013, ratownictwo medyczne
SP DZWI K MOJE , Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki
3 W LEPKO CIECZY, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
wykłady NA TRD (7) 2013 F cz`
Pr UE Zródła prawa (IV 2013)
W WO 2013 technologia
Med Czyn Rat1 Ostre zatrucia Materialy
TEORIE 6 2013 R
Wyk ECiUL#1 2013
Leczenie wrzodziejacego zapalenia jelit, wyklad 2013
TEORIE 1 2013 IIR
Wyk ECiUL#9S 2013
więcej podobnych podstron