
13. Aldehydy i ketony.
(konwersatorium, gr. A1 – Chemia, II rok, 2014/2015Z)
Zagadnienia
a) Nazewnictwo systematyczne i zwyczajowe aldehydów i ketonów.
b) Otrzymywanie aldehydów: a) utlenianie alkoholi I-rz. (chlorochromian pirydyny /PCC/); b) utleniające
rozszczepienie alkenów zawierających przynajmniej jeden winylowy atom wodoru (ozonoliza: O
3
, Zn,
AcOH); c) częściowa redukcja estrów (wodorek diizobutyloglinowy /DIBAH lub DIBAL-H/);
d) hydroborowanie alkinów terminalnych połączone z utlenianiem (1. BH
3
, 2. H
2
O
2
/OH
-
).
c) Otrzymywanie ketonów: a) utlenianie alkoholi II-rz. (KMnO
4
, CrO
3
/H
2
SO
4
/odczynnik Jonesa/, Na
2
Cr
2
O
7
,
chlorochromian pirydyny /PCC/); b) utleniające rozszczepienie alkenów zawierających przynajmniej jeden
dipodstawiony atom węgla sp
2
(ozonoliza: O
3
, Zn, AcOH); c) acylowanie Friedel'a-Crafts'a (otrz. ketonów
arylowych: zw. aromatyczny+chlorek kwasowy /kat. AlCl
3
/); d) bezpośrednia addycja wody do alkinów
terminalnych (alkin→enol /tautomeria keto-enolowa/→keton metylowy: H
2
O/H
+
, kat. Hg
2+
); e) reakcja
chlorków kwasowych z odczynnikami Gilmana /zw. diorganomiedziowe/; f) przegrupowanie pinakolinowe
(diole wicynalne/ kat. H
+
).
d) Porównanie reaktywności aldehydów i ketonów. Tautomeria keto-enolowa.
e) Addycja nukleofilowa do aldehydów i ketonów(!) (mechanizm: powstawanie tetraedrycznego produktu
pośredniego połączone z jego protonowaniem i/lub eliminacją np. cząsteczki H
2
O /tzw. reakcja
kondensacji/):
• Nu
-
= HO
-
(→diole geminalne /tzw. gem-diole/);
• Nu
-
= H
-
(→alkohole /redukcja grupy karbonylowej za pomocą np. NaBH
4
lub LiAlH
4
/);
• Nu
-
= R
3
C
-
(→alkohole /reakcja z odczynnikami Grignarda/);
• Nu
-
= NC
-
(→cyjanohydryny);
• Nu = H
2
O (→diole geminalne, gem-diole /kat. H
+
lub OH
-
);
• Nu = ROH (→hemiacetale, acetale /kat. H
+
);
• Nu = NH
3
(→iminy), RNH
2
(→iminy lub oksymy (R=OH), hydrazony (R=NH
2
) i semikarbazony
(R=NHCONH
2
), RR'NH (→enaminy);
• Nu = R
2
C
-
—P
+
(C
6
H
5
)
3
/tzw. ylid/ (→alkeny; reakcja Wittiga).
• Nu = HSO
3
-
(→tzw. połączenia bisulfitowe).
f) Pozostałe reakcje aldehydów i ketonów: a) redukcja grupy karbonylowej do alkilowej (reakcja Wolffa-
Kiżniera /NH
2
-NH
2
, HO
-
, mechanizm/ lub redukcja Clemmensena /Zn(Hg), H
3
O
+
/); b) reakcja Cannizzaro
(aldehydy nie posiadające H
α
, reakcja dysproporcjonowania; kat. HO
-
, aldehyd → alkohol+kwas karboksy-
lowy, mechanizm); c) sprzężona addycja nukleofilowa I-rz. i II-rz. amin do α,β-nienasyconych zw.
karbonylowych (→β-aminoketony lub β-aminoaldehydy); d) utlenianie aldehydów do kwasów
karboksylowych: próba Tollensa (Ag(NH
3
)
2
+
) oraz próba z odczynnikiem Fehlinga ("Cu(OH)
2
" jako
kompleks winianowy).
Zadania
1. Nazwij poniższe związki.
a)
b)
c)
d)
e)
f)
g)
h)
O
O
Br
O
O
O
CHO
O
O
Cl
O
HO
O
O
i)
j)
O
O
OH
2. Narysuj struktury następujących pochodnych związków karbonylowych.
a) 2,4-dinitrofenylohydrazon benzaldehydu b) semikarbazon cyklobutanonu c) oksym cyklopropanonu
d) acetal dimetylowy formaldehydu
e) acetal etylenowy heksan-3-onu f) (E)-N-etyloimina propiofenonu
g) hemiacetal metylowy propanalu
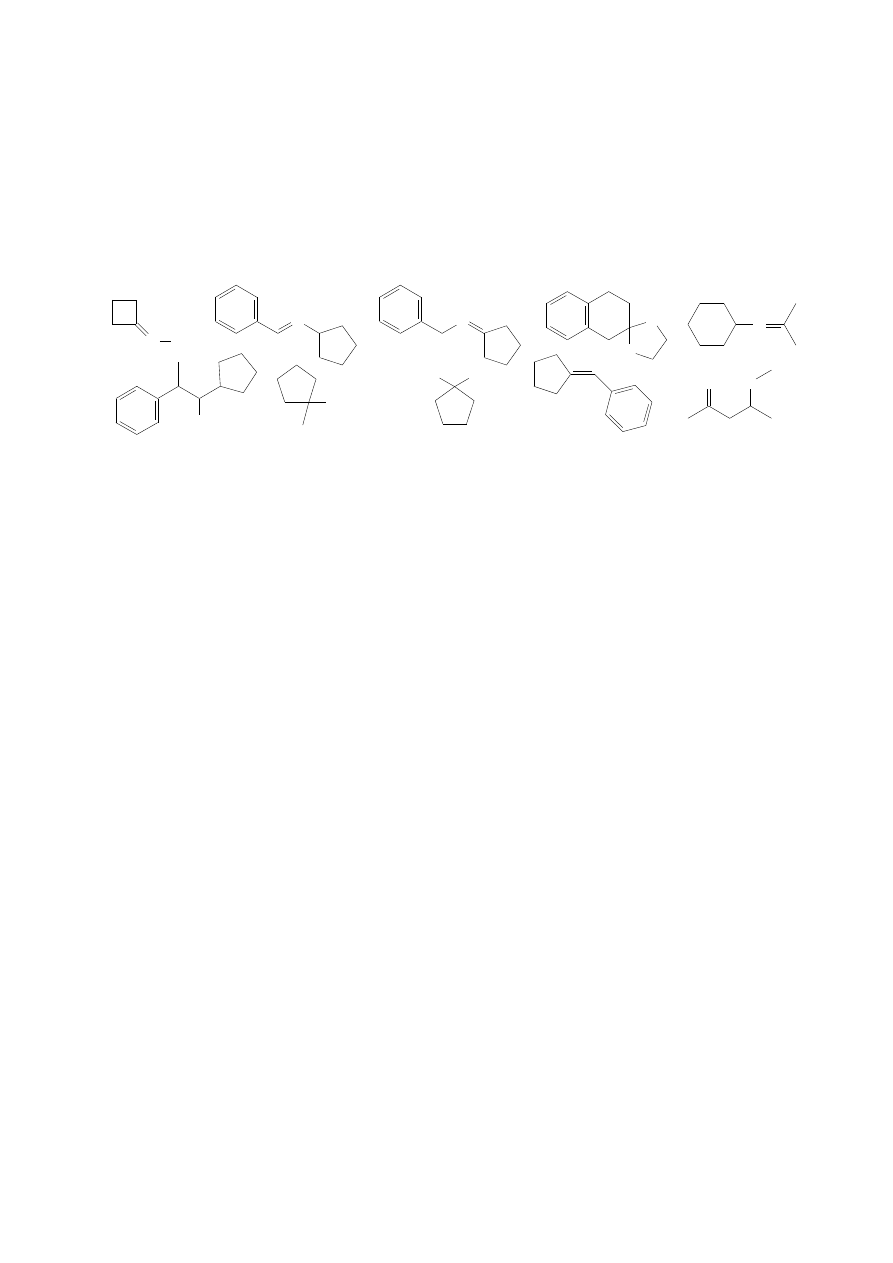
3. Zaproponuj jak największą liczbę sposobów, jakimi można otrzymać acetofenon.
4. Przedstaw produkty reakcji cykloheksanonu z poniższymi odczynnikami, lub zaznacz jeśli reakcja nie
zachodzi.
a) CH
3
NH
2
, H
+
b) nadmiar CH
3
OH, H
+
c) hydroksyloamina, kat. H
+
d) Zn(Hg), HCl
e) fenylohydrazyna, kat. H
+
f) PhMgBr, następnie lekkie zakwaszenie
g) odczynnik Tollensa
h) hydrazyna, KOH
i) Ph
3
P=CH
2
j) cyjanek sodu
k) produkt kwasowej hydrolizy związku j)
l) PCC
5. W jaki sposób można zsyntetyzować poniższe związki z odpowiednich aldehydów lub ketonów?
a)
b)
c)
d)
e)
N OH
N
N
O
O
N
g)
CH
2
OH
CH
3
O
OCH
3
f)
h)
i)
OH
j)
O
HN
6. Mając do dyspozycji stilben (1,2-difenyloeten) jako substrat, zaproponuj ciąg przemian prowadzących do
otrzymania aldehydu difenylooctowego. Przedstaw mechanizmy reakcji wykorzystanych w sugerowanej
syntezie. (Wskazówka: rozważ produkt przejściowy, jakim jest 1,2-difenyloetano-1,2-diol)
7. Pentano-2,4-dion (acetyloaceton) występuje jako mieszaninia 8% formy ketonowej i 92% formy enolowej.
Na podstawie struktury enolowej formy tautomerycznej wytłumacz wyjątkową jej trwałość.
Wyszukiwarka
Podobne podstrony:
13 Aldehydy i ketony kondensacja aldolowa
13 Aldehydy i ketony materiały dodatkowe
aldehydy i ketony addycja nukleofilowa
aldehydy i ketony
Aldehydy i ketony
Aldehydy i ketony
Aldehydy, ketony, kwasy, ALDEHYDY
Aldehydy, ketony i kwasy - test 2, 1p
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
aldehydy i ketony zadania
(3wysł) polifenole, aldehydy, ketony,kwasy,mydła 2010 11(1)
Aldehydy i ketony
wyk 8 aldehydy,ketony cd
6 aldehydy,ketony
więcej podobnych podstron