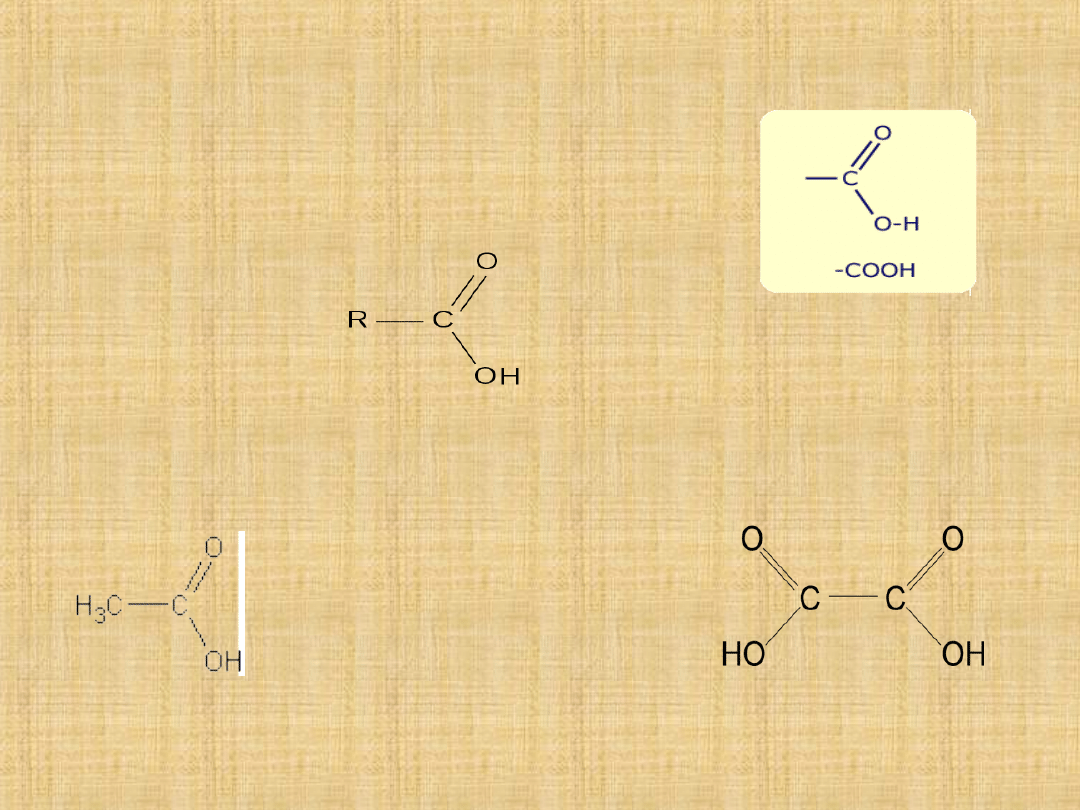
Kwasy karboksylowe
Kwasy karboksylowe są to związki organiczne,
których cząsteczki składają się z grupy
węglowodorowej oraz z gr. karboksylowej
nadającej jej charakterystyczne właściwości.
Ich ogólny wzór to:
Kw. karboksylowe mogą zawierać jedną lub więcej gr.
karboksylowych (kw. monokarboksylowe) lub więcej gr
karboksylowych (kw.polikarboksylowe)
Kw. etanowy
(octowy)
Kw.
etanowodorowy
(szczawiowy)

Nazewnictwo
Nazwy systematyczne kwasów karboksylowych tworzy się z nazw
węglowodorów o tej samej liczbie atomów węgla, dodając końcówkę –OWY:
CH
3
-CH
2
-CH
2
-CH
3
butan
kwas butanowy
Wzór
półstrukturalny
Nazwa
Nazwa
zwyczajowa
H-COOH
kw. metanowy
kw. mrówkowy
CH
3
-COOH
kw. etanowy
kw. octowy
CH
3
-CH
2
-COOH
kw. propanowy
kw. propionowy
CH
3
-(CH
2
)
2
-COOH
kw. butanowy
kw. masłowy
CH
3
-(CH
2
)
3
-COOH
kw. pentanowy
kw. walerianowy

Własności fizyczne i chemicze
*Kwas Mrówkowy
HCOOH
Występuje w jadzie mrówek i w soku liści pokrzyw. Jest bezbarwną
cieczą o duszącym zapachu i właściowościach parzących
*Kwas octowy
CH3COOH
Rozcieńczony 10% to ocet. Stężony kw. octowy jest bardzo
przenikliwą cieczą o charakterystycznym zapachu, w temp. 16 ̊
krzepnie.
*Kwasy karboksylowe są palne. Spalają się do CO
2
i H
2
O
2HCOOH + O
2
-> 2CO
2
+ 2H
2
O
*Dysocjują na jony
CH
3
COOH -> CH
3
COO
-
+ H
+

*Mają wysoką wysoką temp. wrzenia w związku z tym, że
tworzą wiązania wodorowe.
*Kwasy do czeterech at. węgla w cząsteczce dobrze
rozpuszczają się w wodzie.
*W miare wzrostu długości łańcucha węglowego maleje
rozpuszczalność, lotność i zmienia się stan skupienia.
*Reakcja kwasów karboksylowych:
Kw. te reagują z metalami, tlenkami metali i wodorotlenkami
metali. W wyniku takich reakcji powstają sole
2HCOOH + 2Na --> 2HCOONa + H
2
2HCOOH + Na
2
O --> 2HCOONa + H
2
O
HCOOH + NaOH --> HCOONa +H2O
Właściwości c.d.

Otrzymywanie kwasów karboksylowych
-istenieje wiele metod otrzymywania kw. karboksylowych na
skale przemyslową związki te produkuje sie najczęściej
utleniając odpowiednie węglowodory w obecności katalizatora:
2CH
4
+ 3O2 2HCOOH + 2 H
2
O
-kw. karboksylowe można otrzymać również poprzez utlenianie
alkoholi I rzędowych przy zastosowaniu K2Cr2O7 lub KMnO4
jako utleniacz. Ogólny schemat takiej reakcji ma postać:
R-CH
2
-OH + 2[O] R-COOH + H
2
O
W laboratorium kw. karboksylowe powstają w wyniku utleniania
aldehydów np.: r. Trommera i Tollensa
R-CHO + Ag
2
O R-COOH + 2Ag↓
R- CHO + 2Cu(OH)
2
R-COOH + CU
2
O ↓+ 2H
2
O
- w wyniku fermentacjo octowej
C2H
5
OH + O
2
CH
3
COOH + H
2
O
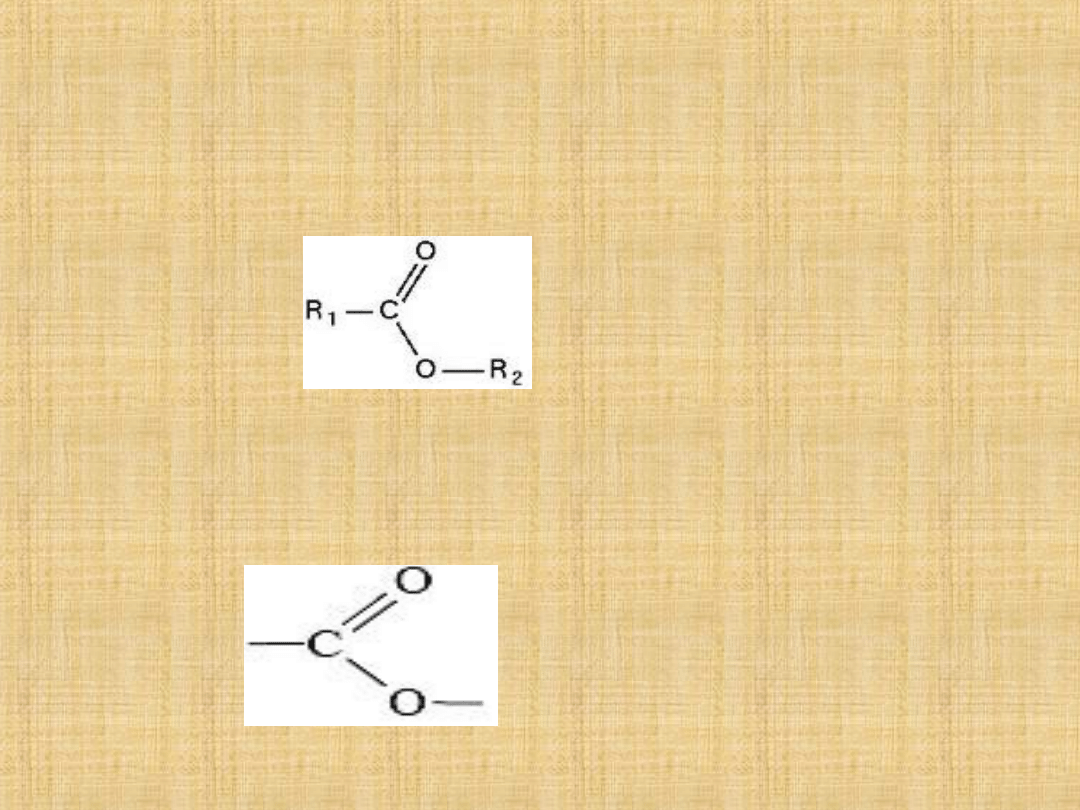
Pochodne kwasów
karboksylowych
Estry
– to połączenie kw. karboksylowych i alkoholi.
Wzór ogólny estrów
, gdzie R
1
to grupa
alkilowa pochodząca od
kwasów, a R
2
od
alkoholi.
Grupa estrowa:
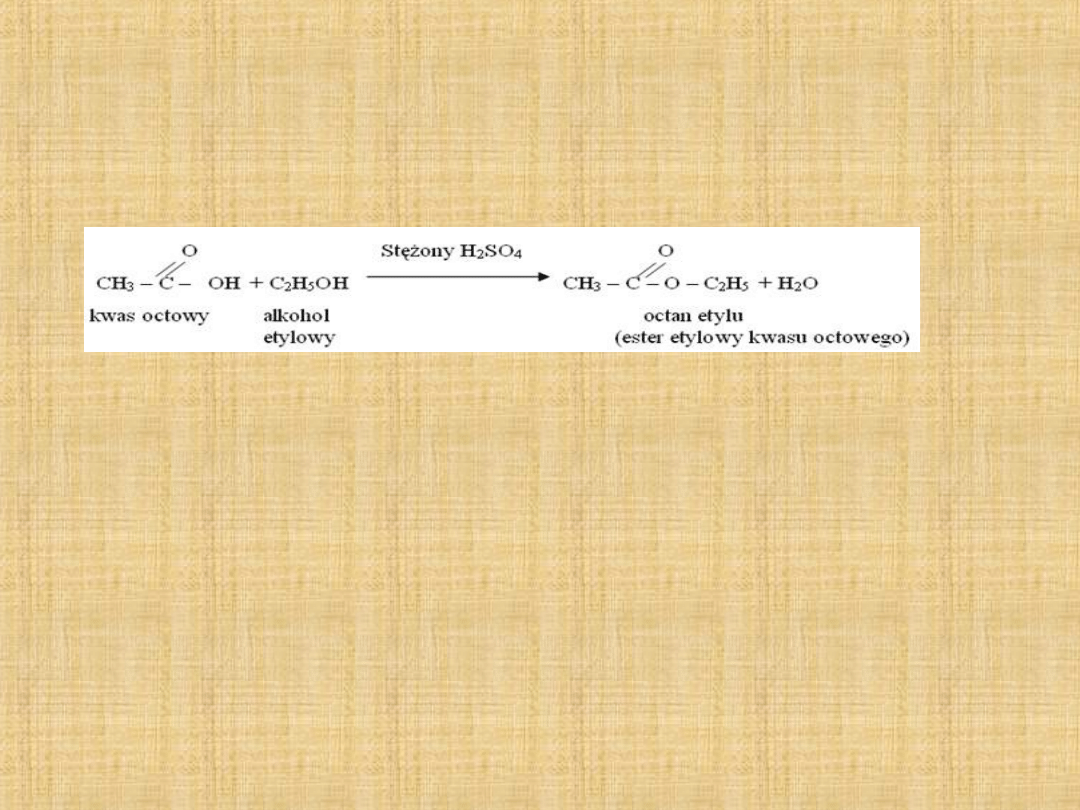
Otrzymywanie estrów:
Kwas + alkohol ester + woda
Właściwości estrów:
Niższe estry są cieczami w miare wzrostu długośći łańcucha
węglowego rośnie gęstość i wyższe estry są ciałami stałymi.
Estry bardzo słabo rozpuszczają się w wodzie ale same sa
dobrymi rozpuszczalnikami, mają bardzo przyjemne zapachy
kwiatów i owoców.
Estry są izomerami kwasów karboksylowych.
Halogenki kwasowe-
funkcja hydroksylowa została zastąpiona
przez halogen, czyli np: Cl, Br, F.
Otrzymywanie
Halogenki kwasowe otrzymuje się z kwasów karboksylowych.
Najczęściej stosowanym odczynnikiem do przekształcania
kwasów w chlorki kwasowe jest chlorek tionylu (SOCl
2
). Jego
zaletą, oprócz niskiej ceny i zapewnienie dobrej wydajności jest
to, że obok chlorku kwasowego powstają łatwe do usunięcia
produkty gazowe (SO
2
i HCl).
C
H
3
CH
3
CH
3
O
OH
C
H
3
CH
3
CH
3
O
Cl
kwas 2,4,6-tri-
metylobenzoesowy
C
SOCl
2
CHCl
3
C
+ SO
2
+ HCl
chlorek 2,4,6-tri-
metylobenzoilu
(90%)

Właściwości halogenków
Halogenki kwasowe są bardzo reaktywne,
ulegają rozkładowi pod wpływem wielu
odczynników. Z wodą zachodzi hydroliza do
kwasów karboksylowych, z alkoholami w wyniku
alkoholizy powstają estry, a z solami kwasów
karboksylowych – bezwodniki kwasowe.
Halogenki kwasowe o niskich ciężarach
cząsteczkowych są cieczami. Są
nierozpuszczalne w wodzie, ale reagują z nią
ulegając rozkładowi do kwasów
karboksylowych.
Halogenki kwasowe mają intensywny, gryzący
zapach; nawet te niskolotne są duszące – dymią
na powietrzu.
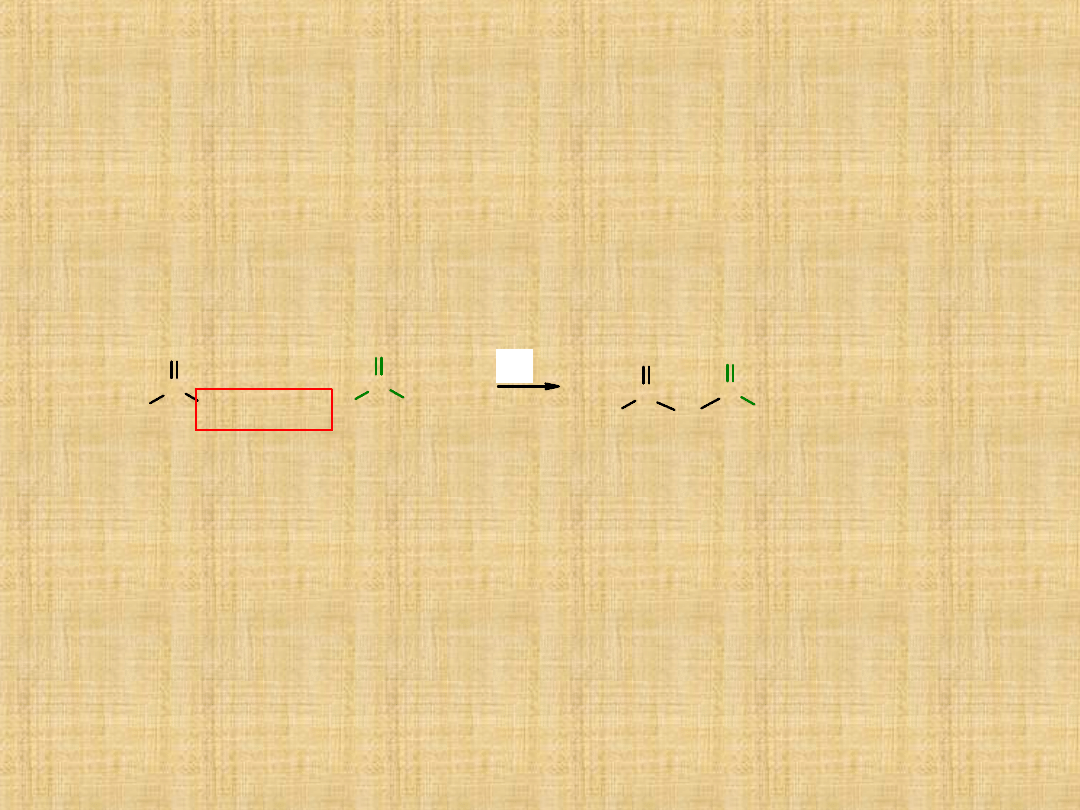
Bezwodniki kwasowe-
pochodnymi kwasów
karboksylowych, w których atom wodoru funkcji
hydroksylowej został podstawiony reszta acylową. Ich nazwa
wywodzi się ze sposobu ich otrzymywania, tj. kondensacji
dwóch cząsteczek kwasu karboksylowego (kwasów), podczas
której wydziela się cząsteczka wody. Wzór sumaryczny
produktu różni się brakiem cząsteczki wody od wzoru dwóch
cząsteczek kwasów, z których powstał, stąd bezwodnik.
O
R
OH
O
O
H
R'
O
R
O
O
R'
C
C
+
- H
C
C
kwas
kwas
bezwodnik
OH
Bezwodniki mogą być symetryczne – jeżeli
zbudowane są z reszt tego samego kwasu (R = R’)
lub niesymetryczne – jeżeli powstały z cząsteczek
dwóch różnych kwasów (R R’).

Właściwości bezwodników kwasowych
Bezwodniki kwasowe swoimi właściwościami przypominają
chlorki kwasowe, są jednak trochę mniej reaktywne.
Ulegają one reakcjom hydrolizy*, alkoholizy*, amonolizy* i
redukcji*.
Hydroliza
(RCO)
2
O + HOH 2 RCOOH
Alkoholiza
(RCO)
2
O + HOR’ RCOOR’ + RCOOH
Amonoliza
(RCO)
2
O + 2 HNR’
2
RCONR’
2
+ RCOO
-
N
+
H
2
R’
2
Redukcja
(RCO)
2
O + LiAlH
4
2 RCH
2
OH
1. eter
2. H
+
/HOH
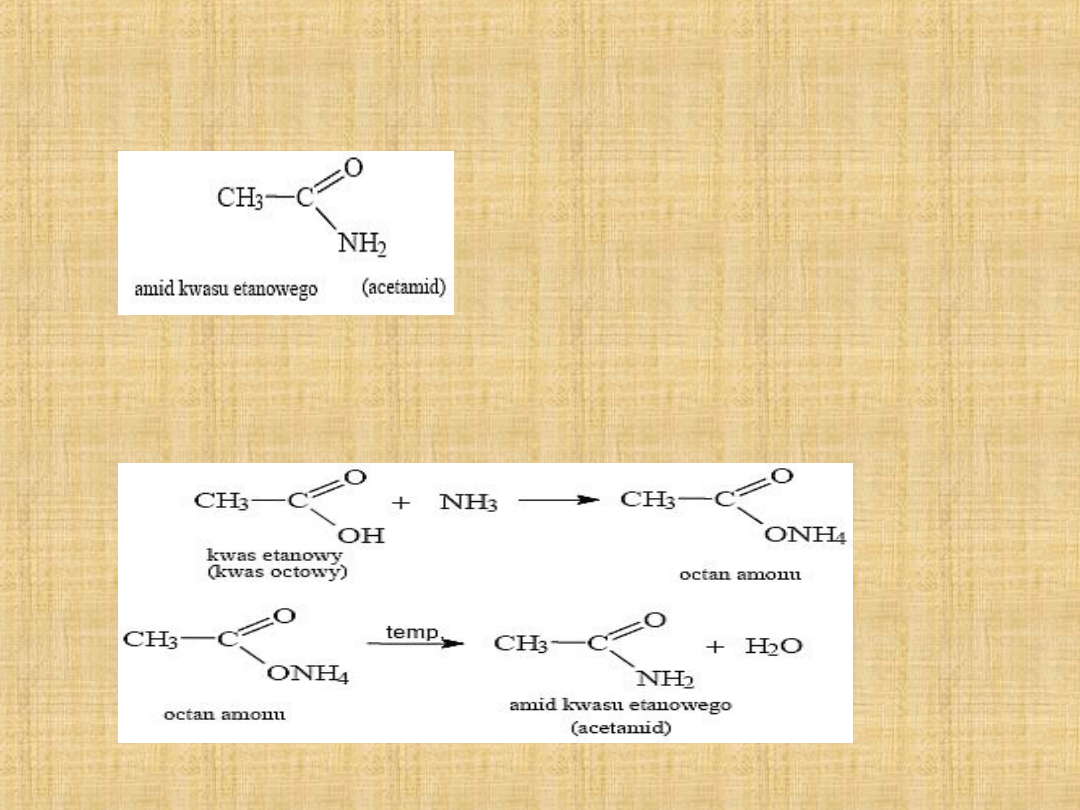
Amidy-
pochodne kwasów karboksylowych, w cząsteczkach
których grupa aminowa (-NH2) zastąpiła grupę hydroksylową (-OH),
np.
Otrzymywanie
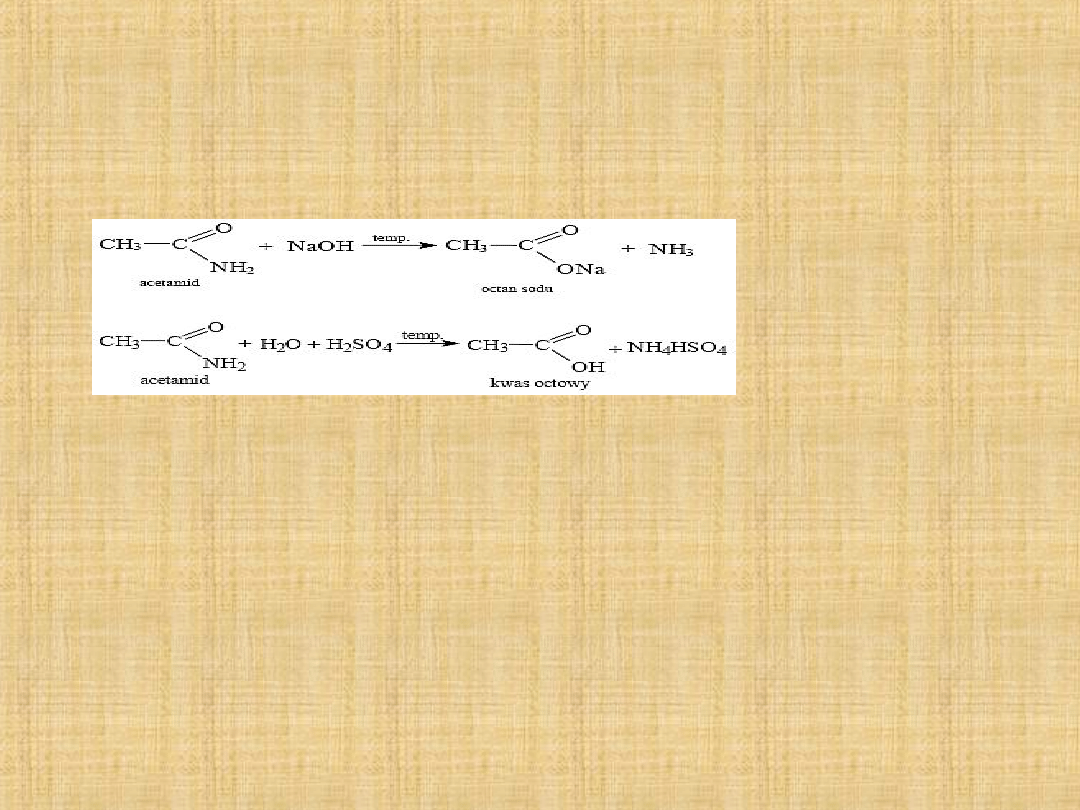
Właściwości amid
Amidy reagują zarówno z zasadami, jak i kwasami:
Amidy są przeważnie związkami krystalicznymi chemicznie
trwałymi i obojętnymi. W przeciwieństwie do amin nie
tworzą one soli z kwasami, ale ulegają hydrolizie. Związki te
posiadają wysokie temperatury wrzenia. Amidy, które
posiadają niskie masy cząsteczkowe dobrze rozpuszczają się
w wodzie w przeciwieństwie do amidów posiadających
wyższe masy.
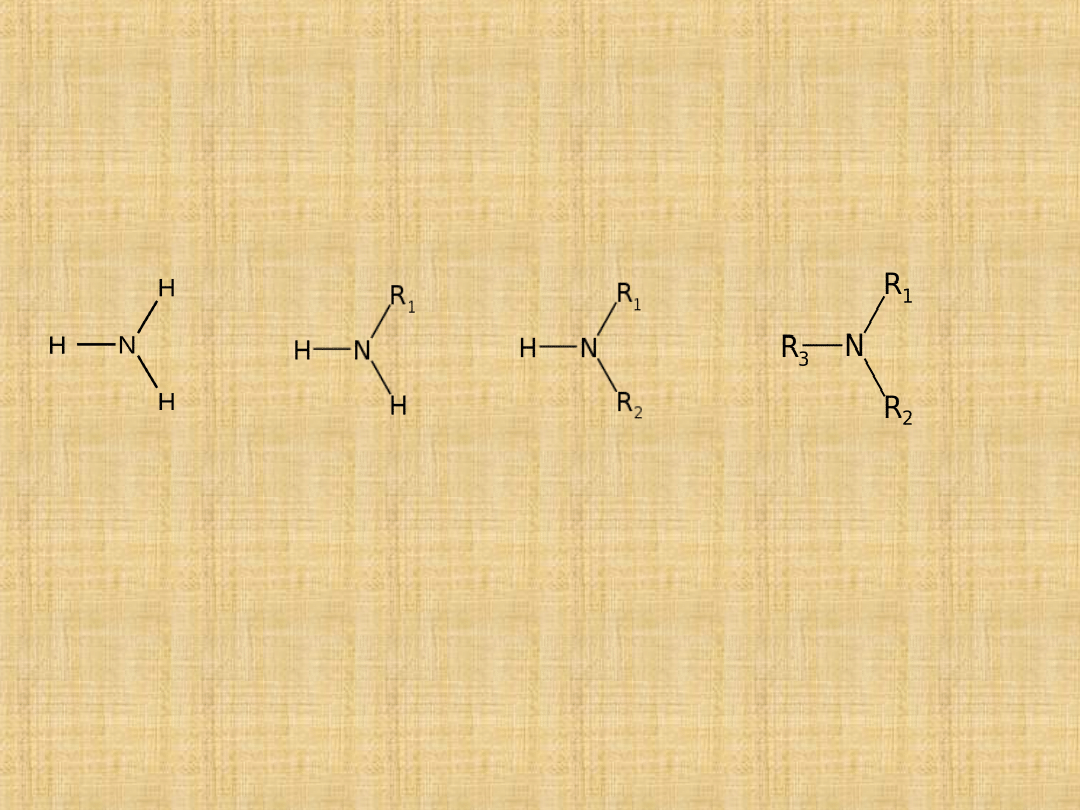
Aminy
To pochodne amoniaku w którym 1,2 lub 3 atomy wodoru
zastąpiono grupami węglowodorowymi.
amonia
k
I rzędowy II rzędowy III
rzędowy
Amina I rz. jest aminą, która powstaje wtedy jeżeli jeden atom
wodoru od amoniaku zastąpiono gr. węglowodorową.
CH
3
- NH
2
metyloamina
Amina II rz. wtedy gdy dwa atomy wodoru zastąpiono gr.
węglowodorowymi.
CH
3
-NH-CH
3
dimetyloamina
Amina III rz. Trzy atomu wodoru zastąpiono gr.
węglowodorowymi.
CH
3
-NCH
3
-CH
3
trimetyloamina

Otrzymywanie amin
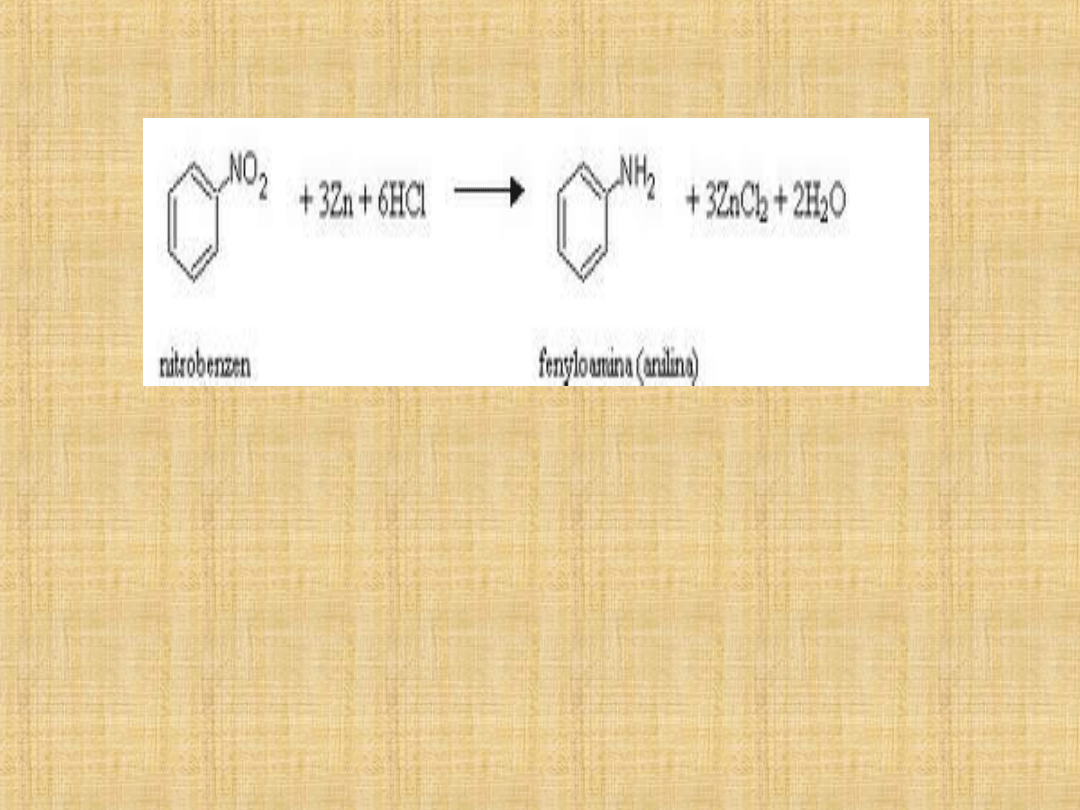
Otrzymywanie amin aromatycznych
Właściwości
Metyloamina jest to gaz o zapachu psującuh się ryb. Wyższe
aminy są cieczami lub ciałami stałymi. Slabo rozpuszczają
się w wodzie. Wykazują słabe właściwości zasadowe.
Anilina jest to ciecz bezbarwna słabo rozpuszczalna w
wodzie, jest bardzo słabą zasadą.
Sole amin
Znane są sole amoniowe pochodne amin 1° , 2 ° , 3° oraz tzw
czwartorzędowe sole amoniowe .
H
N
+
CH
3
H
H
Cl
H
N
+
CH
2
C
H
2
CH
3
CH
3
H
NO
3
–
N
+
H
Br
CH
2
N
+
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
CH
2
CH
2
CH
3
CH
2
CH
2
CH
3
Cl
Cl
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
N
+
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
chlorek
metyloamoniowy
azotan
dietyloamonio
wy
bromek
pirydyniowy
chlorek
benzylotributyloamoniowy,
TBA
chlorek
didecylodimetyloamoniowy,
DDAC
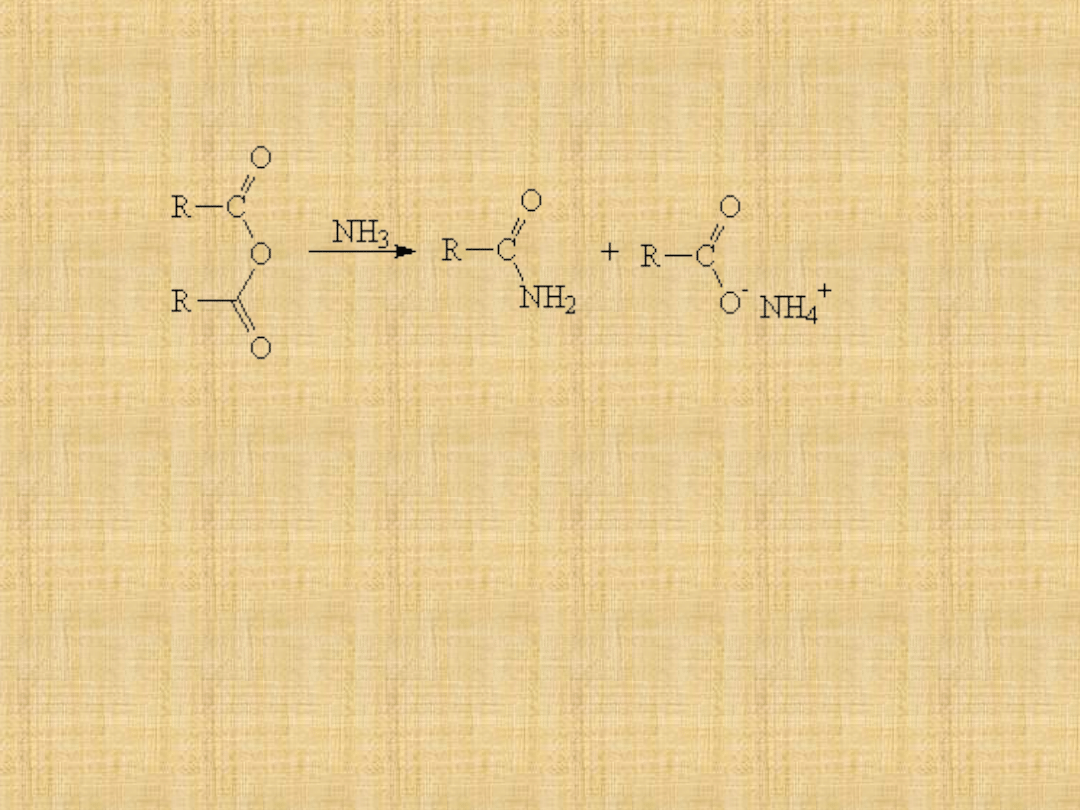
Otrzymywanie

Barwniki azowe
Barwniki azowe − organiczne związki chemiczne z grupy
azozwiązków. Na skalę produkcyjną uzyskiwane są ze związków
diazowych i fenolu. Znajdują zastosowanie w przemyśle jako barwniki.
Są stosowane w farbiarstwie włókienniczym oraz w produkcji lakierów
i farb. Niektóre związki azowe (np. oranż metylowy) są
wykorzystywane w analizie chemicznej jako wskaźniki.
Barwniki azowe wykorzystywanie są także w przemyśle spożywczym,
np. tartrazyna (E102), żółcień chinolinowa (E104), żółcień
pomarańczowa FCF (E110), azorubina (E122), czerwień koszenilowa A
(E124), czerwień Allura AC (E129).
Działanie niepożądane barwników azowych
Barwniki azowe mogą spowodować nasilenie objawów nietolerancji
salicylanów (np. aspiryny). Ponadto są czynnikiem wyzwalającym
histaminę, przez co mogą nasilić objawy astmy, a także spowodować
skurcze macicy u kobiet w ciąży, powodując poronienie. Dodatkowo, w
połączeniu z benzoesanami mogą powodować wystąpienie
nadpobudliwości u dzieci. Nawet u osób nieuczulonych mogą być
przyczyną pokrzywki.
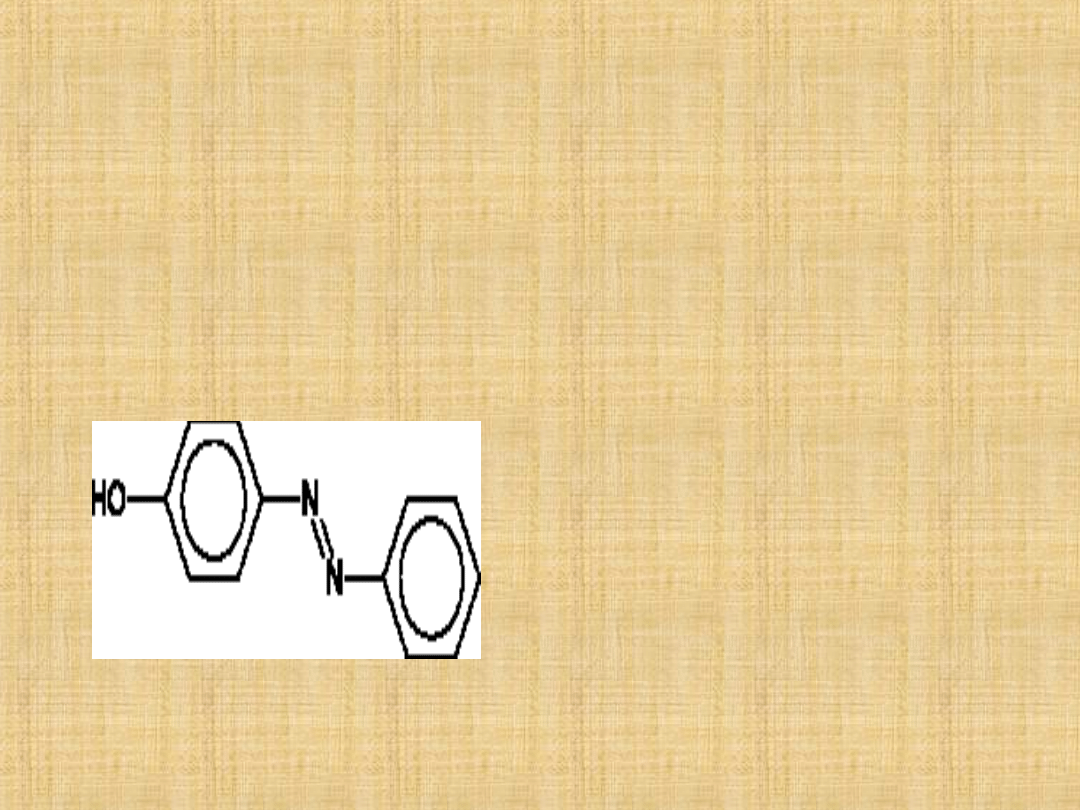
Azozwiązki (związki azowe) – organiczne związki chemiczne
posiadające w swojej strukturze grupę azową o wzorze –N=N–.
Aromatyczne azozwiązki stanowią ważną grupę barwników,
powstają w reakcjach sprzęgania soli diazoniowych z fenolami,
aminami aromatycznymi i innymi pochodnymi węglowodorów
aromatycznych stosunkowo podatnymi na substytucję
elektrofilową - z pierścieniem aktywowanym.
Azozwiązki alifatyczne są często nietrwałe.
grupa azowa
Document Outline
- Kwasy karboksylowe
- Nazewnictwo
- Własności fizyczne i chemicze
- Slide 4
- Otrzymywanie kwasów karboksylowych
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
Wyszukiwarka
Podobne podstrony:
Kwasy Karboksylowe i ich pochodne
KWASY KARBOKSYLOWE I ICH SOLE, farmacja cm umk, Farmacja III rok, chemia leków
przykładowe zadania kwasy organiczne i ich pochodne nazewnictwo
Kwasy i ich pochodne polecenai, Szkoła, Biologia
7 kwasy karboksylowe&pochodne 2
Kwasy i ich pochodne 09
Kwasy i ich pochodne polecena i odpowiedzi, Szkoła, Biologia
Kwasy i ich pochodne 09
7 kwasy karboksylowe&pochodne
8 Kwasy karboksylowe i pochodne Nieznany (2)
Kwasy karboksylowe i pochodne(14)GOHAR
7 kwasy karboksylowe i pochodne materiały cd
7 kwasy karboksylowe i pochodne materiały
Kwasy karboksylowe są to związki organiczne pochodne węglowodorów
Kwasy i ich pochodne polecenai, Szkoła, Biologia
więcej podobnych podstron