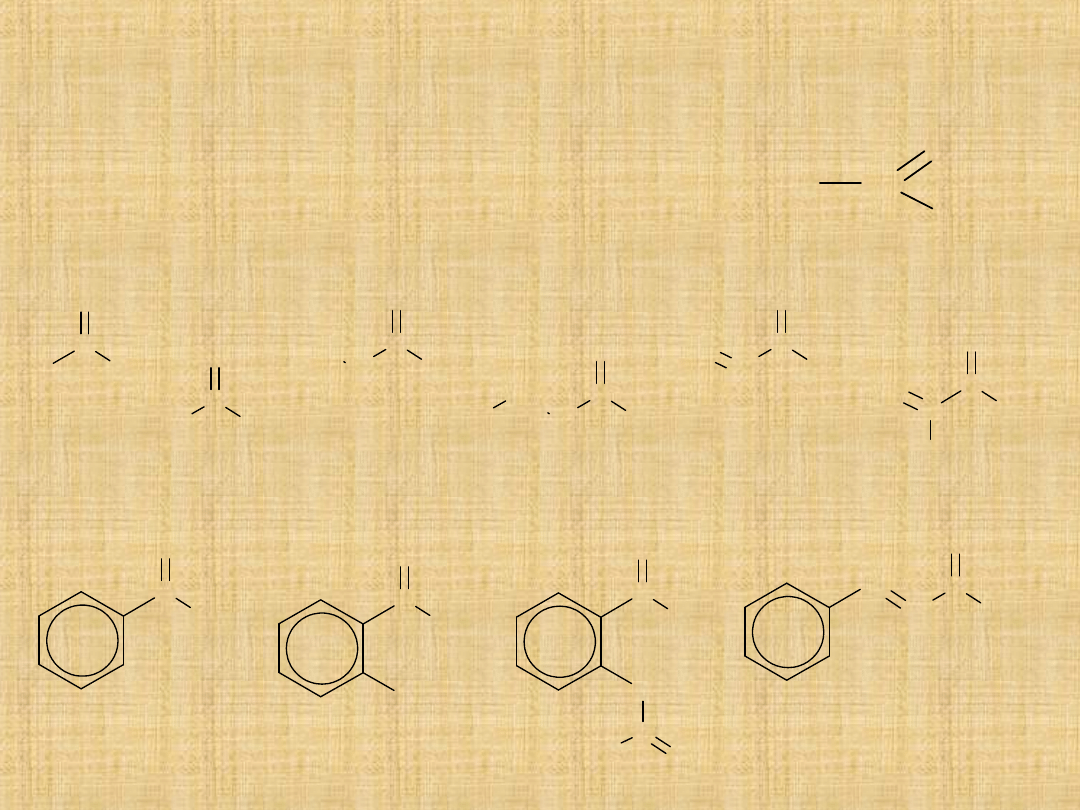
Kwasy karboksylowe
OH
C
H
O
OH
C
CH
3
O
CH
3
OH
C
CH
2
O
CH
2
CH
3
OH
C
CH
2
O
CH
2
OH
C
CH
O
CH
3
CH
2
OH
C
C
O
OH
C
O
OH
C
O
OH
O
C
CH
3
O
OH
C
O
OH
C
CH
O
CH
mrówkowy
propionowy
akrylowy
metakrylowy
salicylowy
acetylosalicylowy
benzoesowy
masłowy
octowy
cynamonowy
Największą kwasowość spośród związków organicznych
wykazują kwasy karboksylowe.
Związki te zawierają w cząsteczce grupą karboksylową –
COOH,
połączoną albo z grupą alkilową R (RCOOH)
albo grupą arylową Ar (ArCOOH).
C
O
OH

Nazewnictwo
C
C
C
C
C
C
O
OH
C
6
5
4
3
2
1
Tworzenie nazw polega na dodaniu do nazwy węglowodoru końcówki
–owy
i słowa kwas. Szeroko stosowane są też tradycyjne nazwy zwyczajowe
tych związków.
HCOOH
kwas metanowy (mrówkowy)
CH
3
COOH
kwas etanowy (octowy)
CH
3
CH
2
COOH kwas propanowy (propionowy)
CH
3
CH
2
CH
2
COOH kwas butanowy (masłowy)
CH
3
CH
2
CH
2
CH
2
COOH kwas pentanowy (walerianowy)
Miejsce przyłączenia podstawnika do łańcucha podstawowego wskazuje się w
nazwie liczbą odpowiadającą kolejnemu numerowi wągla w łańcuchu. Za
atom C-1 uważa się atom węgla grupy karboksylowej.
W nazewnictwie zwyczajowym kolejne atomy węgla sąsiadujące z węglem
grupy karboksylowej oznacza się kolejnymi literami greckimi (α, β, γ itd.).
Atom węgla α w nazwie zwyczajowej odpowiada atomowi C-2 w nazwie
systematycznej.
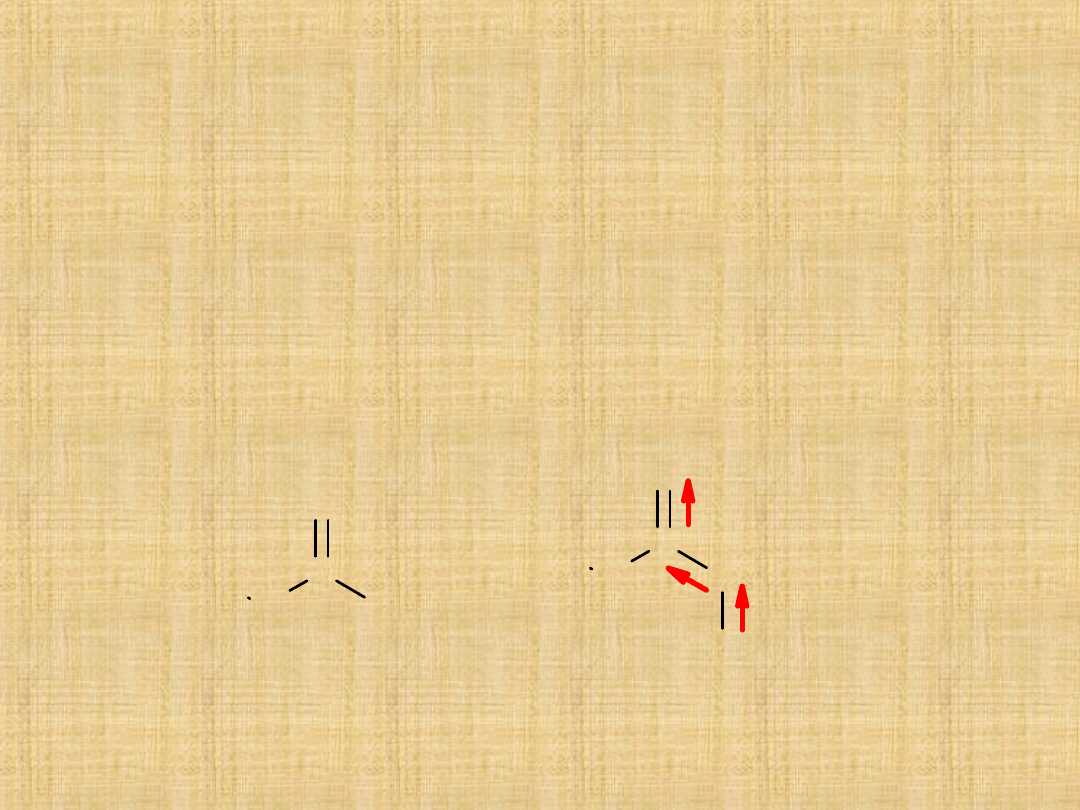
Budowa związku
Grupa funkcyjna zbudowana jest z dwóch części:
1. grupy karbonylowej C=O
2. grupy hydroksylowej –OH
Każda z tych grup oddzielnie nie wykazuje własności kwasowych.
Na skutek indukcji zachodzi przesunięcie elektronów od atomu
wodoru ku atomowi tlenu. W wyniku tego następuje osłabienie
wiązania wodór – tlen, co ułatwia oderwanie protonu.
O
CH
2
C
O
CH
3
H
Z reguły kwasy organiczne są kwasami słabymi, ulegającymi tylko
w nieznacznym stopniu dysocjacji na jony.
OH
CH
2
C
O
CH
3
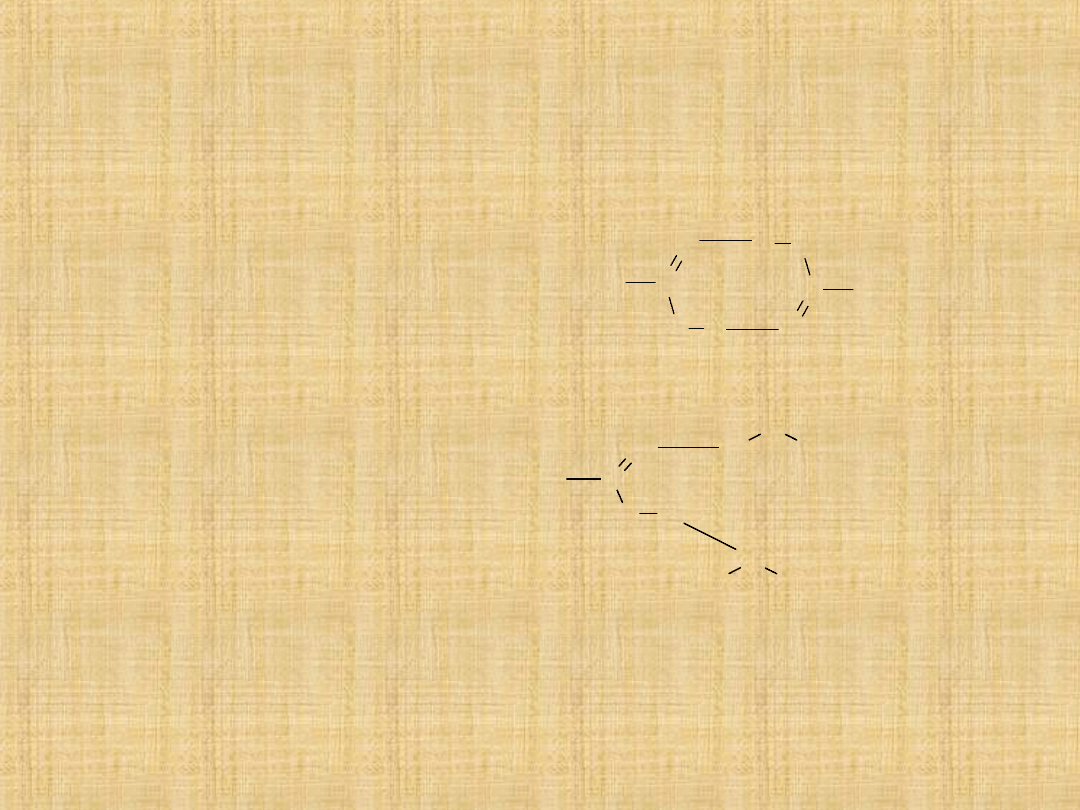
Własności fizyczne
Kwasy karboksylowe są związkami polarnymi i podobnie
jak alkohole silnie zasocjowanymi stąd wysoka
temperatura wrzenia wywołana tworzeniem wiązań
wodorowych.
C
O
O
R
H
C
O
O
R
H
-asocjacja pomiędzy czasteczkami
kwasów karboksylowych
-asocjacja pomiędzy wodą i kwasem
C
O
O
R
H
H
O
H
H
O
H
Wskutek możliwości koasocjacji z cząsteczkami wody kwasy
karboksylowe C1-C4 łatwo są rozpuszczalne w wodzie kwas
walerianowy (C5) rozpuszcza się częściowo,wyższe
homologi kwasów są praktycznie nierozpuszczalne.
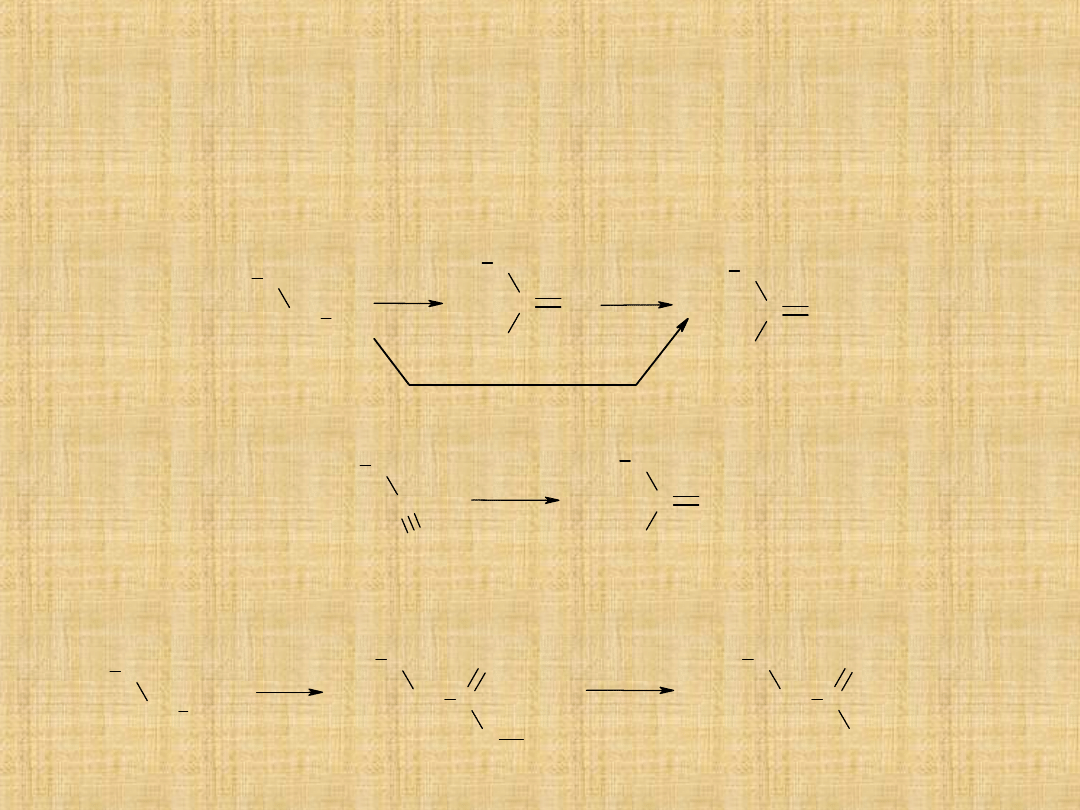
Otrzymywanie kwasów karboksylowych
Utlenianie alkoholi 1°-rzędowych
Można utlenić do aldehydów, stosując mieszaninę K
2
Cr
2
O
7
i
rozcieńczonego kwasu siarkowego. Utlenianie do kwasu realizuje się
przez ogrzewanie z roztworem KMnO
4
.
CH
3
CH
2
C
O
H
CH
3
CH
2
CH
2
OH
CH
3
CH
2
C
O
OH
[O]
[O]
KMnO
4
Hydroliza nitryli (poprzez ogrzewanie nitrylu z wodnym
roztworem kwasu mineralnego)
Reakcja związków Grignarda z dwutlenkiem węgla
CH
3
CH
2
C
N
CH
3
CH
2
C
O
OH
H
2
O/H
+
CH
3
CH
2
CH
2
MgBr
CH
2
CH
2
C
OH
O
CH
3
CH
2
CH
2
C
O
O
CH
3
MgBr
CO
2
H
2
O/H
+
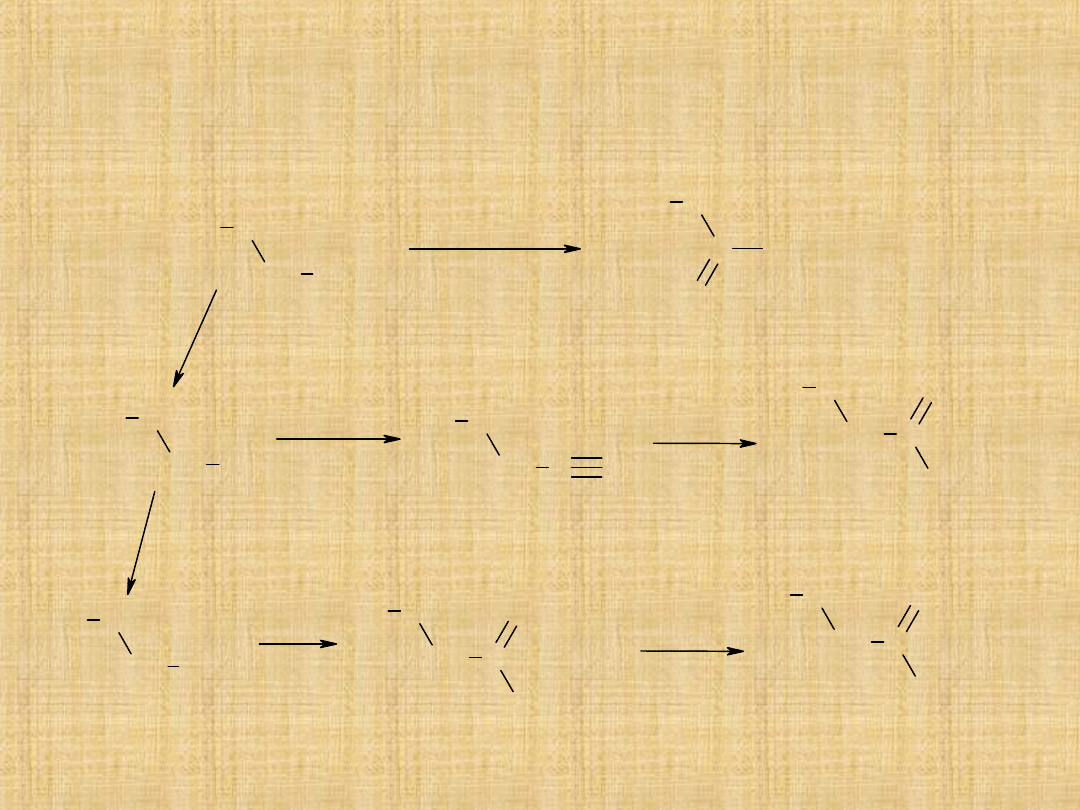
Otrzymywanie kwasów karboksylowych
Schemat syntez z alkoholi:
CH
3
CH
2
CH
2
MgBr
CH
2
CH
2
C
OH
O
CH
3
CH
3
CH
2
CH
2
OH
CH
3
CH
2
C
OH
O
CH
3
CH
2
CH
2
Br
C
CH
3
CH
2
CH
2
N
CH
2
CH
2
C
OH
O
CH
3
CH
2
CH
2
C
OMgBr
O
CH
3
CO
2
H
2
O/H
+
[O]
HBr
NaCN
Mg
H
2
O/H
+
(C
3
)
(C
3
)
(C
4
)
(C
4
)
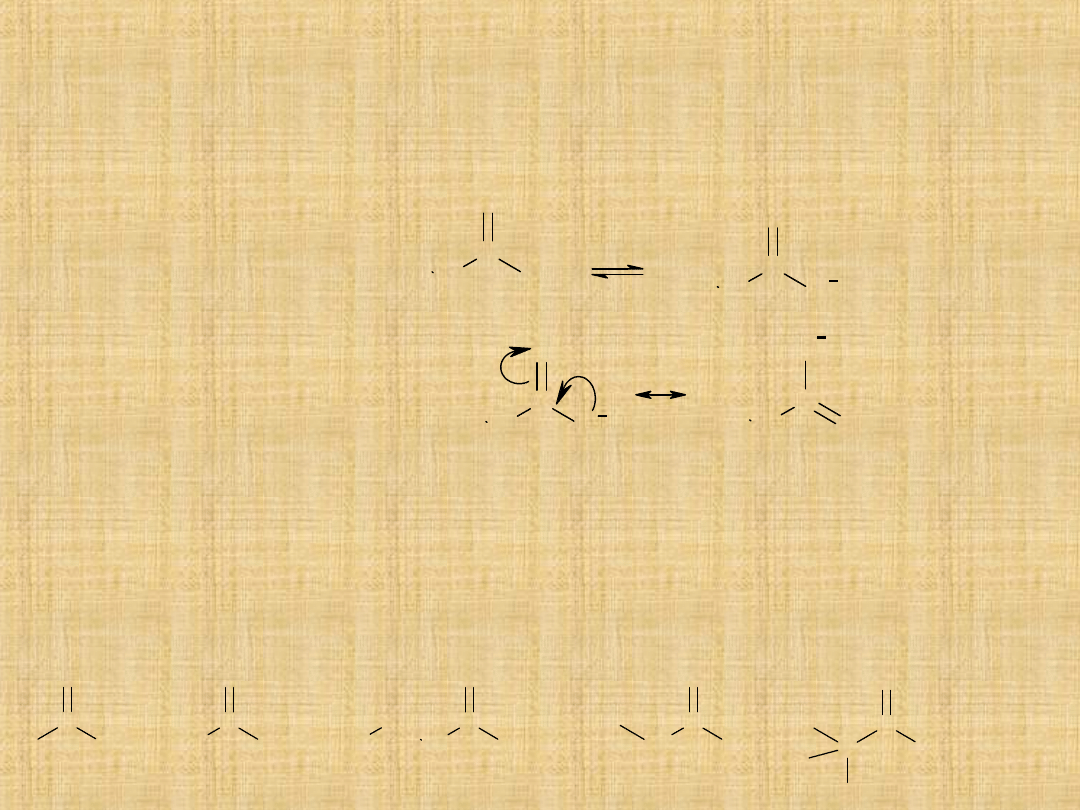
Reakcje kwasów karboksylowych
1.Reakcje wodoru grupy
hydroksylowej
Kwasowość kwasów
karboksylowych związana
jest z ich strukturą
(silna stabilizacją ich
anionu przez rezonans)
Wpływ podstawników na kwasowość
Podstawniki przyciągające elektrony (elektronoakceptorowe)
redukują ładunek ujemny anionu karboksylowego – stabilizują
go, zwiększając moc kwasów.
Podstawniki elektronodonorowe powoduja zmniejszenie mocy
stała kwasowości
K
a
×10
5
:
O
CH
2
C
O
CH
3
O
CH
2
C
O
CH
3
O
CH
2
C
O
CH
3
OH
CH
2
C
O
CH
3
+ H
+
OH
H
C
O
17,
7
OH
CH
3
C
O
1,7
5
CH
3
OH
CH
2
C
O
CH
2
1,5
2
OH
CH
2
C
O
Cl
13
6
OH
C
C
O
Cl
Cl
Cl
2320
0

Kwasowość kwasów karboksylowych
Kwasowość kwasów karboksylowych jest przyczyną tworzenia soli.
Działanie na metale
Powoduje utlenienie metalu do jonu przez jon wodorowy z
jednoczesna redukcją tego ostatniego do wolnego wodoru.
2CH
3
COOH + Zn (CH
3
COO)
2
Zn + H
2
Reakcja z wodorotlenkami, tlenkami metali, węglanami
CH
3
COOH + NaOH CH
3
COONa + H
2
O
2CH
3
COOH + HgO (CH
3
COO)
2
Hg + H
2
O
2CH
3
COOH +CaCO
3
(CH
3
COO)
2
Ca + H
2
O + CO
2
CH
3
COOH + NH
4
OH CH
3
COONH
4
+ H
2
O
Sole niższych kwasów karboksylowych są łatwo
rozpuszczalne w wodzie, co można wykorzystać do
wydzielenia kwasów karboksylowych z mieszanin z innymi
związkami organicznymi.

Podstawianie grupy hydroksylowej w
kwasch
-tworzenie chlorków kwasowych
CH
2
CH
2
C
OH
O
CH
3
CH
2
CH
2
C
Cl
O
CH
3
PCl
5
, PCl
3
lub SOCl
2
O
H
CH
3
CH
3
OH
CH
2
C
O
CH
2
O
CH
3
CH
3
CH
2
C
O
CH
2
H
+
+
+
H
2
O
CH
3
CH
2
C
OH
O
CH
3
CH
2
C
Cl
O
CH
3
CH
2
C
NH
2
O
CH
3
NH
2
CH
3
CH
3
CH
2
C
NH
O
PCl
5
+
NH
4
Cl
NH
3
-przekształcanie w amidy
-tworzenie estrów
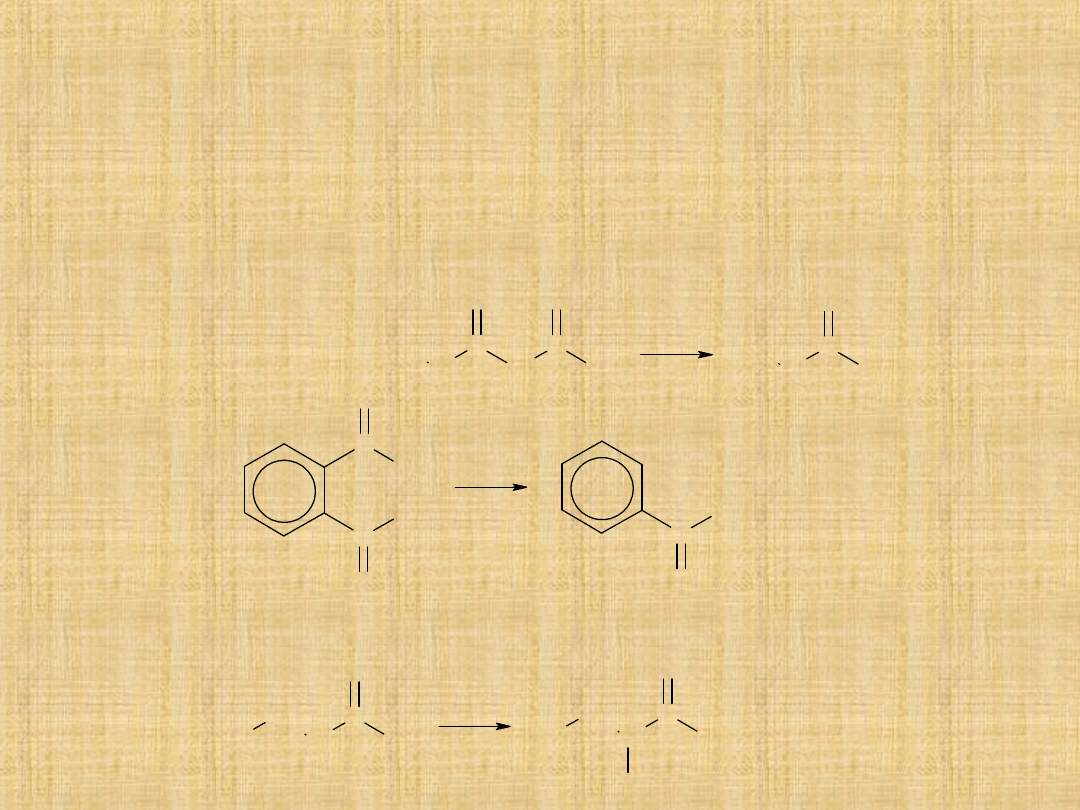
Pozostałe reakcje kwasów karboksylowych
Redukcja kwasów do alkoholi ma znaczenie praktyczne ze względu
na dostępność niektórych kwasów w wyniku hydrolizy tłuszczów.
Doskonałym reduktorem jest LiAlH
4
RCOOH R CH
2
OH
Reakcje
dekarboksylacji – są
to reakcje w których
cząsteczka kwasu
rozkłada się z
wydzieleniem
dwutlenku węgla.
Chlorowanie kwasów w grupie alkilowej lub arylowej
CH
3
CH
2
OH
CH
2
C
O
C
O
CH
3
CH
2
CH
3
C
O
T
+
CO
2
OH
C
O
O
CH
3
C
O
CH
3
C
T
+
CO
2
CH
3
OH
CH
2
C
O
CH
2
CH
3
OH
CH
C
O
CH
2
Cl
Cl
2
/P
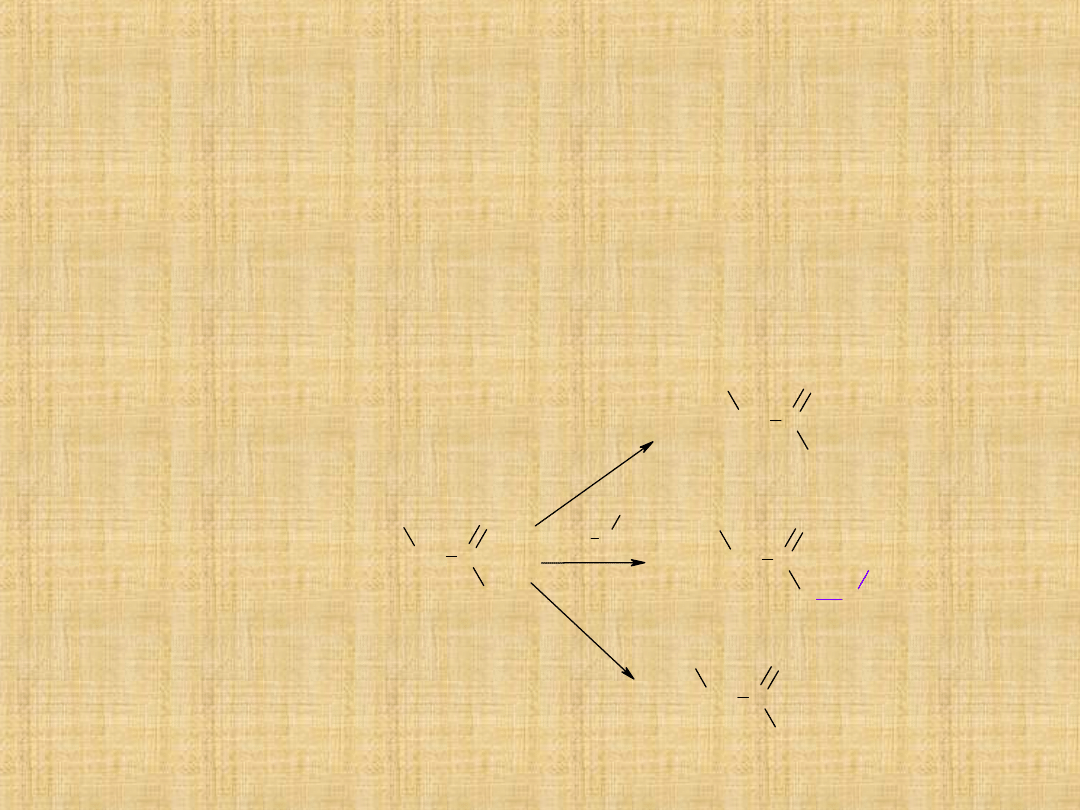
Pochodne kwasów karboksylowych
Są to związki, w których grupa
–OH
w grupie karboksylowej została
zastąpiona odpowiednim ugrupowaniem
–Cl
(chlorki kwasowe),
–
OCOR
(bezwodniki),
–NH
2
(amidy),
–OR’
(estry).
Chlorki kwasowe (R–COCl) podobnie jak inne pochodne kwasów
karboksylowych
ulegają
substytucji
nukleofilowej.
Następuje
odszczepienie jonu chlorkowego, a jego miejsce zajmuje grupa o
charakterze zasadowym.
Chlorki kwasowe są bardzo reaktywne.
Ich podstawowe reakcje to:
1)przemiana w kwasy i ich pochodne
-hydroliza
-alkoholiza
-amonoliza
CH
3
CH
2
C
Cl
O
CH
3
CH
2
O
CH
3
CH
2
C
O
CH
3
CH
2
OH
CH
3
CH
2
C
OH
O
CH
3
CH
2
C
NH
2
O
NH
3
H
2
O
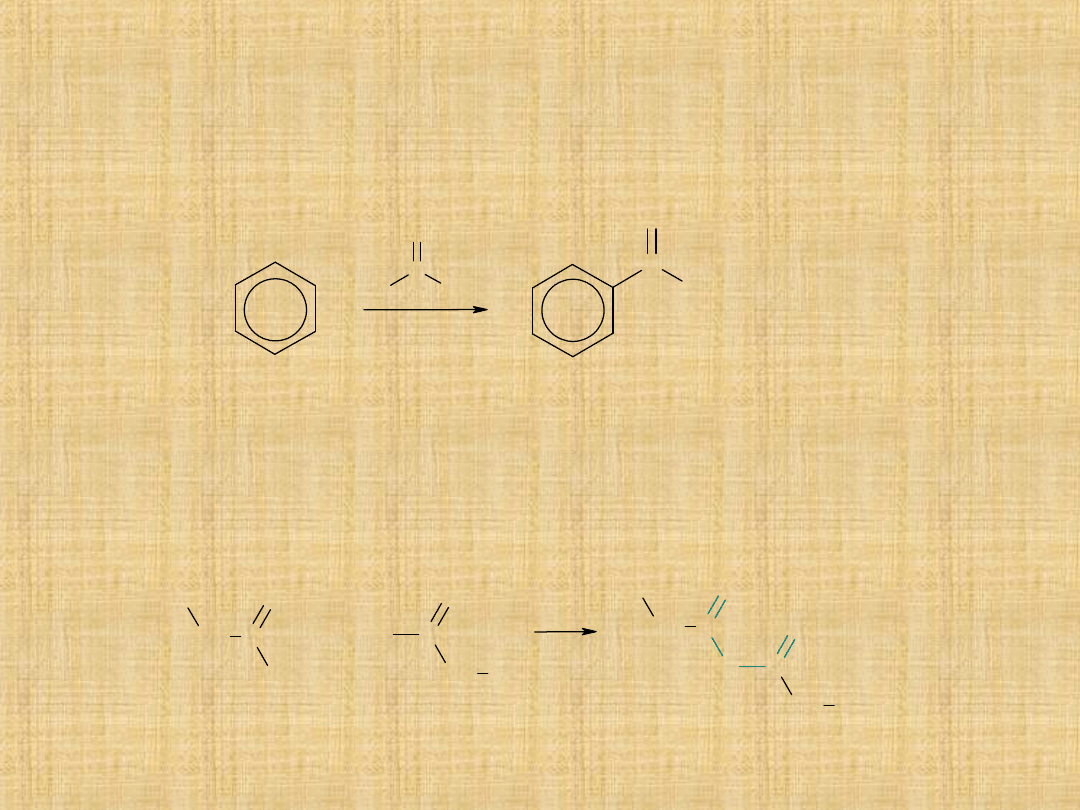
Pochodne kwasów karboksylowych
Reakcje chlorków kwasowych:
2) Acylowanie metodą Friedla -Craftsa
CH
3
CH
2
C
Cl
O
CH
3
CH
2
C
NaO
O
CH
3
CH
2
C
O
O
CH
3
CH
2
C
O
+
O
CH
3
C
O
CH
3
C
Cl
AlCl
3
3) Tworzenie bezwodników kwasowych
Są to pochodne kwasów karboksylowych, w których dwie grupy
hydroksylowe (OH) podstawione są atomem tlenu. Otrzymywane są
najczęściej w reakcji:
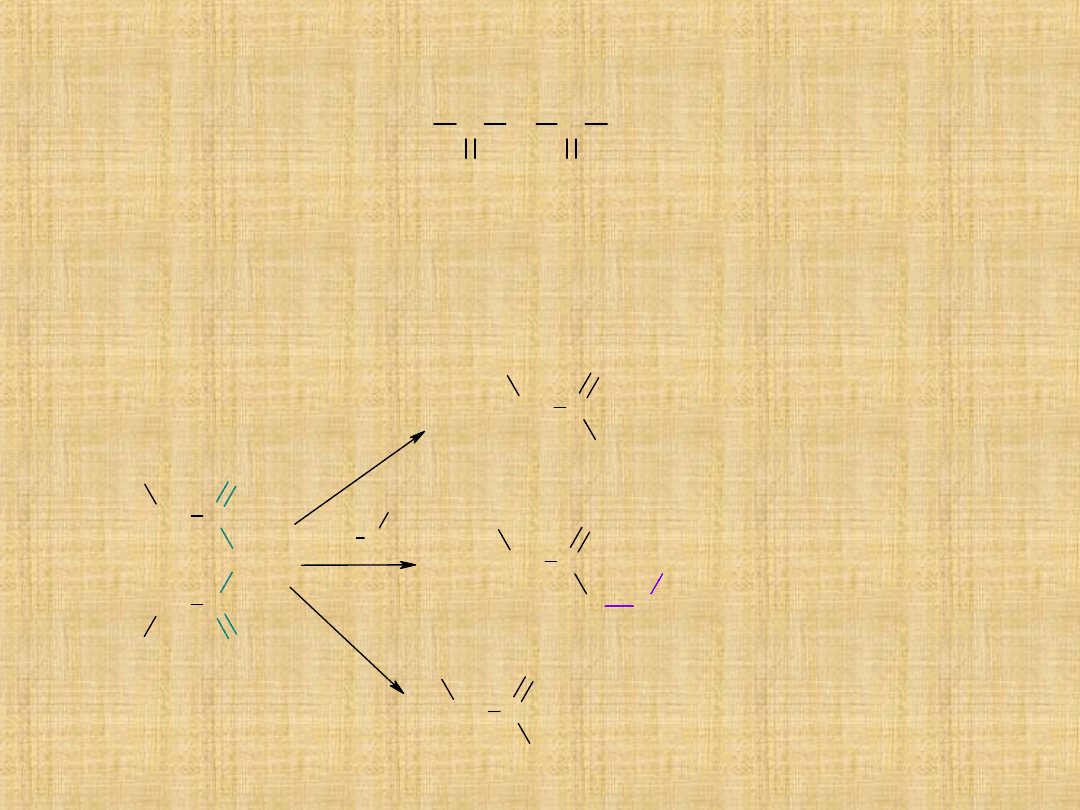
Bezwodniki kwasowe
R C
O
O C
O
R
Bezwodniki kwasowe ulegają takim samym reakcjom jak
chlorki kwasowe, przy czym zamiast cząsteczki
HCl
w
reakcjach tworzy się
cząsteczka kwasu karboksylowego
.
CH
3
CH
2
C
O
CH
3
CH
2
C
O
O
CH
3
CH
2
O
CH
3
CH
2
C
O
CH
3
CH
2
OH
CH
3
CH
2
C
OH
O
CH
3
CH
2
C
NH
2
O
NH
3
H
2
O
2
+ C
2
H
5
COONH
4
+ C
2
H
5
COOH

Estry (RCOOR’)
Jeśli w reakcji bierze udział alkohol i kwas nieorganiczny,
powstaje ester nieorganiczny.
Reakcje te mają charakter odwracalny Zamiast kwasów w
reakcji estryfikacji można wykorzystać bezwodniki lub chlorki
kwasowe. Np.
RCOCl + R’OH RCOOR’ + HCl reakcja ma charakter
nieodwracalny.
Nitroestry (azotany) mają właściwości
wybuchowe.
OH
CH
3
C
O
CH
3
CH
2
CH
2
O
H
CH
2
CH
3
CH
2
CH
2
CH
2
O
CH
3
C
O
H
+
+
+
H
2
O
Estry są związkami powstałymi przez eliminację wody w
reakcji alkoholu z kwasem.
OH
CH
3
CH
2
O
N
O
CH
3
CH
2
O
HNO
3
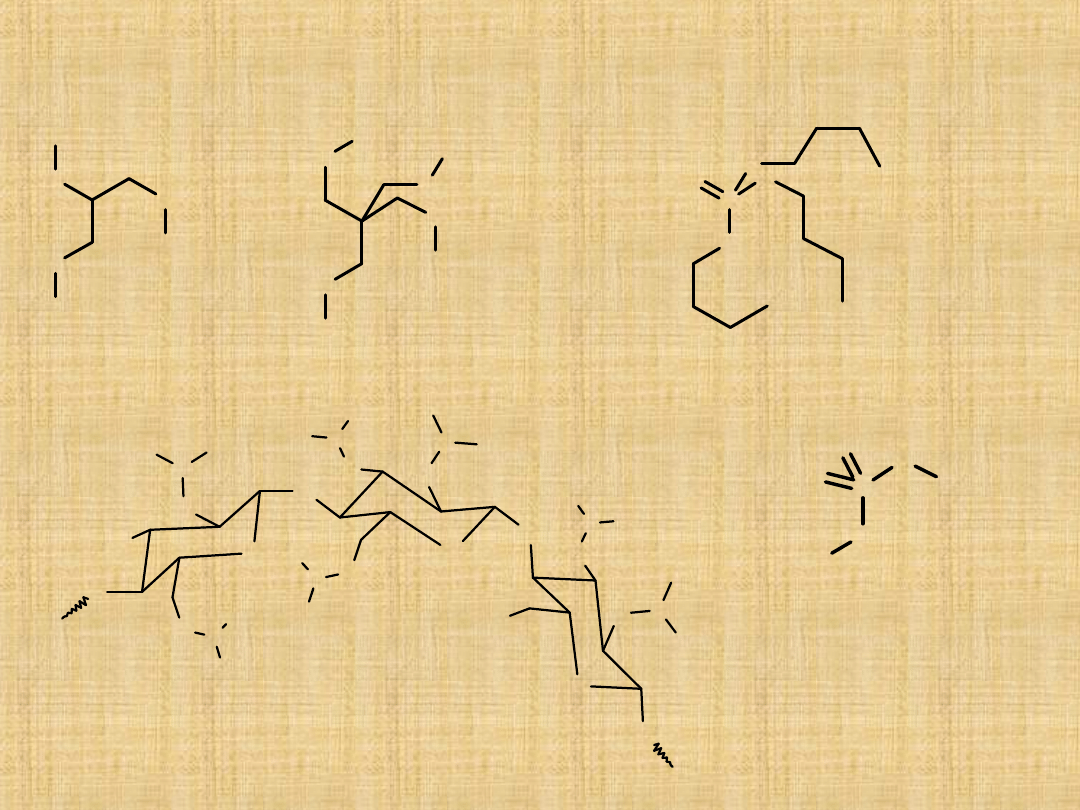
Estry nieorganiczne
O
O
O
NO
2
NO
2
NO
2
nitrogliceryn
a
O
NO
2
O
NO
2
O
NO
2
O
NO
2
pentryt
P
O
O
O
O
fosforan
tributylu
S
O
CH
3
O
O
C
H
3
O
siarczan
dimetylu
O N
O
O
O
O
O
O
H
N
O
O
O
O
O
O
H
O
O
N
O
O
N
O
O
O
O
O
O
O
N
O
O
N
O
O
N
O
O
nitroceluloza
Podstawowe reakcje estrów
Estry ulegają substytucji nukleofilowej.
W wyniku reakcji grupa –OR’ zostaje zastąpiona grupą –OH, –OR”
lub –NH
2
.
:Z = :OH
–
, :OR”
–
, :NH
3
1.Hydroliza
OR
CH
3
C
O
OR
CH
3
C
O
Z
Z
CH
3
C
O
+
+
OR
–
:Z
–
OH
CH
3
C
O
CH
3
O
H
CH
2
CH
3
CH
2
O
CH
3
C
O
H
+
+
+
H
2
O
O
CH
3
C
O
CH
3
O
H
CH
2
CH
3
CH
2
O
CH
3
C
O
OH
+
+
kwasowa
odwracalna
zasadowa
nieodwracaln
a
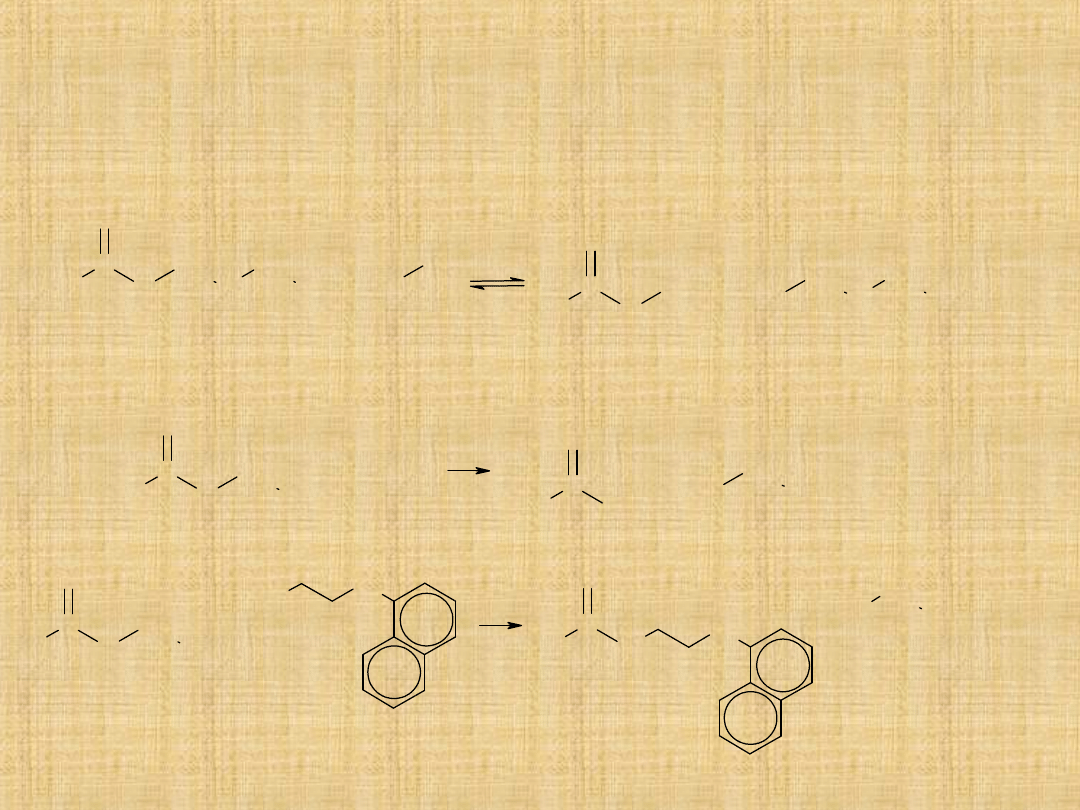
Podstawowe reakcje estrów
3. Amonoliza
2.Transestryfikacja - czynnikiem nukleofilowym jest cząsteczka
alkoholu.
NH
2
CH
3
C
O
CH
3
O
H
CH
2
CH
3
CH
2
O
CH
3
C
O
+
+
NH
3
CH
3
CH
2
CH
2
O
H
CH
2
CH
3
CH
2
CH
2
CH
2
O
CH
3
C
O
CH
3
O
H
CH
3
O
CH
3
C
O
H
+
+
+
CH
3
O
H
CH
2
CH
3
CH
2
O
CH
3
C
O
NH
2
NH
NH
NH
CH
3
C
O
+
+
N-(1-naftylo)-etylenodiamina
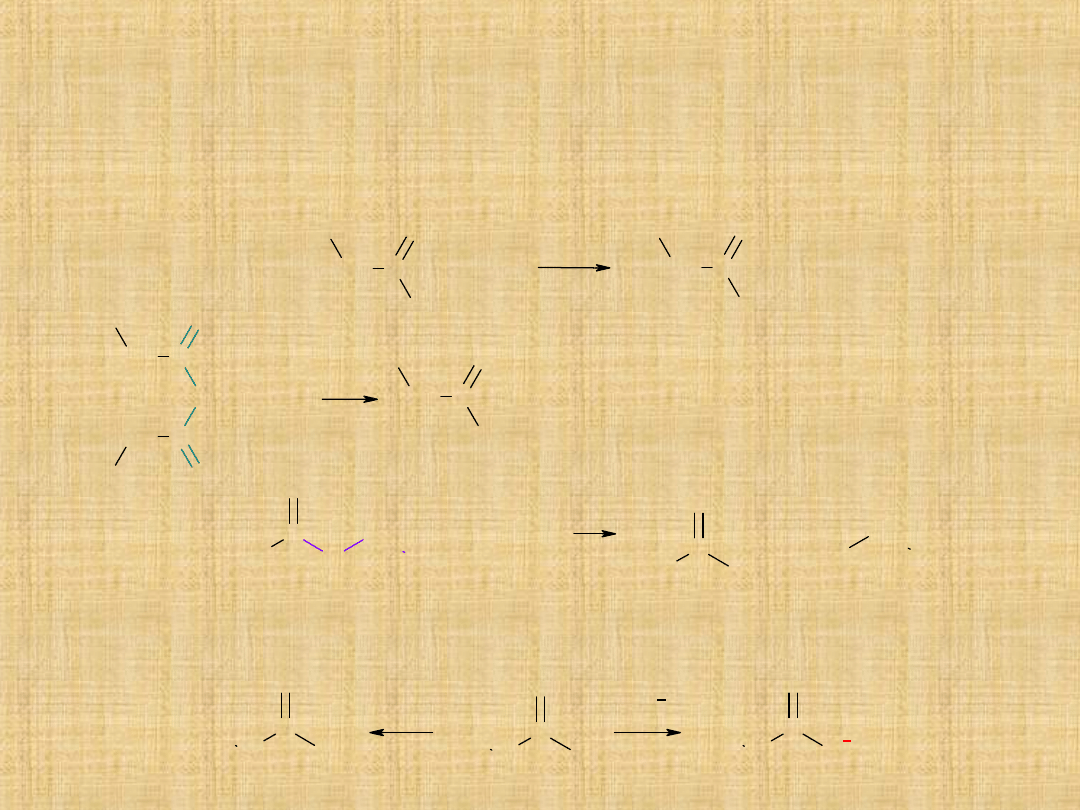
Amidy (RCONH
2
)
Amidy otrzymuje się w reakcji amoniaku z chlorkami kwasów
karboksylowych lub odpowiednimi bezwodnikami.
CH
3
CH
2
C
Cl
O
CH
3
CH
2
C
NH
2
O
NH
4
Cl
NH
3
+
+
CH
3
CH
2
C
O
CH
3
CH
2
C
O
O
CH
3
CH
2
C
NH
2
O
NH
3
+ C
2
H
5
COONH
4
+
NH
2
CH
3
C
O
CH
3
O
H
CH
2
CH
3
CH
2
O
CH
3
C
O
+
+
NH
3
Najważniejszą reakcją amidów jest hydroliza do kwasów
karboksylowych
NH
2
CH
2
C
O
CH
3
O
H
3
+
OH
OH
CH
2
C
O
CH
3
O
CH
2
C
O
CH
3
Podsumowanie
CH
3
CH
2
C
OH
O
CH
3
CH
2
C
Cl
O
CH
3
CH
2
O
CH
3
CH
2
C
O
CH
3
CH
2
C
NH
2
O
CH
3
CH
2
C
O
O
CH
3
CH
2
C
O

Tłuszcze
Tłuszcze pod względem chemicznym są estrami różych kwasów
karboksylowych oraz jednego tylko alkoholu
trójwodorotlenowego – gliceryny. Stąd ogólna ich nazwa
glicerydy.
Są to więc dokładnie triacylowe pochodne gliceryny.
CH
2
CH
O
CH
2
O
O
C
C
C
O
R1
O
R2
O
R3
triacylowy ester gliceryny
(gliceryd)
R1 R2 R3
(przeważnie)
Proporcje różnych kwasów zmieniają się w zależności od
rodzaju tłuszczu.
W zależności od składu chemicznego tłuszcze mają
charakter stały, półstały (mazisty) lub ciekły.

Otrzymywanie
1) Tłuszcze zwierzęce (głównie stałe) otrzymuje się z tkanek
tłuszczowych na drodze wytapiania, obecnie zwykle przez
ekstrakcję – rozpuszczenie tłuszczów w benzynie a następnie jej
oddestylowanie..
Tłuszcz ciekły Tłuszcz stały
Reakcja biegnie w procesie uwodornienia, jako
katalizatora używamy Ni Raney`a w temperaturze
~200°C i ciśnieniu ~2 atm.
Proces utwardzenia tłuszczu ciekłego (oleju) prowadzi się do
uzyskania produktu o pożądanym stopniu nienasycenia.
Stopień nienasycenia określa tzw. liczba jodowa. (Określa ilość
gramów I
2
, która przyłącza się do wiązań podwójnych w 100g
tłuszczu).
2) Tłuszcze roślinne (oleje) – poprzez wyciskanie, na zimno
lub na gorąco.
Tłuszcze ciekłe można obecnie przeprowadzić w stałe drogą
katalitycznego procesu zwanego utwardzaniem.

Kwasy tłuszczowe
Podstawowe kwasy wchodzące w skład tłuszczów
Nasycone np. kwas palmitynowy C
15
H
31
COOH, kwas
stearynowy C
17
H
35
COOH. Są to kwasy stałe, T
topn
poniżej 100°C,
powyżej 12 atomów węgla w cząsteczce, nierozpuszczalne w
wodzie.
Nienasycone
a. Jedno podwójne wiązanie – np. kwas oleinowy C
17
H
33
COOH,
kwas erukowy C
22
H
43
COOH
b. Dwa podwójne wiązania – np. kwas linolowy C
18
H
31
COOH
c. Więcej niż dwa podwójne wiązania – np. kwas linolenowy.
Kwasy z podwójnym wiązaniem są bardzo reaktywne.
Ulegają reakcjom:
– uwodornienia
– utlenienia.

Reakcje tłuszczów
1. Hydroliza tłuszczów – reakcja odwracalna
Reakcja biegnie w autoklawach
Z otrzymanych w ten sposób kwasów karboksylowych można
otrzymać mydła.
C
15
H
31
COOH + NaOH C
15
H
31
COONa + H
2
O
Palmitynian sodu (mydło
twarde)
OCOC
15
H
31
OCOC
15
H
31
CH
2
CH
OCOC
15
H
31
CH
2
OH
OH
CH
2
CH
OH
CH
2
+ 3H
2
O
H
+
+ 3C
15
H
31
COOH
trójpalmitynian gliceryny
(tłuszcz stały)
Reakcje tłuszczów cd.
2. Zmydlanie tłuszczów
Mydło można otrzymać podczas alkalicznej hydrolizy tłuszczów
– tzw. reakcji zmydlania
Oddzielanie mydła od gliceryny odbywa się przez dodanie
NaCl. Proces taki nazywamy wysalaniem mydła.
Mydła stosowane są jako m.in. składniki środków czystości
oraz materiałów smarnych, a także jako substancje
zagęszczające w bojowych środkach zapalających (napalm).
CH
2
CH
OCOC
17
H
35
CH
2
OCOC
17
H
35
OCOC
17
H
35
OH
OH
CH
2
CH
OH
CH
2
+3NaOH
+ 3C
17
H
35
COONa
trójstearynian gliceryny
(tłuszcz stały)
stearynian sodu

Woski
Woski są to estry nasyconych kwasów tłuszczowych (często
ponad 20 atomów węgla) i alkoholi o nierozgałęzionych długich
łańcuchach (do ponad 30 atomów węgla).
Np.:wosk pszczeli zawiera głównie palmitynian mircylu
C
15
H
31
COOC
31
H
63
Woski u roślin i zwierząt spełniają funkcję ochronną.
Powlekają cienką warstwą liście, owoce lub pióra, skórę
chroniąc przed działaniami bodżców zewnętrznych lub zbytnią
utratą wody drogą parowania.
Zastosowanie
Przemysł włókienniczy –powłoki wodoodporne,
farmaceutyczny,kosmetyczny (kremy, maści).
C
R
O
OR
1
R i R
1
- C
16
do
C
31
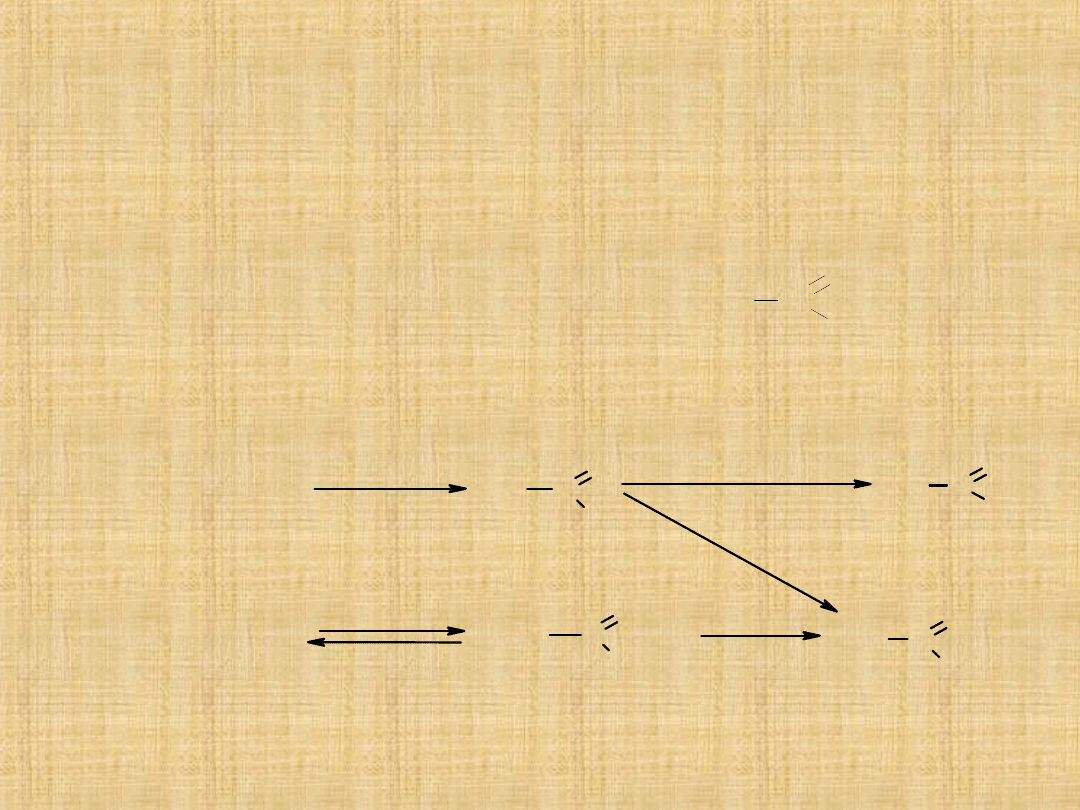
Pochodne kwasu węglowego
Podstawowe właściwości chemiczne pochodnych kwasu
węglowego są podobne do właściwości kwasów karboksylowych.
Najprostsze
przemiany:
C
O
H
O
OH
Trwałe są odmiany w których
podstawione są dwie grupy OH.
C
O
Cl
Cl
C
O
ONH
4
N
H
2
C
O
NH
2
N
H
2
C
O
OEt
EtO
+
Cl
2
C
akt
200
0
C
fosgen
CO
CO
2
+
2NH
3
karbaminian amonu
T
mocznik
NH
3
2EtOH
węglan dietylu

Mocznik
Zastosowanie
Nawóz sztuczny –w skład mocznika wchodzi ok..46.6%azotu a
więc jako nawóz sztuczny przewyższa on zawartością azotu takie
nawozy azotowe jak azotan i siarczan amonowy.
Do produkcji żywic mocznikowo –formaldehydów
Melamina
Przez polimeryzację cyjanoamidu powstaje jego trimer zwany
zwyczajowo-melaminą
W wyniku kondensacji melaminy z formaldehydem otrzymuje
się tzw. żywice melaminowe
C NH
2
N
H
2
O
N
CH
2
C
O
N CH
2
n
n
+
2n HCHO
2n H
2
O
+
N
H
2
C N
C
N
C
N
C
N
NH
2
NH
2
N
H
2
3
katalizator
melamina
Do produkcji leków-barbiturany (środki nasenne)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
7 kwasy karboksylowe&pochodne 2
8 Kwasy karboksylowe i pochodne Nieznany (2)
Kwasy karboksylowe i pochodne(14)GOHAR
7 kwasy karboksylowe i pochodne materiały cd
7 kwasy karboksylowe i pochodne materiały
7 kwasy karboksylowe&pochodne 2
Kwasy karboksylowe i pochodne(14)GOHAR
Kwasy karboksylowe i ich pochodne
Kwasy karboksylowe są to związki organiczne pochodne węglowodorów
Kwasy Karboksylowe i ich pochodne
KWASY KARBOKSYLOWEreaktyw 1
KWASY KARBOKSYLOWE id 256009 Nieznany
więcej podobnych podstron