
Hydroliza
wpływ stężenia soli słabego kwasu
na pH
Karolina Marchańska
Technologia chemiczna
13T1

Co to jest hydroliza?
Hydroliza jest to rozkład substancji pod wpływem wody, często
odwracalny. Ulegają jej sole słabych kwasów i mocnych zasad, sole
mocnych kwasów i słabych zasad oraz sole słabych kwasów i
słabych zasad.
Zjawisko hydrolizy wyjaśnia nam teoria Lowry'ego i Bronsteda.
Przykładem jest hydroliza CH3COONa, którą możemy zapisać w
nastepujący sposób:
CH3COONa ↔ CH3COO
-
+ Na
+
CH3COO- + HOH ↔ CH3COOH + OH-
zasada1
kwas2
kwas1
zasada2
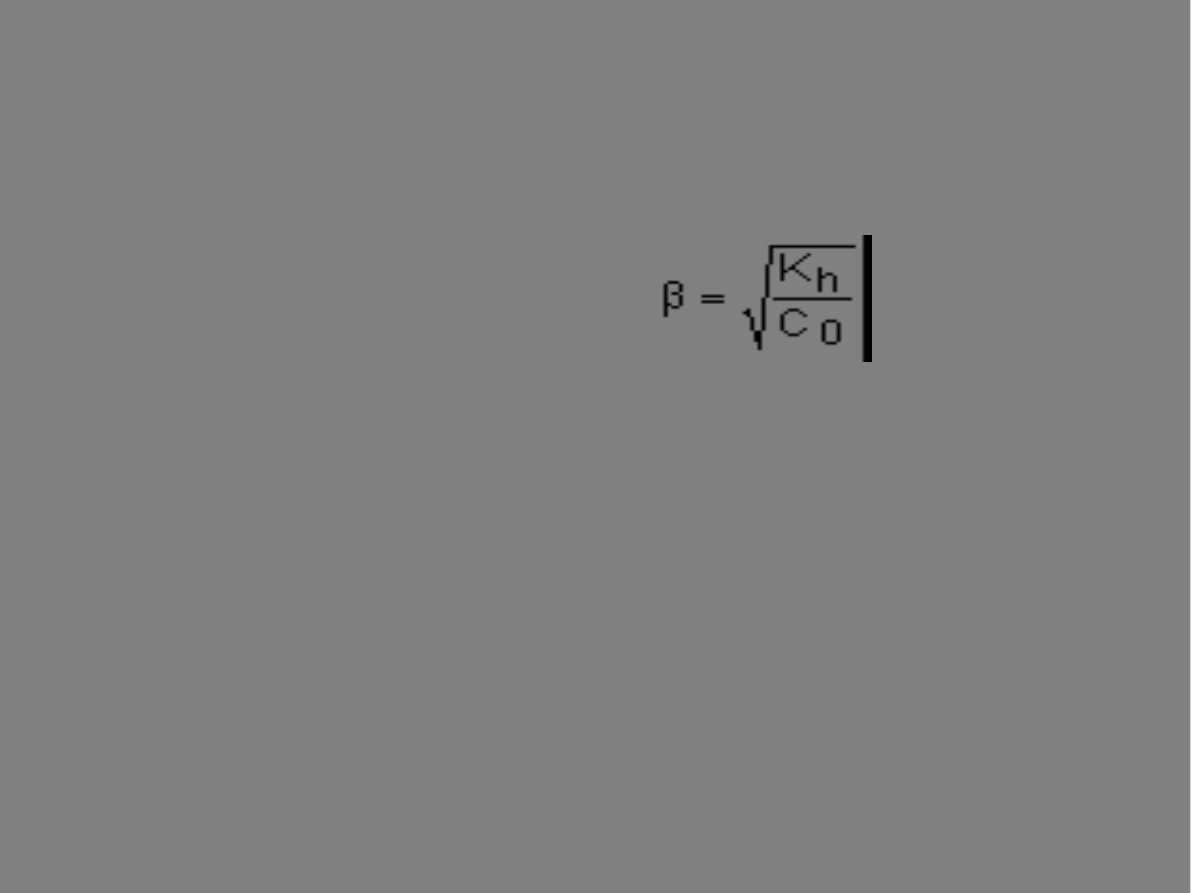
Stopień hydrolizy można
obliczyć także ze wzoru:
Miarą zaawansowania procesu hydrolizy jest stopień hydrolizy oznaczany
jako β i zdefiniowany jest jako stosunek liczby zhydrolizowanych
cząsteczek soli do liczby wszystkich rozpuszczonych cząsteczek soli.
stała hydrolizy soli mocnej zasady i słabego kwasu Kh jest równa:
Kh=Kw/Kk
stała hydrolizy soli słabej zasady i mocnego kwasu jest równa:
Kh=Kw/Kz
stała hydrolizy soli słabej zasady i słabego kwasu jest równa:
Kh=Kw/Kz·Kk
gdzie: Kw - iloczyn jonowy wody, Kk - stała dysocjacji słabego kwasu, Kz -
stała dysocjacji słabej zasady.

Do
obliczeń
wykorzystano
język
programowania scilab.
Dane potrzebne nam do obliczeń:
Stała dysocjacji słabego kwasu: 1,8*10
-5
Iloczyn jonowy wody: 1*10
-14
Stężenie początkowe soli: 1 mol/dm
3
Układ równań:
H
C
OH
OH
H
Kw
OH
Kh
0
1
C
0
zmnieniało się w 10
próbach:
1,0
-
0,0000001 mol/dm
3

Wyniki obliczeń:
1)K
h
= 0,004
pH=9,1
2)K
h
=0,0127
pH=8,6
3)K
h
=0,0402
pH=8,1
4)K
h
=0,1262
pH=7,6
5)K
h
=0,37
pH=7,2
6)K
h
=0,7564
pH=6,9
7)K
h
=0,9158
pH=6,8
8)K
h
=0,9379
pH=6,8
9)K
h
=0,9401
pH=6,8
10)K
h
=0,9404
pH=6,8
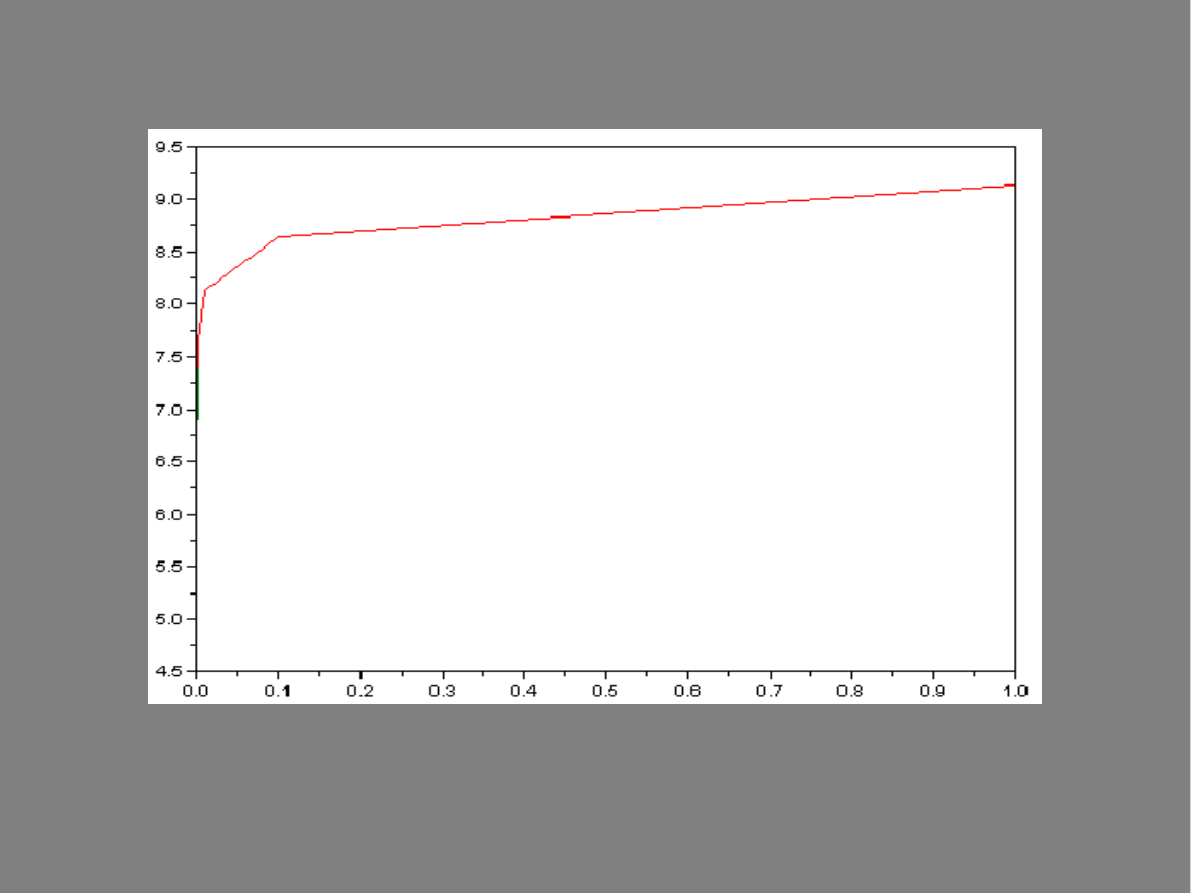
Wykres:
pH
Stała hydrolizy

Wnioski
W przypadku soli którą omawialiśmy wraz
ze spadkiem stężenia rośnie pH i stała
hydrolizy.

Koniec
Document Outline
Wyszukiwarka
Podobne podstrony:
Hydroliza poprawiona
hydro-egzamin-wype B3nione-poprawione, Studia PG, Semestr 05, Hydraulika i Hydrologia, Egzamin
Enzymatyczna hydroliza pektyn poprawione
hydra-laska-poprawione, Uczelnia - Politechnika Slaska, Hydrologia
Hydrologia cwiczenia 7 i 8 poprawione
Hydrologia cwiczenia 7 i 8 poprawione
POPRAWA HYDROLOGII
Hydrologia cwiczenia 7 i 8 poprawione
3 Zasady oddawania, poprawiania i oceniania projektu Pomiary hydrometryczne młynek i pływak z przed
Hydrologia cwiczenia 7 i 8 poprawione
test poprawkowy grupa 1
WADY STÓP poprawki
ZPSBN T 24 ON poprawiony
Prezentacja poprawiona
więcej podobnych podstron