
reakcje - inż. materiałowa
1
Treść wykładu
1. Rola chemii we współczesnym życiu. Podstawowe prawa i definicje.
Nazewnictwo chemiczne.
2. Występowanie pierwiastków we wszechświecie. Układ okresowy
pierwiastków – budowa i właściwości.
3. Atomy, cząsteczki i jony. Budowa atomu.
4. Gramoatom, mol, objętość molowa gazów. Elektroujemność
pierwiastków.
5. Wiązania chemiczne.
6. Chemia metali. Pierwiastki niemetaliczne i ich związki
7. Charakterystyka stanów materii.
8. Warunki przebiegu reakcji chemicznych. Katalizatory. Procesy
odwracalne.
Równowaga chemiczna.
9. Właściwości fizyczne roztworów. Roztwory wodne. Roztwory związków
jonowych. Dysocjacja elektrolityczna. Pojęcie pH.
10. Związki nieorganiczne. Kwasy i zasady.
11. Związki organiczne i ich nomenklatura.
12. Podstawy chemii organicznej. Właściwości fizyczne i chemiczne
polimerów.
13. Podstawowe zagadnienia z technologii chemicznej. Źródła energii.
14. Organiczne i nieorganiczne materiały dla przemysłu.
15. Woda jako medium stosowane do celów komunalnych i przemysłowych.
Jonity. Wybrane zagadnienia z chemii technicznej

reakcje - inż. materiałowa
2
Potencjał termodynamiczny
G = H - TS
G - pot. termodynamiczny (Energia użyteczna
reakcji)
S - zmiana entropii,
T - temperatura
TS - to energia „nieużyteczna”
H - całkowita zmiana energii
G 0 -
proces samorzutny
(tj. zwiększenie G
określonego wartością ujemną) tj. H 0
G= 0 -
proces w równowadze
G 0 -
proces wymuszony lub niemożliwy

reakcje - inż. materiałowa
3
Typy reakcji chemicznych
Reakcja chemiczna
jest to przemiana zachodząca na
zewnętrznych powłokach uczestniczących atomów.
Prowadzi zazwyczaj do powstania nowego związku
chemicznego.
Podział ogólny
SYNTEZA
A+B = AB
ANALIZA
AB = A+B
WYMIANA
A+BC = AC + B
AB+CD = AD + CB
Podział pod względem efektu energetycznego
-reakcje
egzotermiczne
(z wydzieleniem energii)
-reakcje
endotermiczn.
W chemii organicznej wyróżnia się jeszcze kilka innych
typów reakcji.
reakcje - inż. materiałowa
4
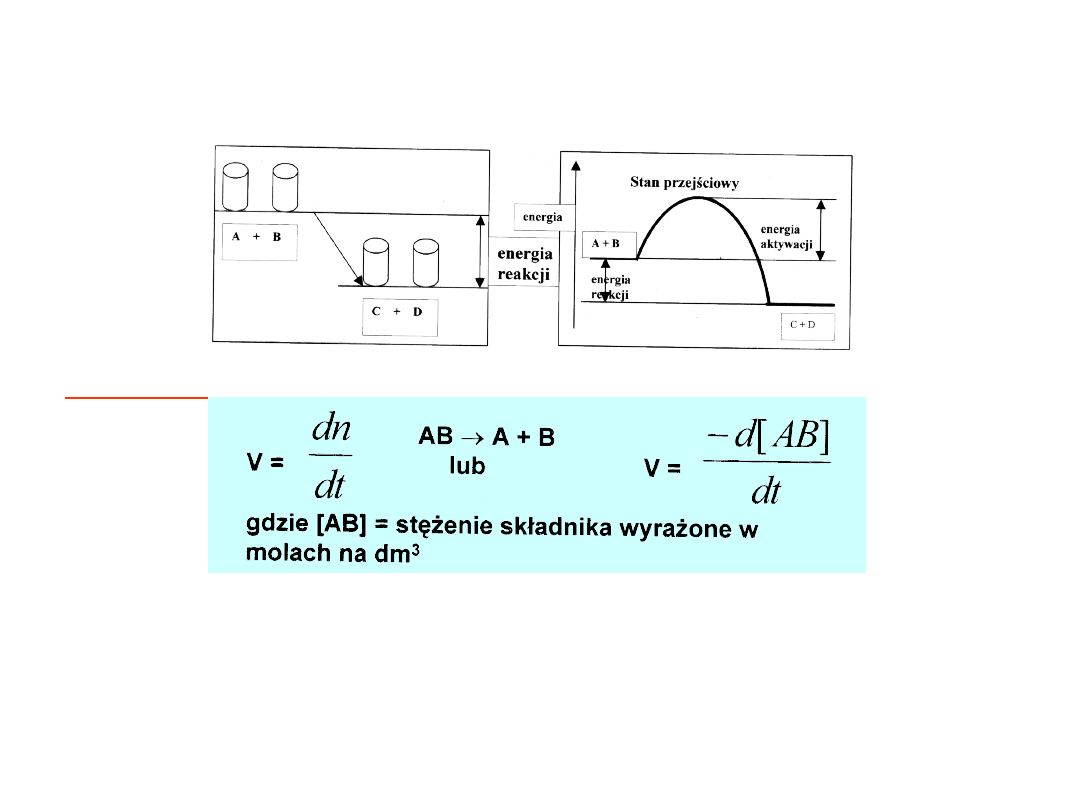
Kierunek przebiegu reakcji wyznacza zysk
energii.
A + B C + D + energia
Szybkość reakcii chemicznych
Szybkość reakcji zależy od:
– szansy zderzenia
– czynnika sterycznego
– energii aktywacji
V =

reakcje - inż. materiałowa
5
Energetyczne aspekty reakcjii
G = G – G*
K* - stała
równowagi dla
kompleksu
aktywnego

reakcje - inż. materiałowa
6
Szansa zderzenia
Wpływ stężenia:
(a)
A+B AB
k - stała szybkości reakcji
(b)
2A + B = A
2
B
(c) uogólnienie:
mA + nB + pC produkty
V =
d AB
dt
[
]
= k [AB]
V = k[A]
2
[B]
V = k[A]
m
[B]
n
[C]
p
reakcje - inż. materiałowa
7
Wpływ czynników zewnętrznych
Temperatura
Reguła van’t Hoffa
t = 0
o
v
t = 50o 32v 2
5
Ciśnienie
Ma znaczenie w
reakcjach w fazie
gazowej.
Wzrost temperatury o
każde 10
o
zwiększa
szybkość reakcji od 2 do
3 razy
v
t
reakcje - inż. materiałowa
8
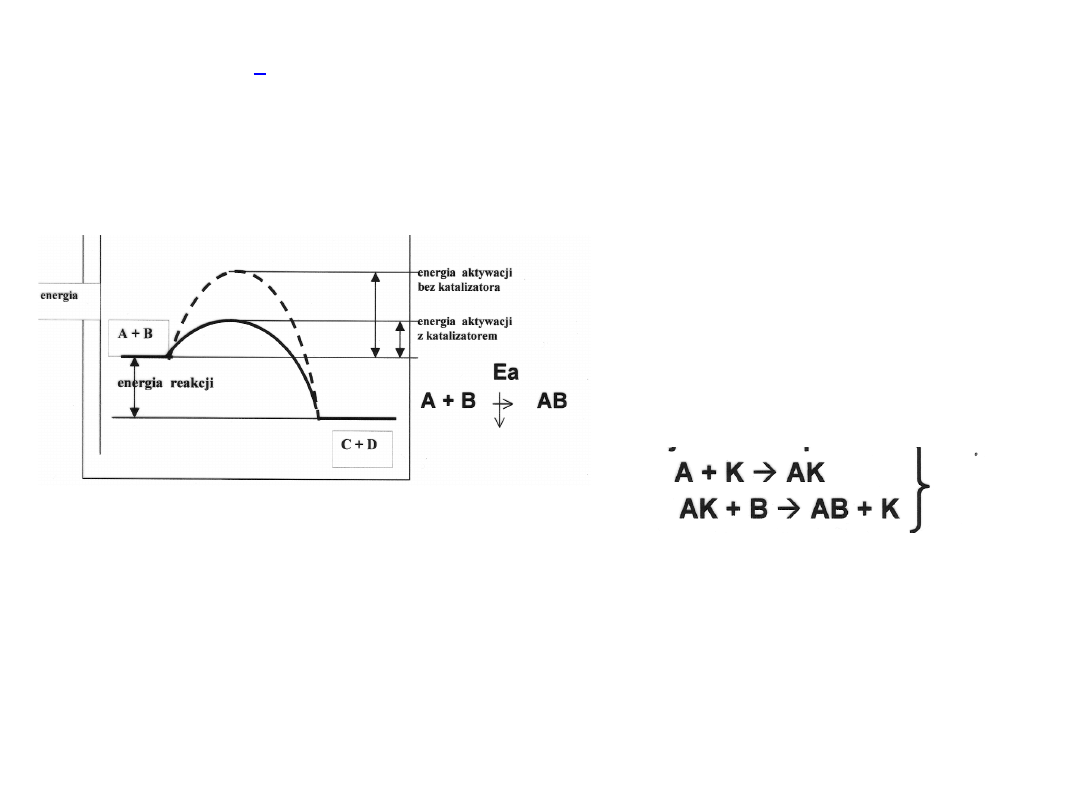
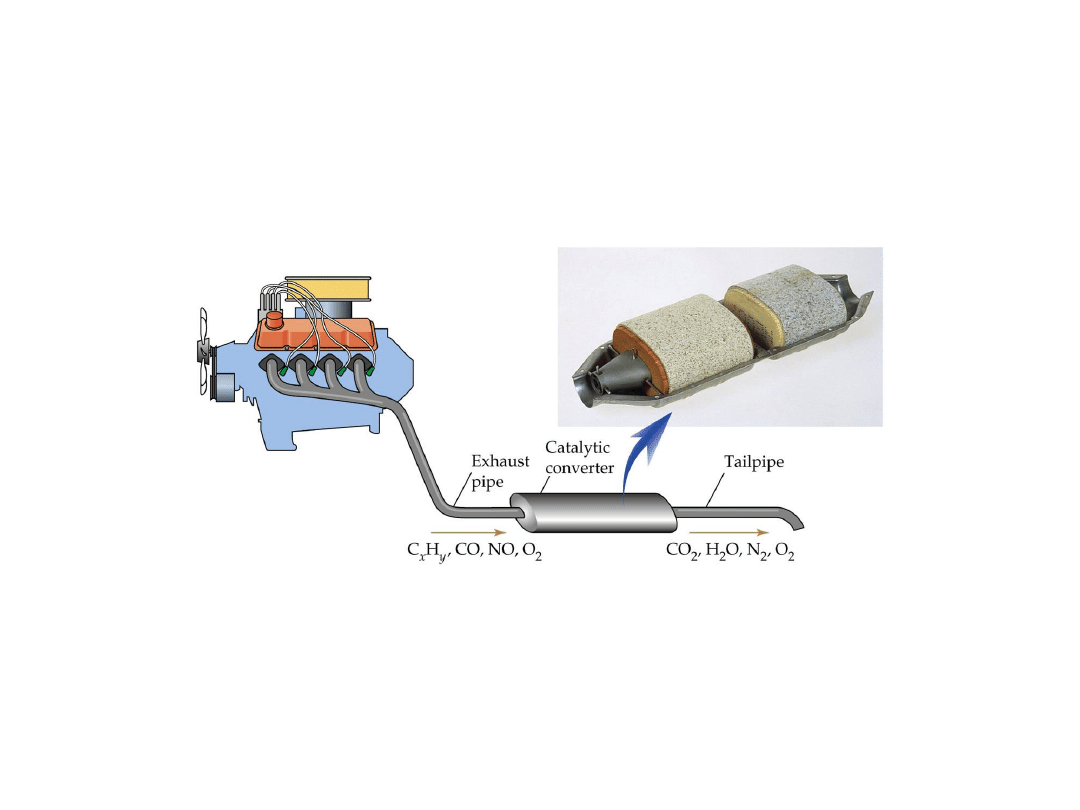
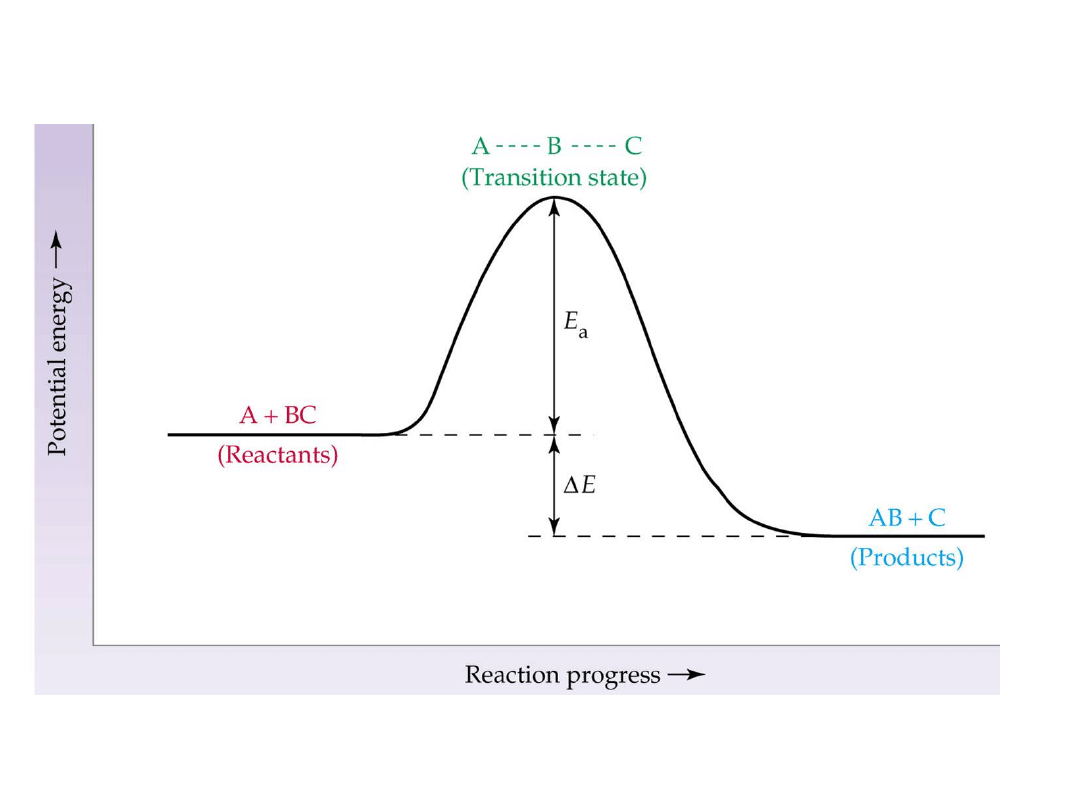
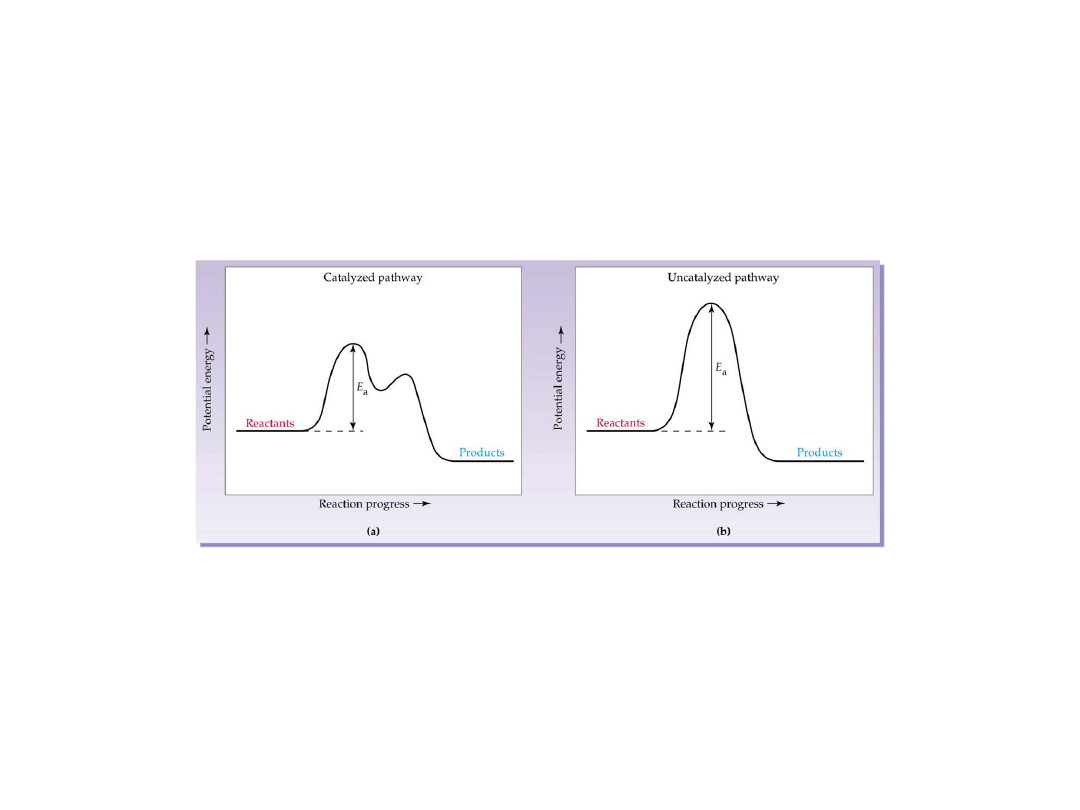
Kataliza
to ogólnie sposób zmniejszania lub
zwiększania szybkości reakcji chemicznej
przez wprowadzenie innej substancji.
Przy wysokiej energii
aktywacji reakcja
przebiega z trudem, a
podwyższenie
temperatury, tak by
osiągnąć Ea powoduje
rozkład produktu AB
Typy katalizatorów
:
Homogeniczne, heterogeniczne
Biochemiczne
Inhibitory, stabilizatory, konserwant y
reakcje - inż. materiałowa
9
reakcje - inż. materiałowa
10
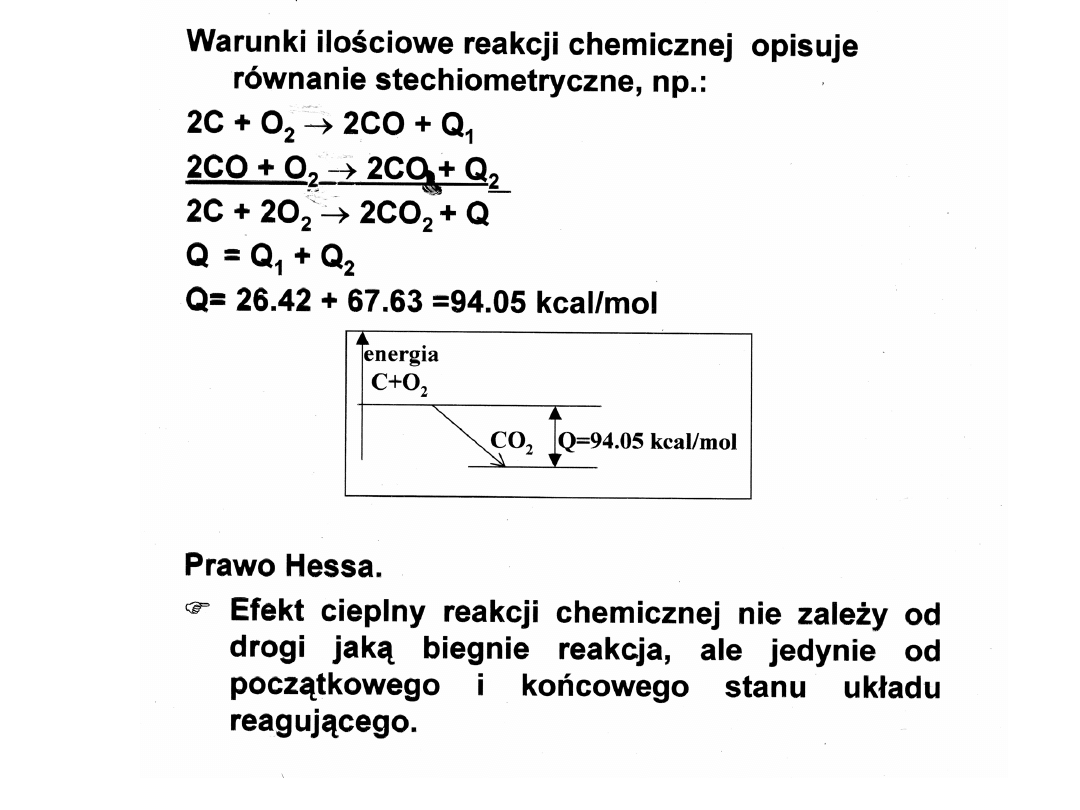
Reakcje odwracalne
Prawo działania mas:
W stanie równowagi chemicznej stosunek iloczynu
stężeń substancji reagujących w jednym kierunku do
iloczynu stężeń ciał reagujących w kierunku
przeciwnym jest w danej temperaturze wielkością
stałą
k
k
K
AB
A B
1
2
[
]
[ ][ ]
k
produkty
substraty
A + B
AB + Q
A + B
K
1
AB + Q
v
1
= k
1
[A][B]
AB
K
2
A + B - Q
v
1
= k
2
[AB]
v
1
= v
2

reakcje - inż. materiałowa
11
Reguła przekory
reakcje - inż. materiałowa
12
reakcje - inż. materiałowa
13
reakcje - inż. materiałowa
14
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
Wyszukiwarka
Podobne podstrony:
wyklad 14
Vol 14 Podst wiedza na temat przeg okr 1
Metoda magnetyczna MT 14
wyklad 14 15 2010
TT Sem III 14 03
Świecie 14 05 2005
2 14 p
i 14 0 Pojecie administracji publicznej
Wyklad 14 2010
14 Zachowanie Przy Wypadkach 1 13
Wyklad 14 PES TS ZPE
Ergonomia w Transporcie Chemiczne czynniki pracy materiały pędne i smary
14 Ogniwa słoneczne
Wyklad 14
Wykład z fizyki 14
1 Wprowadzenie do psychologii pracy (14)id 10045 ppt
więcej podobnych podstron