1
CHEMIA ORGANICZNA
cz.I
1. Wprowadzenie
2. Węglowodory:
alkany
alkeny i alkiny
areny
Koniec XVIII w.:- zainteresowanie chemików
organizmami żywymi:
- przemiany substancji w tych organizmach,
- wyodrębnienie substancji z organizmów roślinnych i zwierzęcych
SUBSTANCJE ORGANICZNE WĘGIEL -
główny składnik
CHEMIA ORGANICZNA
Wprowadz
enie
2
Hipoteza “siły życiowej” - “vis vitalis” dotyczyła przemian i
wytwarzania substancji w organizmach żywych. Możliwość taką
tłumaczono interwencją sił nadprzyrodzonych.
Oprócz WĘGLA
w związkach organicznych występują
i
nne
pierwiastki
: WODÓR (H) TLEN (O) AZOT (N) SIARKA
(S) CHLOROWCE (F,Cl,Br,I) FOSFOR (P) METALE
ogrzewanie
NH2
NH4OCN
C = O
cyjanian amonowy
mocznik
NH2
W 1928 r. WÖHLER przeprowadził pierwszą syntezę związku
organicznego, obalając: hipotezę „vis vitalis”
CHEMIA ORGANICZNA - chemia związków węgla (za wyjątkiem
kilku związków uważanych za nieorganiczne:
CO, CO2, H2CO3, węglany)
3
Charakterystyczne właściwości związków organicznych:
1. Duża ilość poznanych związków organicznych: 4 mln w stosunku do ok.
100 tys. związków nieorganicznych.
2. Niska odporność na wysoką temperaturę - rozkład już w temp.ok. 500
C, spalanie do CO2 i H2O.
3. Występowanie zjawiska
IZOMERII
Elementy budowy związków
organicznych:
1.Skład jakościowo - ilościowy cząsteczki: jakie i ile pierwiastków
tworzy związek:
wzór sumaryczny
wzór cząsteczkowy
Np.
C2H6O wzór sumaryczny (cząsteczkowy)
alkoholu etylowego
C H2O wzór sumaryczny; C2H4O2
wzór cząsteczkowy
4
2. Struktura - kolejność powiązania atomów w cząsteczce.
wzór strukturalny
H H
H—C—C—O—H
wzór strukturalny cząsteczki
H H alkoholu etylowego
CH3—CH2—OH wzór strukturalny skrócony
4. Stan elektryczny i magnetyczny
cząsteczki - rozmieszczenie elektronów
względem naładowanych jąder atomowych;
rozkład i wielkość ładunków elektrycznych,
dipole - moment dipolowy.
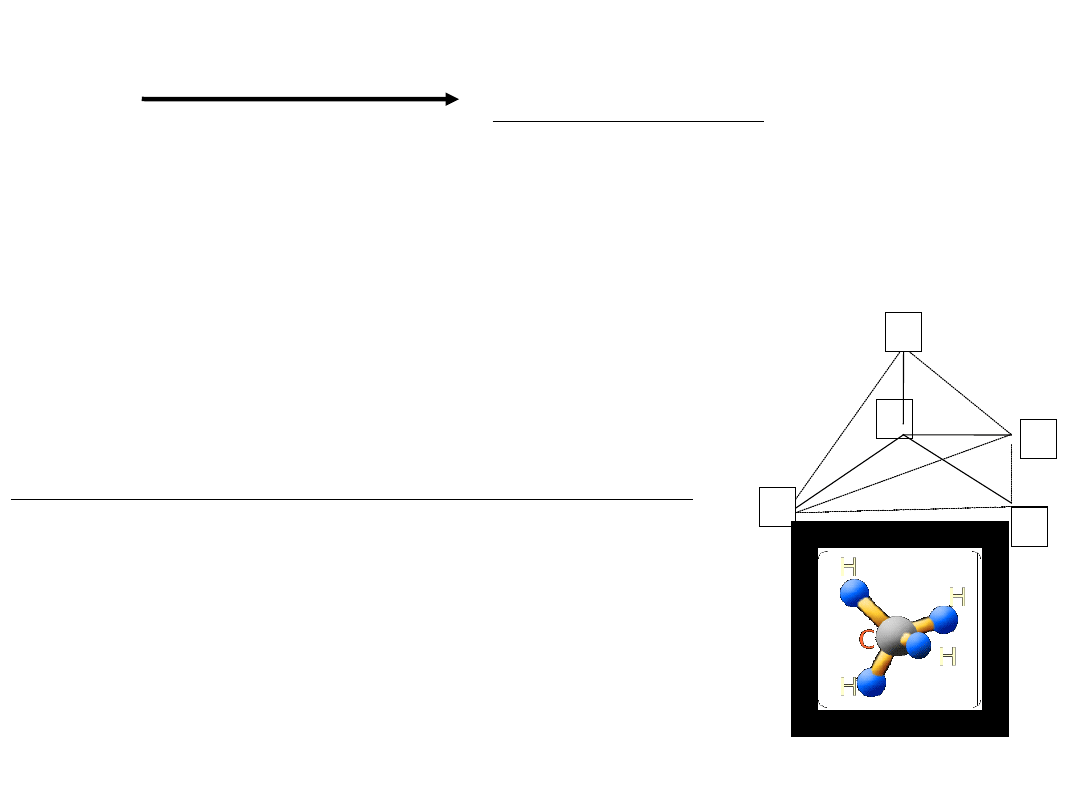
3. Architektura - przestrzenne rozmieszczenie atomów
w cząsteczce (istotne elementy: długość wiązań,
odległość między atomami, kąty między kierunkami
wiązań).
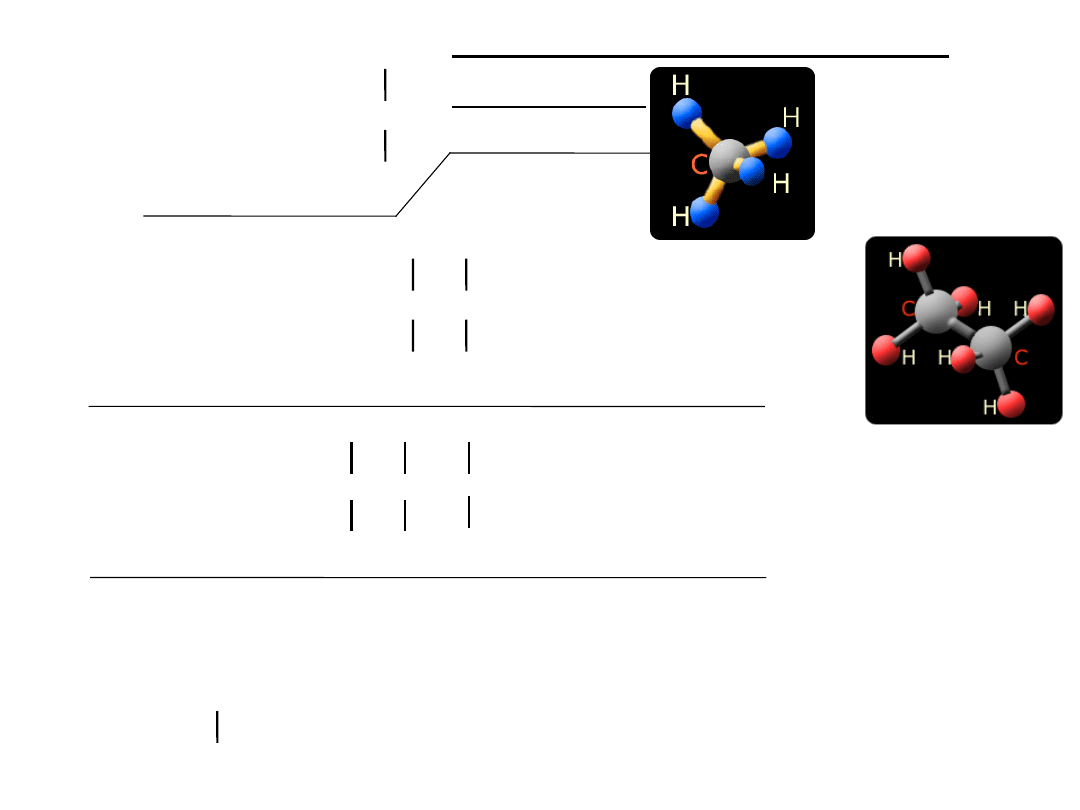
Np.:Budowa przestrzenna cząsteczki metanu CH4:
C
H
H
H
H
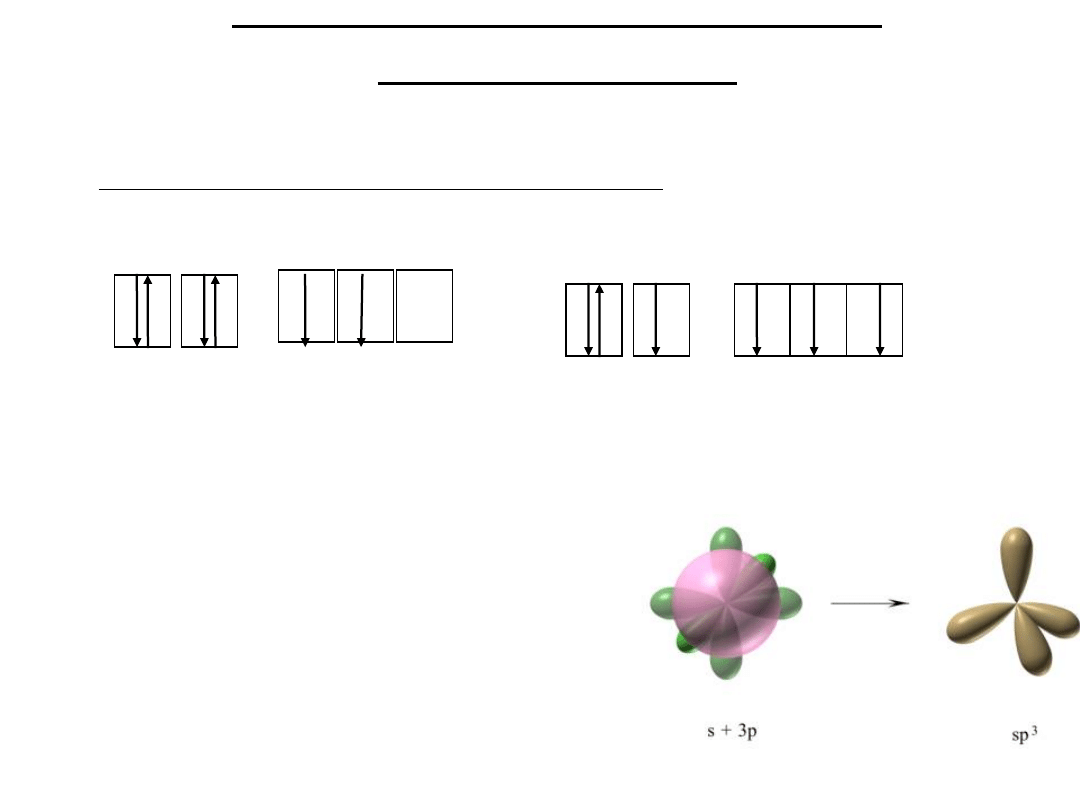
5
Cechy budowy związków
organicznych
1. Czterowartościowość węgla - wynika z pozycji jaką węgiel zajmuje w
układzie okresowym.
Schemat konfiguracji elektronowej węgla:
6C
1s2 2s2 2p2
1s2 2s1 2px1 2py1
2pz1
Stan wzbudzony
(podczas tworzenia związków)
stan podstawowy
2. Wszystkie cztery wartościowość węgla są
równocenne,
tzn.
mają
te
same
właściwości. Jest to wynikiem hybrydyzacji
orbitali atomowych:
2s1 2px1 2py1
2pz1 - hybrydyzacja sp3.
6
3. Atomy węgla mogą łączyć się ze sobą tworząc otwarte struktury
łańcuchowe lub zamknięte pierścienie.
Np. CH3—CH2—CH2—CH2—CH2—CH3 n-heksan
cykloheksan
4. Wiązania między atomami węgla oraz węgla z innymi pierwiastkami,
poza nielicznymi wyjątkami, są typu kowalencyjnego (atomowego).
Mogą to być wiązania:
Pojedyncze: C—C C—H N—H
Podwójne: C=C C=O
Potrójne: C C CN
7
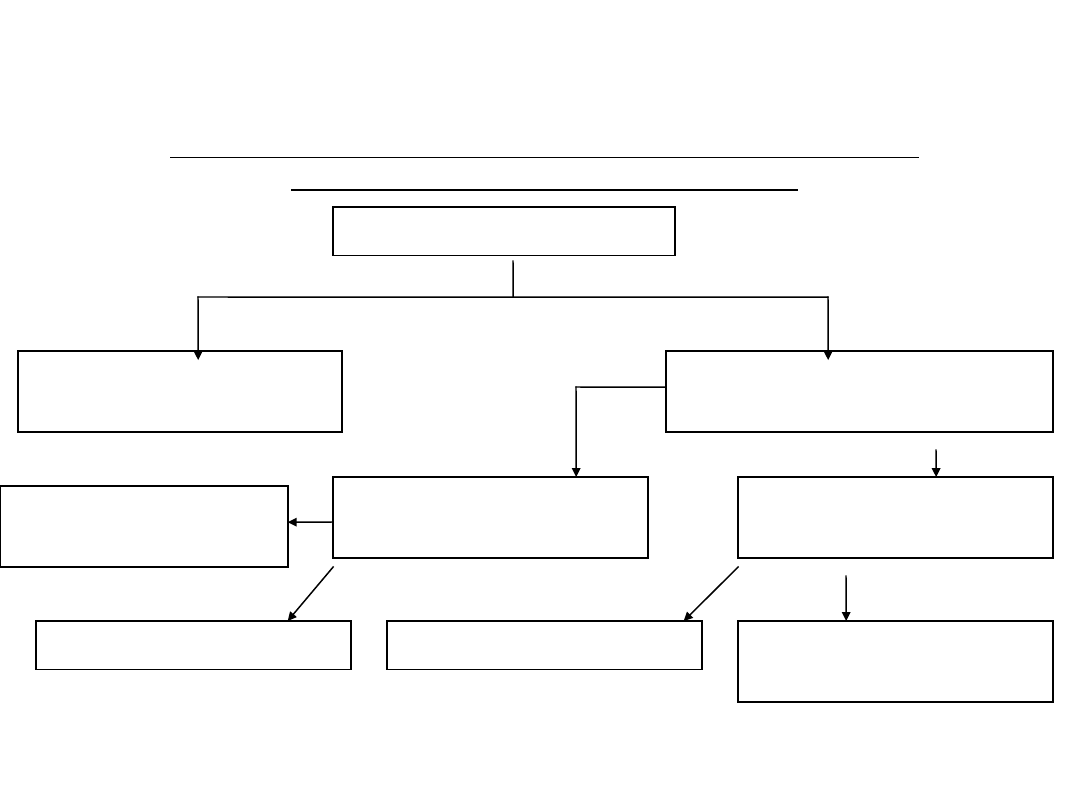
Klasyfikacja związków
organicznych
Podział związków organicznych w zależności od rodzaju
szkieletu atomowego cząsteczek.
Związki organiczne
Związki łańcuchowe
(acykliczne)
Związki pierścieniowe
(cykliczne)
Związki
heterocykliczne
Związki
karbocykliczne
Związki
niearomatyczne
Związki
niearomatyczne
Związki aromatyczne
Związki aromatyczne
8
Klasyfikacja związków
organicznych
Przykłady:
Heterocykliczne
-
w
pierścieniu oprócz atomów
węgla występują atomy innych
pierwiastków
CH — CH
CH — CH
CH CH
CH CH
S
O
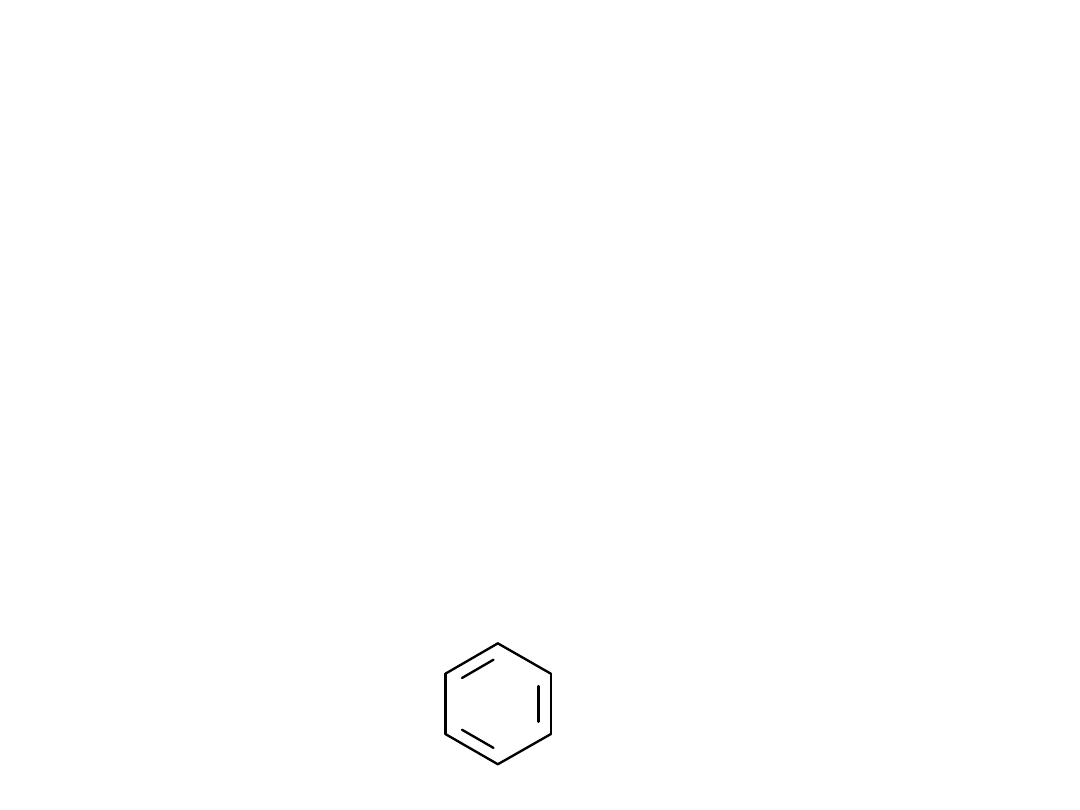
łańcuchowy
cykliczne
Karbocykliczne - w pierścieniu
występują tylko atomy węgla
CH3CH3
CH2
CH2
CH2
CH2
CH2
C
C
C
C
C
C
H
H
H
H
H
H
9
Klasyfikacja związków
organicznych
Z innego punktu widzenia związki organiczne dzielimy na:
1. związki nasycone
2. związki nienasycone
3. związki aromatyczne
ad.1. Pojedyncze wiązania między atomami węgla
CC
ad.3. Układ wiązań charakterystyczny dla benzenu
ad.2. Podwójne lub potrójne wiązania między atomami węgla
C=C
C C

10
Klasy związków
organicznych
Nazwa
Wzór
Grupa funkcyjna
Węglowodory
C H
-
Chlorowco -pochodne
C X
X = F, Cl, Br, I
Chlorowiec
Wodorotlenowe
pochodne
C OH
wodorotlenowa
Aldehydy
O=C H
aldehydowa
Ketony
O=C C
C
ketonowa
Kwasy karboksylowe -COOH karboksylowa
Aminy
Związki nitrowe
Nitryle
C—NH
2
C —NO
2
—C
N
aminowa
nitrowa
nitrylowa
11
Rodzaje reakcji związków
organicznych
Podstawowy podział reakcji organicznych:
1.
Reakcje podstawienia (substytucji) - S
2. Reakcje przyłączania (addycji) - A
3. Reakcje odszczepiania (eliminacji) - E
Reakcja podstawienia (substytucji) polega na tym, że atom wodoru
lub grupa funkcyjna zostaje podstawiona (zastąpiona) przez inny
atom lub inną grupę funkcyjną.
CH4 + Cl2 CH3Cl + HCl
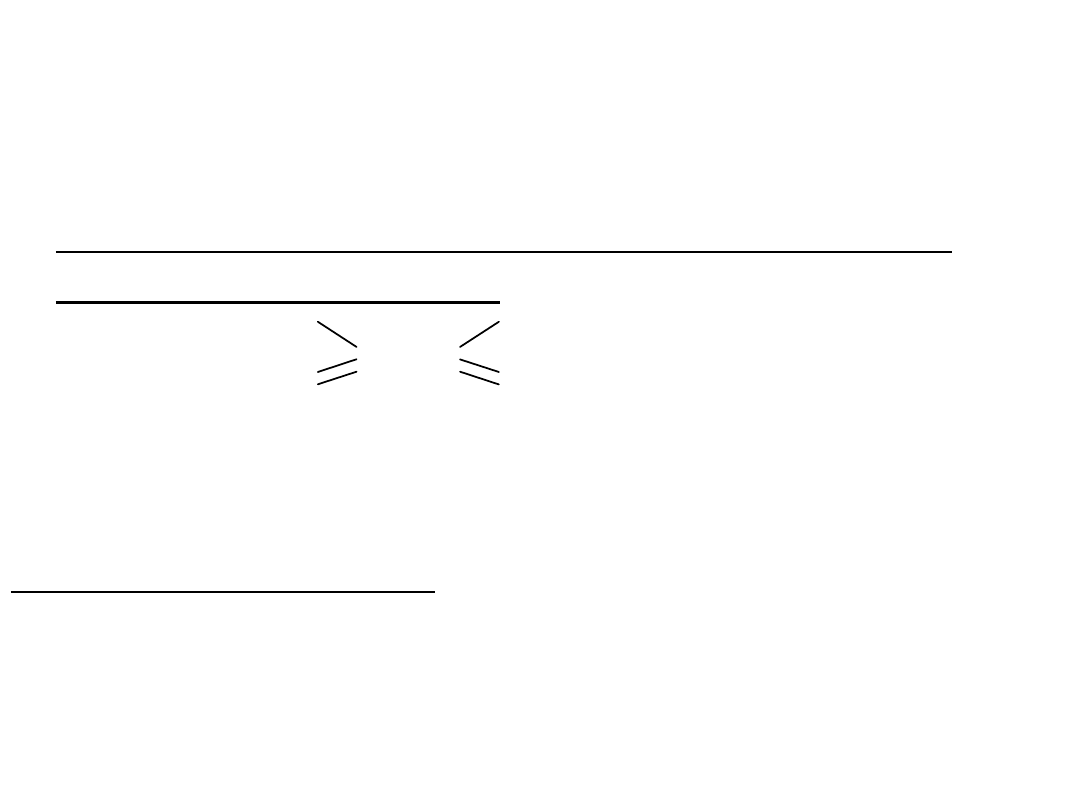
Reakcje przyłączenia (addycji) są charakterystyczne dla związków
zawierających wiązania wielokrotne i polegają na przyłączeniu do
cząsteczki związku organicznego atomu lub grupy atomów.
A = B + RR` R—A—B—R`
12
Reakcje odszczepiania (eliminacji)
polegają na oderwaniu od
cząsteczki substratu dwóch podstawników.
- eliminacja:
Z A—B Y A=B + ZY
odszczepienie od sąsiednich atomów
związki nienasycone
Reakcje organiczne mogą przebiegać wg dwóch mechanizmów:
- reakcje
rodnikowe
(homolityczne)
- reakcje
jonowe
(heterolityczne)
W reakcjach rodnikowych tworzą się tzw. rodniki - układy pośrednie o
nieparzystej liczbie elektronów.
A
B A + B rodniki
Reakcje jonowe - elektrofilowe i nukleofilowe
W reakcjach jonowych podczas rozerwania wiązania atomowego para
elektronów zostaje przy jednym fragmencie, który staje się anionem,
drugi fragment staje się kationem:
A
B A: + B
-
+
13
WĘGLOWODORY
Związki organiczne, których cząsteczki zbudowane są wyłącznie z
atomów
węgla
i
wodoru
.
Szereg homologiczny - nieskończony szereg związków
chemicznych, których cząsteczki różnią się od siebie
dowolną liczbą grup atomów (np.: grup metylenowych —
CH2— w przypadku alkanów), przy czym związki te mają
podobną budowę, a wskutek tego podobne własności
chemiczne.
1.
Węglowodory
łańcuchowe
nasycone -ALKANY
Między atomami węgla występują tylko wiązania
pojedyncze:
C—C
Wszystkie alkany mają ogólny wzór sumaryczny:
CnH2n+2
n - całkowita liczba naturalna
Tworzą tzw.
szereg homologiczny
14
Szereg homologiczny
alkanów
5.
BUTAN
- C
4
H
10
CH
3
—CH
2
—CH
2
—CH
3
n-butan
CH
3
— CH—CH
3
izo-butan; 2-metylopropan
CH
3
H
1.
METAN
H—C—H
CH
4
H
H H H
3.
PROPAN
H—C—C—C—H
H H H
CH
3
—CH
2
—CH
3
(C
3
H
8
)
H H
2.
ETAN
H—C—C—H
CH
3
—CH
3
(C
2
H
6
)
H H
15
Szereg homologiczny
alkanów
Począwszy od butanu w alkanach występuje zjawisko
izomerii strukturalnej (szkieletowej), związanej są
rozgałęzieniem łańcucha węglowego.
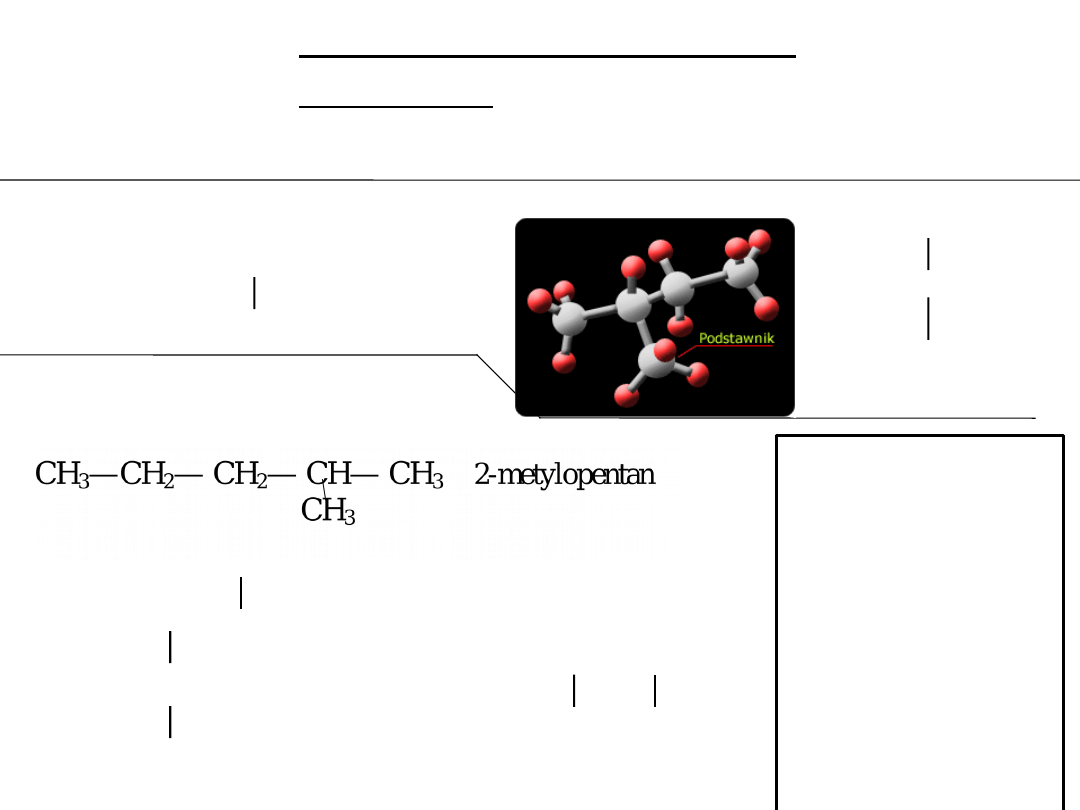
HEKSAN
- C
6
H
14
CH
3
—CH
2
— CH
2
— CH
2
— CH
2
— CH
3
n-heksan
CH
3
—CH
2
— CH— CH
2
— CH
3
3-metylopentan
CH
3
CH
3
CH
3
—C— CH
2
— CH
3
CH
3
CH
3
—CH—CH—CH
3
CH
3
CH
3
2,2-dimetylobutan
2,3-dimetylobutan
PENTAN
- C
5
H
12
CH
3
—CH
2
— CH
2
— CH
2
— CH
3
n-pentan
2-metylobutan
dimetylopropan
CH
3
—CH
2
— CH— CH
3
CH
3
CH
CH
3
CH
3
—C—CH
3
3
Dziewięć
izomerów :
heptan (n-
heptan)
2-metyloheksan
3-metyloheksan
2,2-
dimetylopentan
2,3-
dimetylopentan
2,4-
dimetylopentan
3,3-
dimetylopentan
3-etylopentan
2,2,3-
trimetylobutan
16
Jest to część cząsteczki węglowodoru mająca określoną
liczbę wolnych jednostek wartościowości. Nazwy rodników
ustala się wychodząc z nazw odpowiednich alkanów, przy
czym końcówkę zmienia się z -an na -yl.
CH
3
—CH
2
—CH
2
— CH
3
—CH
2
—CH
C
3
H
8
propyl
propyliden
propan
CH
3
—
metyl
CH
2
metylen
CH
4
metan
CH
3
—CH
2
—
etyl
CH
3
—CH
etyliden
CH
3
—CH
3
etan
Rodniki węglowodorowe
Im większa jest liczba atomów węgla w cząsteczce
węglowodoru tym możliwa jest większa liczba izomerów
strukturalnych:
8 18
9 35
10 75
15 4347
20 336 319
25 36 795 588
30 4 111 846 763
Liczba atomów węgla
liczba izomerów

17
Rzędowość węgla
organicznego
Stopień podstawienia, czyli liczba grup
alkilowych związanych z określonym atomem
węgla, wyznacza jego rzędowość.
R
4
R
1
—
C
—R
3
węgiel czwartorzędowy
R
2
R—
C
H
3
węgiel pierwszorzędowy
R
1
—
C
H
2
—R
2
węgiel drugorzędowy
R
1
—
C
H—R
3
węgiel trzeciorzędowy
R
2
18
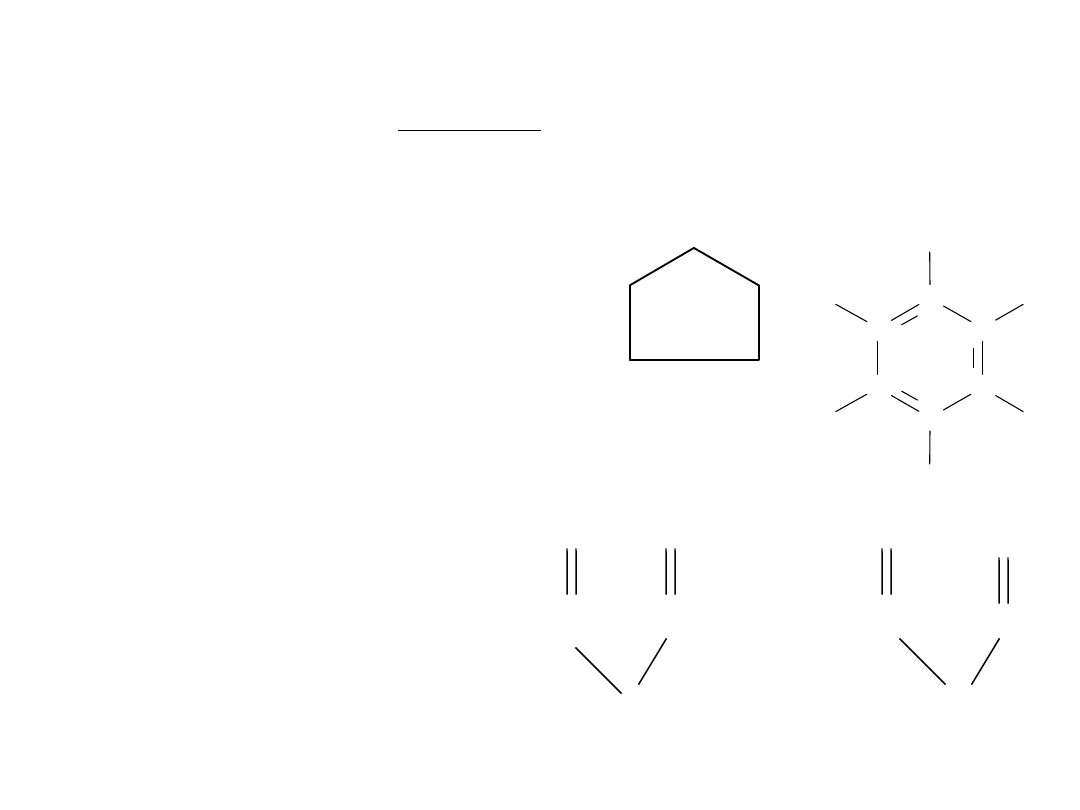
CYKLOALKANY
Cykloheksan
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
C6H12
Nazwa
Wzór strukturalny
Wzór
sumaryczny
Cyklopropan
Cyklobutan
Cyklopentan
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
C
3
H
6
C
4
H
8
C
5
H
10
W
nazwach
stoso-wany jest
przedros-tek
cyklo.
Przykłady najprostszych cykloalkanów:
Tworzą szereg homologiczny o wzorze:
C
n
H
2n
n - całkowita liczba naturalna

19
Własności chemiczne alkanów
Przemiany chemiczne węglowodorów mogą zachodzić albo wskutek
rozerwania wiązań C—C lub C—H. Następuje wtedy albo rozpad
cząsteczki, albo podstawienie atomu wodoru innym atomem lub
grupą atomów.
Ulegają najczęściej reakcji podstawiania - substytucji
.
Alkany są odporne na działanie kwasów i zasad oraz
reduktorów.
1. Ulegają spalaniu - przy czym produktami są albo CO2, CO lub
C (sadza) w zależności od ilości tlenu biorącego udział w reakcji.
C4H10 + 6,5 O2 = 4 CO2 + 5 H2O
C4H10 + 4,5 O2 = 4 CO + 5 H2O
C4H10 + 2,5 O2 = 4 C + 5 H2O
Utlenienie

2
0
1.
CHLOROWCOWANIE
- podstawianie atomów wodoru chlorowcem.
Np. chlorowcowanie metanu:
CH4 + Cl2 = HCl + CH3Cl jednochlorometan
CH3Cl + Cl2 = HCl + CH2Cl2 dichlorometan
CH2Cl2 + Cl2 = HCl + CHCl3 trichlorometan-chloroform
CHCl3 + Cl2 = HCl + CCl4 tetrachlorometan-czterochlorek
węgla Jest to reakcja łańcuchowa - zachodzi wg mechanizmu
podstawiania rodnikowego.
Reakcja podstawiania
I etap - rozpad wiązania atomowego Cl—Cl pod wpływem energii
świetlnej lub cieplnej:
Cl—Cl
Cl
*
+ Cl
*
chlor rodnikowy
lub temp.
II etap - wytworzenie rodnika węglowodorowego działaniem chloru
rodnikowego:
CH4 + Cl* CH3* + HCl rodnik metylowy
III etap - działanie rodnika węglowodorowego na chlor
cząsteczkowy:
CH3* + Cl2 CH3Cl + Cl* itd.
Reakcja z innymi chlorowcami przebiega podobnie, przy
czym reaktywność chlorowców maleje w szeregu: F >
Cl > Br > I

21
Węglowodory nienasycone
W cząsteczkach węglowodorów nienasyconych występują:
Wiązania podwójne:
C=C ALKENY (Olefiny)
Wiązania potrójne:
CC
ALKINY (Acetyleny)
ALKENY tworzą szereg homologiczny o ogólnym wzorze:
CnH2n
1.
ETEN C2H4,
(etylen)
C H
2
C H
2
2.
PROPEN C3H6, (propylen)
CH
2
CH CH
3
4
3.
BUTEN
C
H
8
CH
2
=CH—CH
2
—CH
3
1-buten
CH
3
—CH=CH—CH
3 2-buten
izobuten
metylopropen
3
CH
2
=C—CH
3
CH
Występuje izomeria związana z położeniem wiązania
podwójnego.
Również
izomeria
szkieletowa
związana
z
rozgałęzieniem łańcucha.
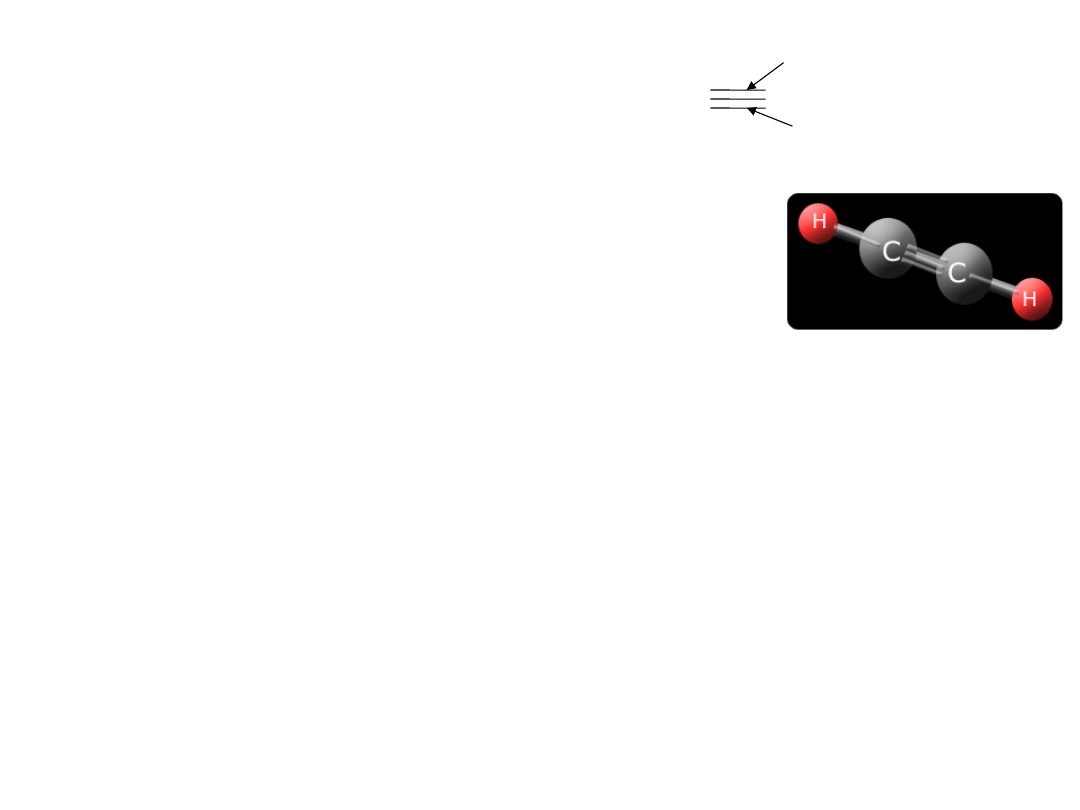
22
Występuje wiązanie potrójne:
—C
C—
ALKINY tworzą szereg homologiczny o ogólnym wzorze:
CnH2n-2
1.
ETYN - ACETYLEN C2H2 H—CC—H
CHCH
2. PROPYN C3H4
CH3—CCH
3. BUTYN
C4H6
CHC—CH2—CH3 1-butyn
CH3—CC—CH3 2-butyn
CHC—CH2—CH2—CH3 1-pentyn
CH3—CC—CH2—CH3 2-pentyn
CHC—CH—CH3 3-metylo-1-butyn
CH3
4.
PENTYN C5H8
Występuje izomeria związana z położeniem wiązania
podwójnego.
Również
izomeria
szkieletowa
związana
z
rozgałęzieniem łańcucha.
23
Otrzymywanie
1. Acetylen otrzymuje się z karbidu (CaC2) działając na niego wodą:
CC + 2H2O CHCH + Ca(OH)2
Ca
acetylen
Karbid można otrzymać przez ogrzewanie wapna palonego w temp. 2500
C z węglem:CaO + 3C = CaC2 + CO
CH2—CH2
Br
Br
1,2-dibromoetan
+ 2KOH = CHCH + 2KBr + 2H2O
2. Eliminacja chlorowcowodorów z jedno- lub dichlorowco-pochodnych
alkanów:
CH
2
CH
2
Br
H
CH
2
CH
2
+ KOH
eten
bromoetan
+ KBr + H2O
etyn
Reakcja eliminacji dotyczy także alkoholi i alkanów
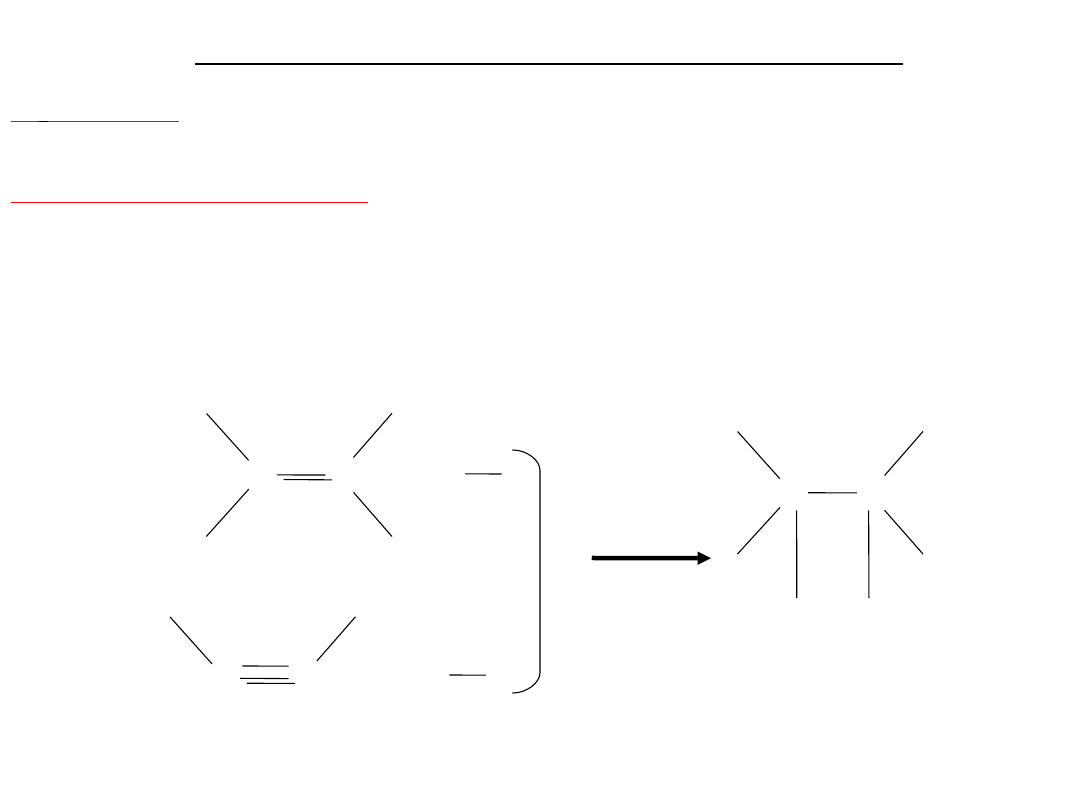
24
WŁASNOŚCI CHEMICZNE
1.
Spalanie
- podobnie jak alkany
2. Reakcja przyłączania
Najbardziej charakterystycznymi reakcjami alkenów i alkinów są reakcje
przyłączania, polegające na tym, że podstawniki przyłączają się do
wiązań wielokrotnych między atomami węgla.
Wiązania zostają zastąpione przez nowo utworzone wiązania :
C
C
+ A
B
C
C
B
A
alken
C
C
+ 2 A
B
alkin
alkan lub jego
pochodna
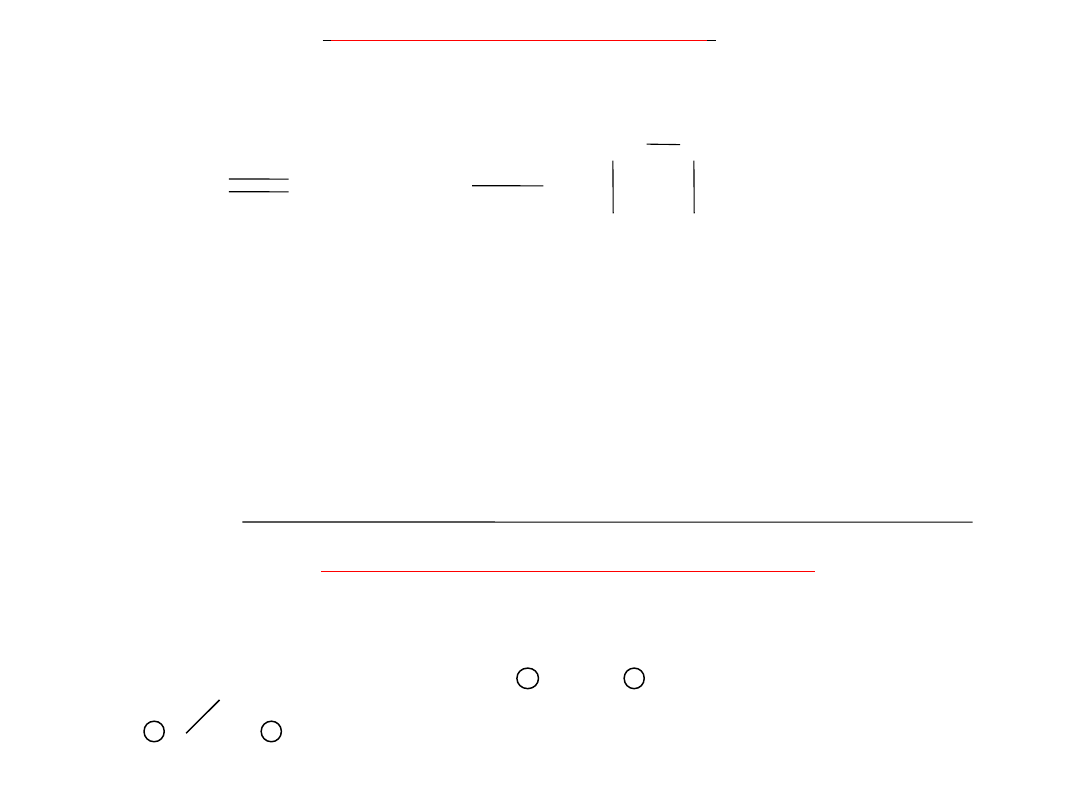
25
Przyłączenie chlorowców
:
Chlorowce (szczególnie Cl2 i Br2) przyłączają się łatwo do podwójnego i
potrójnego wiązania:
C H2
C H
C H
2
C H
2
C l
C l
+ Cl2
1,2-dichloroetan
2
eten
CHCH + 2Br2 Br—CH—CH—Br 1,1,2,2,-tetrabromoetan
Br Br
etyn
Jest to tzw. przyłączenie elektrofilowe (chlorowiec atakuje alken
dodatnim biegunem dipola).
Przyłączenie chlorowcowodorów
CH
2
=CH
2
+ HI CH
3
—CH
2
—I jodoetan
CH
3
—CH
2
+ I CH
3
—CH
2
—I
CH
2
=CH
2
H — I
-
+
+
-
etylokarbokation

26
CHCH + HCl CH2=CH—Cl chloroeten; chlorek winylu
CH2=CH rodnik winylowy
Nadmiar HCl:
CH2=CH—Cl + HCl CH3—CHCl2 1,1-dichloroetan
Chlorek winylu służy do otrzymywania polimeru - poli(chlorku winylu)
Jeżeli alken jest niesymetryczny możliwe są dwa produkty reakcji, Np.:
CH
3
—CH=CH
2
+ HBr
CH
3
—CH
2
—CH
2
—Br
1-bromopropan
(nie powstaje)
2-bromopropan
CH
3
— CH—CH
Br
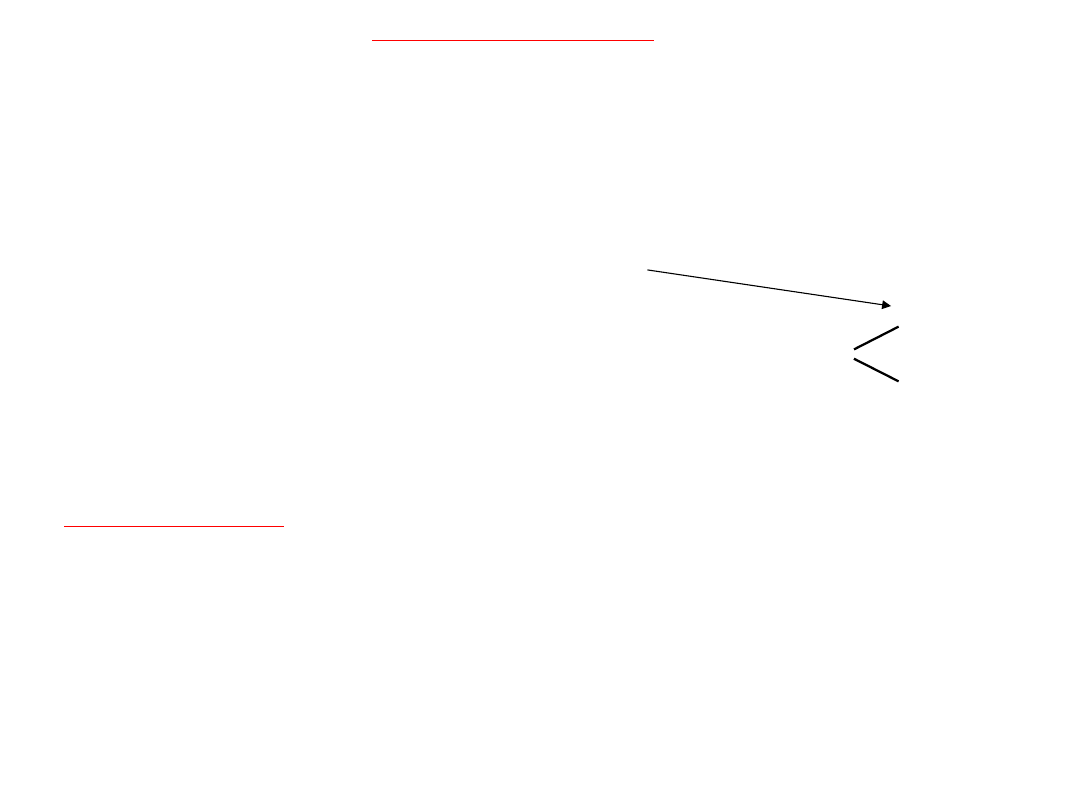
Kierunek takiego przyłączania określa reguła Markownikowa:
wodór przyłącza się do węgla, który związany jest z większą
liczbą atomów wodoru.
27
Uwodornienie:
alkiny alkeny alkany
CH3—CCH + H2 CH3—CH=CH2
propyn
propen
CH3—CH=CH2 + H2 CH3—CH2—CH3
propan
Przyłączenie wody
CHCH + H2O CH2=CH—OH CH3—C
alkohol winylowy (nietrwały)
W przypadku alkinów powstaje aldehyd octowy - reakcja
Kuczerowa.
W obecności mocnych kwasów (H2SO4) woda przyłącza się do alkenów
tworząc alkohole.
CH
2
=CH
2
+ H
2
O CH
3
—CH
2
—OH
alkohol etylowy
H
O
28
WĘGLOWODORY
AROMATYCZNE
ARENY
Należą do grupy węglowodorów cyklicznych.
Szczególny rodzaj wiązania występujący w benzenie.
BENZEN C6H6
- posiada raczej własności nasycone
Związki aromatyczne - benzen i jego pochodne.
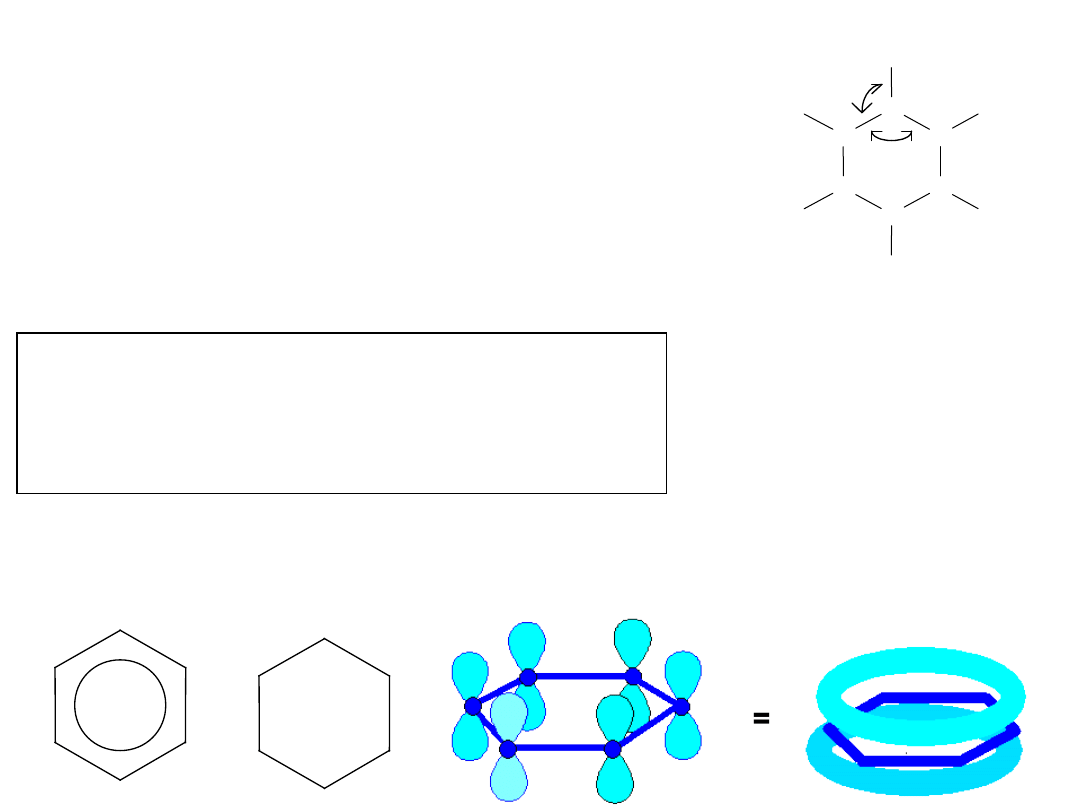
Budowa benzenu
C
C
C
C
C
C
H
H
H
H
H
H
lub
Kekulé wysunął hipotezę, że benzen jest
cykloheksatrienem
Taka struktura nie tłumaczyła braku własności nasyconych
układu aromatycznego.
29
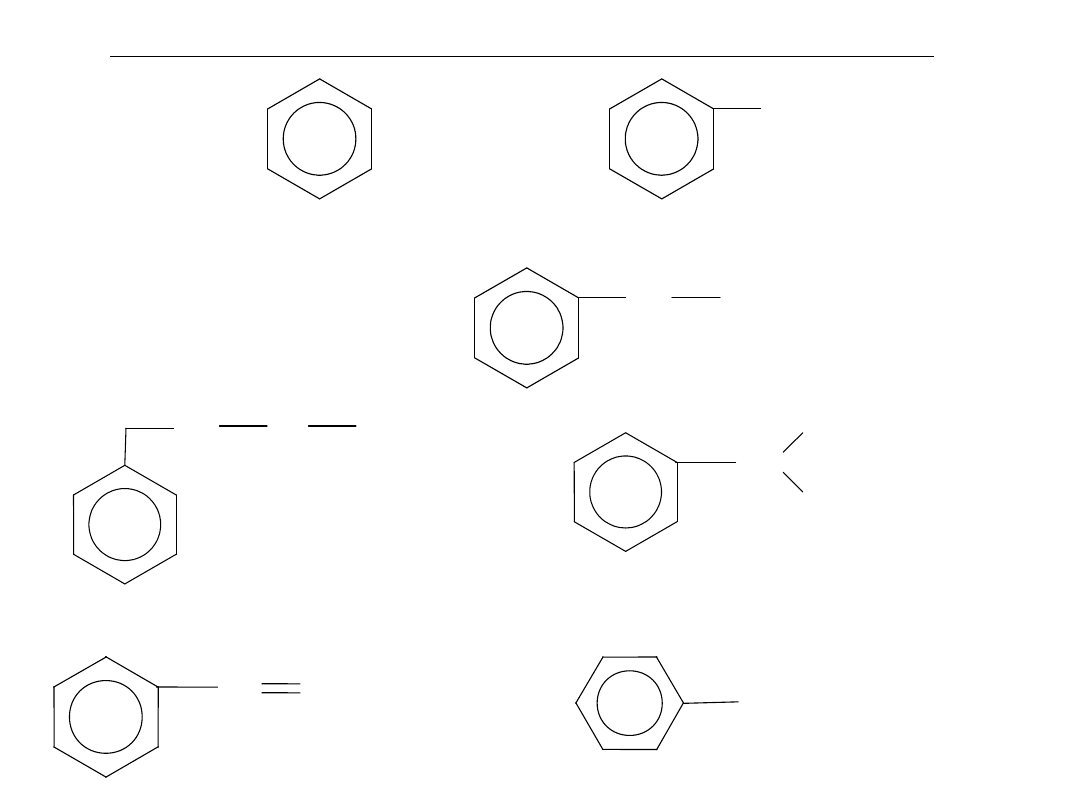
Budowa benzenu
Na podstawie badań rentgenograficznych i
spektroskopowych
ustalono,
że
cząsteczka
benzenu tworzy układ płaski, w którym atomy
węgla tworzą sześciokąt foremny.
C
C
C
C
C
C
H
H
H
H
H
H
1,09A
1,39A
120
120
Szkieletowy
model
cząsteczki
benzenu
Wszystkie wiązania między atomami
węgla są
równocenne
i nie występują
na przemian wiązania pojedyncze i
podwójne.
pozostałych
sześć
elektronów
jest
zdelokalizowanych
symetrycznie
na
skutek
nałożenia się orbitali pz sześciu atomów węgla.
Elektrony zajmujące zdelokalizowane orbitale benzenu
stanowią tzw. sekstet elektronowy zaznaczany
symbolicznie:
lub
30
Nazewnictwo i izomeria węglowodorów aromatycznych
Benzen: C6H6
Toluen - metylobenzen:C6H5—CH3
CH
3
Etylobenzen:C6H5—C2H5
C8H10
CH
2
CH
3
CH
CH
2
winylobenzen (styren)
izopropylobenzen (kumen)
CH
2
CH
3
CH
2
CH
CH
3
CH
3
Propylobenzen
Rodnik fenylowy
31
IZOMERIA
Jednopodstawione
pochodne benzenu nie posiadają izomerów,
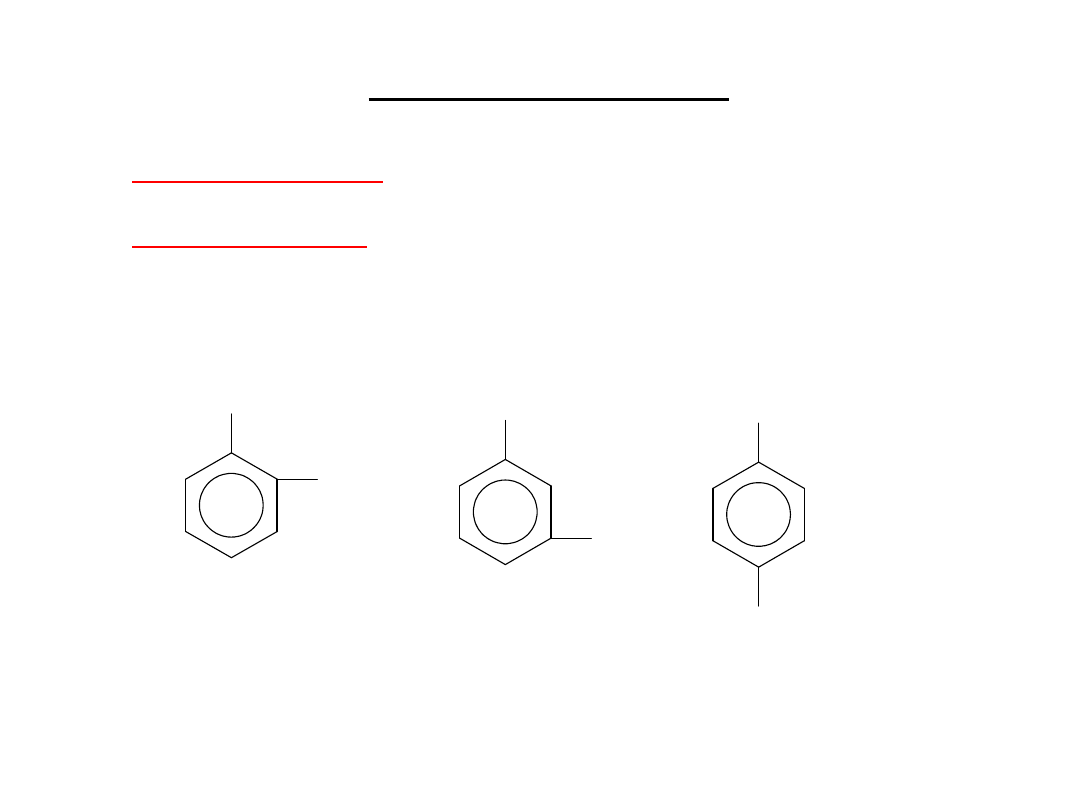
Dwupodstawione
benzenu istnieją w trzech odmianach
izomerycznych: 1,2-; 1,3- i 1,4-.
CH
3
CH
3
CH
3
CH
3
CH
3
CH
3
1,2-dimetylobenzen
orto-dimetylobenzen
o-ksylen
1,3-dimetylobenzen
meta-dimetylobenzen
m-ksylen
1,4-dimetylobenzen
para-dimetylobenzen
p-ksylen
32
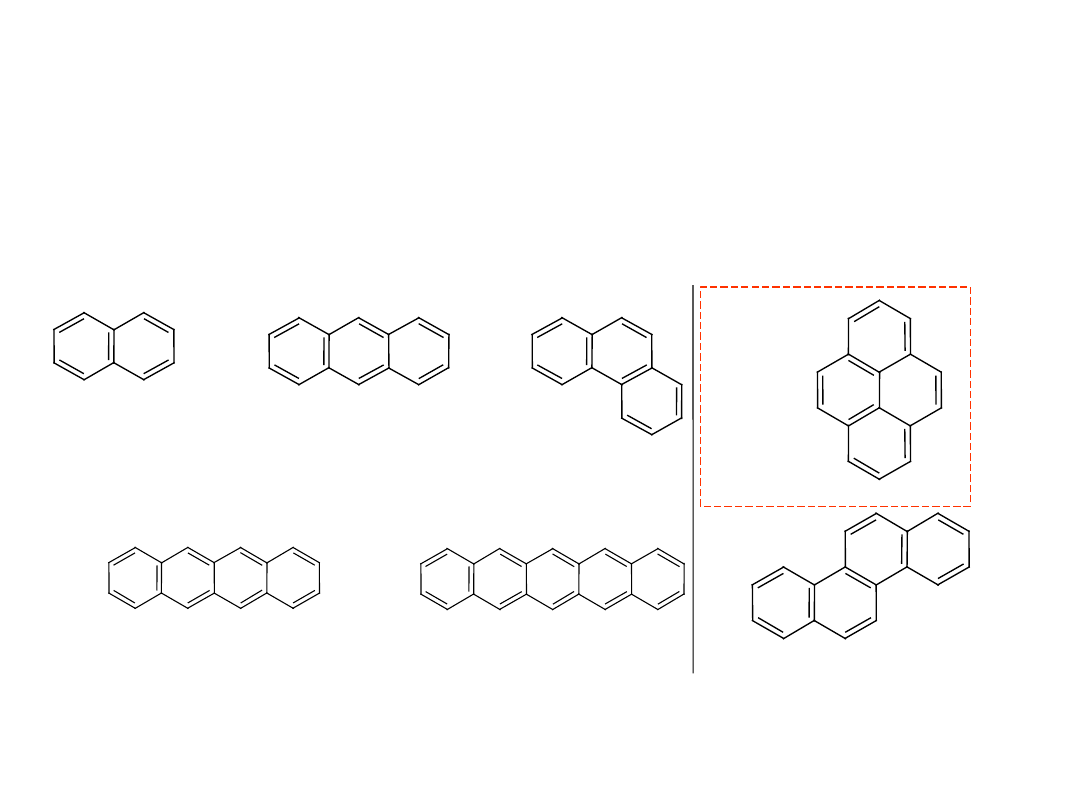
Węglowodory aromatyczne
o pierścieniach
skondensowanych
Znane są węglowodory aromatyczne zawierające kilka
pierścieni skondensowanych (sąsiadujące ze sobą pierścienie
mają po dwa wspólne atomy węgla):
naftacen (
żółty)
C
18
H
12
pentacen (niebieski)
C
22
H
14
piren
C
16
H
10
chryzen
C
18
H
12
naftalen
C
10
H
8
antracen
C
14
H
10
fenantre
n
C
14
H
10
33
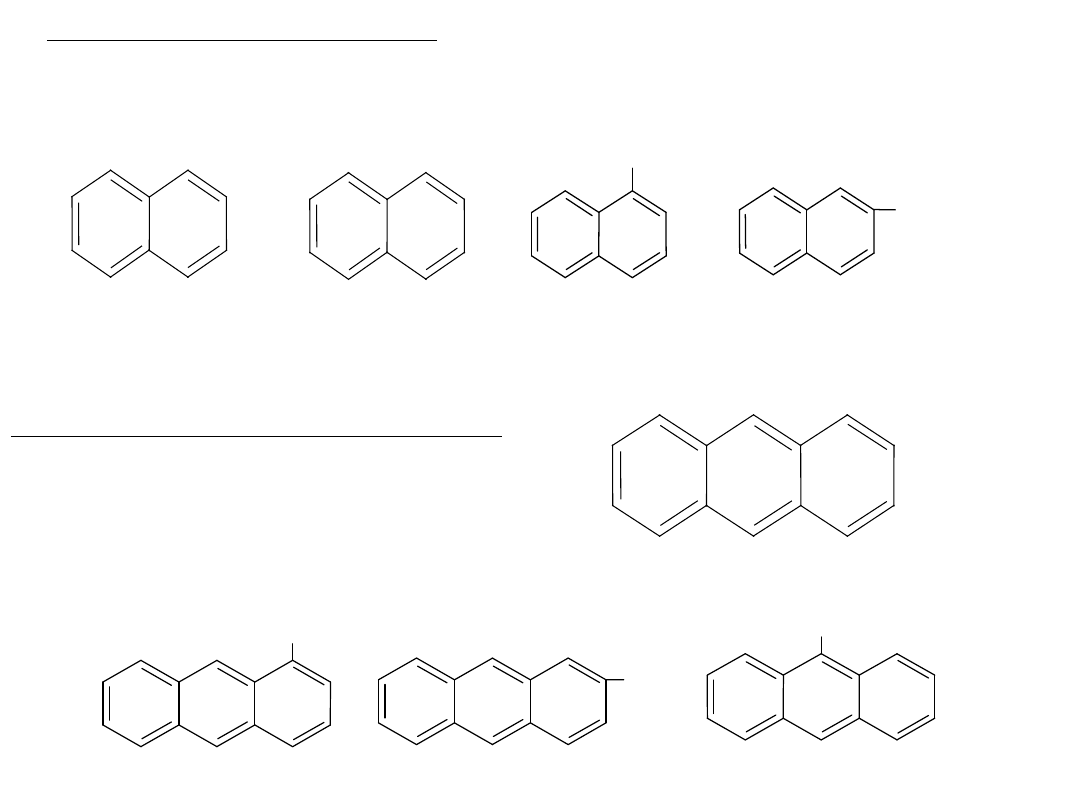
Jednopodstawione pochodne naftalenu mają dwa izomery:
(alfa) i (beta):
CH
3
CH
3
- metylonaftalen
- metylonaftalen
Na przykład:
Jednopodstawione
pochodne
antracenu mają trzy izomery:
, , .
CH
3
CH
3
CH
3
- metyloantracen
- metyloantracen
- metyloantracen
Na przykład: 3 izomery metyloantracenu:
34
Własności chemiczne węglowodorów
aromatycznych
Sumarycznie:
C6H6 + Z+ [C6H6Z]+ C6H5—Z + H+
H
Z
(+)
(-)
+ Z
+
polarna cząstka
aromatyczna
kation przejściowy
+
+
+
+
Mechanizm:
I Etap: Kation Z+ wiąże się z atomem węgla o największym ładunku
ujemnym kation przejściowy o dużej energii - stan nienasycony.
II Etap: Odszczepienie kationu przejście nienasyconego kationu
w cząstkę aromatyczną:
Z
+
H+
REAKCJE PODSTAWIANIA ELEKTROFILOWEGO.
Czynnikiem atakującym ujemny biegun cząsteczki układu
aromatycznego
jest
kation
lub
dodatni
biegun
spolaryzowanej
cząsteczki
odczynnika,
przy
czym
podstawieniu ulega atom wodoru związany z węglem pierścienia
aromatycznego.
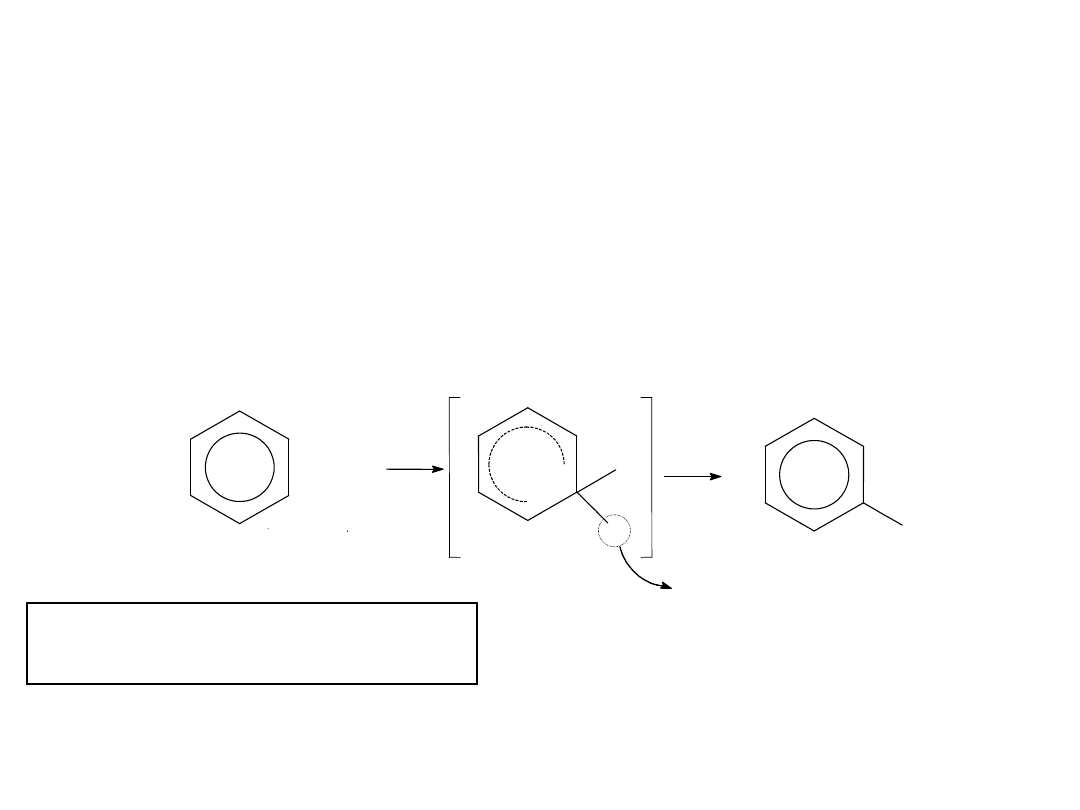
35
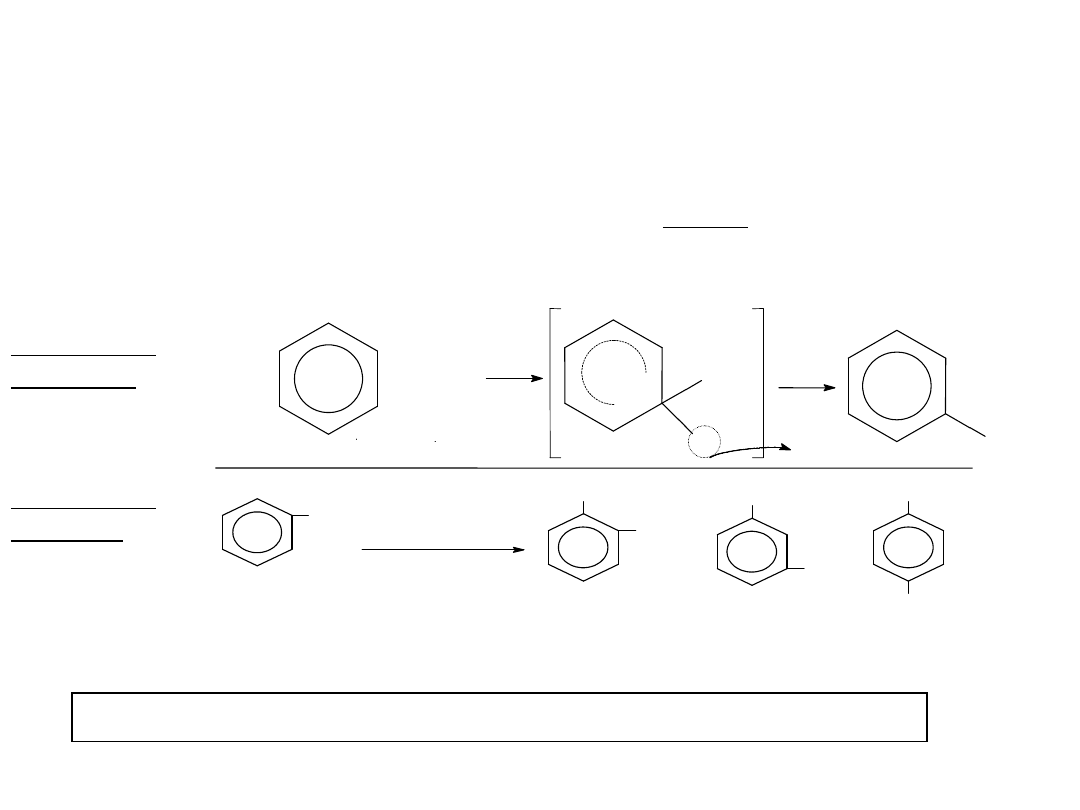
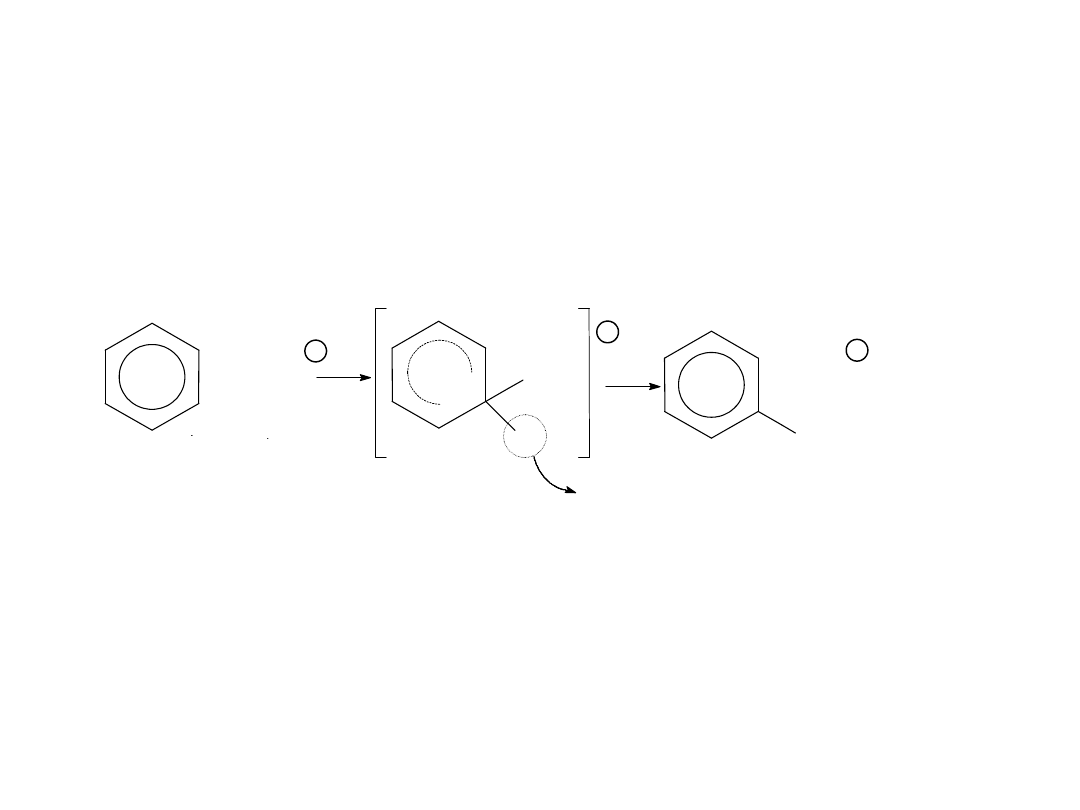
CHLOROWCOWANIE
Polega na
podstawieniu
atomem
chlorowca
atomu
wodoru
związanego z
węglem pierścienia aromatycznego.
Stosuje się katalizator w postaci halogenków żelazowych FeX3.
Ułatwiają one powstawanie kationów chlorowcowych:
X2 + FeX3 [FeX4]- + X+
H
X
+ H
+
X
+ X
+
chlorowcobenzen
+
+
+
+
Sumarycznie:
X2 + Ar—H Ar—X + HX
H+ + [FeX4]- FeX3 + HX
Kation chlorowcowy atakuje cząsteczkę związku aromatycznego zgodnie z
mechanizmem:
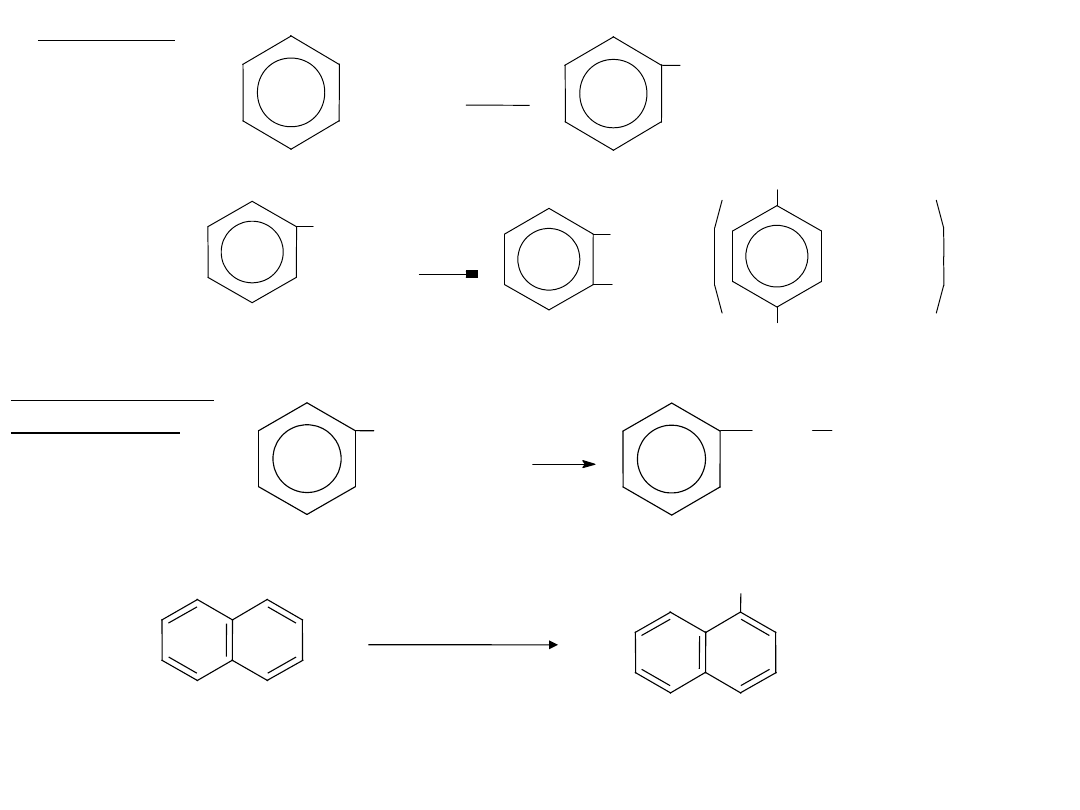
36
C l
+ Cl
2
FeCl
3
+ HCl
chlorobenzen
Przykłady:
CH
3
CH
3
Br
CH
3
Br
+ Br
2
FeBr
3
+
+ HBr
p-bromotoulen
toulen
o-bromotoulen
CH
3
CH
2
Cl
+ Cl
2
światło
+ HCl
chlorek benzylu
Bez
użycia
katalizatora:
Br2
Br
1-bromonaftalen
(-bromonaftalen)
naftale
n
37
NITROWANIE
Polega na podstawieniu atomu wodoru układu aromatycznego grupą
nitrową - NO2
Nitrowanie wykonuje się tzw. mieszaniną nitrującą:
2H2SO4 + HONO2 2HSO4 + H3O + NO2+
H
NO
2
+ H
+
NO
2
+ NO
2
+
+
+
+
+
Nitrowanie
benzenu:
Sumarycznie:Ar—H + HNO3 Ar—NO2 + H2O
C H
3
N O
2
C H
3
C H
3
N O
2
N O
2
C H
3
H N O 3 + 2H 2S O 4
+
+
62%
o-nitrotoluen
5%
m-nitrotoluen
33%
p-nitrotoluen
Nitrowanie
toluenu:
38
SULFONOWANIE
Polega na wprowadzeniu do pierścienia aromatycznego grupy
sulfonowej - SO3H w miejsce atomu wodoru.
Grupa sulfonowa jest resztą kwasu siarkowego i zachowuje własności
tego kwasu:
H
S O
3
H
+ H
S O
3
H
+ S O
3
H
kwas
benzenosulfonowy
+
+
+
+
+
+
Ogólnie:
H2SO4 + Ar—H H2O + Ar—SO3H
Reakcja sulfonowania jest reakcją odwracalną.
39
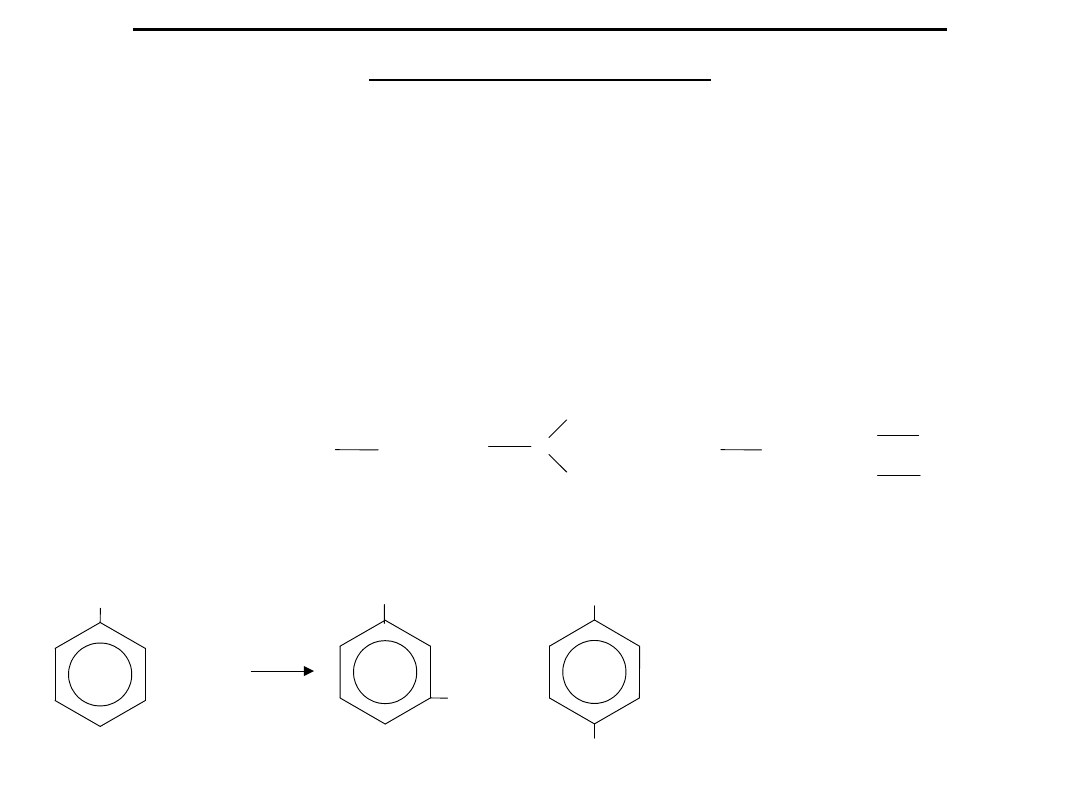
Reguły podstawiania w pierścieniu
aromatycznym
Podstawienie atomów wodoru w pierścieniu benzenowym, jeżeli występuje
w nim już jakiś podstawnik, przebiega wg określonych reguł. Każdy
podstawnik “kieruje” (orientuje) drugi podstawnik w określone
miejsce.
W zależności od działania kierującego podstawniki dzieli się na dwie
grupy:
1. Podstawniki pierwszego rodzaju kierują w położenie:
ORTO—
lub PARA—
NH
2
N
CH
3
CH
3
OH
CH
3
R
aminowa dimetyloaminowa hydroksylowa
metylowa i alkilowa
A
+ B
B
A
A
B
odmiana orto-
odmiana para-
+
A
-
podstawnik
pierwszego
rodzaju
B
-
podstawnik
wprowadzany
40
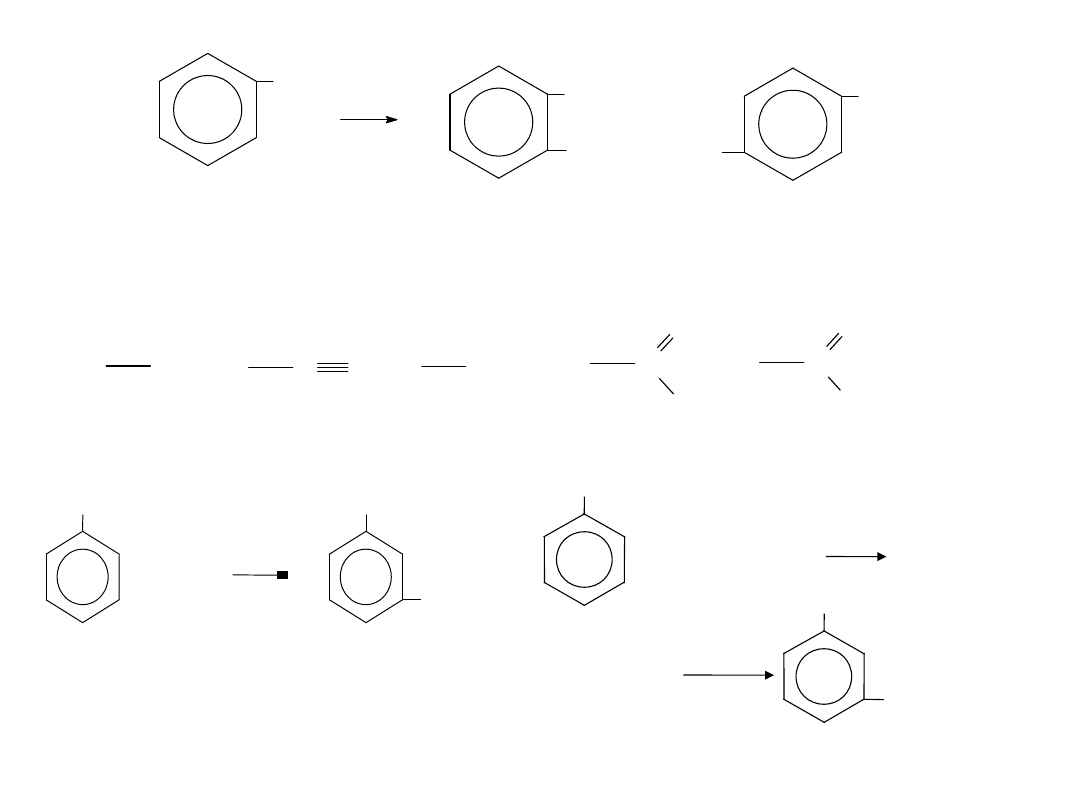
2. Podstawniki drugiego rodzaju kierują wprowadzany podstawnik w
położenie
META—
NO
2
C N
SO
3
H
C
O
H
C
O
OH
nitrowa
nitrylowa
sulfonowa aldehydowa karboksylowa
C
C
B
+ B
C - podstaw nik drugiego rodzaju
NO
2
+ HO-NO
2
NO
2
NO
2
+ H
2
O
m-dinitrobenzen
nitrobenzen
N p.:
C H
3
C H
3
B r
C H
3
B r
Br
2
+
41
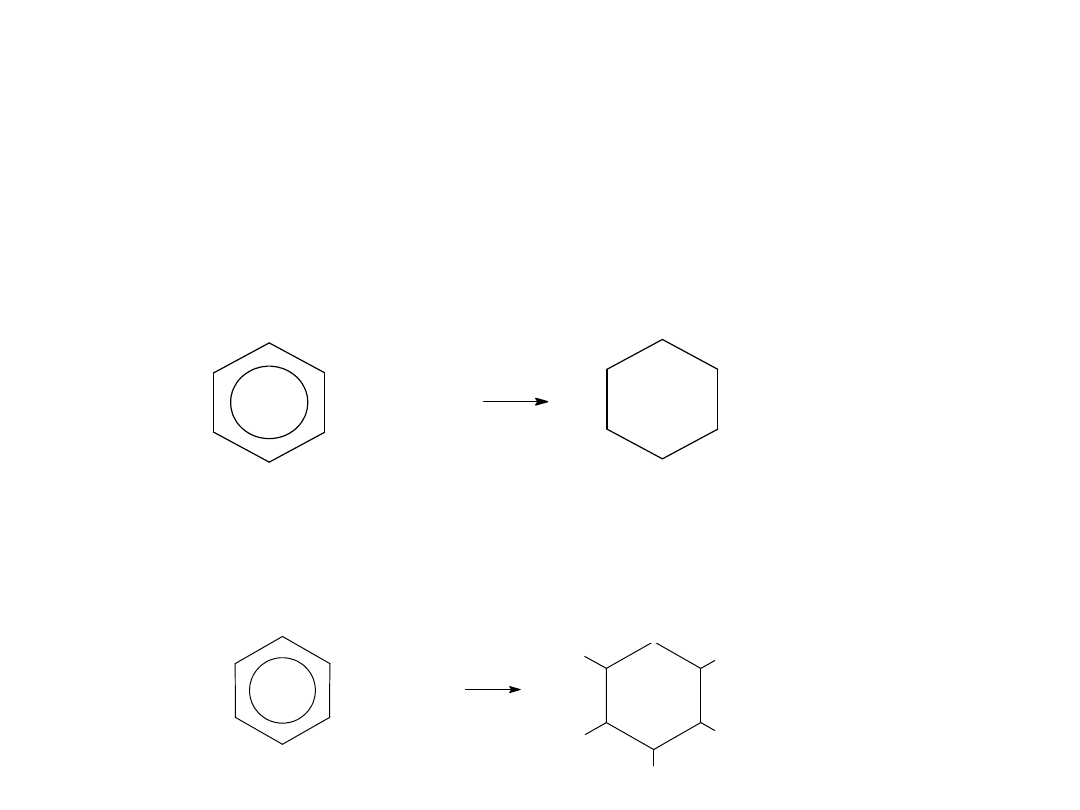
Reakcje przyłączenia
węglowodorów
aromatycznych.
Znane są reakcje przyłączenia do arenów (przebiegają trudniej
niż do węglowodorów nienasyconych).
Uwodnienie benzenu - przebiega wobec niklu jako katalizatora
oraz przy podwyższonym ciśnieniu.
benzen
+ 3H
2
Ni
cykloheksan
Jeżeli mieszanina benzenu i chloru są naświetlane
promieniowaniem ultrafioletowym następuje przyłączenie
chloru:
Cl
Cl
Cl
Cl
Cl
Cl
+ 3Cl
2
h
heksachlorocykloheksan
42
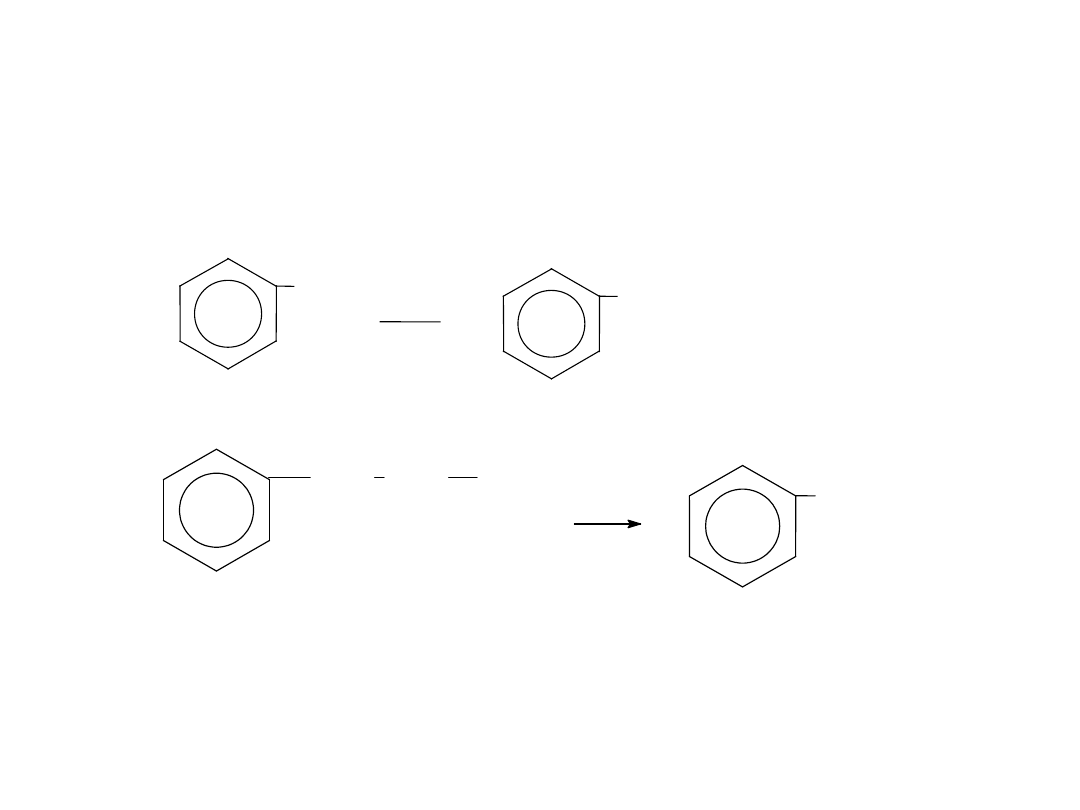
UTLENIENIE
Utlenieniu łatwo ulega łańcuch boczny w węglowodorach
aromatycznych do grupy karboksylowej:
—COOH.
COOH
CH
2
CH
2
CH
3
[O]
n-propylobenzen
kwas benzoesowy
CH
3
COOH
metylobenze
n
[O]
kwas
benzoesowy
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
Wyszukiwarka
Podobne podstrony:
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
chemia organiczna 2003 cała PDF(1)
Egzamin Chemia organiczna zestawy 1 8
więcej podobnych podstron