
Funkcjonały gęstości
elektronowej.
Metody DFT
Wykład 8

Koszt obliczeniowy ~ N
4
(N jest liczbą funkcji
bazy)
STO-3G
6-31G 6-31G* 6-31G**
H
1
2
2
5
C
5
9
15
15
C
6
H
6
36
66
102
120
Praktyka metody HF
e
-
e
-
Dokładność - ograniczona (nie uwzględnia
korelacji elektronów
).
Ruch elektronów jest
skorelowany
:
Dwa elektrony, które mają
ten sam
spin
unikają się (ten efekt jest uwzględniony
w metodzie HF przez zastosowanie
wyznacznika Slatera)
Dwa elektrony o
przeciwnym
spinie
też się unikają (ten efekt nie jest uwzględniony
w metodzie HF)
Korelacja elektronów
Metoda HF
Metody półempiryczne
Korelacyjne
metody ab initio
Metody uwzględniające
pośrednio
korelację elektronów
AM1, PM3, MNDO, itd.
•Metoda perturbacyjna Møller-
•Plesset MPn (n = 2, 3, 4…)
•Metody Configuration Interaction
Full CI, CISD, MRCI, itd.
•Metody sprzężonych klasterów
CCSD, CCSD(T), itd.
nie uwzględnia
korelacji
elektronów
Metody uwzględniające
wprost
korelację elektronów
Metody
DFT

Krótka historia metod DFT
1927
: Model Thomasa-Fermiego statystycznego rozkładu
elektronów w atomie.
1964
: Artykuł Hohenberga i Kohna udowadniający istnienie
dokładnego funkcjonału gęstości.
1965
: Równania Kohna-Shama.
lata1970-te i wczesne 80
: Przybliżenie lokalnej gęstości
LDA. Metoda DFT staje się użyteczna.
1985
: Wprowadzenie metod DFT do dynamiki molekularnej
(Car-Parrinello) (Obecnie jedna z 10 najczęściej cytowanych
publikacji).
1988
: Funkcjonały Becke i LYP. DFT zaczyna być stosowane
w chemii.
1998
: Nagroda Nobla dla Waltera Kohna w dziedzinie
chemii za rozwój metod DFT.

Walter Kohn, nagroda Nobla
1998
“Self-consistent Equations including Exchange and Correlation
Effects”
W. Kohn and L. J. Sham, Phys. Rev. 140, A1133 (1965)
Cytat z pracy Kohna i Shama :
“…
“…
nie oczekujemy
nie oczekujemy
dokładnego opisu wiązania chemicznego
dokładnego opisu wiązania chemicznego
.”
.”

Funkcja
zależy od zmiennych liczbowych. Jest to
przepis jak z
liczby
(lub z wielu liczb) otrzymać
inną
liczbę
.
y = f (x)
np. funkcja falowa zależy od współrzędnych
elektronu.
Co to jest funkcjonał?
Funkcjonał
zależy od funkcji, która z kolei
zależy od zmiennych liczbowych. Jest to przepis
jak z
funkcji
otrzymać
liczbę
.
E = F [ f (x) ]
np. energia zależy od funkcji falowej, z ta
zależy od współrzędnych elektronu.
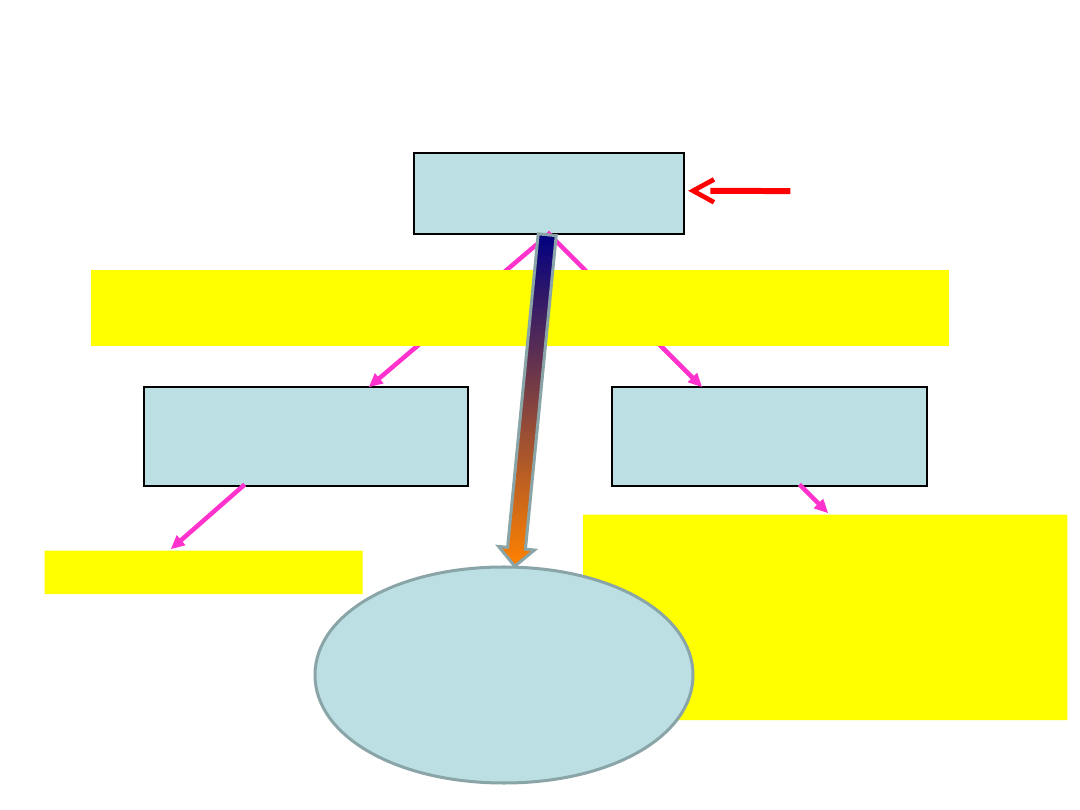
Gęstość elektronową można obliczyć jako
kwadrat funkcji falowej scałkowany po
współrzędnych N-1 elektronów.
Stopień skomplikowania funkcji falowej
wzrasta wraz z liczbą elektronów,
natomiast gęstość elektronowa zawsze
zależy od 3 współrzędnych.
Teoria funkcjonałów
gęstości
x
x
1964 Hohenberg & Kohn
●
Energia
stanu podstawowego
jest
całkowicie określona przez gęstość
elektronową
.
E = F [
(x) ]
●
Jeżeli znamy gęstość elektronową
,
możemy bezpośrednio obliczyć energię,
pomijając funkcję falową.
●
Energia E osiąga
minimum
jeżeli gęstość
elektronowa
, jest
dokładną
gęstością
stanu podstawowego.
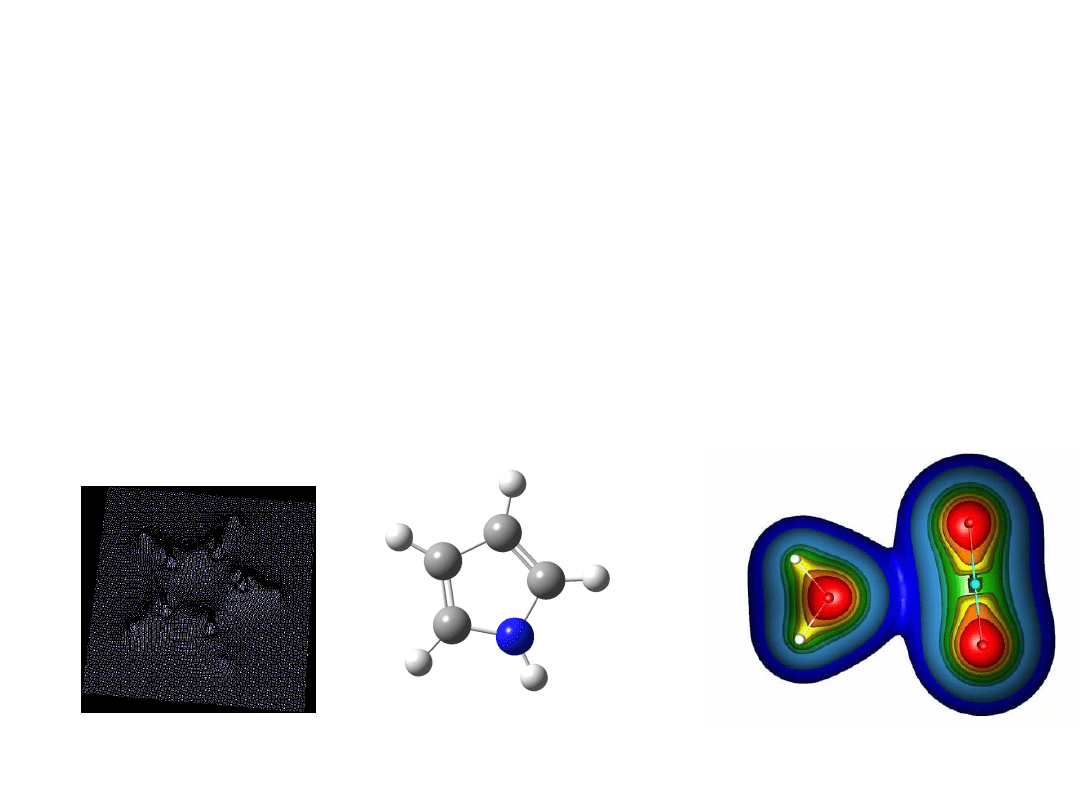
Lemat* Hohenberga-Kohna
Gęstość elektronowa (r) całkowicie definiuje
układ chemiczny. Intuicyjny dowód tego
stwierdzenia:
Całka gęstości elektronowej określa liczbę elektronów
w układzie
Szpice gęstości elektronowej określają położenia jąder
atomowych
Wysokość tych szpiców jest proporcjonalna do ładunku
jąder atomowych
*Lemat – w matematyce twierdzenie pomocnicze, którego głównym
zastosowaniem jest uproszczenie dowodów innych, bardziej istotnych
twierdzeń.
pirol
H2O + CO2
Istnieje ścisła zależność pomiędzy energią cząsteczki E a
gęstością elektronową
: E = F [
(x) ], ale nie znamy
funkcjonału F!
Głównym celem metod DFT jest znaleźć postać F[
(x)
].
Funkcjonał energii można podzielić na kilka części:
E[
] = T[
] + E
ne
[
] + J[
] + K[
]
Teoria funkcjonałów
gęstości
Energia
kinetyczna
elektronów
Energia przyciągania
jąder i elektronów
Energia odpychania
elektron - elektron
Energia wymiany
Energia odpychania
jąder atomowych jest w
przybliżeniu Borna-
Oppenheimera stała
r
r
R
r
R
d
Z
E
M
a
a
a
a
ne
)
(
)
(
]
[
'
'
)
'
(
)
(
2
1
]
[
r
r
r
r
r
r
d
d
J
Z wzorami na E
ne
[
] + J[] nie ma problemu:
Ale jak obliczyć T[
] i K[] ?
Funkcjonał energii
kinetycznej i wymiany
Wczesne próby znalezienia postaci funkcjonału energii
kinetycznej opierały się na teorii gazu elektronowego Thomasa-
Fermiego:
r
r d
C
T
F
TF
)
(
]
[
3
5
3
2
2
)
3
(
10
3
F
C
A wzór na funkcjonał wymiany został zaproponowany przez
Diraca:
r
r d
C
K
X
D
)
(
]
[
3
4
3
1
3
4
3
X
C
Ta wczesna (nie używająca pojęcia orbitali elektronowych) teoria
funkcjonału gęstości nieźle opisywała elektrony walencyjne w
metalach, ale zupełnie nie nadawała się do opisu atomów i
cząsteczek. W tej teorii wiązanie chemiczne nie istniało!

Teoria Kohna-Shama
Głównym powodem niepowodzenia wczesnej teorii Thomasa-
Fermiego był nieodpowiedni funkcjonał energii kinetycznej, co
powodowało błąd ok. 10-20%.
Ideą metody KS jest podzielić funkcjonał energii kinetycznej na dwie
części – jedną, która może być obliczona dokładnie i drugą - małą
poprawkę.
Ceną, którą trzeba zapłacić jest ponowne wprowadzenie orbitali co
zwiększa liczbę zmiennych do 3N. Metoda KS jest podobna do
metody Hartree-Focka, stosuje takie same wzory na energię
kinetyczną, energią oddziaływania elektronów z jądrami atomowymi i
elektronów między sobą.
W metodzie KS nieco inaczej dzieli się funkcjonał energii całkowitej:
Gdzie
T
0
[]
jest energią kinetyczną nieoddziaływujących ze sobą
elektronów, które mają ten sam rozkład gęstości elektronowej (r) jak
układ rzeczywisty.
J(r)
to coulombowskie oddziaływanie elektronów
(również oddziaływanie elektronu z samym sobą), a
V
ext
(r)
to
potencjał zewnętrzny, pochodzący od jąder atomowych, a
E
XC
[]
zawiera wszystkie pozostałe składniki.
]
[
)
(
)]
(
ˆ
)
(
ˆ
[
]
[
]
[
0
XC
ext
E
d
J
V
T
E
r
r
r
r

Energia korelacyjno-wymienna jest podstawową wielkością
w DFT
Dokładna postać funkcjonału tej energii nie jest znana.
Stosowane są różne przybliżenia.
W funkcjonale
E
XC
[]
zostały
„zamiecione pod dywan”
wszystkie trudne do policzenia oddziaływania:
energia wymiany
energia korelacji elektronów
korekta energii kinetycznej
korekta energii coulombowskiej (oddziaływanie elektronu z
sobą)
Energia korelacyjno-
wymienna
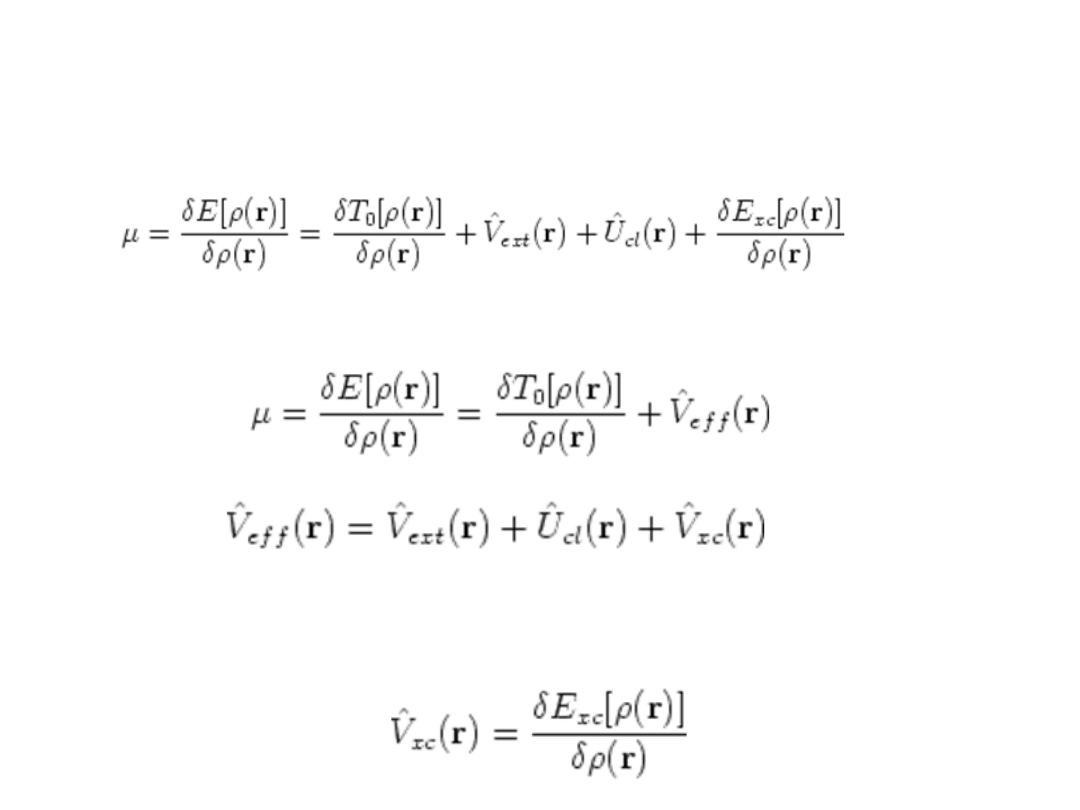
Stosując zasadę wariacyjną otrzymamy:
Potencjał efektywny
Co inaczej można
zapisać:
gdzie:
Potencjał korelacyjno-wymienny jest pochodną
funkcjonału energii korelacyjno-wymiennej:
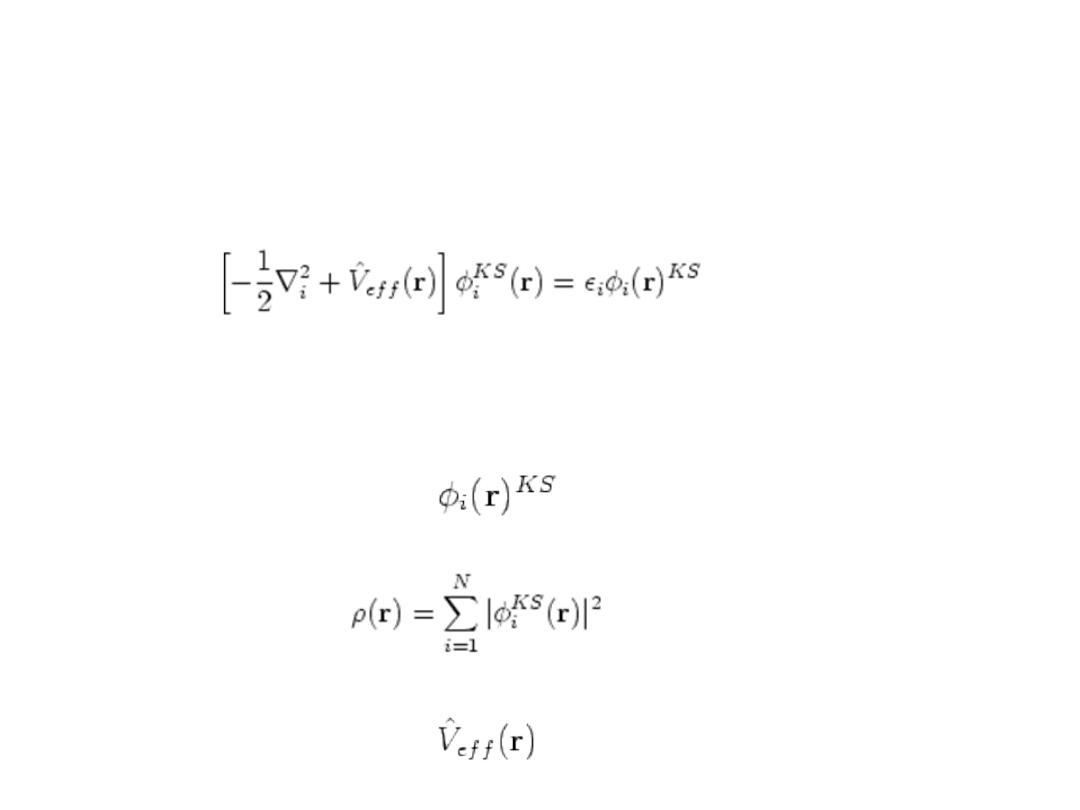
Równanie Kohna-Shama
Równania Kohna-Shama to jednoelektronowe równania
Schrödingera dla fikcyjnego układu nieoddziaływujących
elektronów w zewnętrznym polu pochodzącym od jader
atomowych
Które mogą być użyte do obliczenia gęstości elektronowej:
Tak! Te równania są podobne do równań Hartree-Focka ale są
znacznie łatwiejsze do rozwiązania, bo operator w równaniach
KS jest taki sam dla wszystkich orbitali. Rozwiązując je
otrzymujemy orbitale Kohna-Shama:
Która może być użyta do obliczenia poprawionego potencjału
efektywnego :
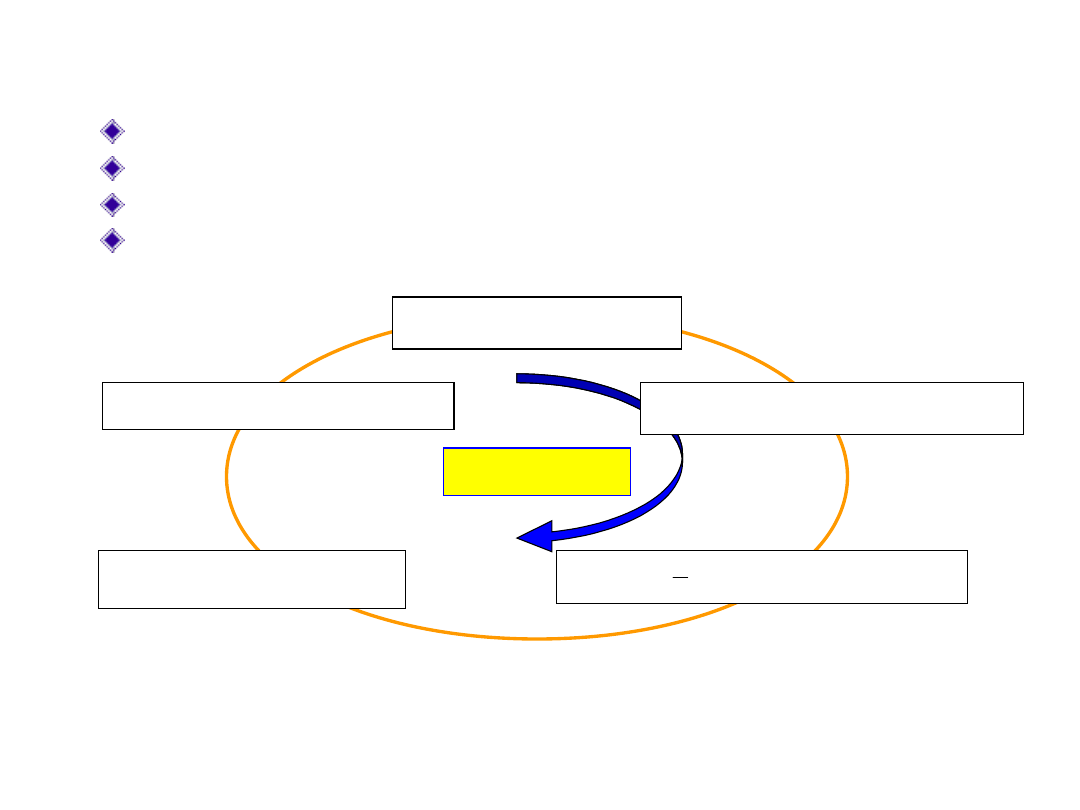
Algorytm metody KS
Aby rozwiązać równania KS musimy znać potencjał V
ef
(r)
Do V
ef
(r) niezbędna jest gęstość elektronowa (r)
Gęstość (r) można otrzymać z orbitali ψ(r)
ψ(r) są nieznane dopóki nie rozwiążemy równań KS.
The computational complexity goes like O(NlogN) , O(N^3)
cykl SCF
Zacznij od
in
(r)
oblicz V
ef
(r) =f[
(r)]
)
(
)
(
)}
(
2
1
{
R
2
r
r
r
i
i
i
ef
V
ozwiąz
F
i
E
i
blicz
2
|
)
(
|
)
(
O
r
r
użyj poprawionej
(r)

Głównym celem metody DFT jest znalezienie funkcjonału
najlepszego z możliwych. (Możliwe, że nigdy nie poznamy
dokładnego
funkcjonału…)
Proponowane są różne funkcjonały, których współczynniki są
dopasowywane tak, aby uzyskać zgodność z eksperymentem
lub wynikami zaawansowanych obliczeń ab initio.
Funkcjonały gęstości
Przybliżenie lokalnej gęstości (
ang. Local Density
Approximation
(
LDA
))
Przyjmuje się, że funkcjonał zależy wyłącznie od gęstości
elektronowej
Przykłady: LSDA (w), VWN (k)
Przybliżenie uogólnionych gradientów (
ang. Generalized
Gradient Approximation
(
GGA
))
Przyjmuje się, że funkcjonał zależy zarówno od gęstości
elektronowej jak i od gradientu tej gęstości.
Przykłady: PW86 (w), B88 (w), PW91 (k), LYP (k), BLYP
(w = wymiana, k =korelacja)

Funkcjonały
hybrydowe
•Tworzone jako kombinacja liniowa różnych funkcjonałów i
metody Hartree-Focka.
•Przykłady: HH (w), B3 (w), B3LYP
• Funkcjonały podwójnie hydrydowe
•Oprócz mieszania funkcjonałów wymiany z energią
wymiany Hartree-Fock, również miesza funkcjonał
korelacji z energią korelacji liczona metodą MP2.
•Przykłady: MC3MPW, MC3BB
• Funkcjonały Meta-GGA
•Przyjmuje się, że funkcjonały zależą od gęstości
elektronowej, jej gradientu (tak jak w GGA) i jeszcze od
energii kinetycznej.
•Przykłady: VSXC, BB95
Funkcjonały gęstości
(2)
Czas obliczeń metodami DFT jest proporcjonalny do ~ N
4
(N –
liczba funkcji bazy)
Trochę bardziej kosztowne niż metoda HF ale dokładniejsze
Nie ma sposobu na systematyczny wzrost dokładności obliczeń
(przynajmniej na razie).
Dokładność zależy wybranego funkcjonału i od typu
obliczanych układów.
•BLYP
dobry dla metali, kiepski dla związków organicznych
•B3LYP
kiepski dla metali, dobry dla związków organicznych
•MPW1K
specjalnie sparametryzowany do opisu kinetyki reakcji
(dobry dla energii i geometrii stanów przejściowych, kiepski
dla trwałych cząsteczek)
Na ogół uważa, że metoda DFT źle opisuje wiązania
wodorowe i słabe oddziaływanie (dyspersyjne) , ale niektórzy
się z tym nie zgadzają.
Należy sprawdzić funkcjonał zanim go się zacznie używać.
Przetestować metodę na małej cząsteczce dla której są dostępne
wiarygodne dane eksperymentalne lub wyniki zaawansowanych
metod ab initio.
Który funkcjonał wybrać?

Jak dokładne wyniki daje metoda DFT?
Metoda Kohna-Shama -
testy
Energie dysocjacji cząsteczek
[eV]
Cząsteczk
a
LDA
GGA
Dokł.
H
2
4.9
4.6
4.7
CH
4
20.0
18.2
18.2
NH
3
14.6
13.1
12.9
H
2
O
11.6
10.1
10.1
CO
13.0
11.7
11.2
O
2
7.6
6.2
5.2
Długość wiązania [Bohr]
Cząsteczk
a
LDA
GGA
Eksper.
H
2
2.16
2.01
2.07
CO
2.22
2.08
2.13
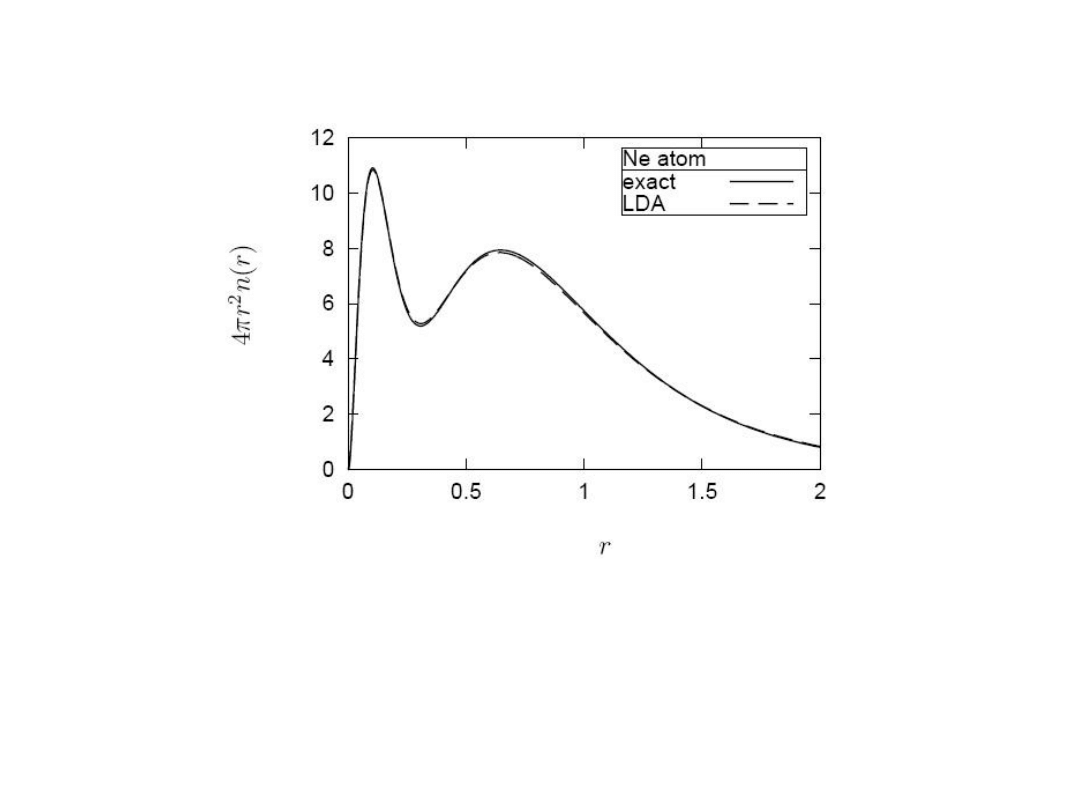
Metoda Kohna-Shama -
testy
Dokładna i obliczona z użyciem funkcjonału LDA
radialna gęstość atomu Ne.
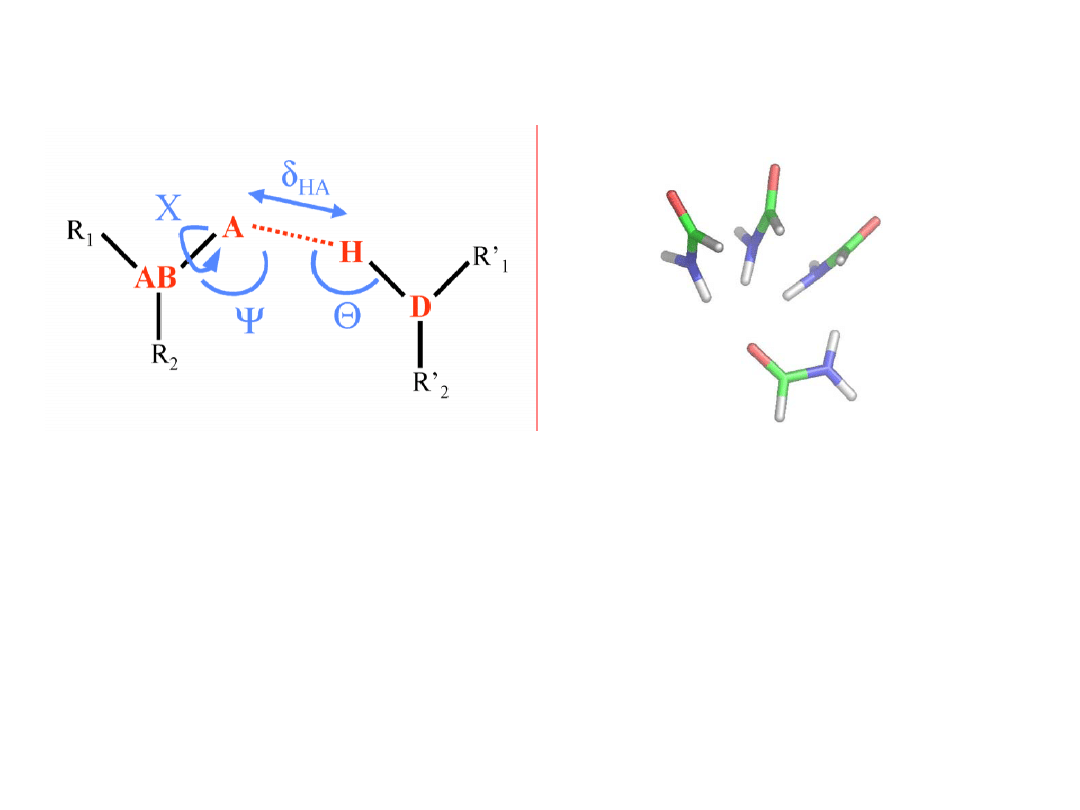
A – akceptor protonu;
D – atom donora;
H –atom wodoru;
4 parametry geometryczne
na jedno wiązanie
wodorowe.
Wiązanie wodorowe – opis
układu
Model wiązania
wodorowego
w białkach to dimery
małych amidów, np.
formamidu
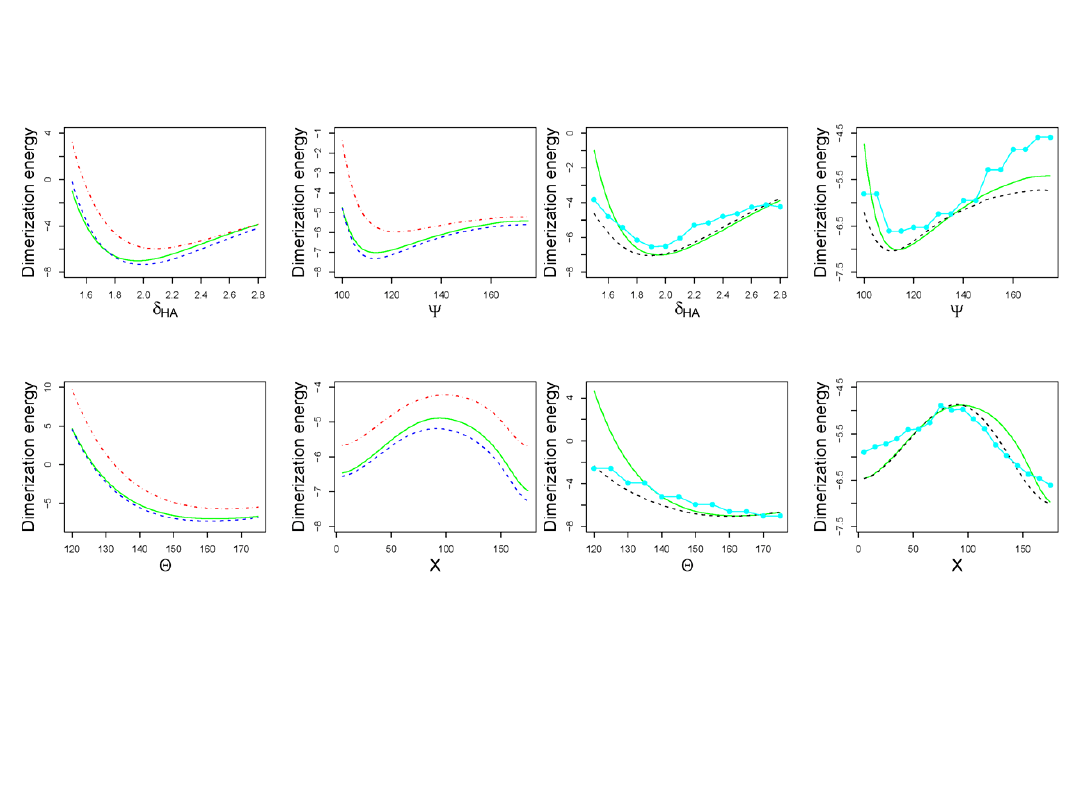
Porównanie wyników DFT
czerwone
– HF;
zielone
– DFT;
niebieskie
– HF+MP2;
czarne – DFT z dodatkową relaksacją energii;
turkusowy
– dane eksperymentalne.

Pytania
•Co to jest funkcjonał? Podać przykłady
•Jakie znasz metody obliczeniowe uwzględniające energię
korelacji elektronów? Jakie są wady i zalety każdej z nich?
•Rodzaje funkcjonałów korelacyjno-wymiennych.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
Wykład 3 1 DFT
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
WYKŁAD VII
Wykład 1, WPŁYW ŻYWIENIA NA ZDROWIE W RÓŻNYCH ETAPACH ŻYCIA CZŁOWIEKA
Zaburzenia nerwicowe wyklad
Szkol Wykład do Or
Strategie marketingowe prezentacje wykład
Wykład 6 2009 Użytkowanie obiektu
wyklad2
wykład 3
wyklad1 4
więcej podobnych podstron