
Nowotwory
dziedziczne.
Zakład Genetyki Katedry Patofizjologii
Akademia Medyczna we Wrocławiu
Przygotowała: dr n.med. Agnieszka Stembalska

Rak piersi
• Corocznie w Polsce około 11 000 nowych
zachorowań.
• Najwięcej nowotworów złośliwych piersi
rozpoznaje się u kobiet w wieku 45-69 lat
• Jest to najczęstsza przyczyna zgonu
wśród kobiet w wieku 50-55 lat.
• Średni wiek zachorowania na raka piersi
w Polsce wynosi 58,3 lat [KRN 2000].

Większość przypadków raka piersi i/lub jajnika ma
nieznaną etiologię,
tylko 10% nowotworów tego typu jest dziedziczna
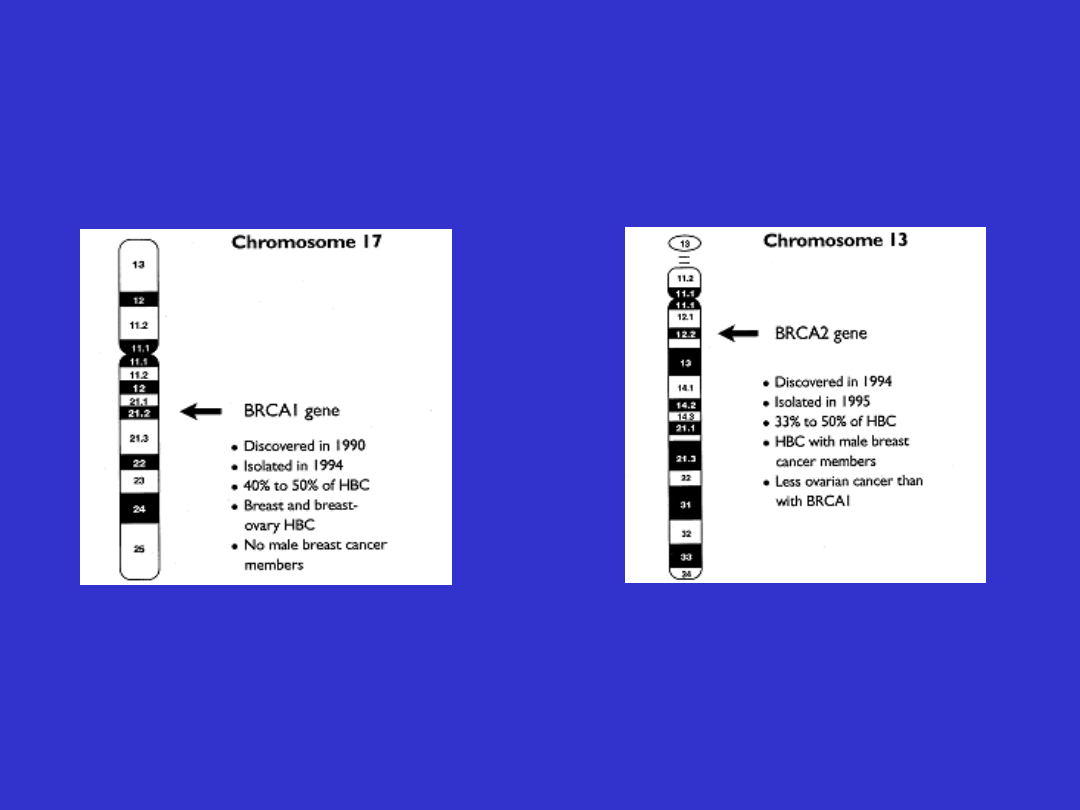
Geny związane z
dziedzicznym rakiem piersi
i/lub jajnika
• Gen BRCA 1
• Gen BRCA 2

Przypadek kliniczny:
Do Poradni Genetycznej zgłosiła się skierowana
przez lekarza onkologa 41 letnia pacjentka, u
której w 38 r.ż. zdiagnozowano pierwotnego raka
jajnika lewego. Obecnie u pacjentki w czasie
badań profilaktycznych stwierdzono pierwotny
nowotwór piersi lewej. Oba nowotwory zostały
potwierdzone histopatologicznie. W rodzinie
pacjentki występowały już nowotwory jajnika i
piersi.
Lekarz onkolog zasugerował rozpoznanie
dziedzicznej predyspozycji do nowotworów u
pacjentki.
Jakie cechy rodowodowo-kliniczne zadecydowały o
postawieniu rozpoznania dziedzicznego raka pierś-
jajnik?

Dane
kliniczne:
rodzaj
nowotworu,
rozpoznanie
histopatologiczne,
stopień
zaawansowania
choroby
nowotworowej,
stopień
zróżnicowania
komórek
nowotworowych
Wywiad rodzinny (rodowód):
- matka, rodzeństwo matki i ich potomstwo,
rodzice matki, ich rodzeństwo i potomstwo
ojciec, rodzeństwo ojca i ich potomstwo,
rodzice ojca, ich rodzeństwo i potomstwo
stopień pokrewieństwa między osobami, u
których wystąpił nowotwór (rodzaj, lokalizacja,
wiek zachorowania, ewentualny wiek zgonu)
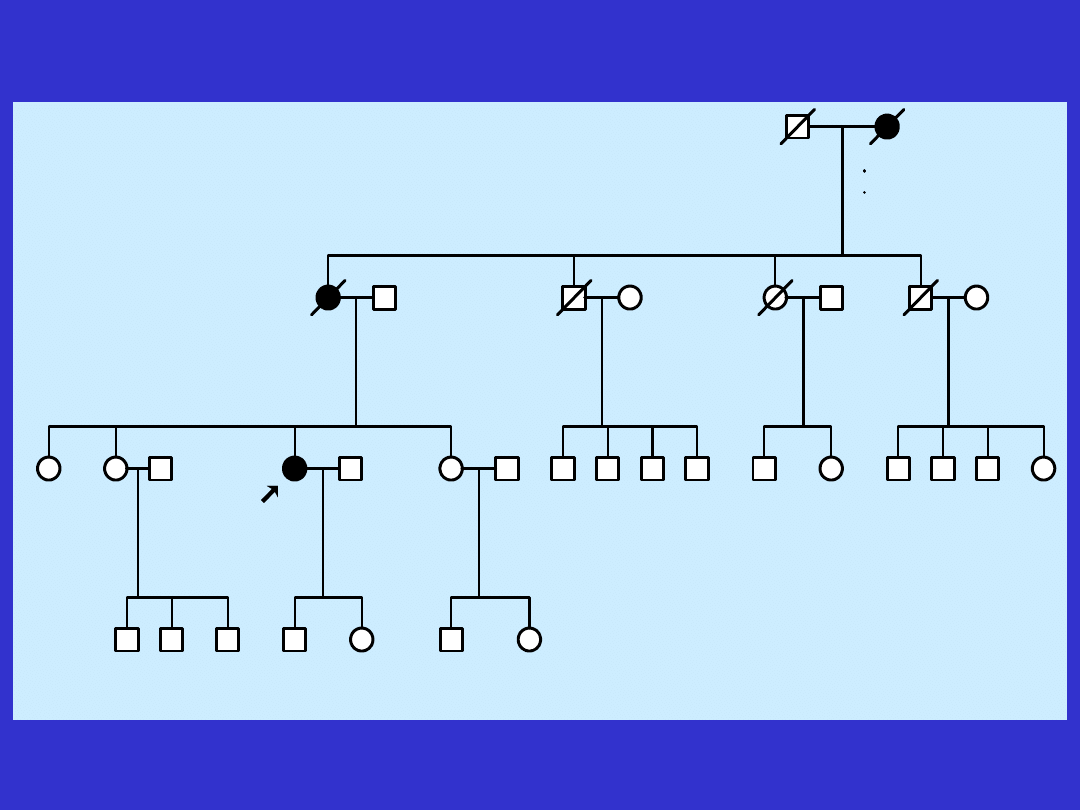
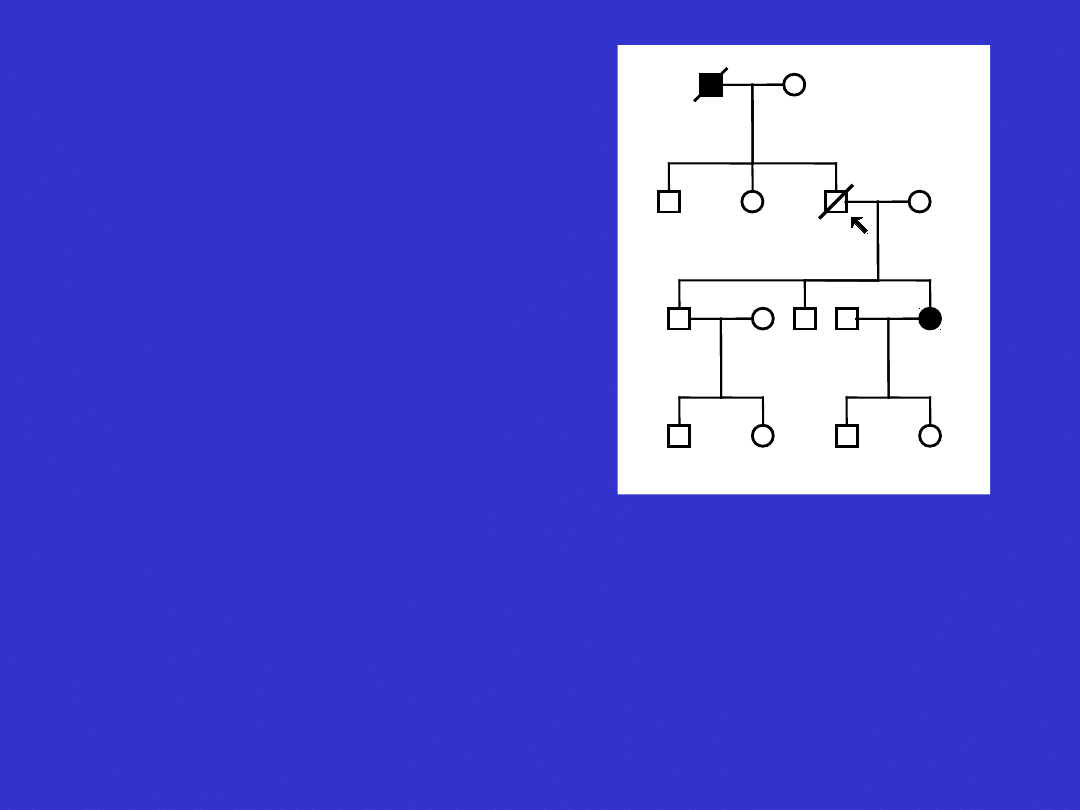
III:1
I:1
I:2
II:1
II:2
III:2
III:3
IV:1
IV:2
IV:3
III:4
III:5
IV:4
IV:5
III:6
III:7
IV:6
IV:7
II:3
II:4
III:8
III:9
III:10 III:11
II:5
II:6
III:12
III:13
II:7
II:8
III:14 III:15 III:16
III:17
rak piersi w 50 r.z.
d 58
41 lat
rak jajnika w 35 r.z.
rak piersi w 40 r.z.
rak jajnika w 40 r.z.
d 50
d 70
d 82
d 69
21 lat
17 lat
35 lat
27 lat 39 lat
9 lat 8 lat 13 lat
2 lata
5 lat

Zebrany wywiad od pacjentki w Poradni Genetycznej
potwierdził wysokie ryzyko istnienia dziedzicznego
raka pierś-jajnik.
Pacjentka została zakwalifikowana do badań
genetycznych.
Postawienie podejrzenia rozpoznania
na podstawie danych rodowodowo-
klinicznych:
dziedziczny rak piersi-jajnika
(hereditary breast-ovarian cancer;
HBOC)

Badania potwierdziły obecność konstytucyjnej
mutacji w genie BRCA1.
Mutacje jakich genów odpowiadają za
powstanie dziedzicznego raka piersi i jajnika?
Jaki rodzaj badań należy zaproponować w celu
potwierdzenia rozpoznania?

Możliwości diagnostyczne:
Badania molekularne w kierunku nosicielstwa
mutacji w genie BRCA1 i BRCA2.
Wyniki badań molekularnych:
- Potwierdzenie obecności mutacji – badania
molekularne u innych członków rodziny
wytypowanych na podstawie rodowodu,
profilaktyka
- Brak potwierdzenia obecności mutacji –
badanie innych genów, objęcie opieka członków
rodziny wytypowanych na podstawie
rodowodu, profilaktyka

Kogo z rodziny należy objąć badaniami genetycznym
w przypadku potwierdzenia mutacji w genie
odpowiedzialnym za dziedziczną predyspozycję do
nowotworów?
Badaniami genetycznymi i poradnictwem
genetycznym objęto innych członków rodziny
wytypowanych na podstawie rodowodu. U
wszystkich osób, u których stwierdzono mutację
w genie BRCA1 wprowadzono badania
profilaktyczne.

Porada genetyczna
Określenie ryzyka powtórzenia się
choroby
(dziedziczenie predyspozycji, ryzyko
zachorowania)
Profilaktyka (badania)

dziedziczne (dziedziczenie
Mendlowskie)
rodzinne (najprawdopodobniej
wieloczynnikowy tor dziedziczenia)
sporadyczne
NOWOTWORY:

30% wszystkich nowotworów powstaje w wyniku
wysokiej, genetycznie uwarunkowanej
predyspozycji
nowotwory dziedziczne powstają
najczęściej w wyniku predyspozycji
jednogenowej lub wielogenowej
ZASADY DZIEDZICZENIA PREDYSPOZYCJI
DO NOWOTWORÓW
Jednogenowa predyspozycja do nowotworów
•
mutacje somatyczne
w pojedynczym genie,
występują jedynie w tkance nowotworowej
•
mutacje konstytucyjne
(tj. obecne we
wszystkich komórkach organizmu)
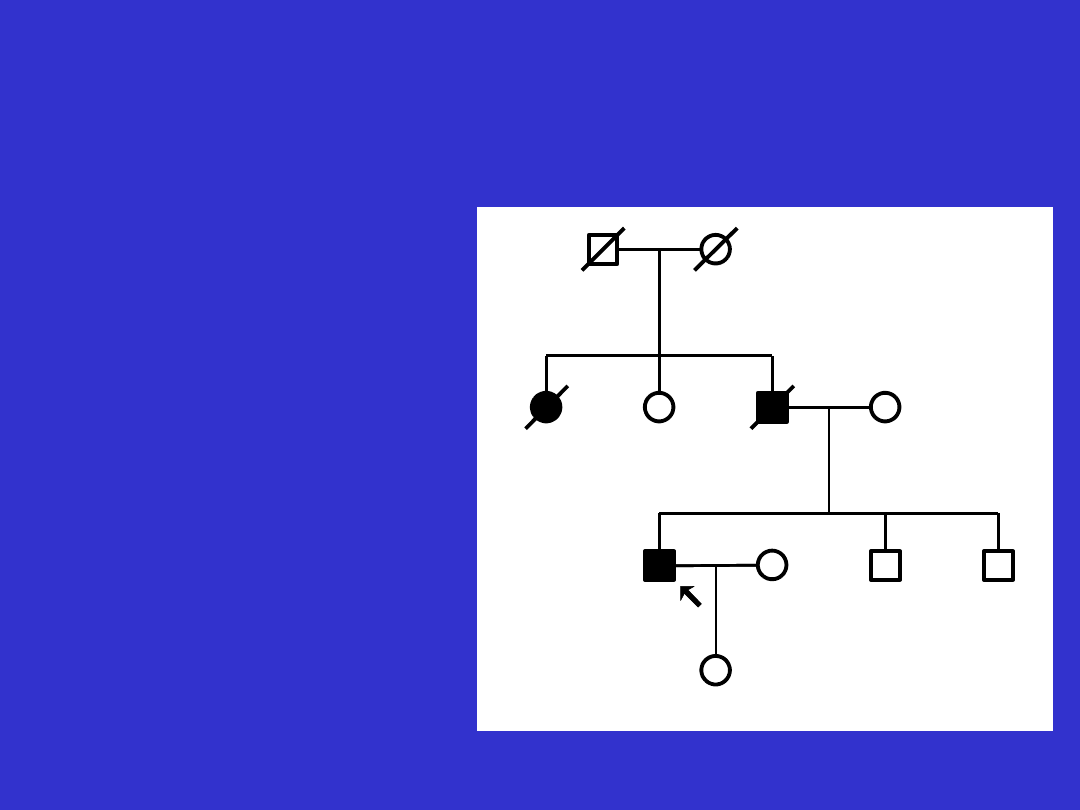
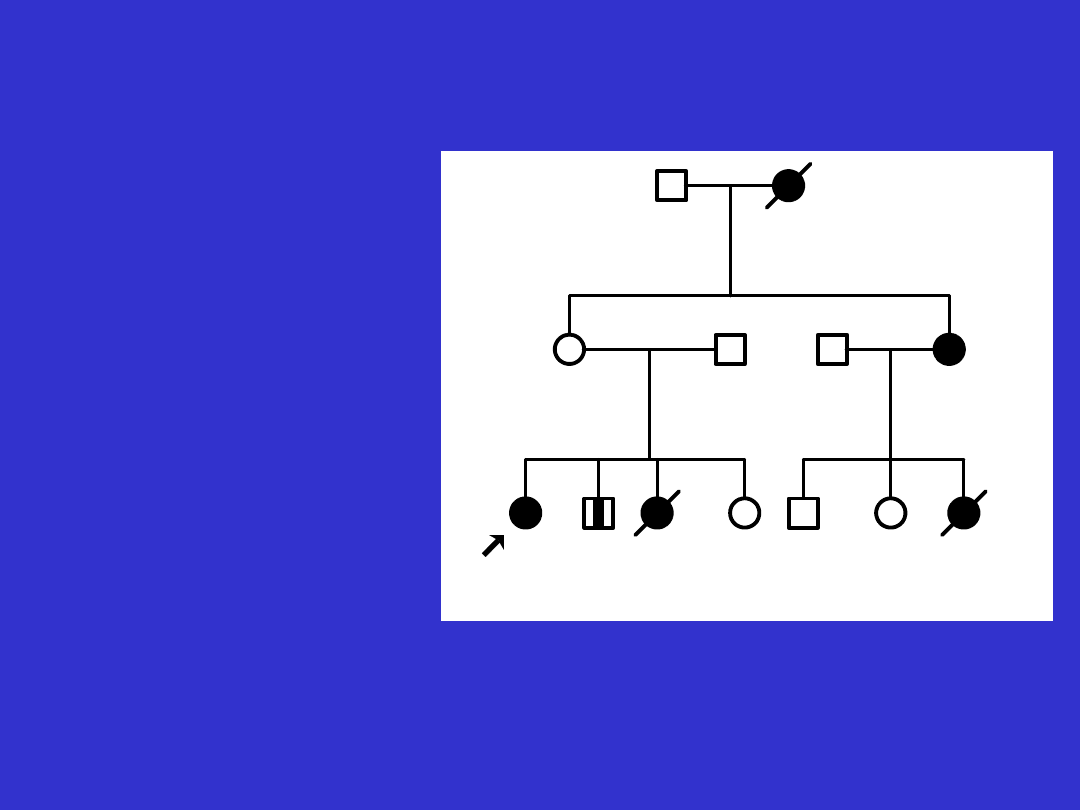
Rodowodowo dziedziczenie jednogenowe
autosomalnie dominujące charakteryzuje
występowanie zachorowań:
• w każdym kolejnym pokoleniu (
pionowa
transmisja)
• zarówno u mężczyzn jak i u kobiet
• u blisko 50% krewnych
8
1
Co36
2
d52
Co49
3
4
5
6
7
9
10
d59
Co58
11
Rodzina z zespołem Lyncha - z rodowodowymi cechami choroby
jednogenowej autosomalnie dominującej.
Co49- rak jelita grubego rozpoznany w
49 roku życia
d52- zgon w 52 roku życia
Antycypacja - coraz młodszy
wiek pojawiania się
nowotworów w każdym
kolejnym pokoleniu
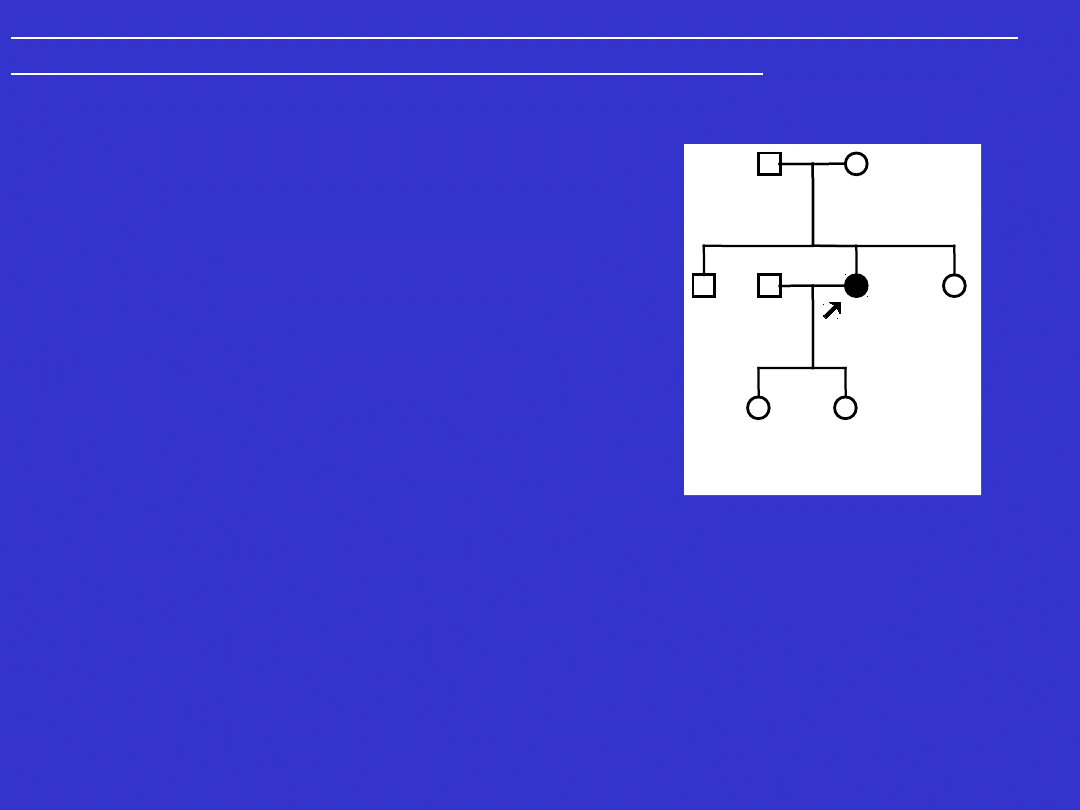
Cech charakterystycznych dla dziedziczenia jednogenowego
dominującego nie stwierdza się w sytuacjach:
• mutacji germinalnych (tj. w plemnikach lub komórkach jajowych) „de novo”
– w takich przypadkach nie występują zachorowania w pokoleniach przodków
probanta (osoby zasięgającej porady genetycznej); mutacja jest przekazywana
na następne pokolenia.
Rodowód rodziny z chorobą wywołaną mutacją
germinalną „de novo” w obrębie genu VHL.
Hb - „hemangioblastoma” siatkówki
*/+/- nosiciel mutacji konstytucyjnej
• mutacji mozaikowych, tj. obecnych tylko w niektórych tkankach. Mutacje
takie powstają zwykle „de novo” w okresie zarodkowym; w takich przypadkach
obserwuje się zachorowania u pojedynczej osoby w rodzinie, a mutacja jest
przekazywana na następne pokolenia tylko wówczas, gdy występuje w
komórkach germinalnych.
• mutacji o niskiej penetracji; penetrację definiujemy jako stosunek liczby
osób chorych do liczby nosicieli mutacji. W zespołach predyspozycji do
nowotworów sięga ona nawet 0.8-0.9; w przypadkach mutacji o niskiej
penetracji jest on dużo niższy i wówczas w rodzinie chorują tylko pojedyncze
osoby.
1
Hb18
*/+/
2
3
4
*/+/
5
55
6
53
7
8
28
1
d60
*/+/
2
3
*/+/
4
*/+/
40
5
Rb1 3
*/+/
6
7
8
*/+/
9
10
*/+/
11
12
d45
*/+/
13
14
15
26
Rb1 3
Rodowód rodziny z niską penetracją mutacji genu Rb1.
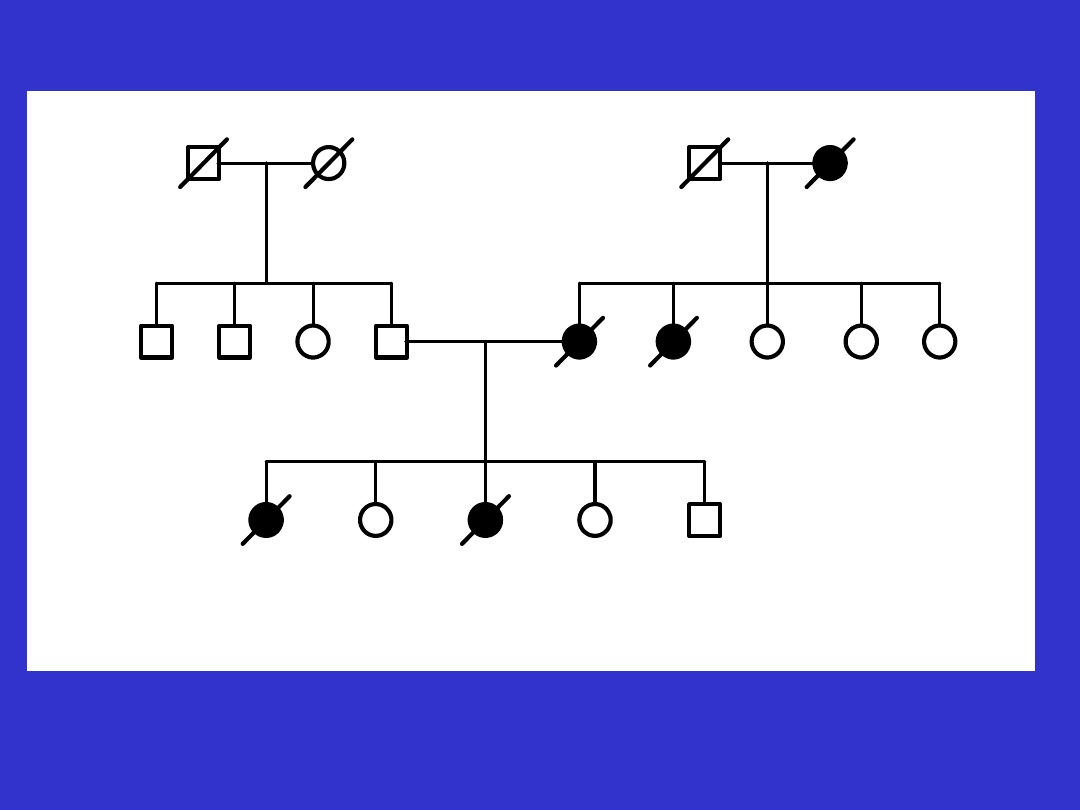
• zwiększonej częstości występowania nosicieli mutacji w kolejnych
pokoleniach. Zjawisko to opisano u potomstwa nosicielek mutacji genu
BRCA1- wśród córek stosunek nosicielek do nie-nosicielek mutacji wyniósł
około 2:1 zamiast oczekiwanego 1:1. Zjawisko to wydaje się prawdopodobne
szczególnie dla mutacji wykazujących „
efekt założyciela
”, tj. takich, które się
szeroko rozprzestrzeniły.
• mutacji skutkujących zachorowaniem tylko u jednej płci. Na przykład
nosicielami mutacji BRCA1 są zarówno mężczyźni jak i kobiety, na raka jajnika
chorują jednak tylko kobiety z tą zmianą
Rb1 3- siatkówczak rozpoznany w 3 r.ż.
*/+/- nosiciel mutacji konstytucyjnej
*/-/- osobnik nie będący nosicielem mutacji konstytucyjnej
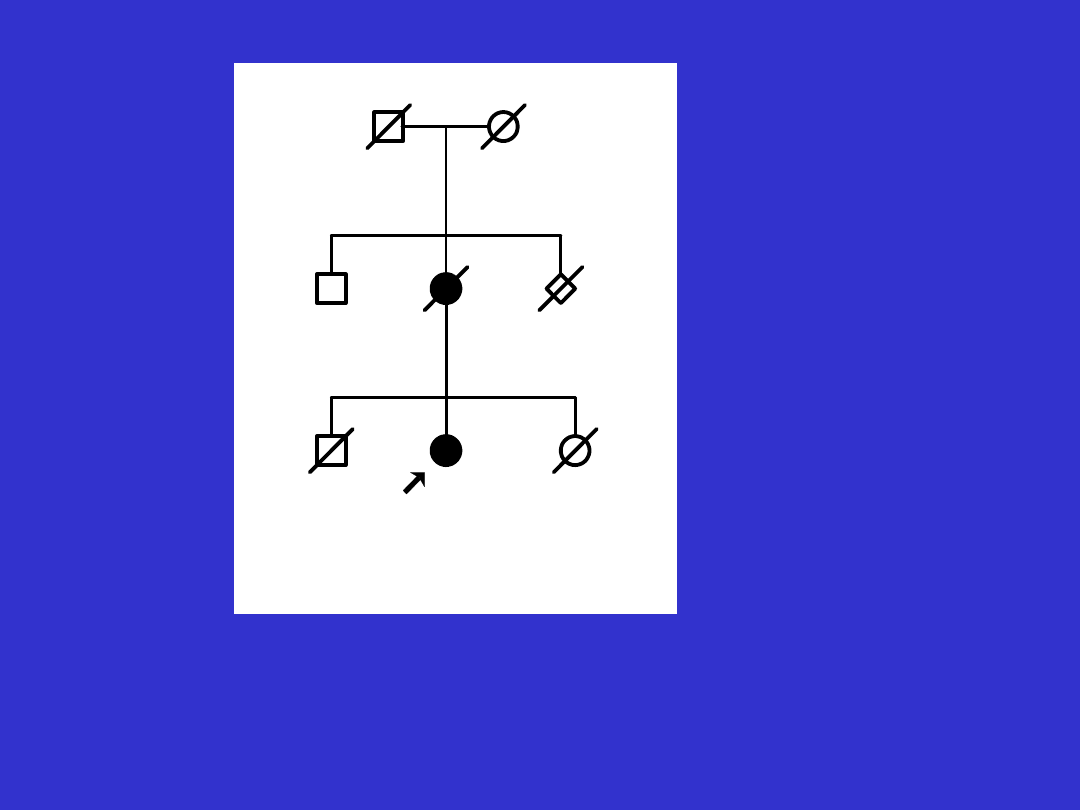
Fenokopia - rak piersi nie związany
z mutacją konstytucyjną w rodzinie
z mutacją BRCA1.
fenokopie - pojawienie się przypadkowych, nie związanych z
nosicielstwem mutacji zachorowań na nowotwory w rodzinie,
wywołanych np. czynnikami środowiskowymi
1
Br
*/-/
2
3
*/+/
4
Pr
5
Br,Ov
*/+/
6
7
8
Br,Ov
*/+/
9
Br
*/+/
10
11
12
13
Br,Ov
*/+/
d45
d60
d39
d60- zgon w 60 roku życia
Br - rak piersi
Ov - rak jajnika
Pr - rak prostaty
*/+/- nosiciel mutacji konstytucyjnej
*/-/- osobnik nie będący nosicielem mutacji
konstytucyjnej

Wielogenowa predyspozycja do nowotworów.
Choruje zwykle tylko pojedyncza osoba w rodzinie.
Ryzyko powtórzenia się choroby wśród krewnych probanta
nie przekracza na ogół 10%.
Czynniki środowiskowe mają duży wpływ na pojawianie się
choroby u osoby
mającej wielogenowe predyspozycje
genetyczne.
Na obecnym etapie rozwoju genetyki nie są znane markery
molekularne,
których rozpoznanie umożliwiałoby
zdiagnozowanie wielogenowej predyspozycji do nowotworów.

Dziedziczny rak piersi i jajnika
- w ok. 30% raków piersi i jajnika - wysoka genetyczna
predyspozycja
Klinicznie predyspozycja ujawnia się najczęściej jako
zespoły tzw.:
• dziedzicznego raka piersi specyficznego narządowo
(hereditary breast cancer – site specific; HBC-ss),
• dziedzicznego raka piersi-jajnika (hereditary breast-
ovarian cancer; HBOC),
• dziedzicznego raka jajnika specyficznego narządowo
(hereditary ovarian cancer; HOC).
1. zespoły HBC-ss, HBOC, HOC - heterogenność kliniczna i
molekularna
2. najczęstsza
przyczyna
powstawania
-
mutacje
konstytucyjne w genach BRCA1 i BRCA2

Wskazania do wykonania badań
genetycznych.
• Wywiad rodzinny (rodowód)
• Dane rodowodowo-kliniczne

KRYTERIA
RODOWODOWO-KLINICZNE
ROZPOZNAWANIA
ZESPOŁÓW
HBC-SS, HBOC I HOC.
Liczba przypadków raka piersi lub jajnika w rodzinie:
A – trzy (diagnoza definitywna)
1. Przynajmniej 3 krewnych dotkniętych rakiem piersi/jajnika
rozpoznanym w dowolnym
wieku;
B – dwa (diagnoza z dużym prawdopodobieństwem)
1. 2 raki piersi lub jajnika wśród krewnych I
o
(lub II
o
przez
mężczyznę);
2. 1 rak piersi i 1 rak jajnika rozpoznane w dowolnym wieku wśród
krewnych I
o
(lub II
o
przez mężczyznę);
C – jeden (diagnoza z dużym prawdopodobieństwem)
1. Wystąpienie raka piersi poniżej 40 roku życia;
2. Wystąpienie raka piersi obustronnego; jeden z nich rozpoznany
przed 50 rokiem życia;
3. Wystąpienie raka piersi rdzeniastego lub atypowego rdzeniastego;
4. Wystąpienie raka piersi i jajnika u tej samej osoby;
5. Wystąpienie raka piersi u mężczyzny;
6. Wystąpienie raka jajnika w wieku 46-50 lat, o stopniu morfologicznej
złośliwości
komórek G3, i/lub w III lub IV stopniu
zaawansowania klinicznego;
7. Wystąpienie raka jajnika w wieku 51-60 lat o stopniu morfologicznej
złośliwości
komórek G1/2, i/lub I lub II stopniu zaawansowania
klinicznego.
1
d42
1958*/+/
2
1938
3
d55
1934
4
1960
5
1961
6
d38
1956
7
1969*/+/
31
d80
32
d48
33
d45
34
35
36
24
d80
25
d80
26
27
30
Ov47
Ov45
Ov55
Ov37
Ov40
Rodzina z zespołem HOC oraz stwierdzoną mutacją
konstytucyjną genu BRCA1 4153delA
1
1940
3
d72
1907
7
8
11
d42
12
d70
13
1917
14
Br57
Br56
Rodzina spełniająca kryteria rodowodowo-kliniczne dla
„podejrzenia HBC-ss” w związku ze stwierdzeniem raka
piersi u probantki i jej matki. Mutacji BRCA1 nie
wykryto.
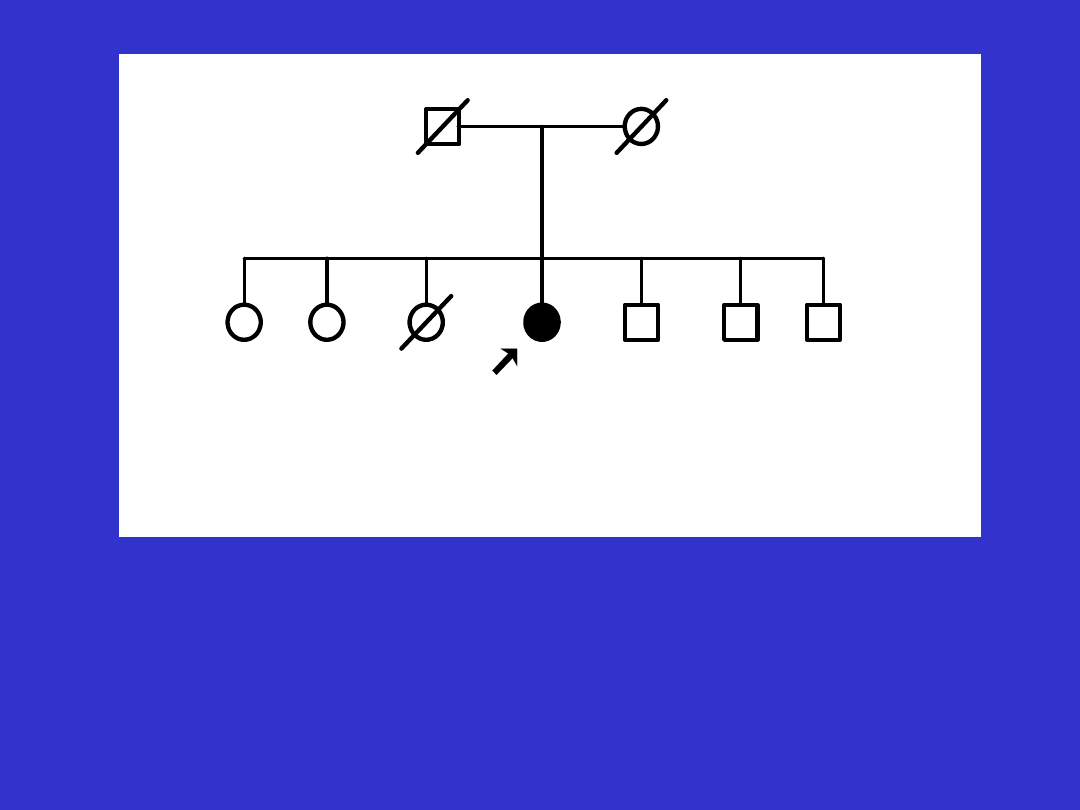
1
1930*/+/
2
d76
1895
3
d86
1901
4
1925
5
1933
6
1943
7
d19
8
1923
9
1935
Ov69
Osoba z rakiem jajnika i ze stwierdzoną mutacją konstytucyjną genu BRCA1 -
5382insC z rodziny bez innych uchwytnych cech rodowodowo-klinicznych
charakterystycznych dla rodzin z dziedzicznym rakiem piersi/jajnika.

•Możliwości diagnostyczne (badania
molekularne).
*
Interpretacja wyników badań
molekularnych
(pewne
potwierdzenie).
Czy można ostatecznie wykluczyć dziedziczną
predyspozycję do wystąpienia nowotworów?
*
Aspekty etyczne i prawne badań
DNA (badania u pełnoletnich, świadoma
zgoda na badanie)

Zespół BRCA1
- konstytucyjna mutacja genu BRCA1 (u nosicielek
obserwuje się około 50-80% ryzyko rozwoju raka
piersi i około 40% ryzyko rozwoju raka jajnika)
Niepełna penetracja BRCA 1 sugeruje, że inne genetyczne i pozagenetyczne
czynniki mają znaczenie w karcinogenezie u nosicieli mutacji. Opisano np.,
że ryzyko rozwoju raka jajnika jest modyfikowane przez VNTR lokus dla
HRAS 1 - ryzyko raka jajnika jest 2-krotnie większe dla nosicieli mutacji
BRCA 1 posiadających jeden lub dwa rzadkie allele HRAS 1.
Charakterystyczne dla raków jajnika u nosicielek mutacji BRCA1 jest
również zwiększone ryzyko raków jajowodu i otrzewnej szacowane na
około 10%.

Raki piersi i jajnika zależne od BRCA1 wykazują szereg
cech klinicznych .
• Średni wiek diagnozowania raków piersi tego typu
wynosi około 42-45 lat a raków jajnika około 54 lat.
• Obustronność stwierdza się w około 32% raków piersi
BRCA1 zależnych.
• Bardzo charakterystyczną cechą jest szybkie tempo
rozrastania się raków piersi – w ponad 90%
przypadków raki BRCA1 zależne wykazują G3 – trzeci
stopień morfologicznej złośliwości już w chwili
rozpoznania. Niemal wszystkie raki jajnika u
nosicielek mutacji BRCA1 diagnozowane są też w
III/IV stopniu zaawansowania klinicznego wg FIGO.
• Raki piersi często są rdzeniaste, atypowe rdzeniaste
lub przewodowe bez wykrywalnej obecności
receptorów estrogenowych (ER-). Raki piersi zależne
od BRCA1 stanowią około 10-15% wszystkich raków
ER-

Zespół BRCA2
- konstytucyjna mutacja genu BRCA2 (w rodzinach z
definitywnym HBC-ss i HBOC u nosicielki mutacji BRCA2
ryzyko raka piersi sięga 31-56% a raka jajnika 11-27%)
Raki piersi i jajnika w rodzinach z mutacjami BRCA2 wykazują szereg cech
charakterystycznych.
• Średni wiek zachorowania na raki zależne od BRCA2 wynosi dla raków
piersi 52 lata u kobiet i 53 lata u mężczyzn oraz dla raków jajnika 62 lata
W odróżnieniu od genu BRCA1, jak dotąd nie opisano dla naszej populacji
”efektu założyciela” dla mutacji genu BRCA2. W związku z powyższym w
Polsce diagnostykę BRCA2 należy najprawdopodobniej wykonywać jedynie w
rodzinach z:
a) rakiem piersi u mężczyzny
b) co najmniej jednym rakiem jajnika i jednym rakiem żołądka, jelita
grubego
lub
trzustki wśród krewnych I lub II stopnia niezależnie od płci osób chorych.

Zespół BRCA X
W Polsce w około 30% rodzin z rozpoznanymi definitywnie
zespołami HBC-ss i HBOC oraz w około 40% rodzin z zespołem HOC
nie są wykrywane mutacje BRCA1 lub BRCA2. W pojedynczych
przypadkach tych rodzin można rozpoznać jeden z rzadkich
zespołów zestawionych w tabeli poniżej, w przebiegu których
występują ze zwiększoną częstością raki piersi/jajnika.
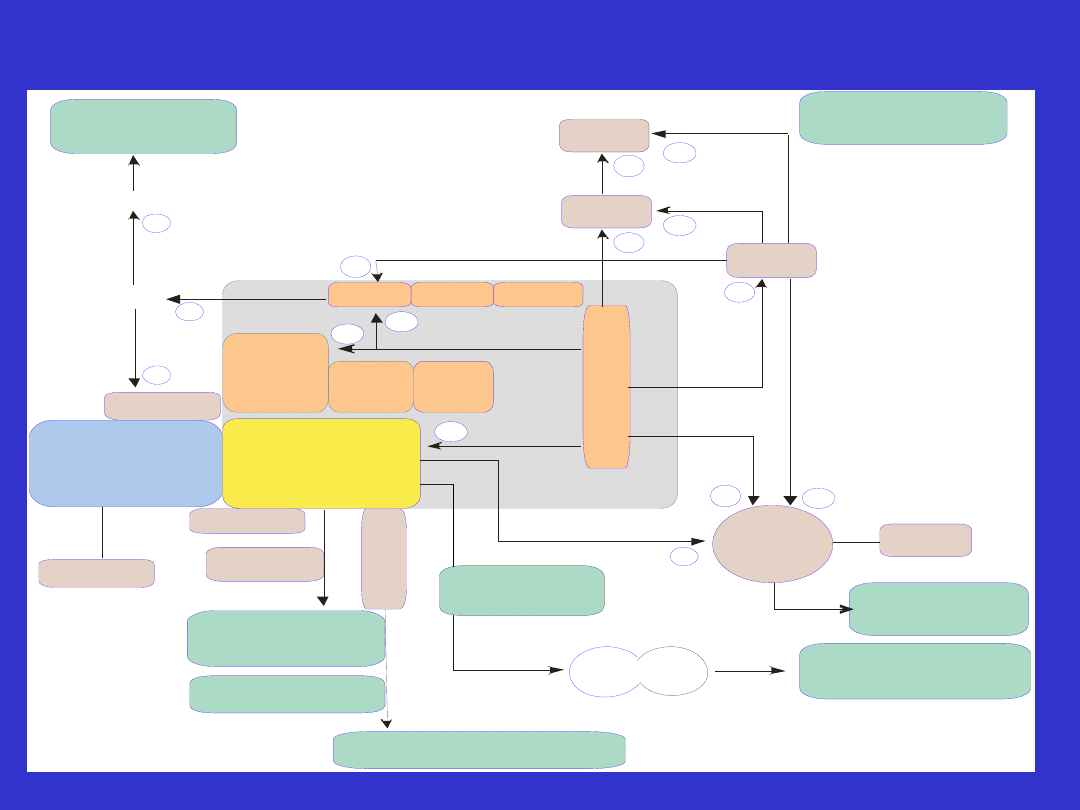
Regulacja
transkrypcji
Punkt kontrolny
G2/M
CDC25
CHK1
CHK2
A
T
M
MMR
MLH1
BLM
BRCA 1
Rad51
BRC A2
FANCD2
SWI/SNF
B
A
R
D
1
Naprawa
DNA
p53
WRN
Regulacja
transkrypcji
Punkty kontrolne
cyklu kom rkowego
ó
Rb-E2F
Obr bka potranskrypcyjna
RNA
ó
Modelowanie
chromatyny
RAD 50
MRE 11
NBS1
cABL
J NK
P
P
P
P
P
P
P
P
P
P
P
+
+
+
+
Ubikwitynacja
BASC
BRAF 35
Inne
geny

Wybrane rzadkie zespoły genetyczne ze zwiększonym ryzykiem
występowania raka piersi i/lub jajnika
.
---------------------------------------------------------------------------------------------------------------------------
Schorzenie
Obraz kliniczny
Mutacje genu/Dziedziczenie
---------------------------------------------------------------------------------------------------------------------------
Zespół
Raki piersi, mięsaki, guzy
p53,
Li-Fraumeni
mózgu, białaczka, raki nad-
wysoka penetracja;
nercza
AD
--------------------------------------------------------------------------------------------------------------------------
Choroba
Wieloogniskowe zaburzenia
PTEN
Cowdena
śluzowoskórne, łagodne
AD
choroby proliferacyjne
różnych organów, raki
tarczycy, raki piersi/jajnika
---------------------------------------------------------------------------------------------------------------------------
HNPCC
Raki jelita grubego, trzonu macicy MSH 2, MLH 1;
i innych organów włączając
AD
raka piersi/jajnika
---------------------------------------------------------------------------------------------------------------------------
Zespół
śluzowoskórna pigmentacja
STK11;
Peutz-Jeghers
melaninowa, polipy jelitowe,
AD
raki
kolorektalne
i
jelita
cien-
kiego, guzy gonadalne, rak
piersi
------------------------------------------------------------------------------------------------------------------------
Zespół
Makrocefalia, polipy jelitowe,
PTEN
Ruvalcaba-
plamy „cafe-au lait” na prąciu,
AD
-Myhre-Smith
tłuszczaki, raki tarczycy
(Z. Bannayan-Riley-
i piersi
Ruvalcaba)
------------------------------------------------------------------------------------------------------------------------
Zespół dziedziczne-
dyfuzyjne raki żołądka, gastritis,
E-kadheryna
go raka żołądka dysplazja żołądkowa, metaplazja
jelitowa, raki jajnika i piersi

------------------------------------------------------------------------------------------------------------------------
Zespół znamion prognatyzm, hyperteloryzm,
PTC
podstawnokomór-
wrodzone torbiele płucne, polipy
kowych
hamartomatyczne żołądka, raki
i włókniaki jajnika, raki i znamiona
podstawnokomórkowe skóry
------------------------------------------------------------------------------------------------------------------------
Heterozygotyczne
Ataksja
móżdżkowa,
telan-
ATM
nosicielstwo mutacji
giektazje oczne i skórne, nad-
genu dla „ataxia wrażliwość na promieniowa-
telangiectasia”
nie radiacyjne, różne
nowotwory włączając raka
piersi/jajnika
------------------------------------------------------------------------------------------------------------------------
Nosiciele mutacji Zwiększone ryzyko rozwoju
niska penetracja
genu ATH
raka piersi u kobiet
20-40%; AD
------------------------------------------------------------------------------------------------------------------------
Zespół
gynecomatia, cryptorchidism,
47, XXY; niska penetracja
Klinefeltera
guzy z ekstragonadalnych
< 10%
komórek germinalnych germ
cell tumors, rak piersi
u mężczyzn
------------------------------------------------------------------------------------------------------------------------
Mutacja genu
Rodzinne raki piersi u Receptor
receptora
mężczyzn
androgenowy; ?
androgenowego
------------------------------------------------------------------------------------------------------------------------
Konstytucjonalna Zwiększone ryzyko rozwoju
translokacja zrównoważona
21
translokacja
raka piersi
t(11q;22q)
t(11q;22q)
------------------------------------------------------------------------------------------------------------------------
Rodowodowo dziedziczenie:
AD - autosomalne dominujące
AR - autosomalne recesywne

Zalecenia postępowania w rodzinach z wysokim ryzykiem
dziedzicznego raka piersi/jajnika
Specjalne zasady postępowania należy zastosować u:
1. nosicieli mutacji genów predysponujących do dziedzicznego raka
piersi/jajnika jeśli takie mutacje zostały wykryte w rodzinie,
2. wszystkich członków rodzin z rozpoznaniem definitywnym lub
podejrzeniem dziedzicznego raka piersi/jajnika według kryteriów
rodowodowo-klinicznych,
jeśli
konstytucyjne
mutacje
predysponujące do rozwoju raków nie zostały wykryte.
Specjalne postępowanie dotyczy:
A. Profilaktyki
B. Schematu badań kontrolnych
C. Leczenia

SCHEMAT BADAŃ KONTROLNYCH W RODZINACH Z ZESPOŁAMI
DZIEDZICZNEGO
RAKA SUTKA/JAJNIKA.
-------------------------------------------------------------------------------------------------------------
--
Narząd
Badanie
Wiek
rozpoczęcia
(lata)
Częstość
-------------------------------------------------------------------------------------------------------------
--
Pierś
samokontrola 20
co miesiąc
palpacyjne badanie
20-25
co 6 miesięcy
lekarskie
USG
25
co 12 miesięcy
(6 miesięcy po mammografii)
mammografia 35
co 12 miesięcy
-------------------------------------------------------------------------------------------------------------
--
Narząd
USG
dopochwowe
30-35
co
12
miesięcy
rodny
CA 125
30-35
co 12 miesięcy
(6 miesięcy po USG)
-------------------------------------------------------------------------------------------------------------
--

Profilaktyka i zalecenia
Doustna hormonalna antykoncepcja
Przeciwwskazania - nosicielki mutacji BRCA1 do 25 roku życia.
Wykazano, że środki te stosowane w młodszym wieku przez 5 lat
zwiększają ryzyko raka piersi nawet o 35%. Wydaje się
konieczne wykonywanie testu BRCA1 u każdej młodej kobiety,
która decyduje się na doustną antykoncepcję.
Środki antykoncepcyjne zmniejszają u nosicielek mutacji BRCA1
o około 50% ryzyko raka jajnika. Uzasadnione wskazanie do
stosowania w późniejszym wieku.
Hormonalna terapia zastępcza, szczególnie długotrwała
powinna być stosowana ze szczególną ostrożnością.
Długotrwałe karmienie piersią
Wczesne urodzenie dziecka (przed 20 r.ż.)
Chemoprewencja
Tamoxifen
Selen
Adnexektomia
Mastektomia profilaktyczna
Document Outline
- Slide 1
- Rak piersi
- Większość przypadków raka piersi i/lub jajnika ma nieznaną etiologię, tylko 10% nowotworów tego typu jest dziedziczna
- Geny związane z dziedzicznym rakiem piersi i/lub jajnika
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Wskazania do wykonania badań genetycznych.
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Możliwości diagnostyczne (badania molekularne). * Interpretacja wyników badań molekularnych (pewne potwierdzenie). Czy można ostatecznie wykluczyć dziedziczną predyspozycję do wystąpienia nowotworów? * Aspekty etyczne i prawne badań DNA (badania u pełnoletnich, świadoma zgoda na badanie)
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
Wyszukiwarka
Podobne podstrony:
Nowotwory dziedziczne
GENETYKA KLINICZNA V rok seminarium Nowotwory dziedziczne wprowadzenie Nowotwory jelita grubeg
Nowotwory dziedziczne 2
Nowotwory dziedziczne 3
Nowotwory dziedziczne Poradnictwo genetyczne
Nowotwory dziedziczne oryginał
Nowotwory dziedziczne, AM, rozne, genetyka, genetyka, GENETYKA, Genetyka ze strony
Nowotwory dziedziczne2
Nowotwory dziedziczne, Genetyka
Ankieta -F-4 NA NOWOTWÓR DZIEDZICZENIE, Dokumenty wnioski wzory pism
Nowotwory dziedziczne 2
białaczka i inne choroby nowotworowe krwi, Materiały naukowe z różnych dziedzin, Patologia chorób
Nowotwory
Nowotworynew
Wybrane markery chorb nowotworowych
Leczenie bólu i opieka paliatywna w chorobach nowotworowych
więcej podobnych podstron