
„Rak zaczyna powstawać wówczas, gdy komórka
wyłamuje się spod kontroli mechanizmów
decydujących o jej podziałach i lokalizacji”
R.A. Weinberg
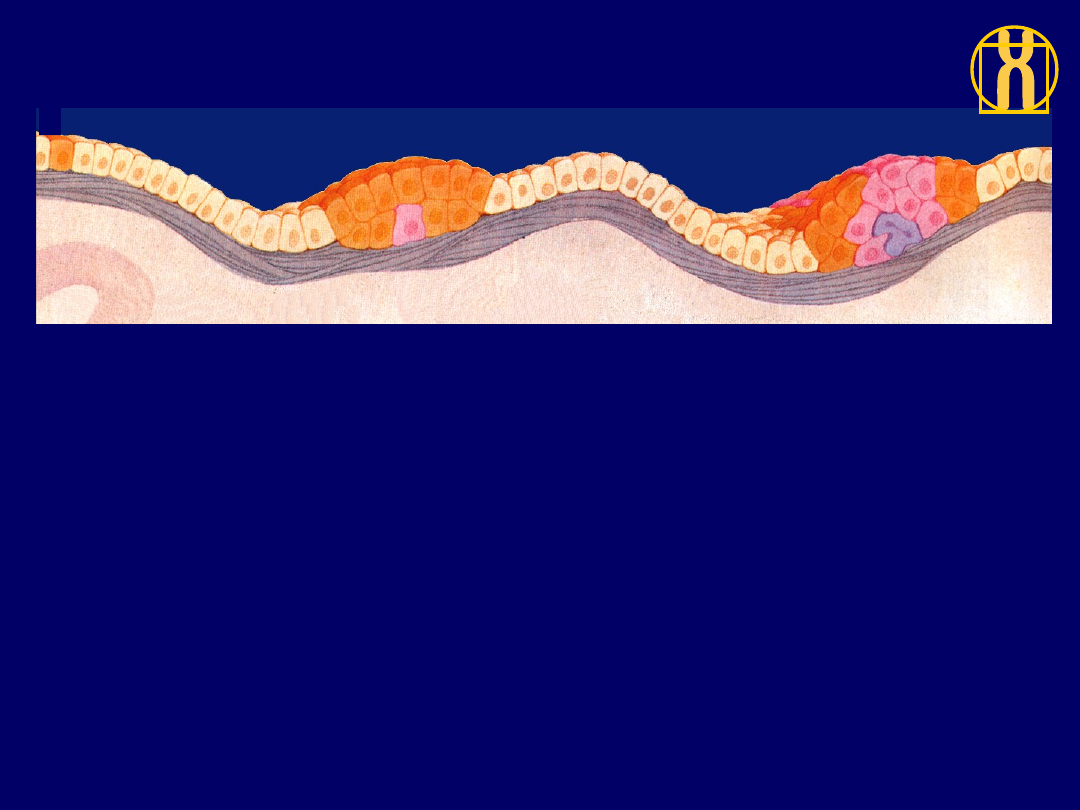
1
. Rozwój nowotworu zaczyna się od genetycznej mutacji niektórych komórek (kolor
pomarańczowy) w obrębie populacji normalnej (kolor beżowy); mutacja
zwieksza skłonność komórek do namnażania się,podczas gby normalnie pozostałyby
one w stanie spoczynku.
2
. Zmieniona komórka i jej komórki potomne nadal wygladają prawidłowo, ale dzielą
się nadmiernie - wykazują hiperplazję (nadmierny rozrost). Po latach jedna na milion
tych komórek (kolor różowy) ulega innej mutacji, która rozluźnia kontrolę wzrostu
komórkowego.
3
. Oprócz nadmiernej poliferacji „potomstwo” tej komórki odbiega pod względem
kształtu i orientacji od normalnych komórek, czyli wykazuje dysplazję. Po pewnym
czasie zachodzi ponownie rzadka mutacja, która zmienia zachowanie komórek
(kolor fioletowy).
Etapy rozwoju
nowotworu
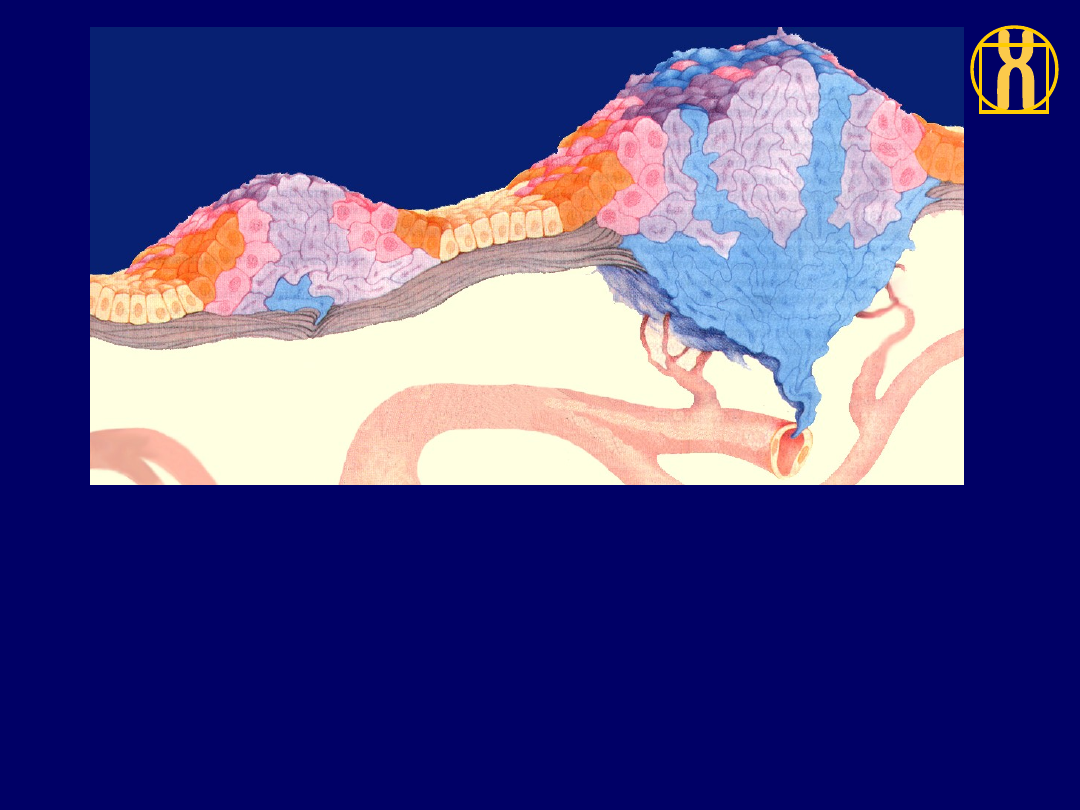
Rak przedinwazyjny
Rak inwazyjny
4
.
Komórki dotknięte mutacjami są coraz bardziej nieprawidłowe pod względem wzrostu
i wyglądu. Jeśli nowotwór nie naruszył jeszcze granic między tkankami, mówimy,
że jest to rak in situ (rak przedinwazyjny). Nowotwór może pozostać w takim stanie
bardzo długo, ale w niektórych komórkach zachodzą czasami dodatkowe mutacje
(kolor niebieski).
5
.
Gdy zmiany genetyczne umożliwią nowotworowi inwazję na tkankę znajdującą się poniżej
i rozsiewanie komórek do krwi lub limfy, nowotwór jest w pełni złośliwy.Zdradzieckie
komórki mogą doprowadzić do powstania w organiźmie nowych guzów (przerzutów);
a przerzuty te prowadzić do śmierci wskutek zniszczenia narządów ważnych dla życia.
Naczynie włosowate

„Cancer is a disease of our
genes”
Jan H. J.
Hoeijmakers
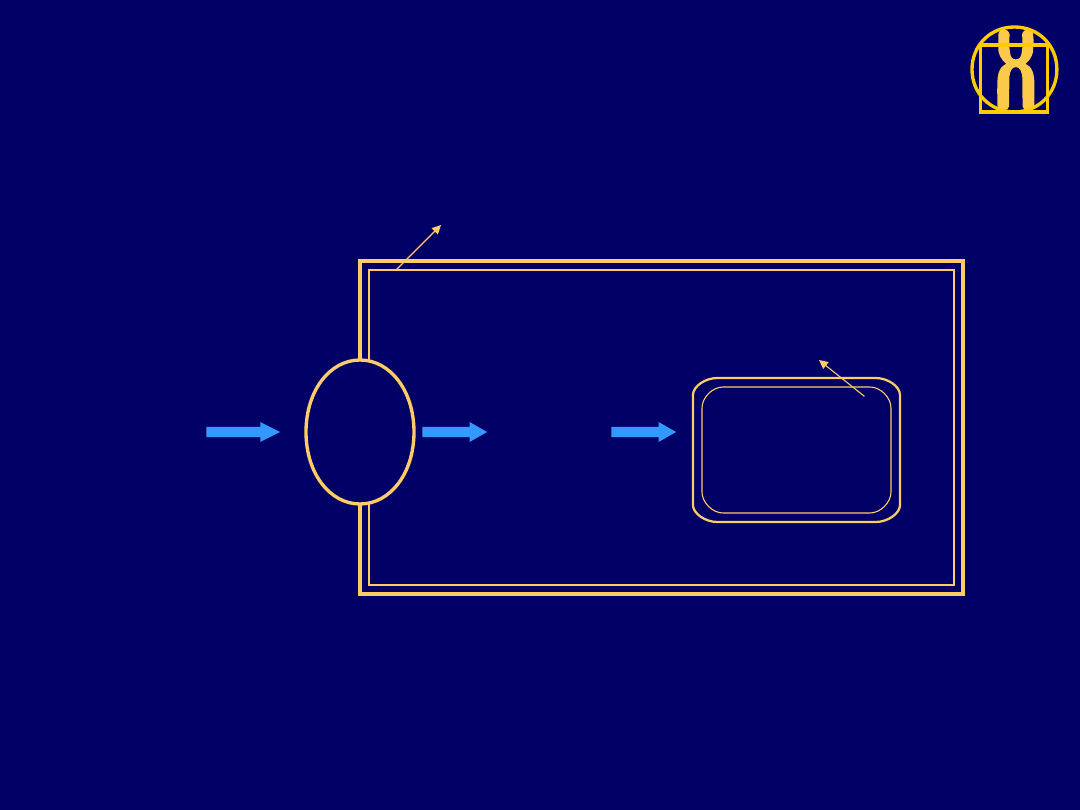
Etapy przekazywania sygnału
w prawidłowych komórkach
Jądro
komórkowe
Cytoplazma
Pozakomórkow
e czynniki
wzrostu
Receptor
y w bł.
kom.
.
Wewnątrz-
komórkowa
transmisja
sygnału
Czynniki
transkrypcyjn
e, synteza
białek
Błona
komórkowa

Grupy genów odgrywające rolę w transformacji
komórki prawidłowej w nowotworową:
1.Geny proto-onc
- mutacja protoonkogenu
pobudza podstawowy szlak stymulujący
proliferację komórki podczas gdy powinien być
nieczynny
2.Geny
supresorowe
-
mutacja
genu
supresorowego
powoduje
inaktywację
szlaku
hamujacego proliferację komórki
3.Geny mutatorowe
- mutacje tych genów
podwyższają
znamiennie
ryzyko
wystąpienia
transformacji nowotworowej, gdyż kodują one białka
biorące udział w różnych mechanizmach usuwania
błędów i uszkodzeń DNA

Wybrane onkogeny zaangażowane w rozwój
nowotworów człowieka
Symbol
genu
Kodowane białka
Nowotwór
C-SIS
Czynnik pochodzenia
płytkowego (PDGF)
Glejaki, mięsaki
C-ERB B1 Naskórkowy czynnik
wzrostu (EGF)
Rak sutka, płuca, glejaki
C-ERB B2 Receptor EGF
Rak sutka
C-SRC
Kinazy tyrozynowe
Mięsaki
C-ABL
Kinazy tyrozynowe
Przewlekła białaczka
szpikowa
C-HA-
RAS
Białka wiążące GTP
Rak pęcherza
C-KI-RAS
Białka wiążące GTP
Rak płuca, trzustki, jelita
grubego
C-MYC
Czynniki
transkrypcyjne
Chłoniak Burkita, rak
sutka, żołądka, płuc
BCL-2
MDM2
Geny regulujące
apoptozę
Białko antagonista P53
Chłoniaki
Mięsaki

Najczęstsze rodzaje mutacji genów ONC
wykrywane w nowotworach
Rodzaj
mutacji
Zmiany w strukturze
genu (DNA)
Zmiany w
produkcie
białkowym genu
Mutacja
punktowa
Zmiana pary nukleotydów
przez inną parę
nukleotydów
Zastąpienie
aminokwasu w
łańcuchu
peptydowym przez
inny
Delecja
Utrata 1 lub 2 nukleotydów
Delecje rozległe
Delecja obu alleli
Zmiana w sekwencji
białka
Wypadnięcie wielu aa
z łańcucha
peptydowego
Brak produktu
białkowego
Translokacja
Przemieszczenie genu w
obszar nowej kontroli
transkrypcji
Powstawanie
nadmiernej ilości
białka
Amplifikacja
Powiększenie liczby kopii
genu
Powstawanie
nadmiernej ilości
białka
Insercja
promotora
Włączenie w sąsiedztwie
genu silnego promotora
Powstawanie
nadmiernej ilości
białka

Wybrane geny supresorowe człowieka
Symbol
genu
Locus
Funkcje białka
APC
5q21
Białko adhezyjne
BRCA1
17q21
Aktywacja transkrypcji
BRCA2
13q12-q22
Czynnik transkrypcji
NF1
17q12-q22
Białko aktywujące
GTPazy
NF2
22q12.2
Białko cytoszkieletu
TP53
17p13
Regulacja przebiegu
cyklu komórkowego
RB1
13q14
Kontrola cyklu
kmórkowego
WT1
11p13
Czynnik
transkrypcyjny (?)
VHL
3p26
Inhibitor elongacji
transkrypcji (?)
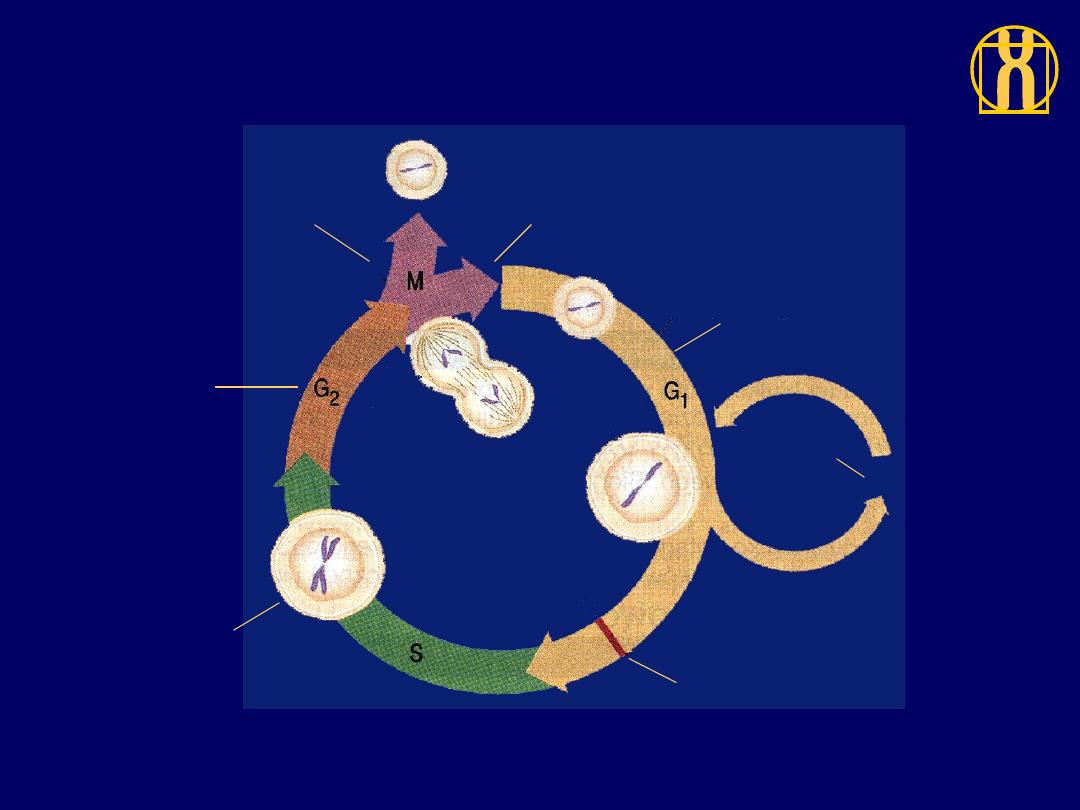
Fazy cyklu komórkowego
Komórka
dzieli się
(mitoza)
Komórka
przygotowuje się
do mitozy
Komórka
replikuje
swój DNA
Punkt restrykcyjny;
komórka decyduje,
czy nadal odpoczywać,
czy wejść w cykl
Faza
spoczynku G
0
Komórka powiększa się
i produkuje nowe białka
Począte
k
cyklu
R
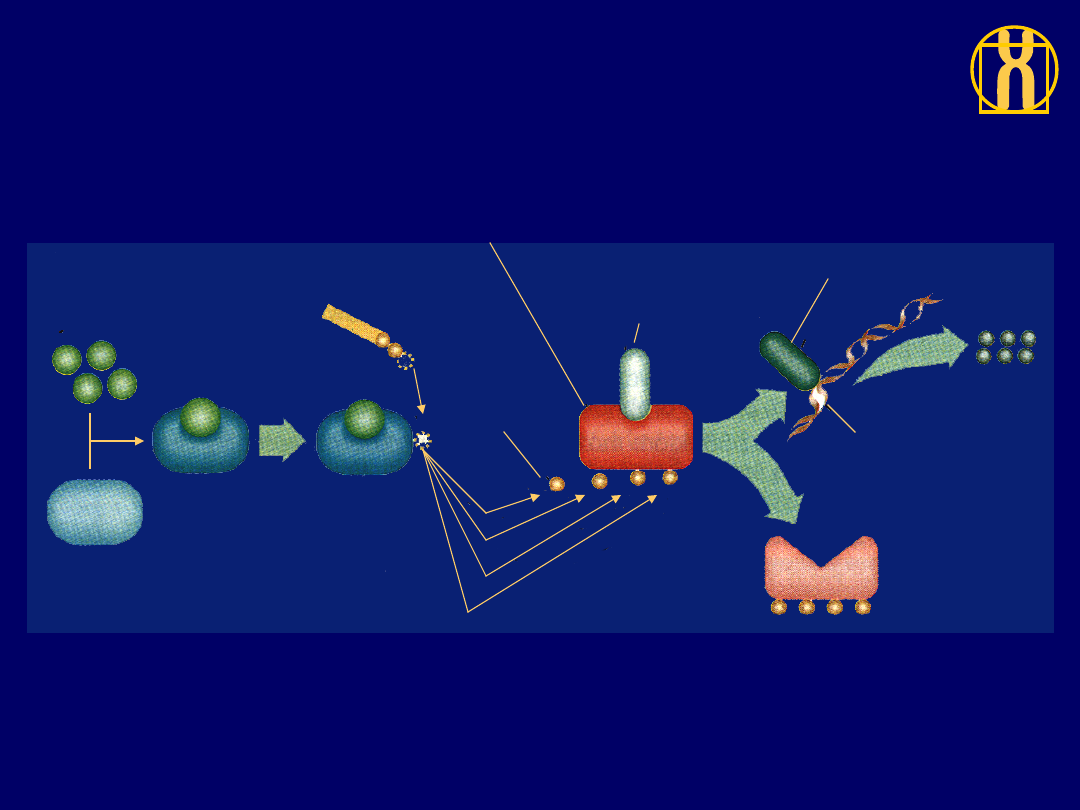
Funkcja białka RB w kontroli cyklu komórkowego
Cyklina D lub E
Cyklinozależna
kinaza
Kompleks
aktywny
ATP
Reszta
fosforanowa
Aktywne pRB
(hamulec główny)
Nieaktywny
czynnik
transkrypcyjny
Aktywny
czynnik
transkrypcyjny
Białka
potrzebne
do przejścia
przez cykl
komórkowy
Gen
Nieaktywne pRB

1979
– odkrycie
1988
– forma WT
zdefiniowana jako supresor
nowotworów
1989
– pierwsza mutacja
znaleziona w nowotworze
jelta grubego
1991
– mutacje
konstytucyjne (Zespół Li-
Fraumeni)
1991
– aktywność p53
indukowana uszkodzeniami
DNA
1992
– u myszy TP53-/-
następuje spontanicznie
rozwój nowotworu
1993
– p53 indukuje
zatrzymanie cyklu
komórkowego
1999
– opisanych
10 000
mutacji
2001
– ponad 16 000 mutacji
Naprawa DNA
Angiogeneza
Kontrola cyklu
komórkowego
Apoptoza
TP53
(Tumor Protein)

Mutacje TP53 w raku pęcherza
moczowego
Najczęstszy rodzaj
mutacji w raku pęcherza
moczowego:
zamiana C
> G
Prescot i wsp. (2001)
wykazali, że
znalezienie mutacji genu TP53 u
chorych z nowotworem pęcherza
moczowego jest
niepomyślnym
czynnikiem prognostycznym
(mutacje w
75% nowotworów „high-grade”), gdyż
wzrasta prawdopodobieństwo
powstania przerzutów i wznowy.
Mutacje somatyczne TP53
14%
15%
7%
25%
19%
5%
11%
4%
AT:CG
AT:GC
AT:TA
GC:AT
GC:AT CpG
GC:CG
GC:TA
ins/del/inne
Na podst. bazy mutacji
P53 IARC(International
Agency for Research on
Cancer)

Mechanizmy zabezpieczające prawidłową komórkę
przed niekontrolowaną proliferacją:
1. Apoptoza
– programowana śmierć komórki
2.Telomery
– sekwencje powtarzające znajdujące
się na końcach chromosomów; ograniczona liczba
podziałów komórkowych uwarunkowana jest ilością
segmentów DNA na końcach chromosomów
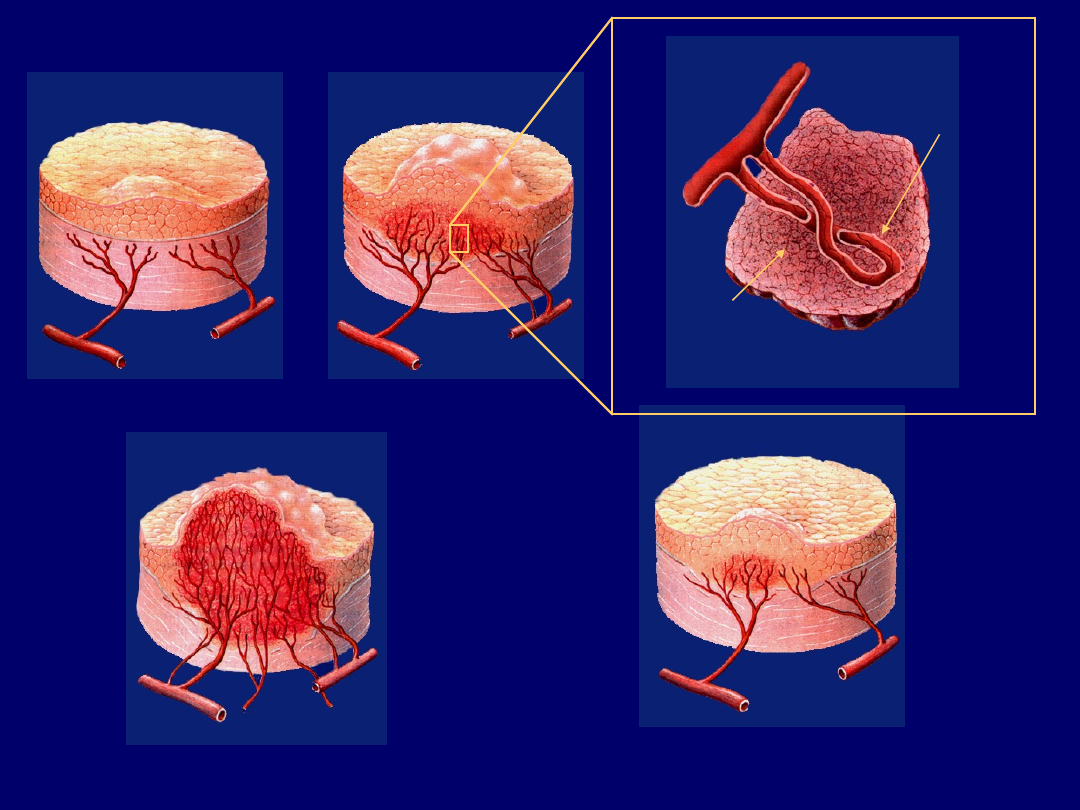
GUZ IN SITU
Włośniczki proliferują,
guz zaczyna rosnąć
Komórki guza
wydzielają angiogenne
białka i obniżają poziomy
inhibitorów angiogenezy
Komórki śródbłonkowe
we włośniczkach
wydzielają białkowe
czynniki wzrostu
Guz ciągle rośnie, w końcu
się rozsiewa do innych narządów
Po zastosowaniu leków przeciw angiogenezie
guz zmniejsza rozmiary
Angiogeneza

Charakterystyka wybranych
nowotworów dziedzicznych
człowieka
Zespół
Nowotwory
Zmutowa
ny gen
Dzedziczny rak sutka i jajnika
Rak sutka, jajnika
BRCA1
Dziedziczny rak sutka
Rak sutka
BRCA2
Rak jelita grubego na podłożu
niepolipowatości (Zespół
Lyncha)
Jelita grubego, macicy
MSH2, MLH1,
PMS1, PMS2
Rodzinna polipowatość jelita
gubego (Zespół Turkota, Zespół
Gardnera)
Gruczolaki jelita
grubego, włókniaki,
kostniaki
APC
Zespół Li-Fraumeni
Sutka, mózgu, płuca,
krtani, pęcherza
moczowego i inne
P53
Nerwiakowłókniakowatość I
(Ch. Von Recklinghausena)
Nerwiakowłókniaki,
glejaki, mięsaki
NF1
Nerwiakowłókniakowatość II
Oponiaki, schwannoma
NF2
Retinoblastoma
Siatkówczak, mięsaki,
sutka
RB
Guz Wilmsa
Nerki
WT1
Zespół Von Hippel-Lindau
Nerki,
hemangioblastomastom
a
VHL

Techniki bezpośredniego wykrywania
nosicielstwa mutacji
Etapy analizy DNA
1
.
Izolacja DNA
2
.
Amplifikacj fragmentów genów
3
.
Wstępne wykrywanie zaburzeń w
produkcie technikami przesiewowymi:
a) Badanie zmian konformacji jednoniciowego
DNA (SSCP)
b) Analiza heterodupleksów (HET)
c) Chemiczne rozszczepianie niesparowanych
heterodupleksów (CMC)
d) Elektroforeza na żelach z gradientem
czynnika denaturującego (DGGE)
4
.
Sekwencjonowanie
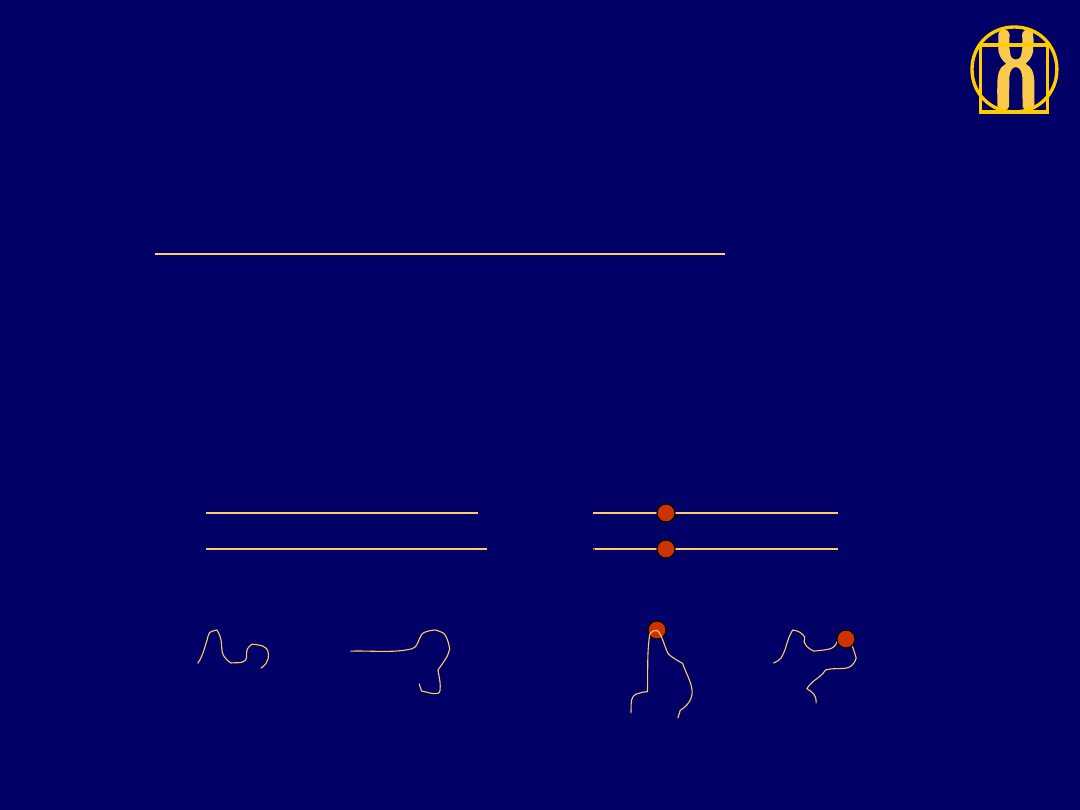
SSCP ( Single Stranded Conformational
Polymorphisms)
Technika opiera się na założeniu:
nawet
pojedyńcza
zmiana
nukleotydu
we
fragmencie DNA wywiera wpływ na konformację
przestrzenną cząsteczki DNA co jest przyczyną
zmiany tempa migracji tej cząsteczki w żelu
poliakrylamidowym
DNA typu dzikiego (wt) DNA z
mutacja (m)
Denaturacja
konformacje pojedyńczych nici

Schematyczny obraz żelu po elektroforezie
w metodzie SSCP
WT
M
WT +M
Nici zmutowane wykazują odmienną niż
prawidłowe ruchliwość elektroforetyczną

Analiza eksonu 8 genu P53
metodą SSCP
a)
b)
a) elektroforeza w 22
0
C b) elektroforeza
w 30
0
C
1- fragment dziki 2 - 5 - próbki badane
1 2 3
4 5

P R O C E D U R A:
1. Izolacja DNA z materiału
biologicznego
2. Powielenie fragmentu DNA metodą
PCR
3. Denaturacja produktu PCR do formy
ssDNA
4. Rozdział elektroforetyczny
zdenaturowanych fragmentów DNA
w natywnym żelu poliakrylamidowym
5. Wizualizacja rozdzielonych
fragmentów DNA (metoda srebrowa)
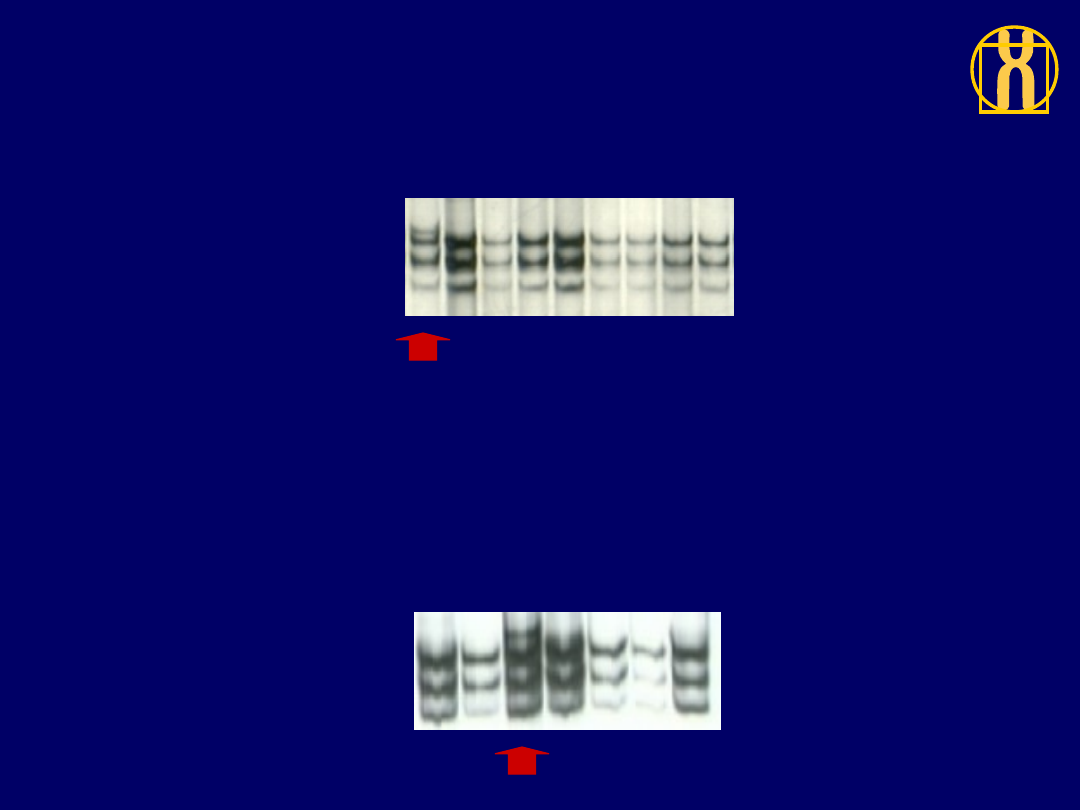
Ekson 6 P53
Kodon 213 CGA-
CGG A>G Arg-Arg
P86
pT2G3
P20
pT2G2
Ekson 8 P53
Kodon 302 AGG-
AAG G>A Arg-Lys
Warunki:
9%żel
poliakrylamidowy
29:1 temp. 15
o
C
Warunki:
9%żel
poliakrylamidowy
29:1 temp. 23
o
C

Prawidłowe płuco
Matczyny
Ojcowski
Mikrosatelita
Matczyny
Ojcowski
Rak płuca
MatczynyMatczyny
zmutowany
Ojcowski Ojcowski
zmutowany
Ojcowski
zmutowany
Ojcowski
Matczyny
zmutowany
Matczyny

Choroby nowotworowe w Polsce
w latach 1963-1996
Liczba zgonów na nowotwory złośliwe w Polsce w 1963 r. –
34
500 osób
Liczba zgonów na nowotwory złośliwe w Polsce w 1996 r. –
78
657 osób
Przyczyny wzrostu liczby zgonów na nowotwory
złośliwe:
1. Wzrost liczby ludności polski z 30,7 mln osób do 38,6 mln
osób
2. Starzenie się ludności w Polsce
1963 r. - 6,5% osób pow.65 r.ż.
1996 r. -11,3% osób pow. 65 r.ż.
3. Wzrost w środowisku ilości czynników rakotwórczych
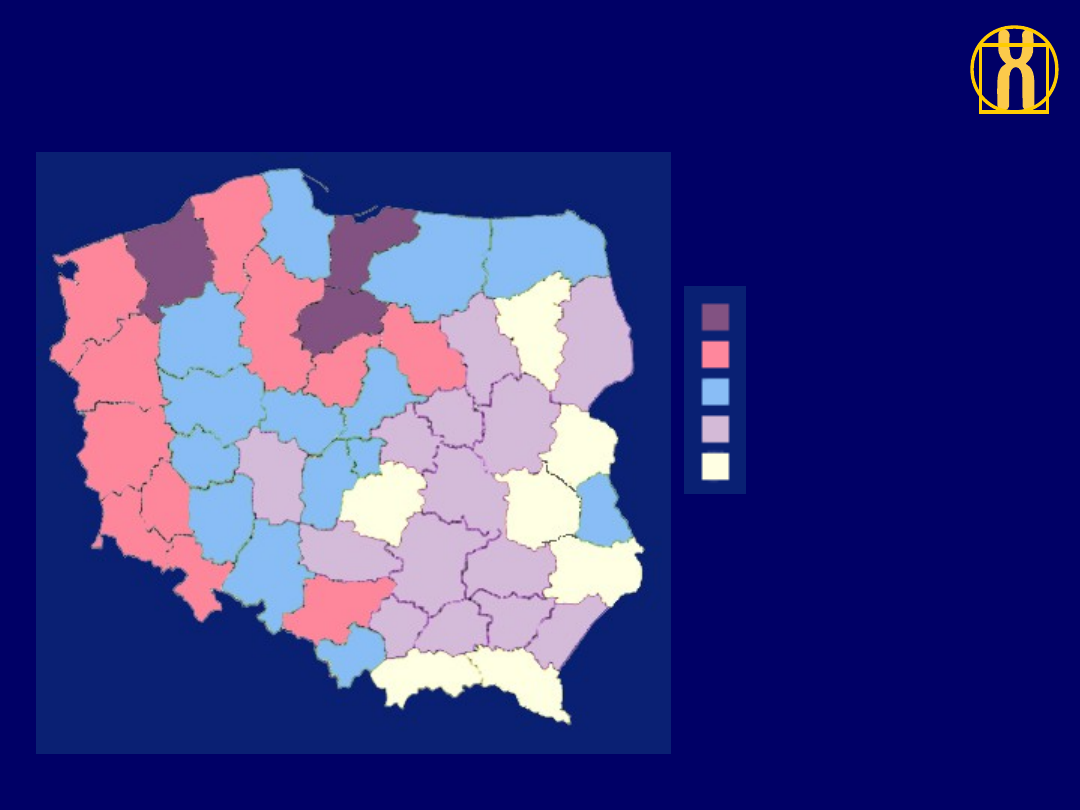
Rozkład geograficzny umieralności
na nawotwory złośliwe ogółem, mężczyźni, Polska 1996
244.2 do 254 (3)
220.5 do 244.2 (11)
204.1 do 220.5 (14)
179.7 do 204.1 (14)
159.9 do 179.7 (7)
ZACHOROWANIA / 100,000
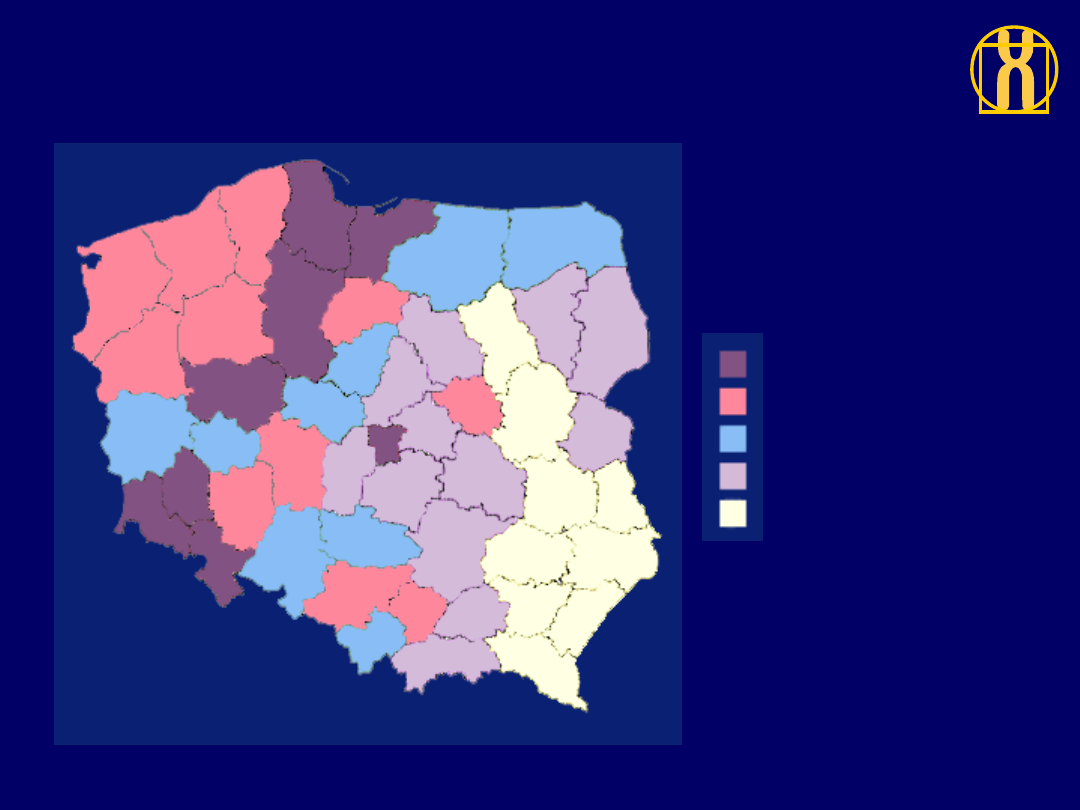
Rozkład geograficzny umieralności
na nawotwory złośliwe ogółem, kobiety, Polska 1996
ZACHOROWANIA / 100,000
118.8 do 125.8 (8)
112.3 do 118.8 (11)
102.2 do 112.3 (9)
91.5 do 102.2 (12)
73.5 do 91.5 (9)
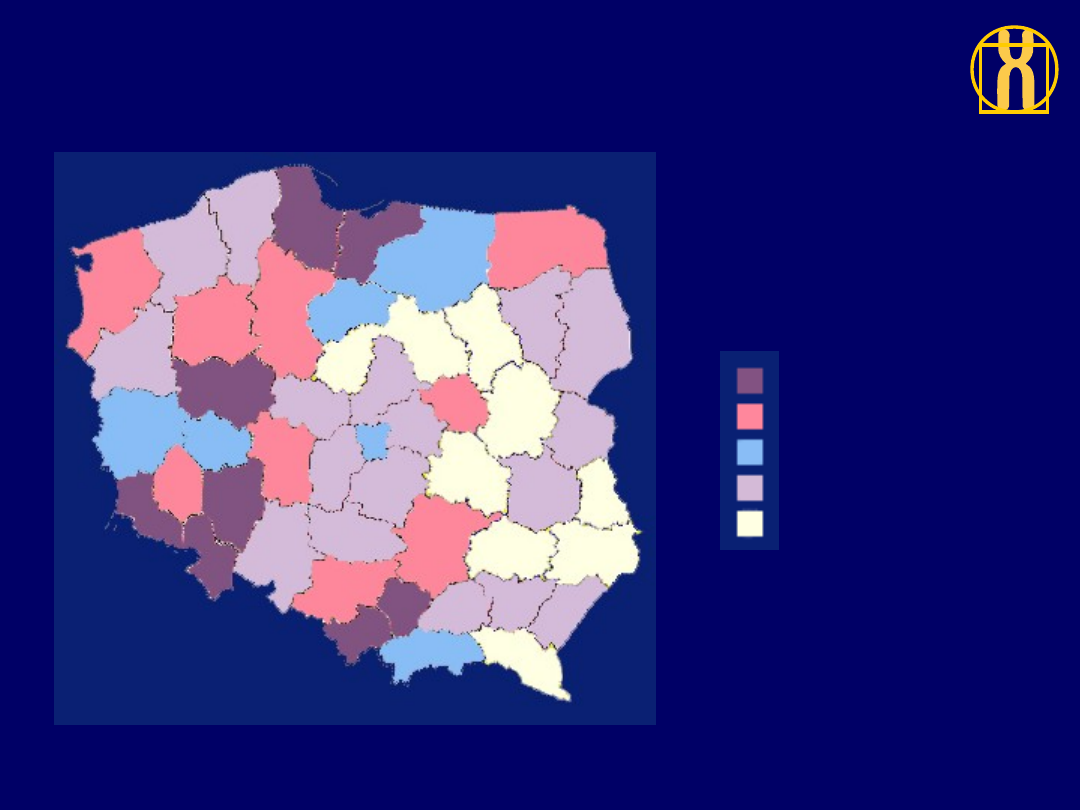
Rozkład geograficzny zarejestrowanej zachorowalności
na nawotwory złośliwe ogółem, kobiety, Polska 1996
203 do 226 (8)
184 do 203 (9)
170 do 184 (6)
144 do 170 (17)
97 do 144 (9)
ZACHOROWANIA / 100,000
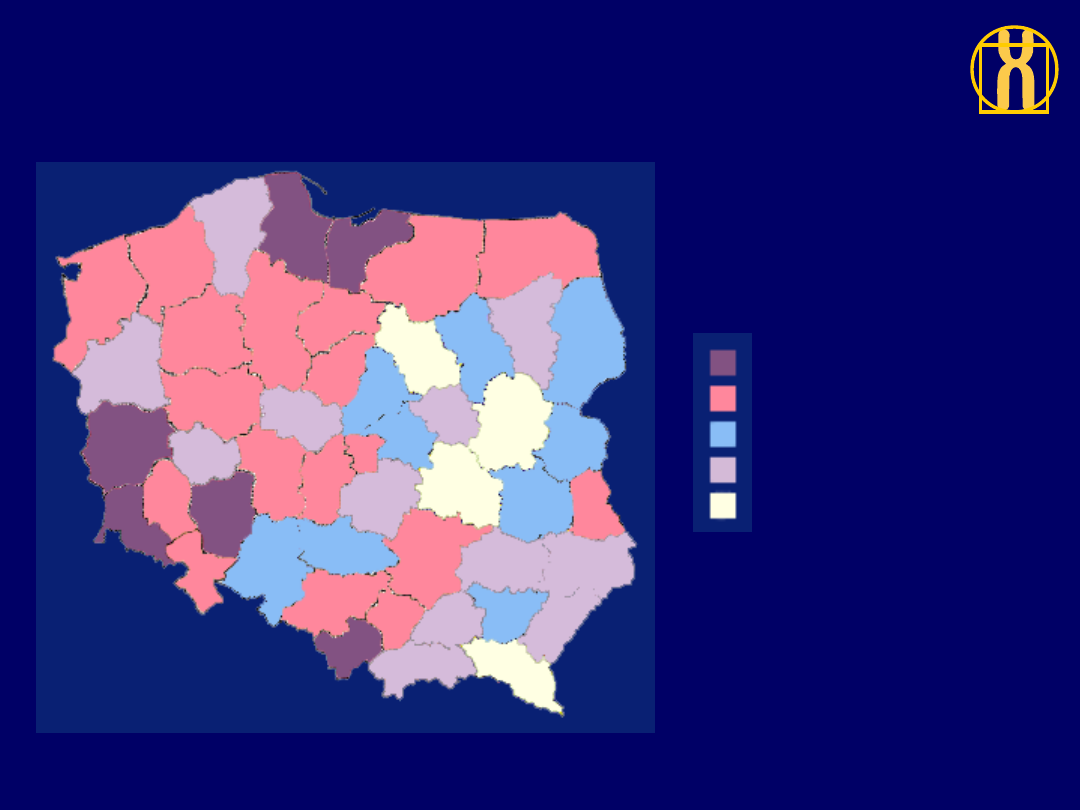
Rozkład geograficzny zarejestrowanej zachorowalności
na nawotwory złośliwe ogółem, mężczyźni, Polska 1996
305 do 330 (6)
266 do 305 (18)
236 do 266 (9)
212 do 236 (12)
127 do 212 (4)
ZACHOROWANIA / 100,000
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
Nowotworynew
Wybrane markery chorb nowotworowych
Leczenie bólu i opieka paliatywna w chorobach nowotworowych
Profilaktyka nowotworowa
nowotwory noworodek
Nowotwory złośliwe odbytnicy + TME prezentacja
Immunologia nowotworów
Markery nowotworowe 2
Leczenie uzupełniające nowotworów narządu rodnego chemioterapia, radioterapia
zmiany nowotworowe
Nowotwory łagodne i złośliwe gardła środkowego
więcej podobnych podstron