
WYKŁAD 7-8
(Mono-
i oligosacharydy)

MONOSACHARYDY
(Cukry proste, monocukry)
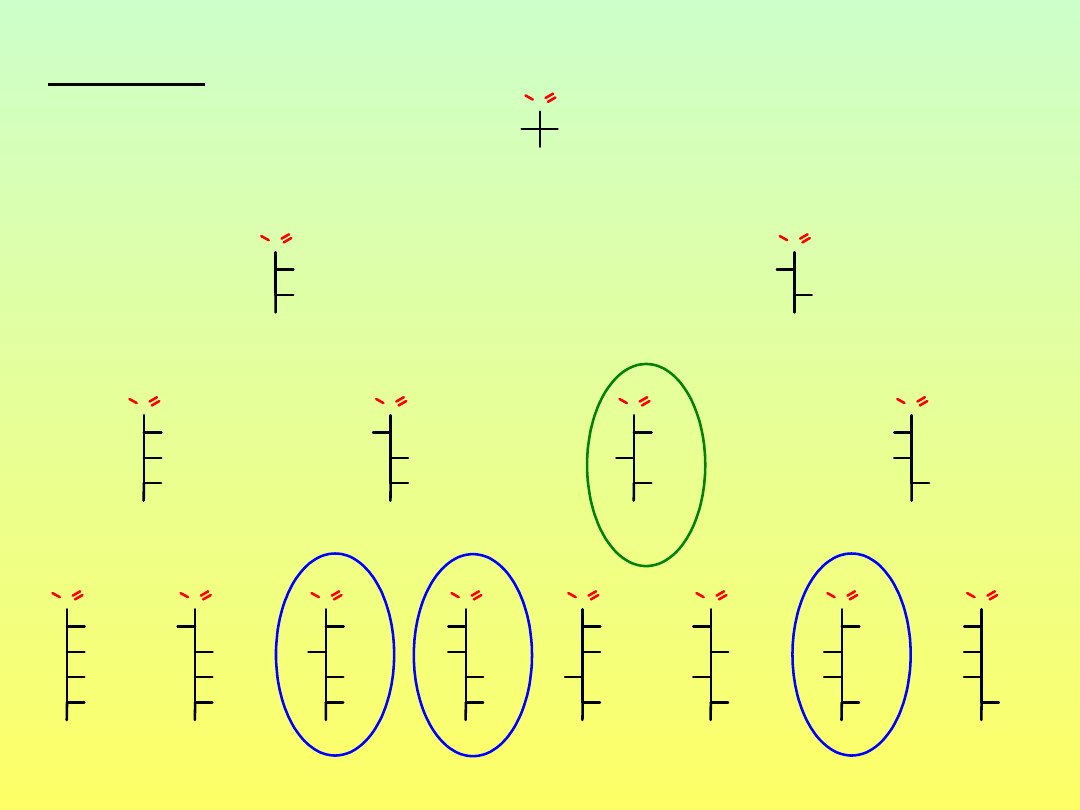
C
O
H
CH
2
OH
H
OH
C
O
H
OH
OH
CH
2
OH
C
O
H
OH
CH
2
OH
O
H
C
O
H
OH
OH
OH
CH
2
OH
C
O
H
OH
OH
OH
CH
2
OH
OH
C
O
H
OH
OH
CH
2
OH
OH
O
H
2
C
1
O
H
3
OH
4
OH
5
CH
2
OH
6
OH
O
H
C
O
H
OH
CH
2
OH
OH
O
H
O
H
C
O
H
OH
OH
CH
2
OH
OH
O
H
C
O
H
OH
CH
2
OH
OH
O
H
O
H
C
O
H
OH
CH
2
OH
OH
O
H
O
H
C
O
H
CH
2
OH
OH
O
H
O
H
O
H
C
O
H
OH
OH
CH
2
OH
O
H
C
O
H
OH
OH
CH
2
OH
O
H
C
O
H
OH
CH
2
OH
O
H
O
H
aldehyd D-glicerynowy
D-erytroza
D-ryboza
D-alloza
D-treoza
D-liksoza
D-ksyloza
D-arabinoza
D-altroza
D-mannoza
D-glukoza
D-guloza
D-idoza
D-galaktoza
D-taloza
Aldozy
CH
2
OH
CH
2
OH
O
CH
2
OH
O
OH
CH
2
OH
CH
2
OH
O
OH
OH
CH
2
OH
CH
2
OH
O
OH
OH
CH
2
OH
OH
2
CH
2
OH
1
3
O
4
OH
5
CH
2
OH
6
OH
O
H
CH
2
OH
O
OH
CH
2
OH
OH
O
H
CH
2
OH
O
CH
2
OH
OH
O
H
O
H
O
OH
CH
2
OH
O
H
CH
2
OH
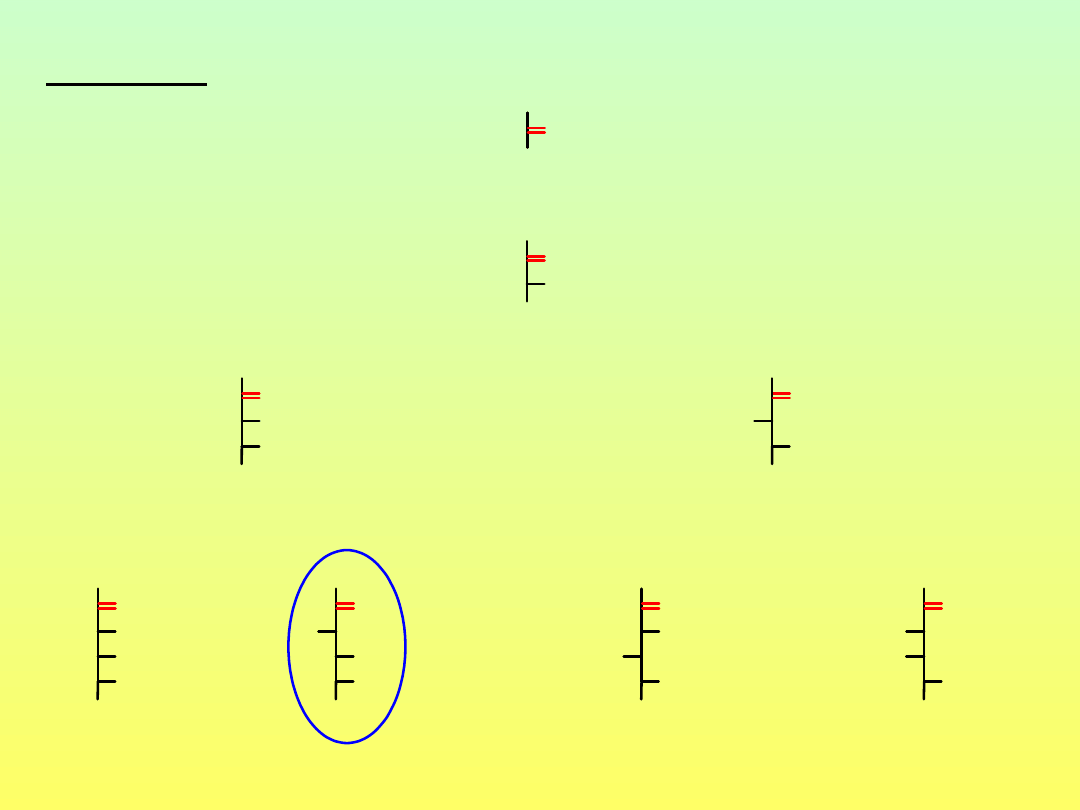
dihydroksyaceton
D-erytruloza
D-rybuloza
D-psikoza
D-ksyluloza
D-fruktoza
D-sorboza
D-tagatoza
Ketozy
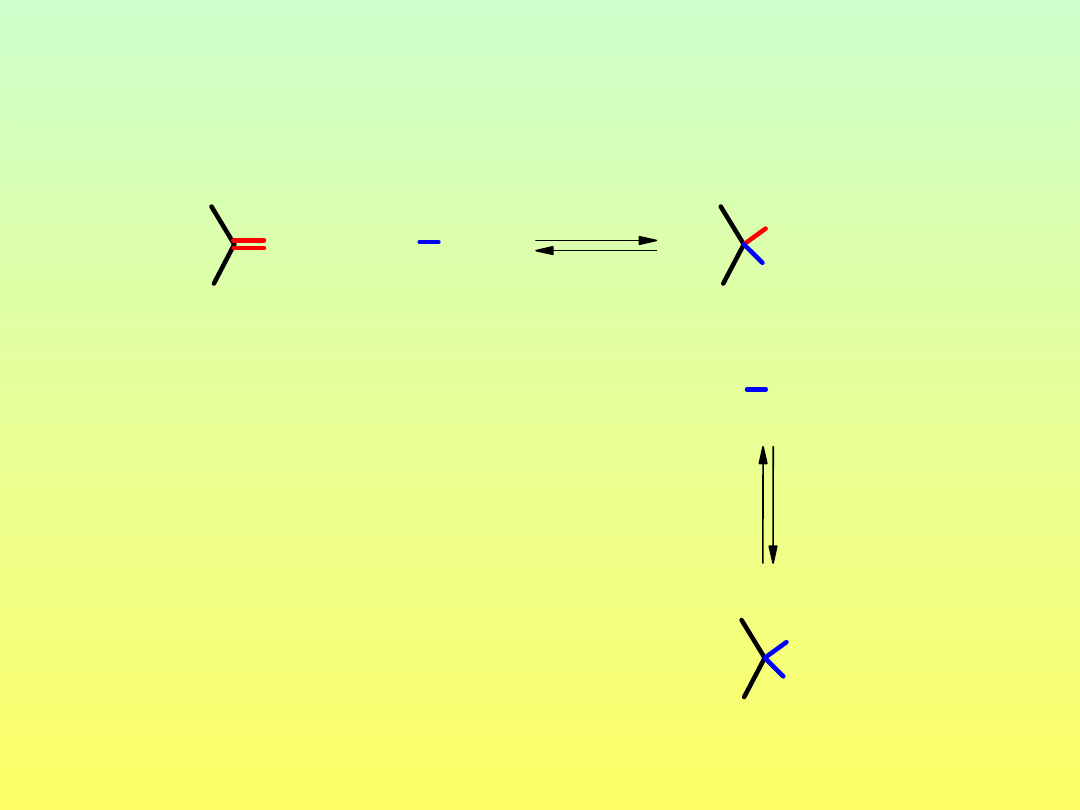
O
R OH
O
OR
R OH
H
OR
OR
+
H
+
+
H
+
+
H
2
O
aldehyd
lub keton
hemiacetal
acetal
Reakcja grupy karbonylowej z alkoholami
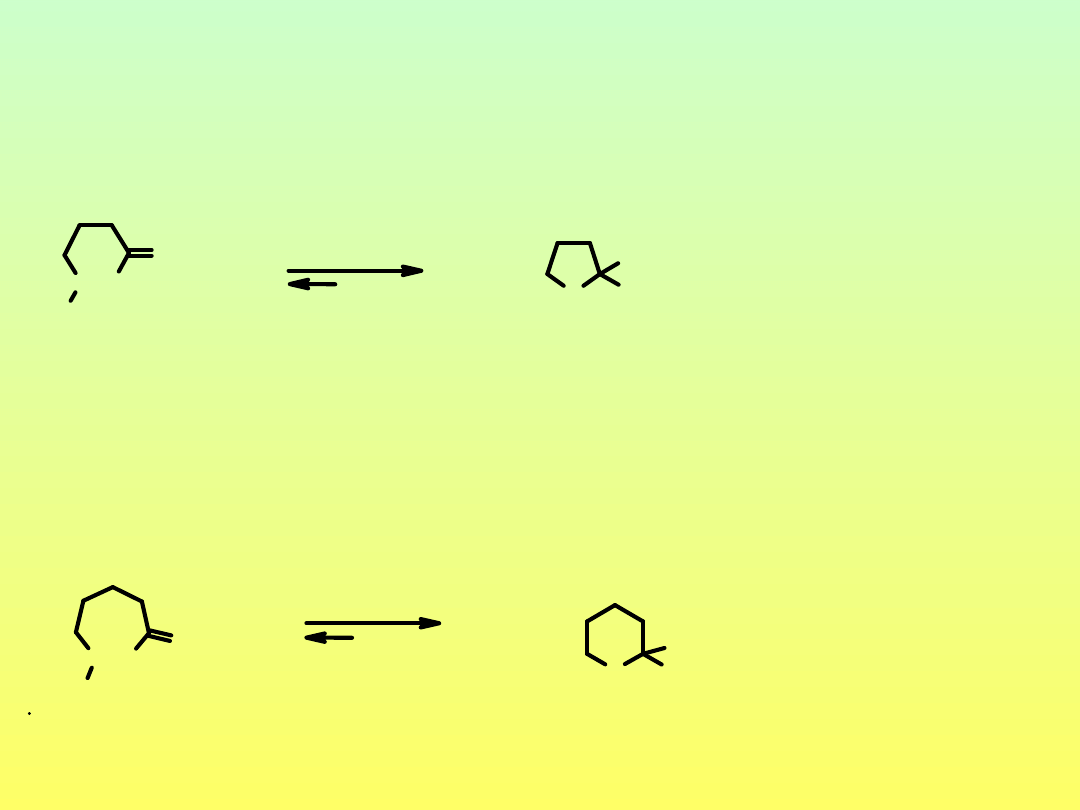
O H
O
H
O
OH
H
O H
O
H
O
OH
H
G
0
= -1.2 Kcal/mol
4-hydroksybutanal
2-hydroksytetrahydrofuran
11%
89%
5-hydroksypentanal
6%
94%
2-hydroksytetrahydropiran
G
0
= -1.6 Kcal/mol
Cyklizacja hydroksyaldehydów
O
O
H
OH
OH
O
H
O
H
O
OH
OH
OH
O
H
O
H
O
H
O
H
OH
OH
O
H
O
H
O
OH
H
O
H
OH
OH
OH
O
OH
O
H
OH
OH
OH
fruktoza
fruktofuranoza
glukoza
0.003%
99.997%
glukopiranoza
G
0
= -6.3Kcal/mol
+
fruktopiranoza
Cyklizacja aldoz i ketoz
C
O
H
OH
OH
CH
2
OH
OH
O
H
C
O
H
OH
OH
OH
O
H
HOCH
2
C
OH
OH
O
O
H
HOCH
2
OH
H
C
OH
OH
O
O
H
HOCH
2
H
O
H
C
OH
O
OH
O
H
HOCH
2
OH
H
C
OH
O
OH
O
H
HOCH
2
H
O
H
D-glukoza
-D-glukopiranoza
-D-glukofuranoza
-D-glukopiranoza
-D-glukofuranoza
Cykliczne hemiacetale D-glukozy
O
OH
OH
OH
O
H
H
CH
2
OH
O
OH
OH
O
H
H
CH
2
OH
OH
O
OH
OH
CH
2
OH
OH
OH
O
OH
OH
CH
2
OH
OH
OH
O
H
OH
O
H
OH
OH
CH
2
OH
-D-glukopiranoza
-D-glukofuranoza
-D-glukopiranoza
-D-glukofuranoza
Cykliczne hemiacetale D-glukozy
OH
CH
2
OH
OH
O
H
O
HOCH
2
OH
OH
CH
2
O
O
H
OH
HOCH
2
OH
OH
O
O
H
HOCH
2
HOCH
2
CH
2
OH
OH
O
O
H
HOCH
2
O
H
CH
2
OH
OH
CH
2
O
O
H
OH
O
H
OH
OH
O
H
O
HOCH
2
HOCH
2
D-fruktoza
-D-fruktopiranoza
-D-fruktofuranoza
-D-fruktopiranoza
-D-fruktofuranoza
=
Cykliczne hemiacetale D-fruktozy
O
OH
OH
O
OH
CH
2
OH
OH
OH
O
OH
OH
OH
CH
2
OH
CH
2
OH
HO
HOCH
2
O
CH
2
OH
OH
OH
HO
HOCH
2
OH
OH
CH
2
OH
OH
OH
O
H
O
HOCH
2
D-fruktopiranoza
-D-fruktofuranoza
-D-fruktopiranoza
-D-fruktofuranoza
Cykliczne hemiacetale D-fruktozy
Temperatur
a
-piranoza
-piranoza -
furanoza
-
furanoza
D-glukoza
20C
36
64
-
-
D-
mannoza
20C
67
33
-
-
D-
galaktoza
20C
32
64
1
3
D-ryboza
40C
20
56
6
18
D-ksyloza
20C
35
65
-
-
D-fruktoza
20C
-
76
4
20
Skład równowagowy cyklicznych form monocukrów
w roztworze wodnym
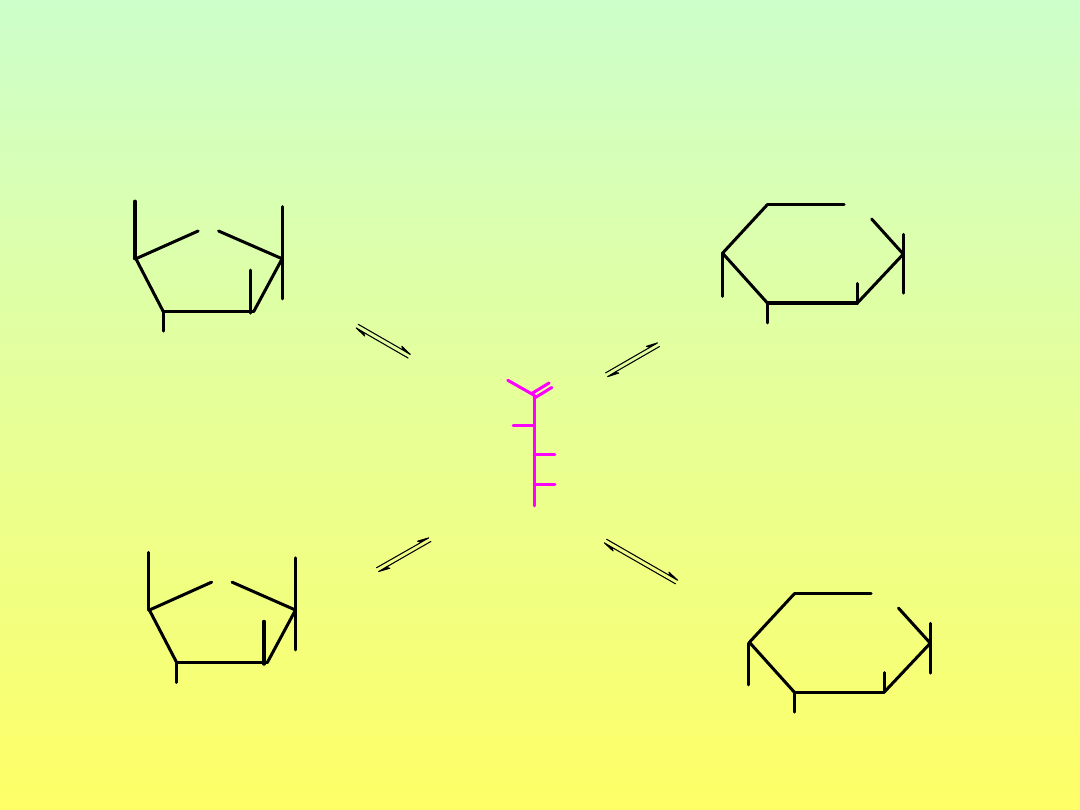
Konformacja pierścienia piranozowego
OH
O
H
O
O
H
OH
HOCH
2
OH
OH
CH
2
OH
OH
OH
O
O
O
piranozy
a
a
a
a
a
e
e
e
e
e
konformacja C1
konformacja 1C
grupy ekwatorialne
grupy aksjalne
inwersja pierscienia
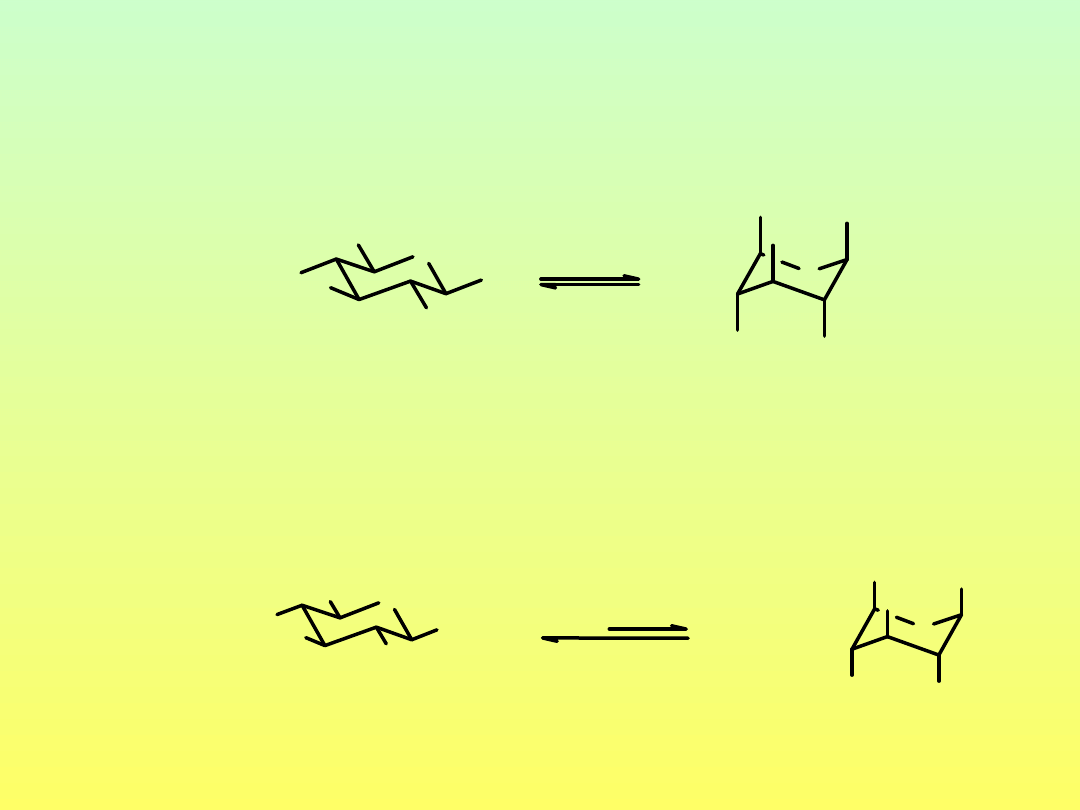
Konformacja pierścienia furanozowego
furanozy
O
koperta
O
konformacja skrecona
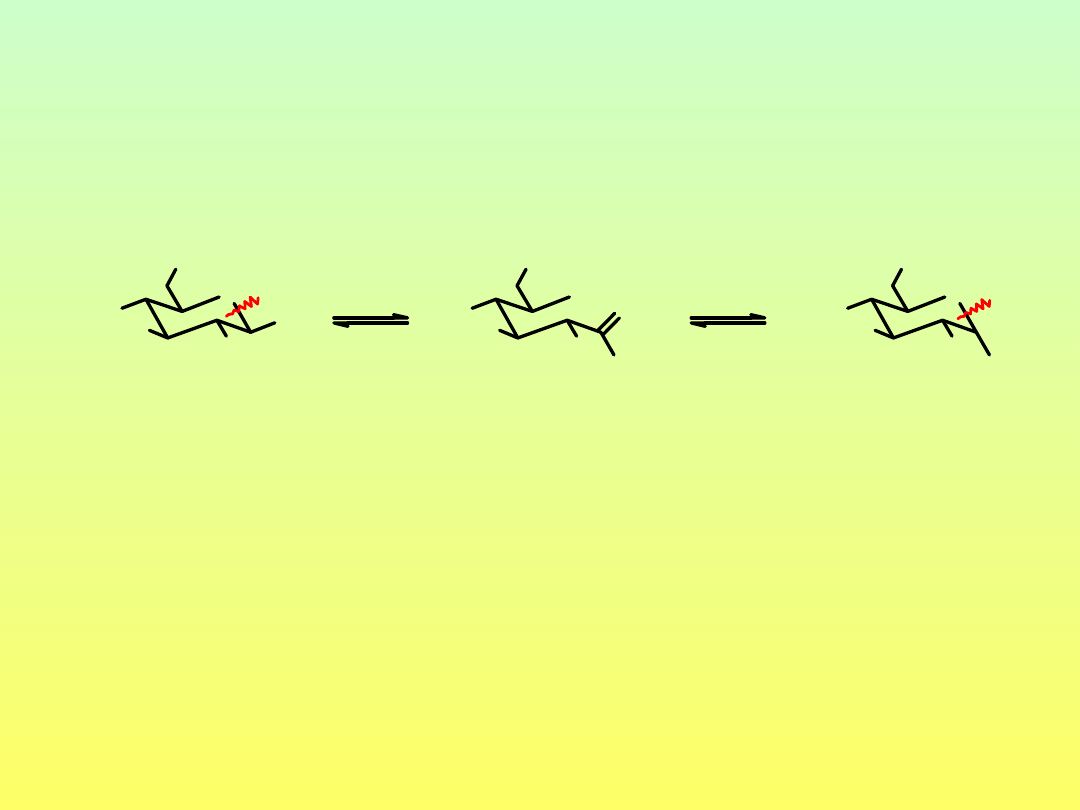
Mutarotacja monosacharydów
glukoza
OH
O
H
O
O
H
OH
OH
O
H
OH
O
H
OH
O
H
OH
O
H
O
O
H
OH
OH
OH
-D-glukoza
-D-glukoza
[α]
D
18.7˚
[α]
D
112˚
w stanie równowagi [α]
D
52.7˚
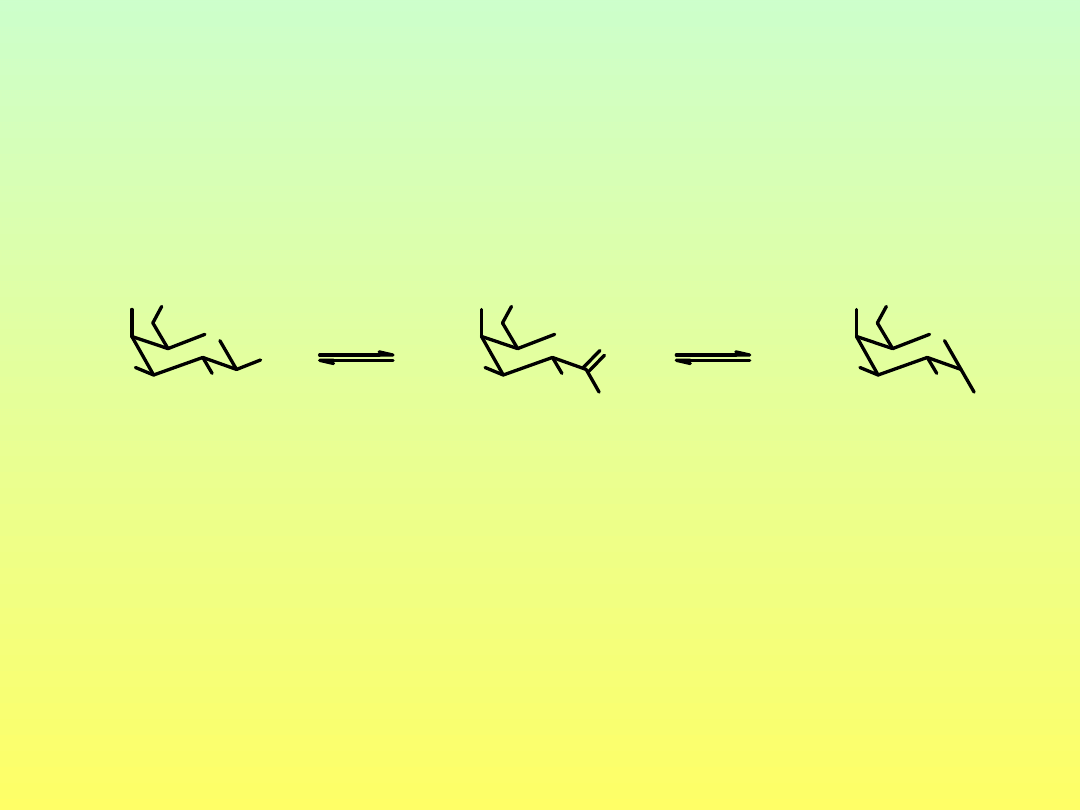
Mutarotacja monosacharydów
galaktoza
OH
O
O
H
OH
OH OH
OH
O
H
OH
O
H
OH OH
O
O
H
OH
OH
OH OH
-D-galaktoza
-D-galaktoza
[α]
D
52.8˚
[α]
D
150.7˚
w stanie równowagi [α]
D
80.2˚
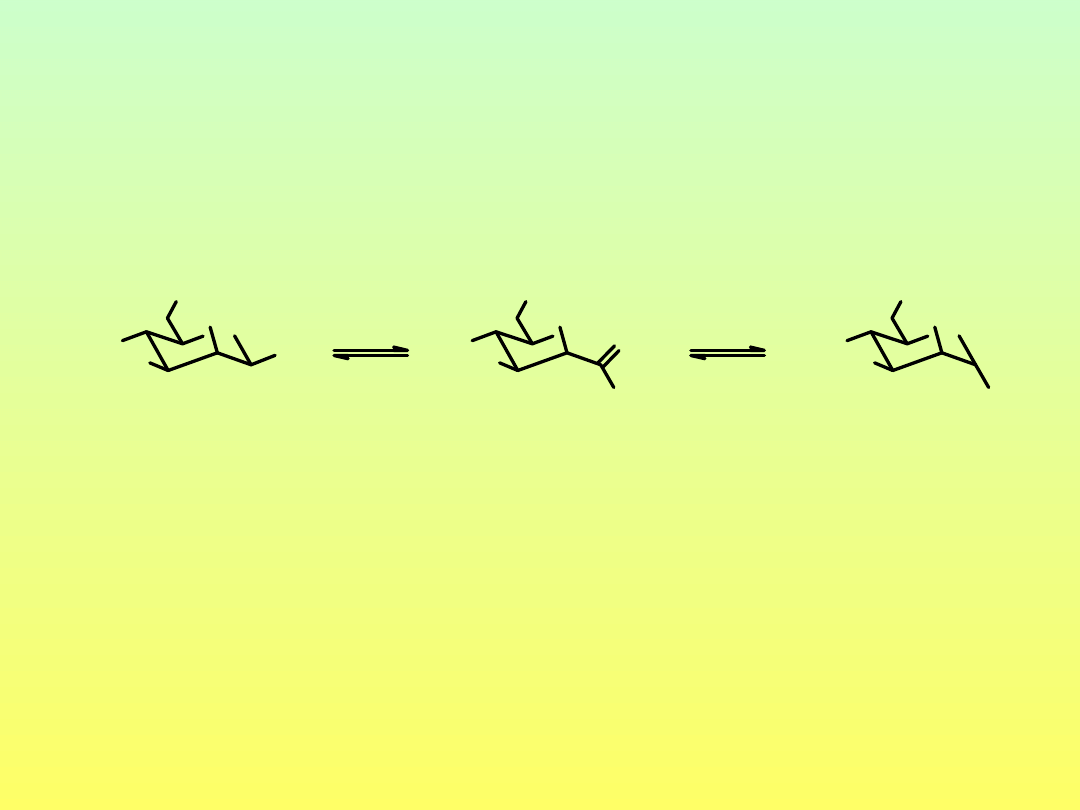
Mutarotacja monosacharydów
mannoza
OH
O
H
O
O
H
O
H
OH
O
H
OH
O
H
O
H
O
H
OH
O
H
O
O
H
OH
O
H
OH
-D-mannoza
-D-mannoza
[α]
D
-17˚
[α]
D
29.3˚
w stanie równowagi [α]
D
14.5˚
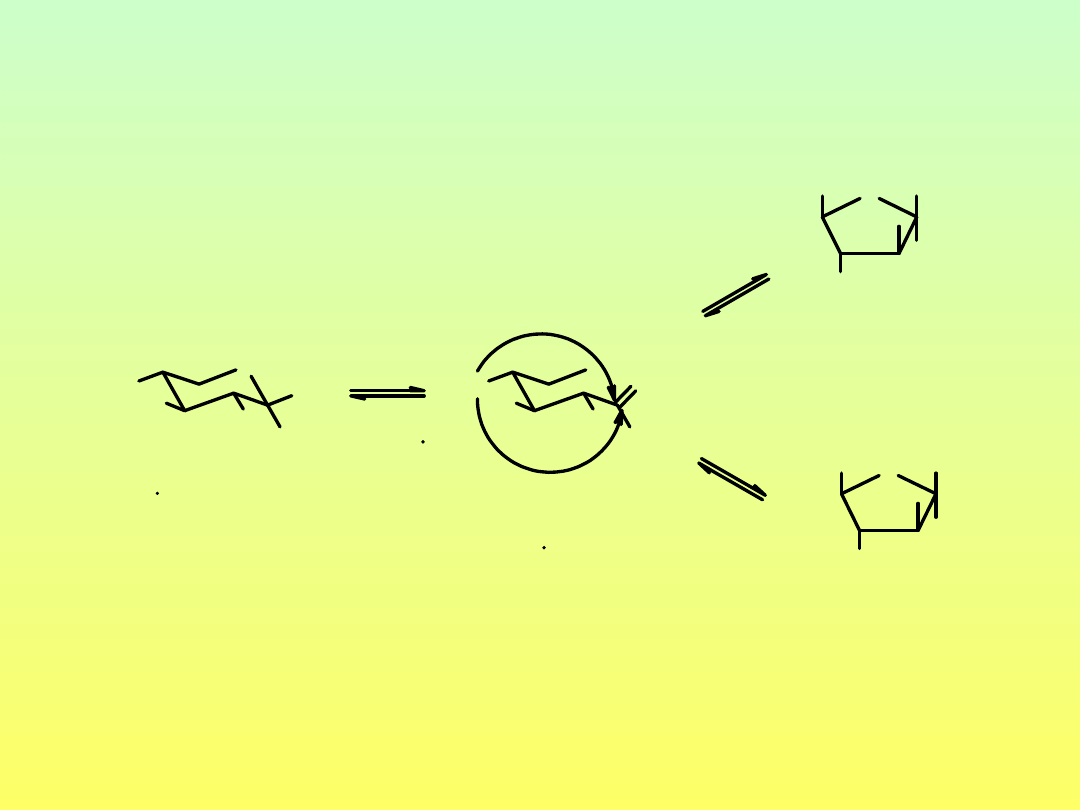
Mutarotacja monosacharydów
fruktoza
w stanie równowagi [α]
D
-92˚
OH
O
H
O
O
H
OH
CH
2
OH
O
H
OH
O
H
OH
O
CH
2
OH
O
CH
2
OH
OH
CH
2
OH
OH
HO
O
CH
2
OH
CH
2
OH
OH
OH
HO
-D-fruktopiranoza
D-fruktofuranoza
D-fruktofuranoza

Reakcje monosacharydów
• redukcja – alditole
• utlenianie – kwasy
aldonowe, laktony
• utlenianie – kwasy
aldarowe, laktony
• utlenianie – kwasy
uronowe
• reakcje z
nukleofilami
azotowymi
• reakcje z alkoholami
– glikozydy (acetale)
• acetylowanie
• metylowanie – etery
• etery TMS
• estry z kwasami
tłuszczowymi (cukry i
alditole – detergenty)
• alkilowanie
• pH<3 enolizacja,
dehydratacja
• pH>7 enolizacja,
fragmentacja, wtórne
reakcje aldolowe
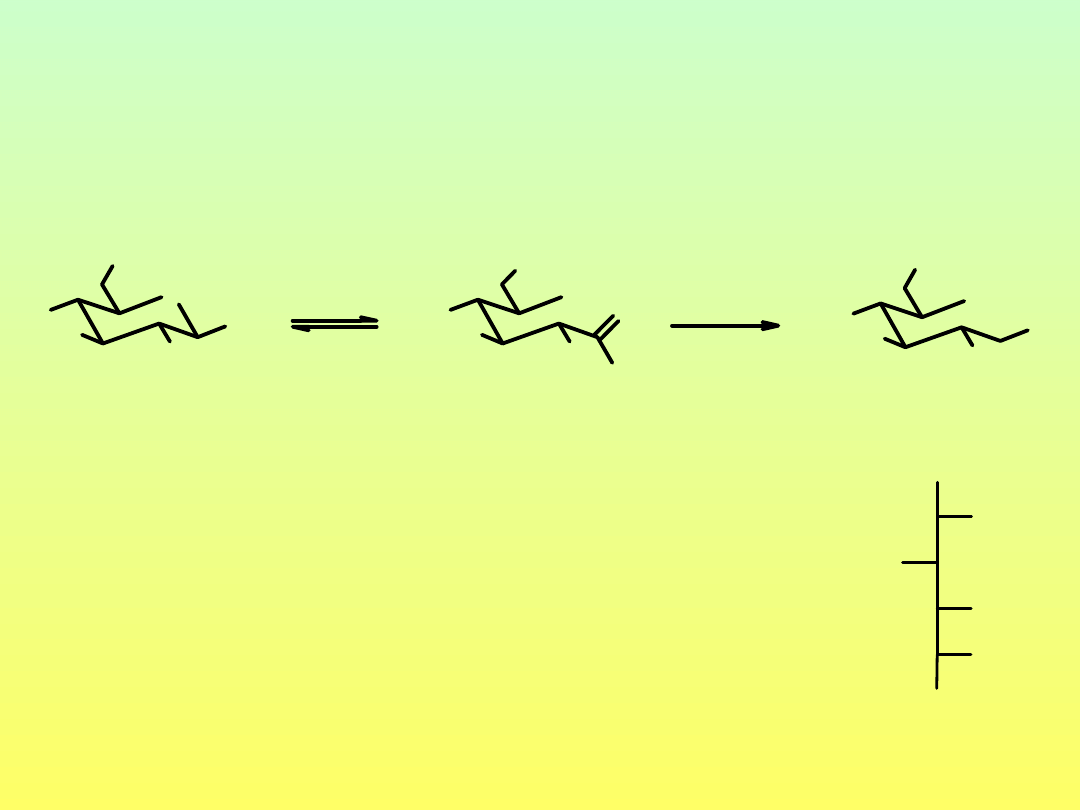
Redukcja do alditoli
OH
O
H
O
O
H
OH
OH
O
H
OH
O
H
OH
O
H
OH
OH
O
H
OH
O
H
OH
OH
H
2
Ni
D-glucitol
(sorbitol)
CH
2
OH
OH
O
H
OH
OH
CH
2
OH
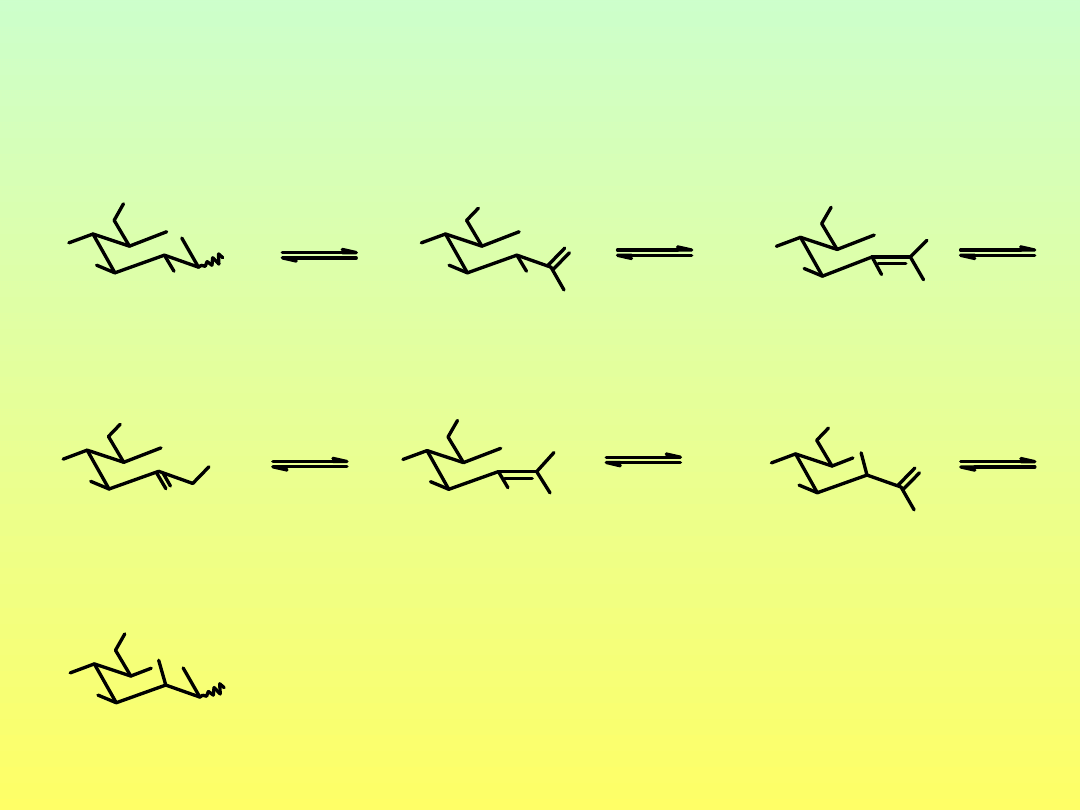
Enolizacja (izomeryzacja)
OH
O
H
O
O
H
OH
OH
O
H
OH
O
H
OH
O
H
OH
O
H
OH
O
H
OH
OH
OH
H
D-glukoza
trans-1,2-endiol
O
H
OH
O
H
O
OH
OH
D-fruktoza
O
H
OH
O
H
OH
OH
H
OH
cis-1,2-endiol
O
H
OH
O
H
O
H
O
H
OH
OH
O
H
O
O
H
O
H
OH
D-mannoza
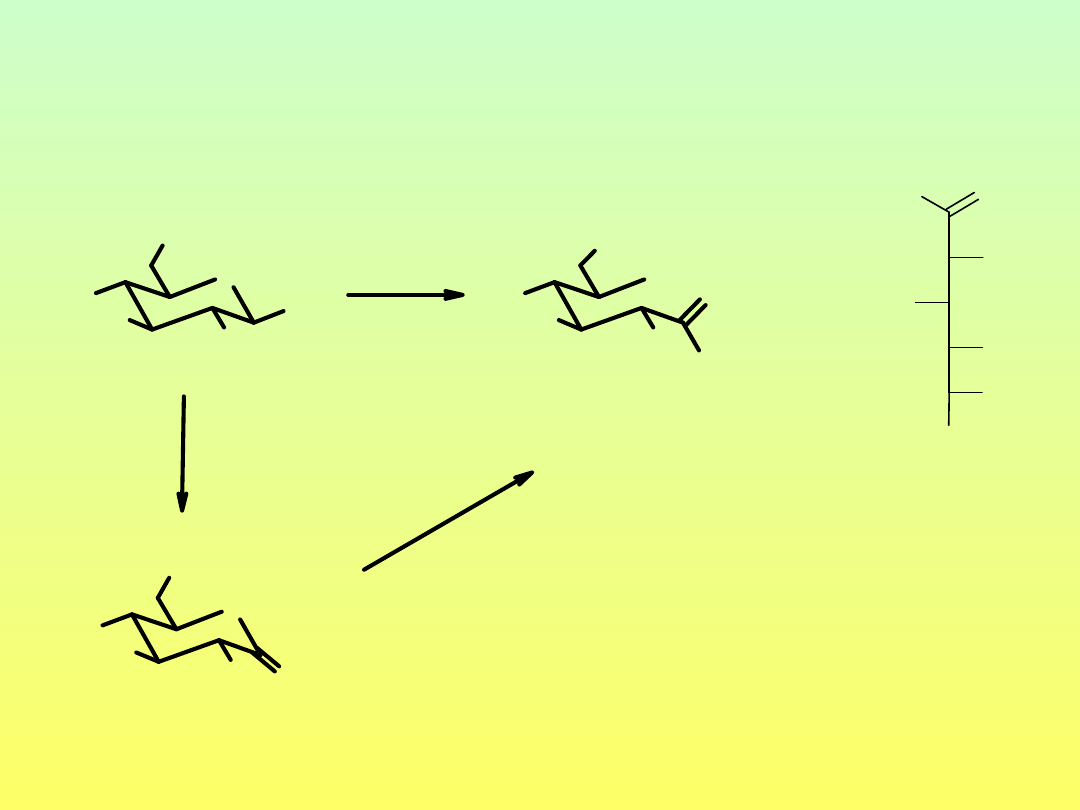
Utlenianie do kwasów aldonowych
OH
O
H
O
O
H
OH
OH
O
H
OH
O
H
OH
O
OH
OH
O
O
H
O
O
H
OH
OH
OH
O
H
OH
OH
CH
2
OH
O
O
H
Cu(OH)
2
oksydaza
glukozowa
kwas D-glukonowy
D-glukono-1,5-lakton
HO
_
=
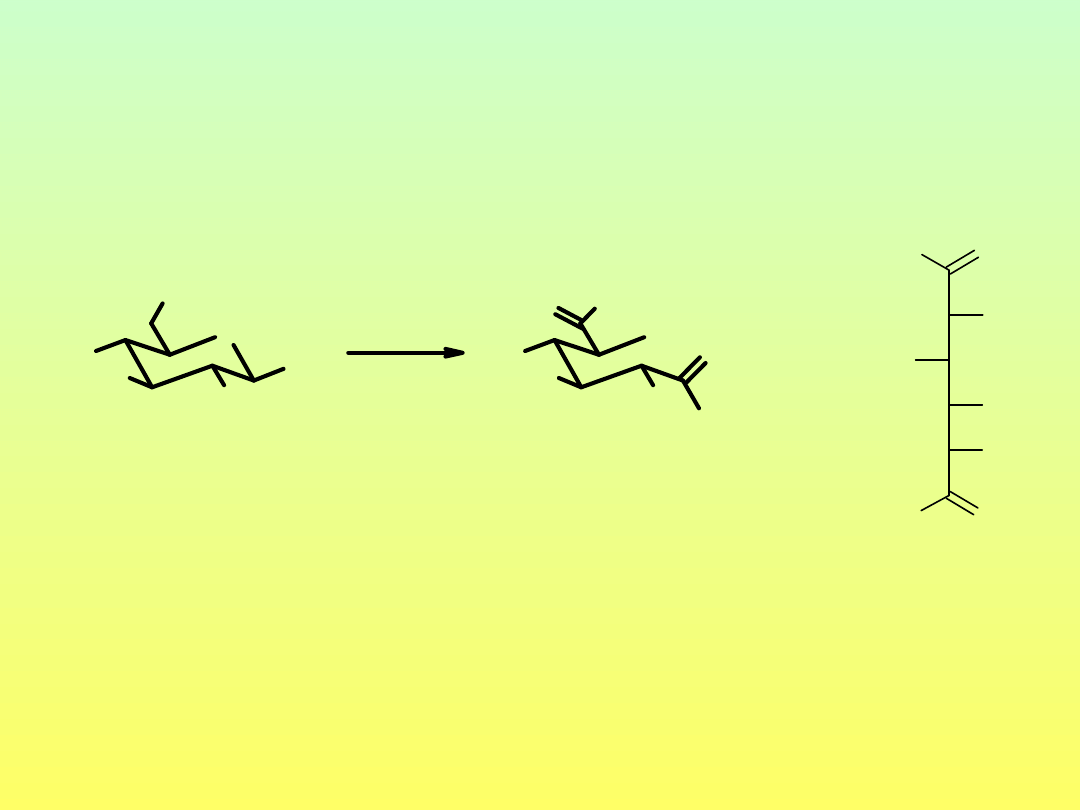
Utlenianie do kwasów aldarowych
OH
O
H
O
O
H
OH
OH
O
H
OH
O
H
OH
O
OH
OH
O
HNO
3
kwas D-glukarowy
OH
O
H
OH
OH
O
O
H
O
H
O
=
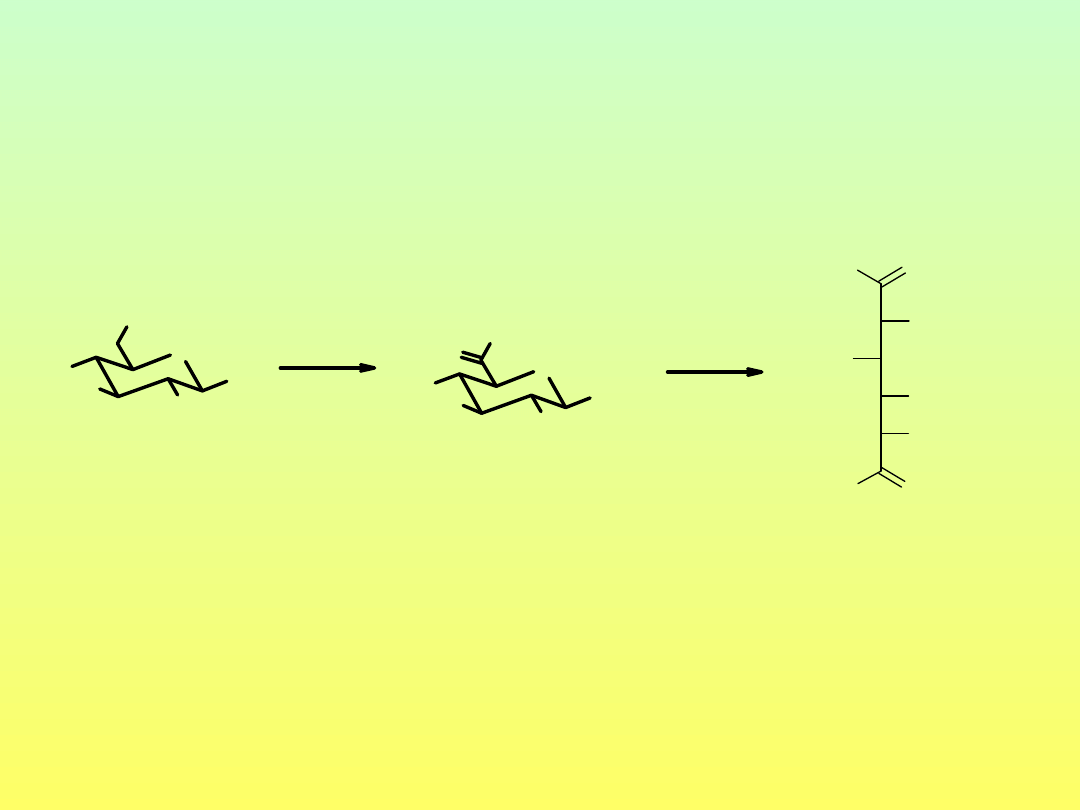
Utlenianie do kwasów alduronowych
OR
O
H
O
O
H
OH
OH
OH
O
H
OH
OH
O
H
O
H
O
OR
O
H
O
O
H
OH
OH
O
[O]
kwas D-glukuronowy
H
2
O, H
+
D-glukozyd
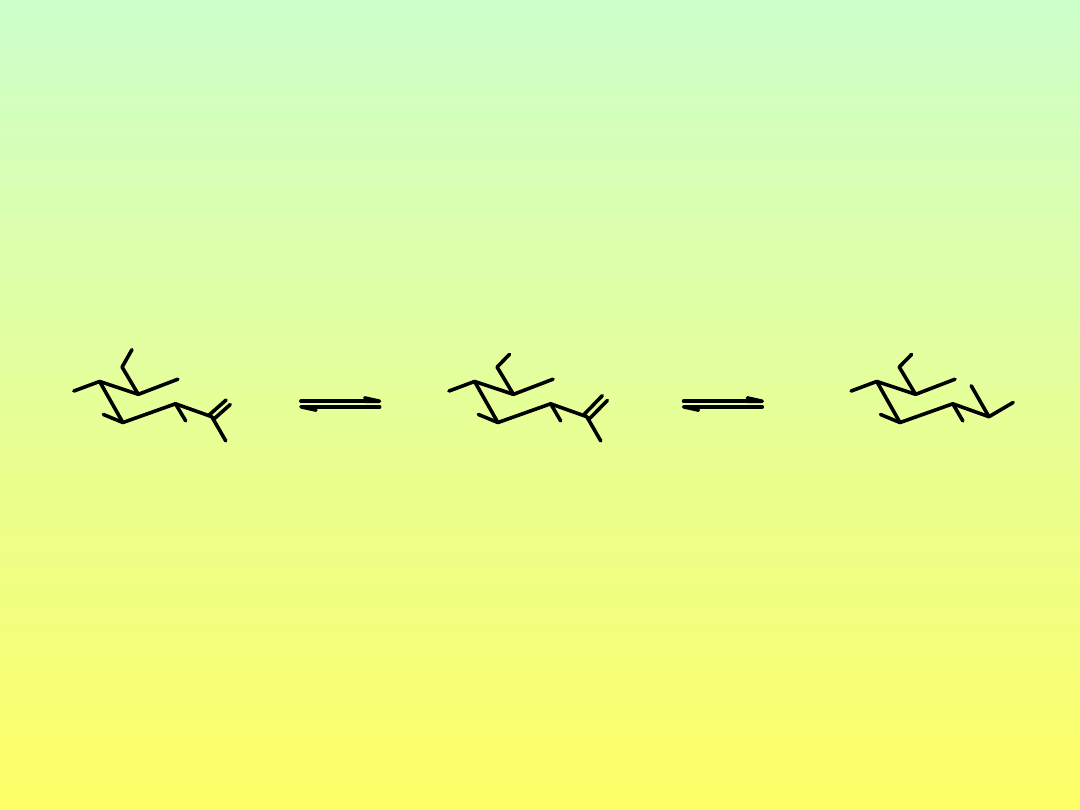
Reakcje z nukleofilami azotowymi
O
O
H
OH
O
H
OH
OH
H
O
H
OH
O
H
OH
NR
H
OH
O
H
O
O
H
OH
NHR
OH
RNH
2
Imina
(zasada Schiffa)
Aldoza
Aminoaldoza
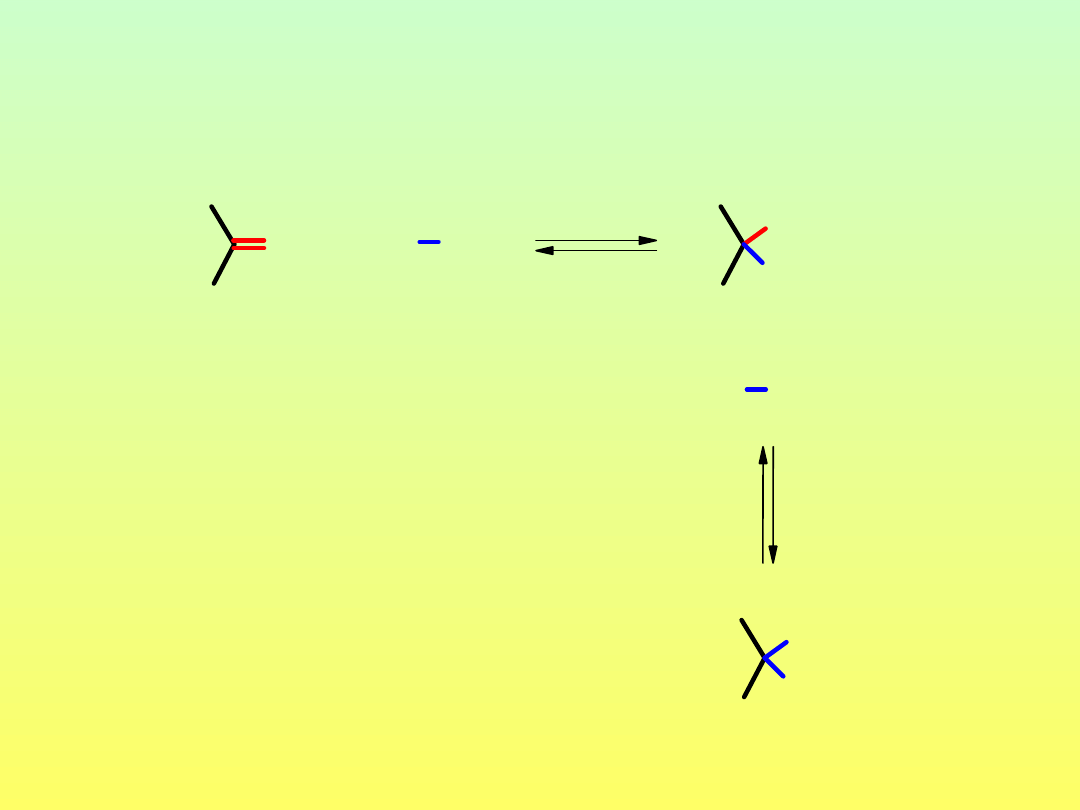
O
R OH
O
OR
R OH
H
OR
OR
+
H
+
+
H
+
+
H
2
O
aldehyd
lub keton
hemiacetal
acetal
Powstawanie acetali
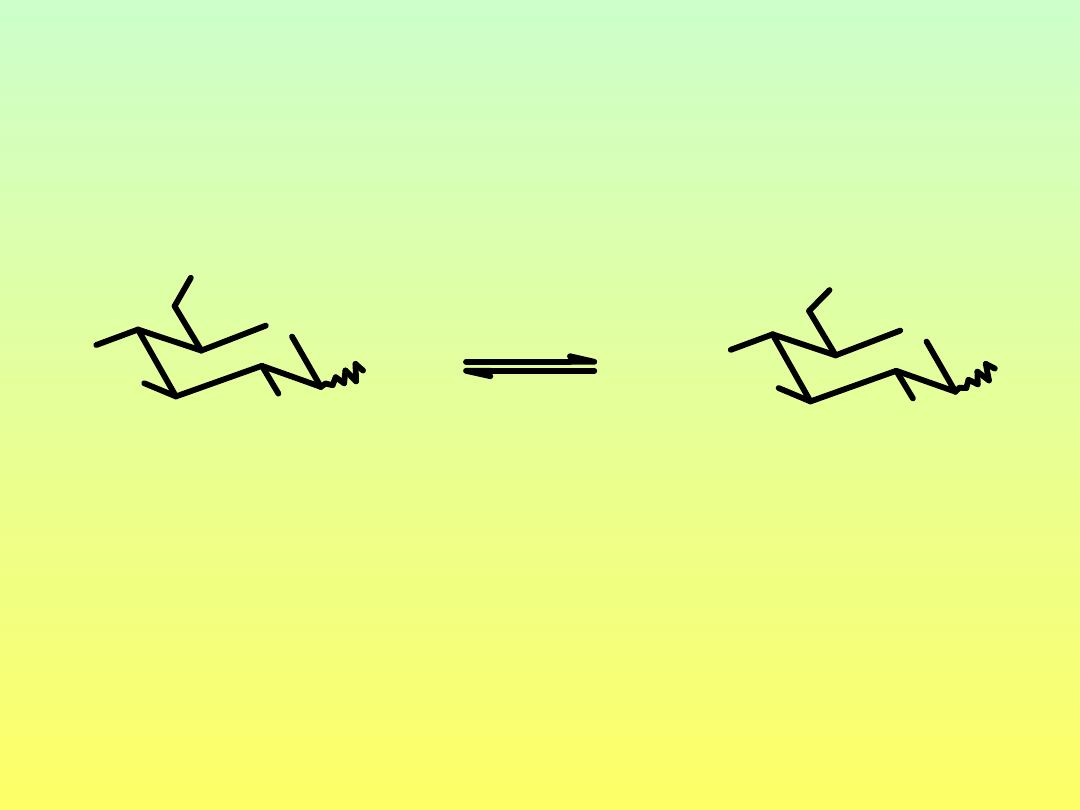
Reakcje monosacharydów z alkoholami
powstawanie glikozydów (acetali)
OH
O
H
O
O
H
OH
OH
O
H
O
O
H
OH
OR
OH
ROH
kwas
Brak mutarotacji
Trwałe w środ. zasadowym
Hydrolizują w środ. kwaśnym
glukozyd
Estry monosacharydów
OH
O
H
O
O
H
OH
OH
O
O
O
O
O
O
R
O
O
R
R
O
R
O
R
O
5RCOCl
pirydyna
Penta-O-acetyloglukoza
Etery monosacharydów
OH
O
H
O
O
H
OH
OH
O
O
O
O
O
O
5CH
3
I
Ag
2
O
Penta-O-metyloglukoza

Etery monosacharydów
OH
O
H
O
O
H
OH
OH
O
O
O
O
O
O
Si
Si
Si
Si
Si
TMS-Cl
Lotne trimetylosililowe
pochodne – analiza metodą
GC, GC-MS
Penta-O-trimetylosililoglukoza

OLIGOSACHARYDY
Reakcje z alkoholami – glikozydy (acetale)
OH
O
H
O
O
H
OH
OH
O
H
O
O
H
OH
OR
OH
ROH
kwas
β-D-glukozyd
Wiązanie glukozydowe
Disacharyd
gdy R jest także
monosacharydem

Disacharydy glukozy
• Maltoza: α-D-Glup-(1→4)-D-Glup
• Izomaltoza: α-D-Glup-(1→6)-D-Glup
• Celobioza: β-D-Glup-(1→4)-D-Glup
• Gencjobioza: β-D-Glup-(1→6)-D-Glup
• Trehaloza: α-D-Glup-(1→1)-α-D-Glup
OH
O
O
O
H
OH
OH
O
OH
O
H
OH
O
H
OH
O
O
O
H
OH
OH
OH
OH
O
H
O
O
H
OH
OGlu
O
H
OH
O
H
OH
O
H
OGlu
O
H
O
O
H
OH
OH
OGlu
-anomer
-anomer
Glu
Glu
Glu
-anomer
-anomer
1,4-glukozyd
1,6-glukozyd
Właściwości redukujące i
mutarotacja disacharydów
Disacharydy redukujące, wykazują mutarotację,
występują w dwóch formach anomerycznych

O
OH
O
OH
OH
O
H
O
H
O
O
H
OH
OH
O
OH
O
OH
O
H
O
H
O
H
O
O
H
OH
OH
OH
O
OH
O
H
OH
O
O
H
O
O
H
OH
OH
1,1-glukozyd
1,1-glukozyd
1,1-glukozyd
Właściwości redukujące i
mutarotacja disacharydów
Disacharyd nieredukujący - nie ma form anomerycznych,
nie wykazuje mutarotacji
trehaloza

Disacharydy w
żywności
• Sacharoza: α-D-Glup-(1→2)-β-D-
Fruf
• Laktoza: β-D-Galp-(1→4)-D-Glup
• Maltoza: α-D-Glup-(1→4)-D-Glup
• Celobioza: β-D-Glup-(1→4)-D-Glup
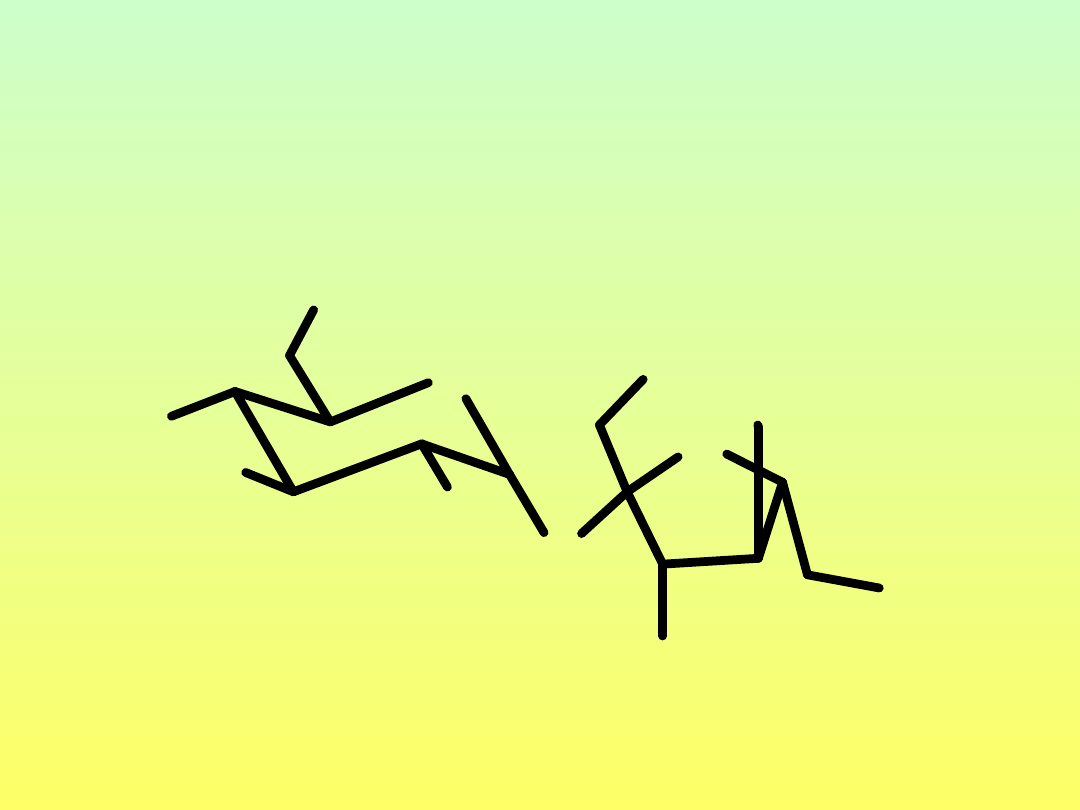
• Sacharoza: α-D-Glup-(1→2)-β-D-Fruf
OH
OH
O
O
H
O
O
H
OH
OH
O
OH
OH
α
β
Disacharyd nieredukujący
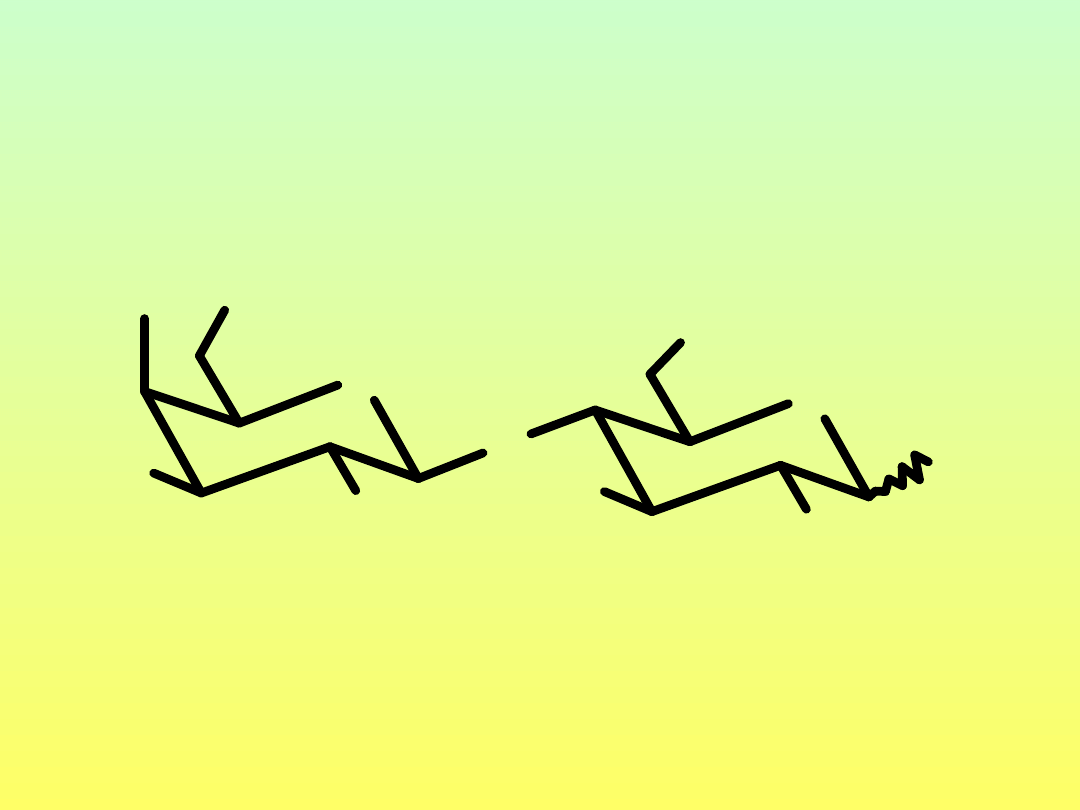
• Laktoza: β-D-Galp-(1→4)-D-Glup
O
O
O
H
OH
OH
OH
O
O
H
OH
OH
OH
β
α/β
Disacharyd redukujący

• Maltoza: α-D-Glup-(1→4)-D-Glup
O
O
O
H
OH
OH
OH
O
O
H
OH
OH
O
H
α
α/β
Disacharyd redukujący
• Celobioza: β-D-Glup-(1→4)-D-Glup
O
O
O
H
OH
OH
OH
O
O
H
OH
OH
O
H
β
α/β
Disacharyd redukujący

Reakcje oligosacharydów
pH<3
• Polimeryzacja
• Anhydrosachary
dy
• Enolizacja
• Dehydratacja
pH>7
• Enolizacja
• Izomeryzacja
• Fragmentacja
• Wtórne reakcje
produktów
fragmentacji

Powstawanie glikozydów (polimeryzacja,rewersja)
OH
O
H
O
O
H
OH
OH
OH
O
H
O
O
H
OH
OH
O
H
O
O
H
OH
O
O
H
O
O
H
OH
OH
OH
OH
O
H
O
O
H
OH
O
O
H
O
O
H
OH
OH
H
+
/H
2
O
izomaltoza
gencjobioza
Anhydrosacharydy – wewnątrzcząsteczkowe glikozydy
OH
O
H
O
O
H
OH
OH
OH
O
H
O
O
OH
O
H
O
O
H
OH
O
O
H
O
O
H
O
OH
H
+
, ogrzewanie
-H
2
O
1,6-anhydro-
1,2-anhydro-
3,6-anhydro-D-glukopiranoza
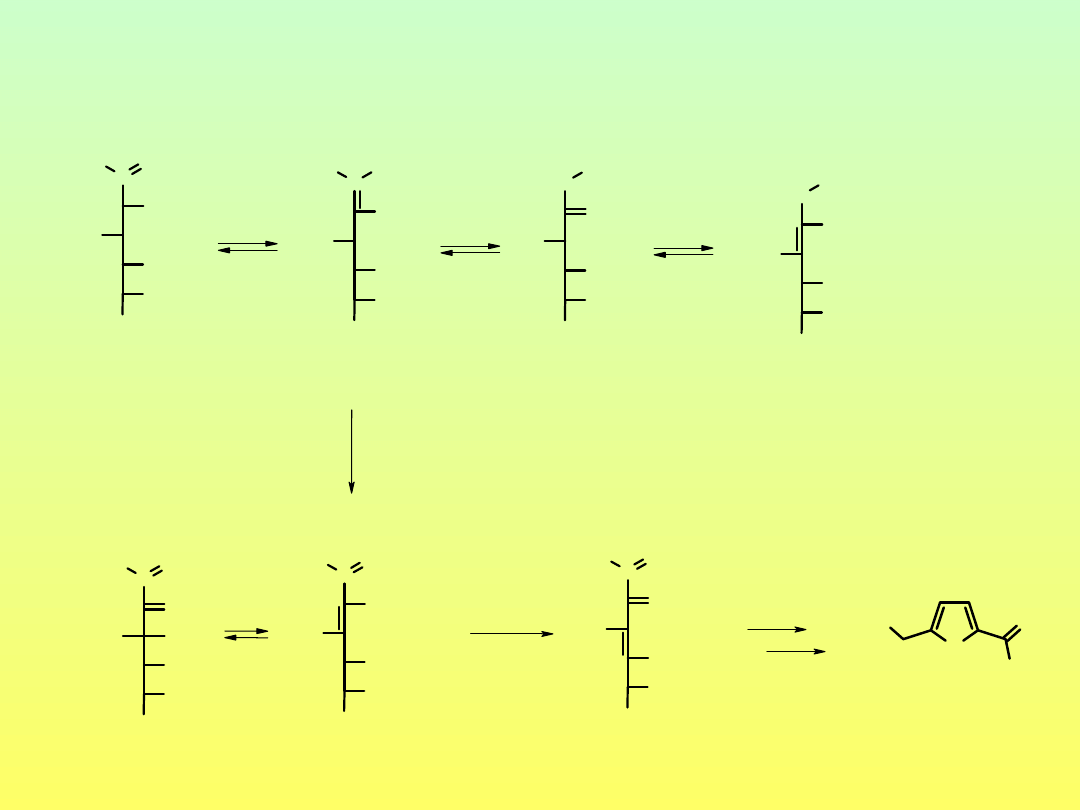
Enolizacja połączona z dehydratacją
C
O
H
OH
OH
CH
2
OH
OH
O
H
C
OH
H
OH
OH
CH
2
OH
OH
O
H
C
H
2
OH
O
OH
CH
2
OH
OH
O
H
C
H
2
OH
OH
OH
CH
2
OH
OH
O
H
D-glukoza
1,2-endiol
D-fruktoza
2,3-endiol
-H
2
O
C
O
H
OH
OH
CH
2
OH
OH
H
C
O
H
O
H
CH
2
OH
OH
H
O
H
O
O
H
C
O
H
O
OH
CH
2
OH
OH
H
H
-H
2
O
hydroksymetylofurfural
(HMF)
3-deoksyoson
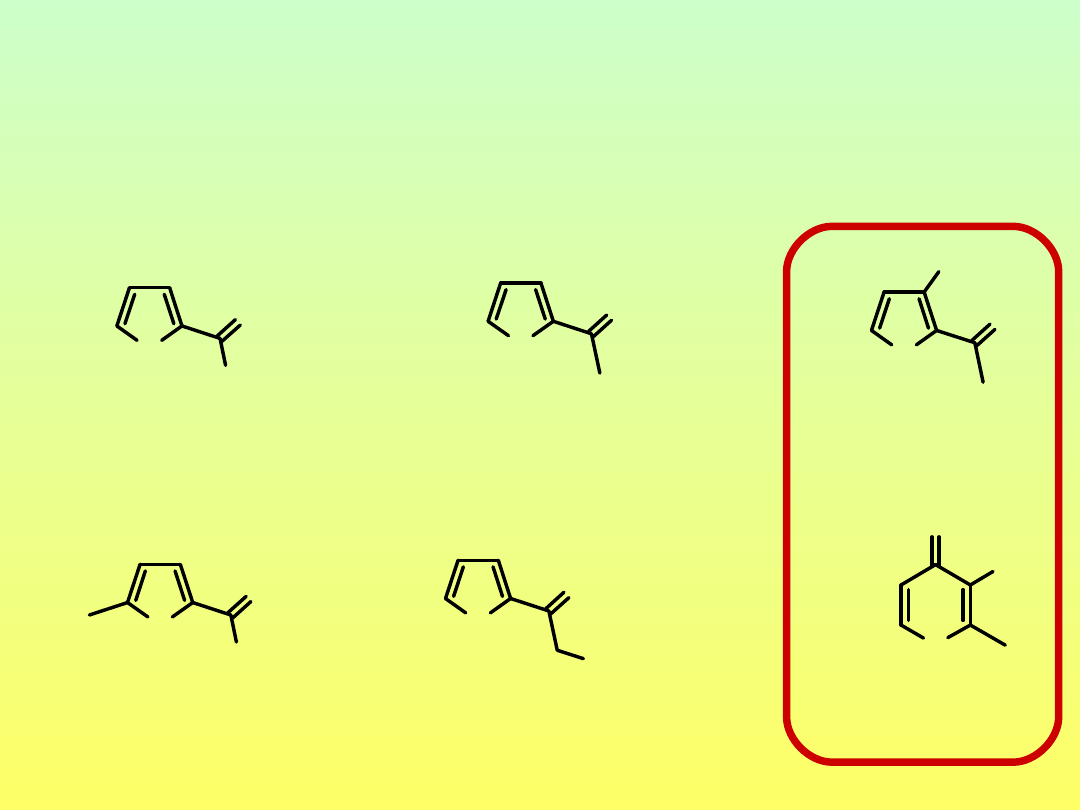
Produkty dehydratacji mono- i oligosacharydów
(Pochodne furanu i piranu)
O
H
O
O
O
O
H
O
O
O
OH
O
O
OH
O
O
OH
furfural
acetylofuran
5-metylofurfural
2-hydroksyacetylofuran
izomaltol
maltol
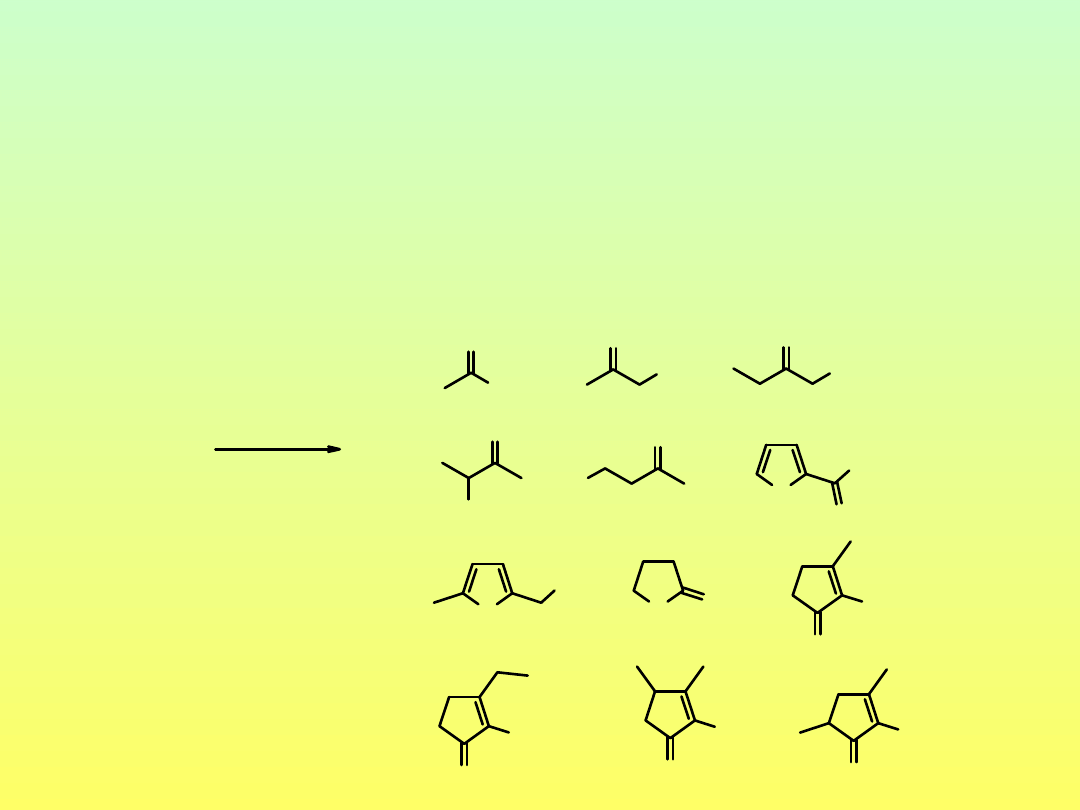
Reakcje cukrów w środowisku zasadowym (pH > 7)
Szybsza enolizacja
Izomeryzacja
Degradacja do reaktywnych związków karbonylowych
ulegających kondensacji aldolowej, reakcji Cannizzaro
OH
O
O
OH
O
OH
O
OH
O
O
H
O
O
H
O
OH
O
O
OH
O
OH
O
OH
O
OH
O
fruktoza
pH 8-10
3h ogrzewania
Skutki reakcji sacharydów redukujących z aminami
(reakcji Maillarda - nieenzymatyczne brązowienie)
Powstają brązowe pigmenty (melanoidyny)
Powstają lotne substancje zapachowe
Powstają substancje smakowe
Powstają substancje o właściwościach redukujących
(zapobiegające lub opóźniające utlenianie)
Straty niezbędnych aminokwasów (lizyna, arginina)
Powstaje akryloamid
Nastepuje sieciowanie białek
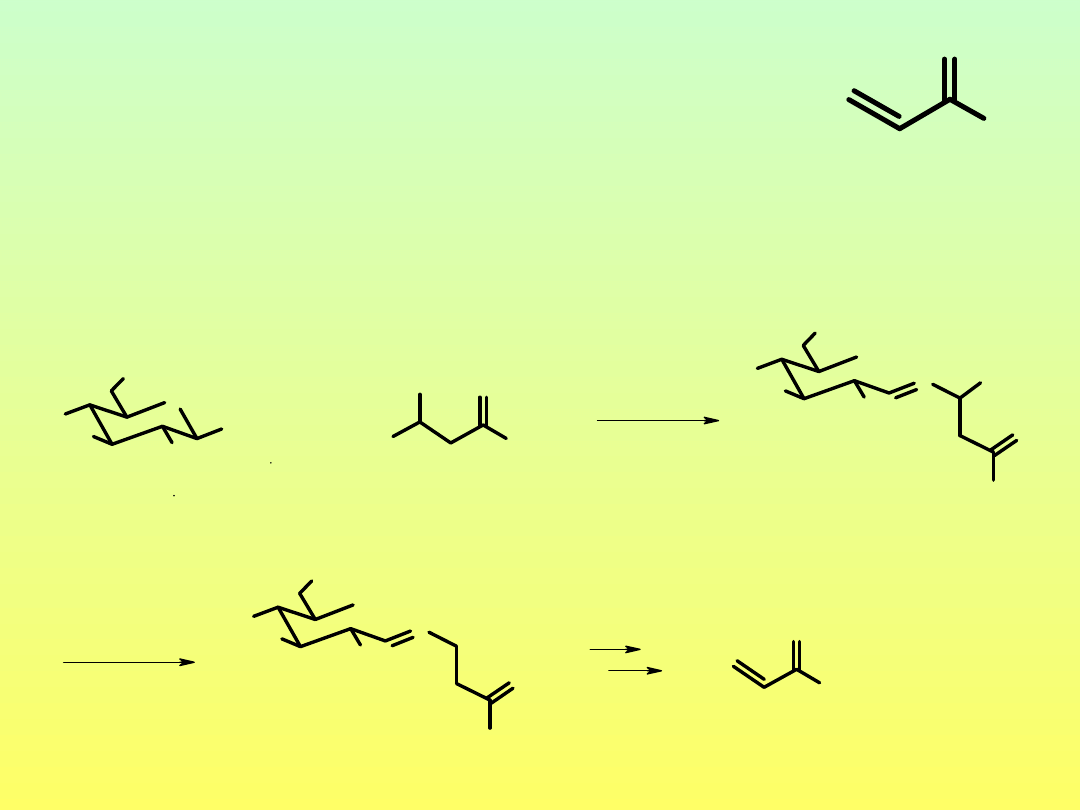
Jak powstaje akryloamid w żywności?
(temp. 120-200°C)
O
NH
2
Działanie neurotoksyczne
oraz kancerogenne
OH
O
H
O
O
H
OH
OH
N
H
2
NH
2
O
CO
2
H
N
O
CO
2
H
O
H
OH
O
H
OH
OH
NH
2
N
O
O
H
OH
O
H
OH
OH
NH
2
NH
2
O
D-glukoza L-asparagina
+
imina
-CO
2
+
+
D-glukoza
amoniak

Powstawanie substancji zapachowych
podczas ogrzewania sacharydów z aminokwasami
aminokwas
glukoza
skrobia
celuloza
-
karmelowy
-
Ala
karmelowy
kawowy
Asp
karmelowy
chlebowy
Phe
czekoladowy
kwiatu lilii
Gly
czek.-
owocowo-
kakaowy
Gln
czekoladowo-
kakaowy
Leu
czekoladowy
czekoladowy
trawiasty
Lys
chlebowy
pieczonych
ziemniaków
placków
cebulowych
Val
czekoladowy
czekoladowy
owocowy

Czynniki wpływające na szybkość reakcji Maillarda
Podwyższona temperatura – wzrost szybkości reakcji
Odczyn środowiska (obniżenie pH zmniejsza szybkość reakcji) )
Aktywność wody (maksimum szybkości reakcji przy aktywności
wody 0.6-0.7)
Rodzaj sacharydu (glukoza reaguje szybciej niż fruktoza)
Obecność dwutlenku siarki lub jonów HSO
3
-
(zmniejszenie szybkości reakcji)
Obecność jonów metali przejściowych Cu(I), Fe (II).

Karmelizacja sacharydów
(Reakcje w temperaturze > 100C)
Brunatno zabarwione polimery
(melanoidyny)
Lotne substancje zapachowe
Substancje smakowe
Karmele
– stosuje się do barwienia i aromatyzowania żywności
- powstawanie karmelu katalizują kwasy, zasady, sole prowadząc
do produktu o odmiennych właściwościach i zastosowaniu

Właściwości sensoryczne mono- i
disacharydów
Względna słodkość
(stęż. wagowe)
Względna słodkość
(stęż. molowe)
Sacharoza
1.00
1.00
Glukoza
0.76
0.40
Fruktoza
1.52
0.80
Galaktoza
0.50
0.26
Mannoza
0.45
0.24
Maltoza
0.43
0.43
Laktoza
0.33
0.33
Ksylitol
0.85-1.2
-
Sorbitol (glucitol)
0.60
-
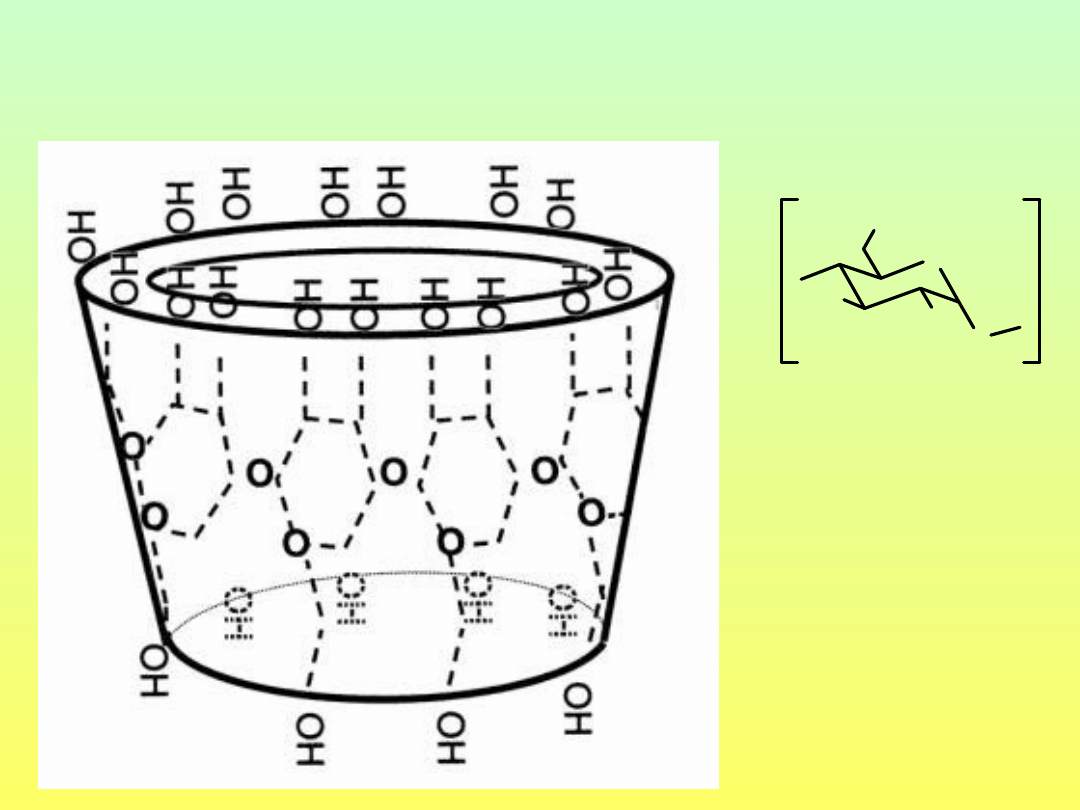
CYKLODEKSTRYNY
-cyklodekstryna
n=8
O
O
H
OH
OH
O
n
n = 6, 7, 8
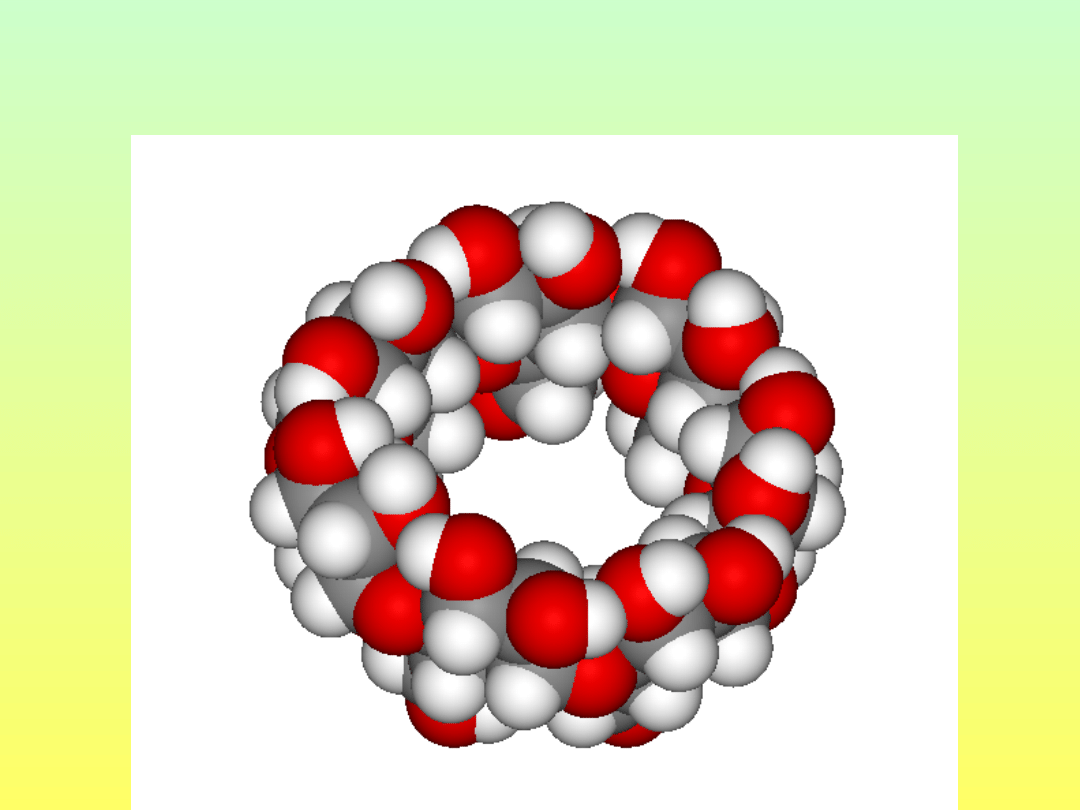
CYKLODEKSTRYNY
-cyklodekstryna
n=7
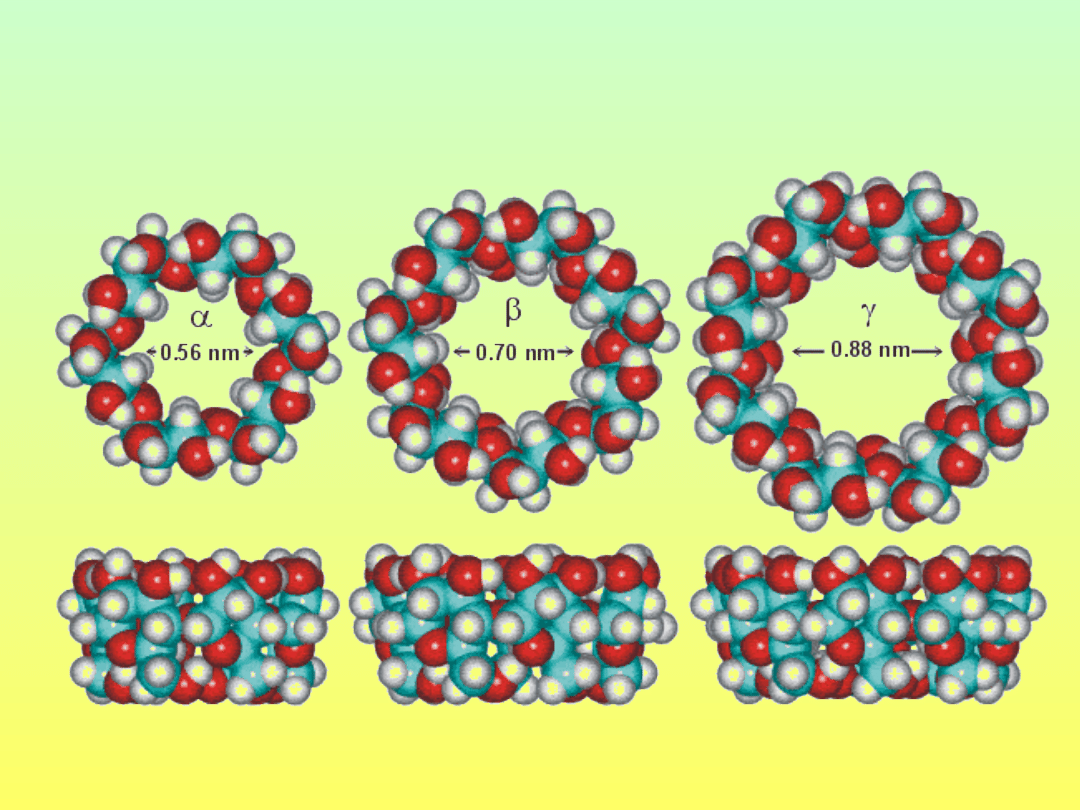
CYKLODEKSTRYNY

Masa
cząsteczkow
a
Średnica
zewnętrzna
[nm]
Wymiary
wnęki
[nm]
Rozp. w H
2
O
[g/kg]
972
1.52
0.45-0.53
129.5
1134
1.66
0.60-0.65
18.4
1296
1.77
0.75-0.85
249.2
CYKLODEKSTRYNY
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
Wyszukiwarka
Podobne podstrony:
Ch ż Wykl1 2 2013
materia éy z wyk é VIII ch fiz 2013
pomiary 17, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Fizy
WGGIS IS 1rok Ch Lab Cw 2 wzor sprawozdania 2013
2013 03 27 Nazwała papieża ch
9 Ch organiczna WĘGLOWODANY
ch wrzodowa prof T Starzyńska
wykłady NA TRD (7) 2013 F cz`
Pr UE Zródła prawa (IV 2013)
W WO 2013 technologia
ch zwyrodnieniowa st
Ch 28 Pelites
11 Ch organiczna AMINOKWASY I BIAŁKAid 12388 ppt
TEORIE 6 2013 R
Wyk ECiUL#1 2013
Leczenie wrzodziejacego zapalenia jelit, wyklad 2013
TEORIE 1 2013 IIR
więcej podobnych podstron