
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.


Spis treści
Reakcja zobojętniania
Definicja soli
Podział soli
Właściwości fizyczne soli
Tabela rozpuszczalności
Dysocjacja elektrolityczna soli
Sole jako produkt reakcji metalu z kwasem
Sole jako produkt reakcji tlenku metalu z kwasem
Sole jako produkt reakcji zasady z tlenkiem kwasowym
Reakcje strąceniowe
Ważniejsze metody otrzymywania soli
Wybrane sole
Bibliografia
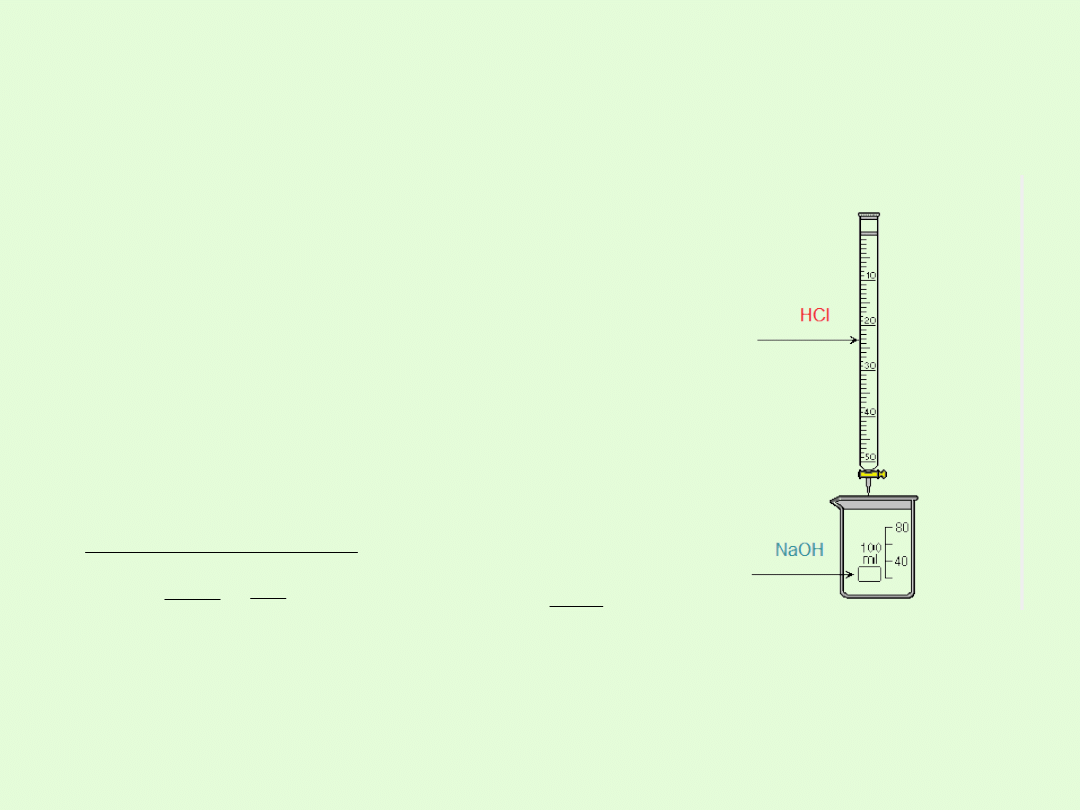
Reakcja zobojętniania
A.
Do zlewki 100 ml zawierającej 10 ml roztworu NaOH o stężeniu 0,1 mol/dm
3
,do
którego dodano kroplę fenoloftaleiny, z biurety dodawano kroplami roztwór HCl o
stężeniu 0,1 mol/dm
3
S
. Po dodaniu 10ml kwasu zniknęło zabarwienie
fenoloftaleiny. Zanurzony papierek uniwersalny nie
zmienił zabarwienia.
W. W roztworze nie wykryto obecności jonów
wodorotlenowych, ani jonów wodorowych
O
H
Cl
Na
Cl
H
OH
Na
Cl
H
kwasu
r.
w
OH
Na
zasady
r.
w
jonowy
Zapis
O
H
NaCl
HCl
NaOH
2
-
2
B.
Po odparowaniu wody pozostały kryształki nowego związku - NaCl
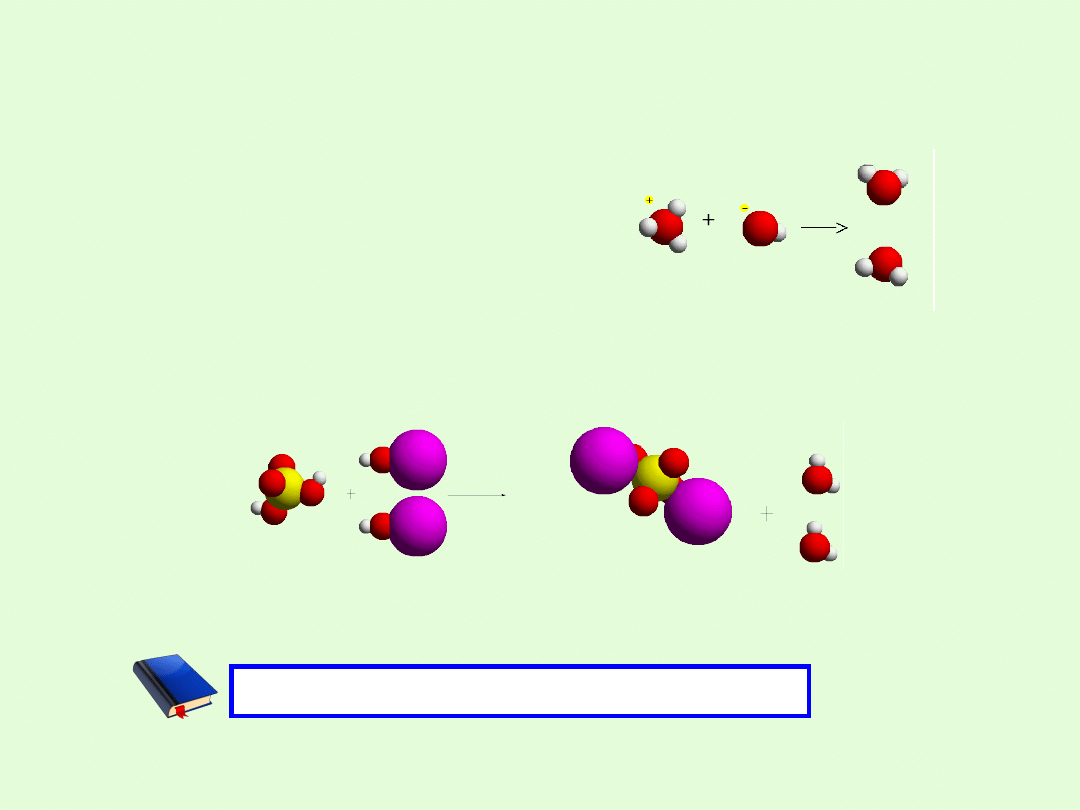
Reakcja zobojętniania polega na łączeniu się jonów
wodorowych (hydroniowych H
3
O
+
) z jonami wodorotlenkowymi
na niezdysocjowane cząsteczki wody.
O
H
OH
H
2
W wyniku tej reakcji powstał związek, którego cząsteczka zbudowana jest
z metalu i reszty kwasowej.
Związki o takiej budowie nazywamy solami.
O
H
SO
Na
2NaOH
SO
H
2
4
2
4
2
woda
sól
kwas
ek
Wodorotlen
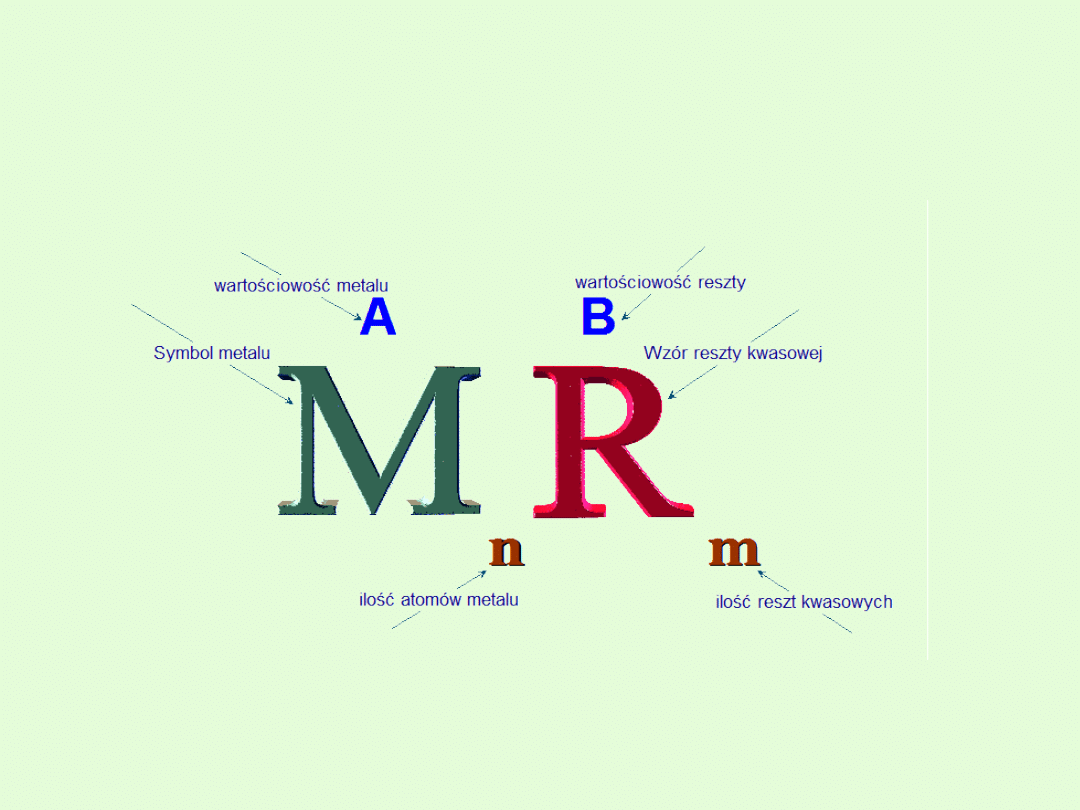
Sól
- związek chemiczny, którego cząsteczka zbudowana jest z kationu
(kationów) metalu i anionu (anionów) reszty kwasowej.

PODZIAŁ SOLI
A. Ze względu na charakter reszty kwasowej:
tlenowe (np..CaSO
4
, K
2
NO
3
)
beztlenowe ( CuCl
2
), Na
2
S)
B. Ze względu na gęstość metalu:
sole metali lekkich (np.. potasu, magnezu)
sole metali ciężkich (np. ołowiu, rtęci)
C. Ze względu na rozpuszczalność w wodzie:
łatwo rozpuszczalne ( np..azotany)
trudno rozpuszczalne (np. CaSO
4
,AgCl)
D. Ze względu na skład cząsteczki
proste - sole zawierające jeden rodzaj kationów i jeden rodzaj
anionów ( np. MgCO
3
, Na
2
S),
podwójne - mogą zawierać dwa rodzaje kationów,( np. MgAl
2
(SO
4
)
4
),
wielokrotne - zawierają trzy i więcej kationów lub anionów.
Są to na ogół minerały.

Oprócz
soli obojętnych
o wzorze ogólnym
Me
n
R
m
występują również
wodorosole
,o wzorze ogólnym
Me
n
(HR)
m
, , w
których część grup wodorotlenowych nie została zastąpiona resztami
kwasowymi (NaHSO
3
)
oraz
hydroksosole
o wzorze ogólnym
(MeOH)
n
R
m
, w których nie
wszystkie atomy wodoru zostały zastąpione kationem metalu
([Cu(OH)]
2
CO
3
]).
Sole uwodnione
(hydraty lub wodziany)- są to sole, które w swej cząsteczce
posiadają na trwałe przyłączone cząsteczki wody (Ca SO
4
×2 H
2
O - uwodniony
siarczan (VI) wapnia (gips)
Sole amonowe
W cząsteczce soli amonowych zamiast atomu metalu, występuje
jednowartościowa grupa amonowa NH
4
.
Wzór ogólny soli amonowej można zapiać:
(NH
4
)
n
R, gdzie NH
4
- grupa amonowa, R - reszta kwasowa, n - ilość grup
amonowych równa wartościowości reszty kwasowej.
(NH
4
Cl - chlorek amonu (salmiak))
Dla zainteresowanych
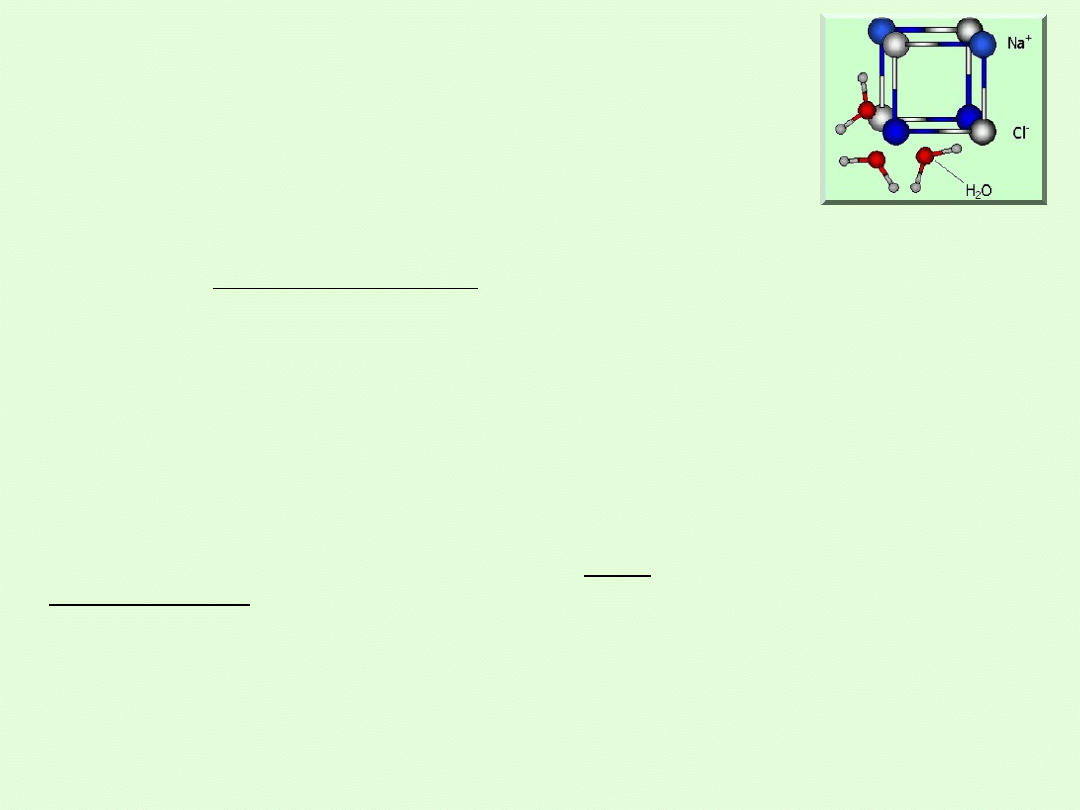
WŁAŚCIWOŚCI FIZYCZNE SOLI
Budowa krystaliczna
Sole w rzeczywistości nie występują w postaci pojedynczych
cząsteczek lecz tworzą kryształy w których poszczególne atomy
połączone są wiązaniami jonowymi.
W większości bezbarwne lub białe
Są też sole barwne jak np.: sole miedzi (zielone, niebieskie),
chromu (fioletowe, zielone, żółte, pomarańczowe), niklu (zielone),
żelaza (żółte, brązowe, zielone).
Mają wysoką temperaturę topnienia.
Większość soli łatwo rozpuszcza się w wodzie.
Istnieje również wiele soli trudno rozpuszczalnych w wodzie.
Rozpuszczalność soli odczytać można z tzw. tabeli
rozpuszczalności.
Wodne roztwory soli oraz sole w stanie stopionym
przewodzą prąd elektryczny, czyli są elektrolitami
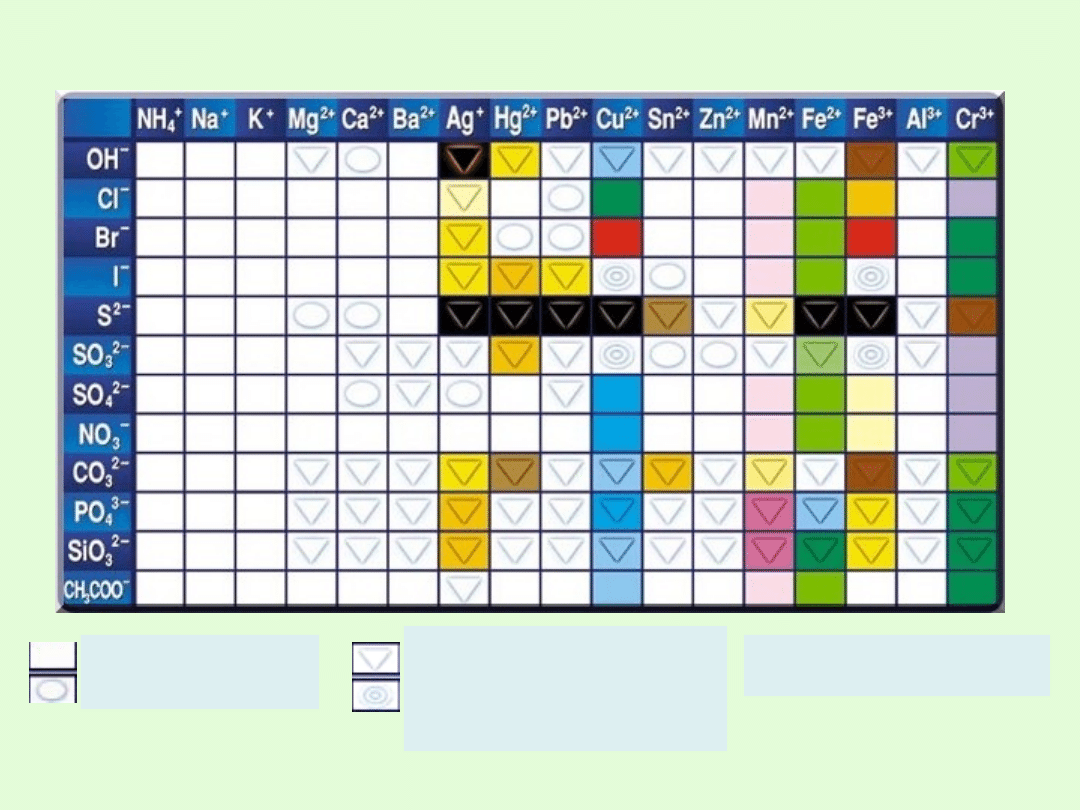
Barwa odpowiada kolorowi
roztworu lub osadu
Rozpuszczalna
Słabo rozpuszczalna
Praktycznie
nierozpuszczalna
W r-rze zachodzą
skomplikowane reakcje
Tabela rozpuszczalności

DYSOCJACJA ELEKTROLITYCZNA SOLI
Wiązania jonowe w sieci krystalicznej soli ulegają rozerwaniu pod
wpływem cząsteczek wody, co powoduje, że w roztworze znajdują się
kationy metalu i aniony reszty kwasowej danej soli.
Sól rozpuszczalna w wodzie dysocjuje na kationy metalu Me
m+
i aniony
reszty kwasowej R
n-
n
m
m
n
mR
nMe
R
Me

Przykłady
3
3
NO
Ag
AgNO
Praktycznie wszystkie azotany oraz sole sodowe, potasowe i amonowe
są bardzo dobrze rozpuszczalne w wodzie.
-
2
4
3
SO
aniony
3
i
Al
kationy
2
na
dysocjuje
glinu
VI)
siarczanu(
cząząstecz
jedna
2
4
3
3
4
2
3SO
2Al
)
(SO
Al
Uwaga: całkowity ładunek elektryczny ma wartość „0”
3
2
2
3
10NO
5Ca
)
5Ca(NO
2
4
3
3
4
2
12SO
8Fe
)
(SO
4Fe
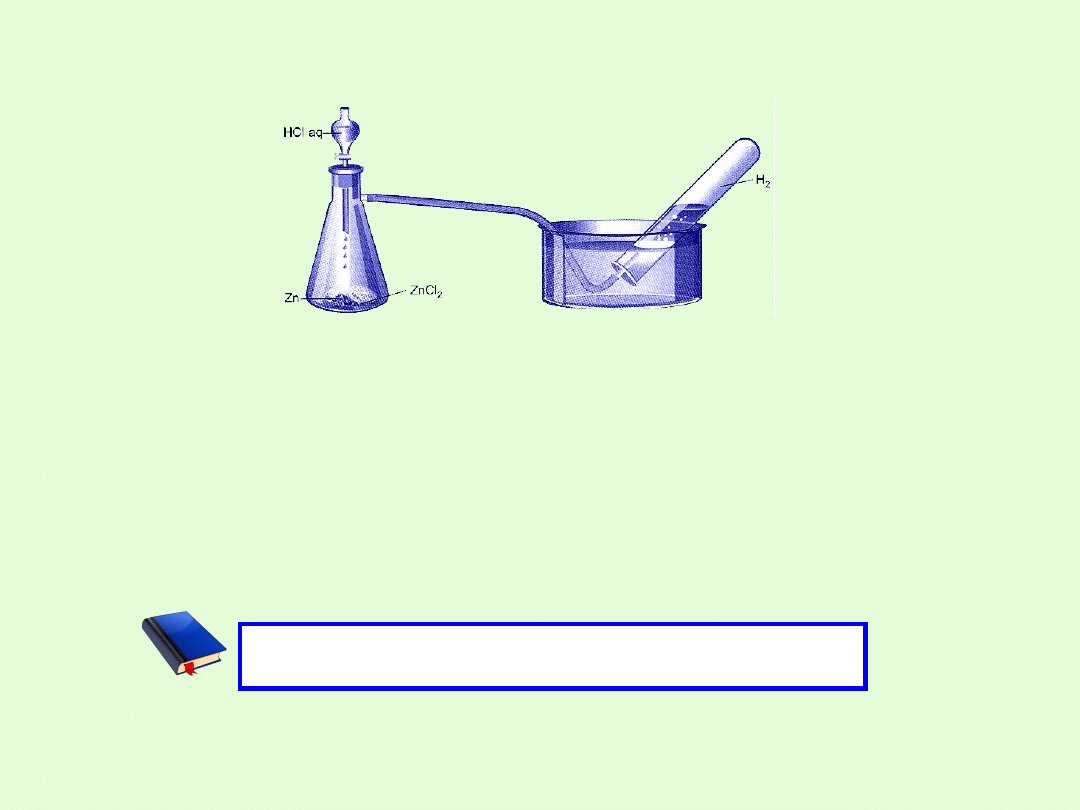
SOLE JAKO PRODUKT REAKCJI METALU Z KWASEM
S. Cynk rozpuścił się w kwasie solnym. W wyniku reakcji wydzielił się
wodór
W. Cynk wyparł wodór z roztworu kwasu. Produktem reakcji jest sól.
2
cynku
ny chlorek
zdysocjowa
2
2
2
H
2Cl
Zn
2Cl
2H
Zn
H
ZnCl
2HCl
Zn
wodór
sól
kwas
Metal
UWAGA
Produktem reakcji metalu z kwasem jest wodór tylko w przypadku
kwasów nie utleniających
(znane kwasy utleniające to: kwas azotowy, stężony kwas siarkowy)
Tylko metale aktywniejsze od wodoru wypierają go z kwasu.
K, Na, Ca, Mg, Al., Zn, Fe, Ni, Sn, Pb
,
H,
Bi, Cu, Hg, Ag, Pt, Au
< Metale aktywniejsze od
wodoru >
Przykłady
2
4
3
4
3
2
2
2
4
4
2
3H
PO
2K
PO
2H
6K
H
MgCl
HCl
Mg
H
CaSO
SO
H
Ca
wodoru)
od
aktywny
mniej
(metal
zachodzi
nie
reakcja
HCl
Cu
2
Produktami reakcji metali z kwasami utleniającymi również są sole, lecz
ich przebieg jest zupełnie inny.
Przykład
y
Ag + 2HNO
3
--> AgNO
3
+ NO
2
+ H
2
O
stężony
Metal mniej
aktywny
od wodoru
3 Cu + 8 HNO
3
--> 3 Cu(NO
3
)
2
+ 2NO↑ + 4 H
2
O
Metal mniej
aktywny
od wodoru
rozcieńczony
Reakcje stężonego kwasu siarkowego (VI) z metalami, mniej
aktywnymi niż wodór:
Cu + 2 H
2
SO
4
--> CuSO
4
+ SO
2
+ 2 H
2
O
Reakcja metalu aktywniejszego od wodoru ze stężonym H
2
SO
4
Zn + 2H
2
SO
4
→ ZnSO
4
+SO
2
+ 2H
2
O
Dla zainteresowanych
SOLE JAKO PRODUKT REAKCJI TLENKU METALU Z KWASEM
woda
sól
talu
tlenek me
Kwas
woda
sól
talu
tlenek me
Kwas
O
2
H
2
3
NO
Cu
3
NO
H
2
CuO
O
2
H
Cl
K
2
Cl
H
2
O
2
K
Przykłady
O
2
H
3
2
4
PO
3
Ca
O
Ca
3
4
PO
3
H
2
O
2
H
4
SO
2
K
O
2
Na
4
SO
2
H

SOLE JAKO PRODUKT REAKCJI ZASADY Z TLENKIEM KWASOWYM
woda
sól
zasada
sowy
tlenek kwa
kwasowy
bezwodnik
woda
sól
zasada
sowy
tlenek kwa
kwasowy
bezwodnik
O
2
H
2
3
NO
Mg
5
O
2
N
2
OH
Mg
O
H
SiO
Na
NaOH
2
SiO
O
H
CaCO
Ca(OH)
CO
2
3
2
2
2
3
2
2
Przykład
y
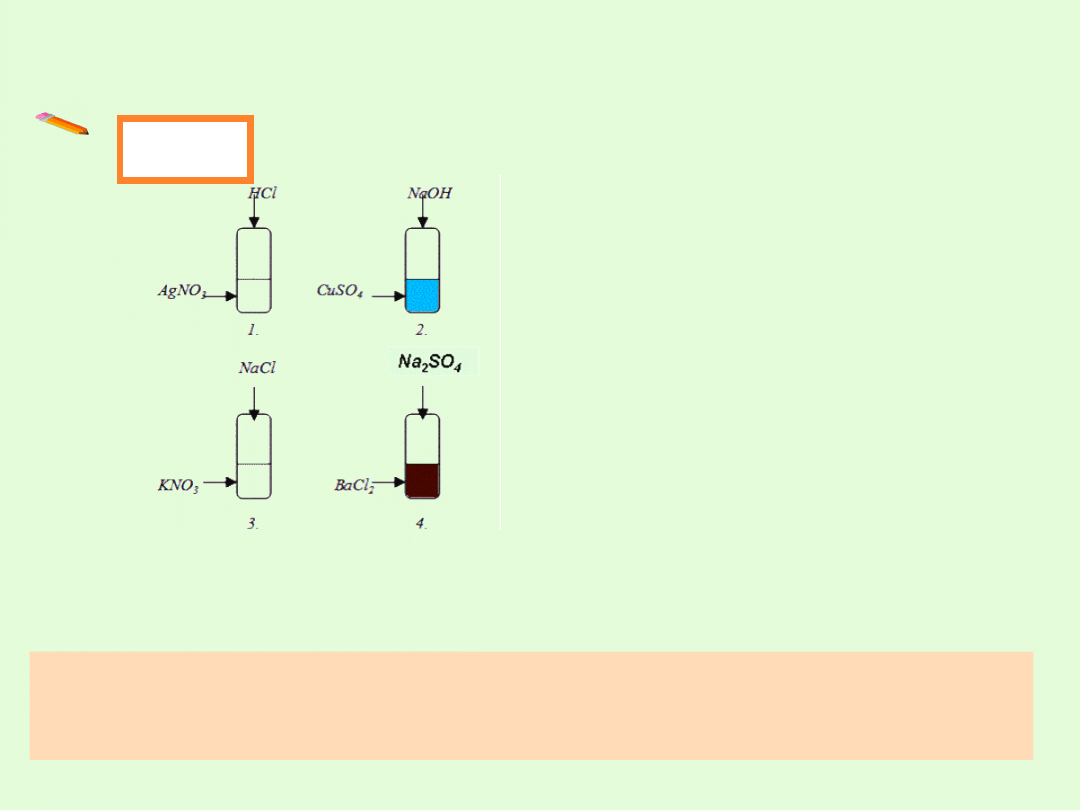
REAKCJE STRĄCENIOWE
Reakcja wytrącania osadu polega na reakcji między niektórymi
jonami – kationami i anionami związków rozpuszczalnych,
tworzącymi nierozpuszczalny związek chemiczny.
Przykład
y
1. Wydzielił się biały serowaty osad,
ciemniejący pod wpływem światła.
2. Wydzielił się niebieski galaretowaty
osad
3. Brak osadu
4. Wydzielił się brunatny kłaczkowaty
osad
We wszystkich przypadkach użyte substraty to roztwory wodne
W 1, 2, 4 przypadku jeden z produktów wytrącił się w postaci osadu.
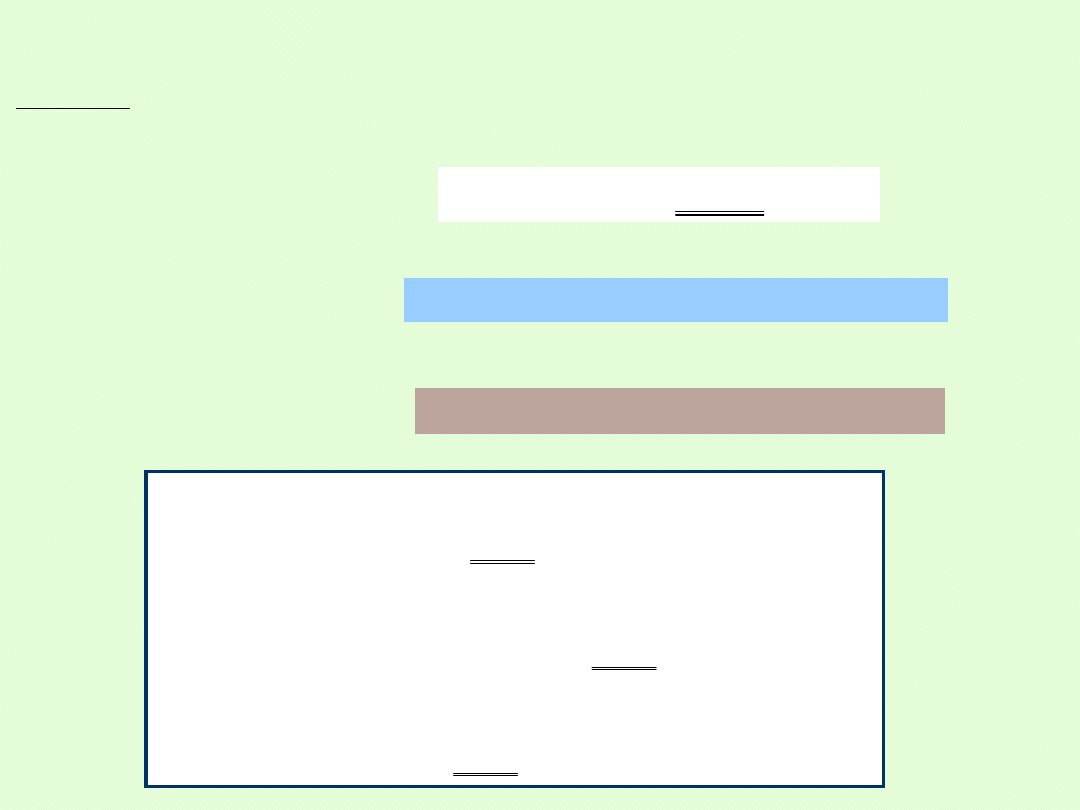
Wnioski:
Reakcje wytrącania osadów zaszły pomiędzy:
solą i kwasem –
probówka 1
solą i wodorotlenkiem –
probówka 2
dwiema różnymi solami –
probówka 4
4
2
2
4
SO
Na
Cu(OH)
2NaOH
CuSO
3
3
HNO
AgCl
HCl
AgNO
2NaCl
BaSO
SO
Na
BaCl
4
4
2
2
4
sól
3
sól
2
sól
1
sól
3.
2
sól
ek
wodorotlen
zasada
1
sól
2.
2
kwas
2
sól
1
kwas
1
sól
1.
OSAD
OSAD
OSAD

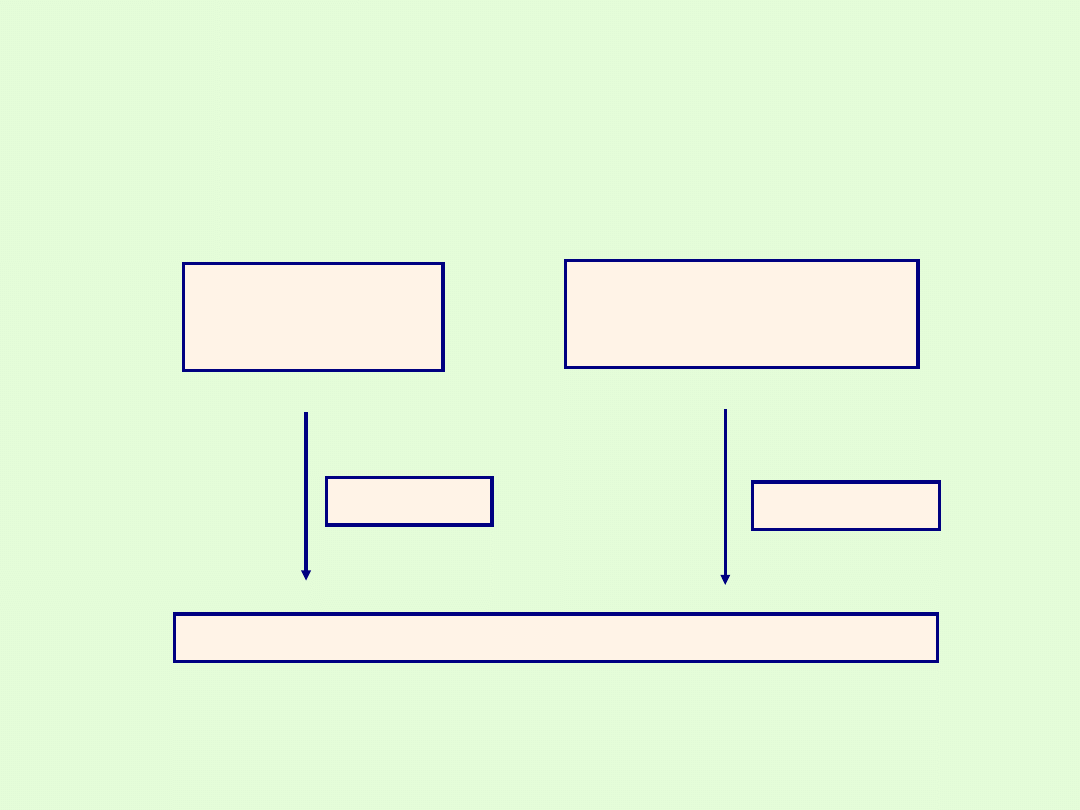
WAŻNIEJSZE METODY OTRZYMYWANIA SOLI
Sposób otrzymywania
Produkty
Uwagi
Metal +niemetal
Sól kwasu
beztlenowego
Tylko sole kwasów
beztlenowych
Metal +kwas
Sól + wodór
Tylko metale
aktywniejsze od wodoru i
kwasy nie utleniające
Tlenek metalu + kwas
Sól + woda
Wodorotlenek metalu
+kwas
Sól + woda
Reakcja zobojętniania.
Tlenek metalu +tlenek
niemetalu
Sól
Tylko dla soli kwasów
tlenowych
Zasada +tlenek
niemetalu
Sól + woda

Sposób
otrzymywania
Produkty
Uwagi
Kwas1 + sól1
Kwas2 +sól2
Działający kwas jest
mocniejszy niż kwas, z
którego powstała sól, lub
gdy w wyniku reakcji
powstaje osad.
Sól1 + wodorotlenek1
Sól 2 + wodorotlenek2
Te procesy, w których
powstaje osad
Sól1 + sól2
Sól3 + Sól4
Obie sole-substraty są
dobrze rozpuszczalne w
wodzie, a sól-produkt
strąca się jako osad
Metal1 + sól1
Metal2 + sól2
Metal mniej szlachetny
powoduje wydzielanie
metalu bardziej
szlachetnego z roztworu
jego soli.
Dla zainteresowanych
soda
Na
2
CO
3
soda oczyszczona
NaHCO
3
+ kwas
sól + woda + dwutlenek węgla
+ kwas
Wybrane sole
Węglan(IV) sodu
CaSO
4
* 2H
2
O
gips krystaliczny
prażenie-
H
2
O
+ H
2
O
twardnienie
gipsu
CaSO
4
* ½ H
2
O sypki
gips palony
Uwodniony siarczan(VI) wapnia
Węglan(IV) wapnia
CaCO
3
prażenie
wapno
palone CaO
-CO
2
+H
2
O
wapno
gaszone
Ca(OH)
2
Podczas nasycania wody wapiennej dwutlenkiem węgla początkowo
wytrąca się osad (woda wapienna mętnieje)
Ca(OH)
2
+ CO
2
→ CaCO
3
↓ + H
2
O
W trakcie dłuższego przepuszczania CO
2
rozpuszcza się.
CaCO
3
+ CO
2
+ H
2
O → Ca(HCO
3
)
2
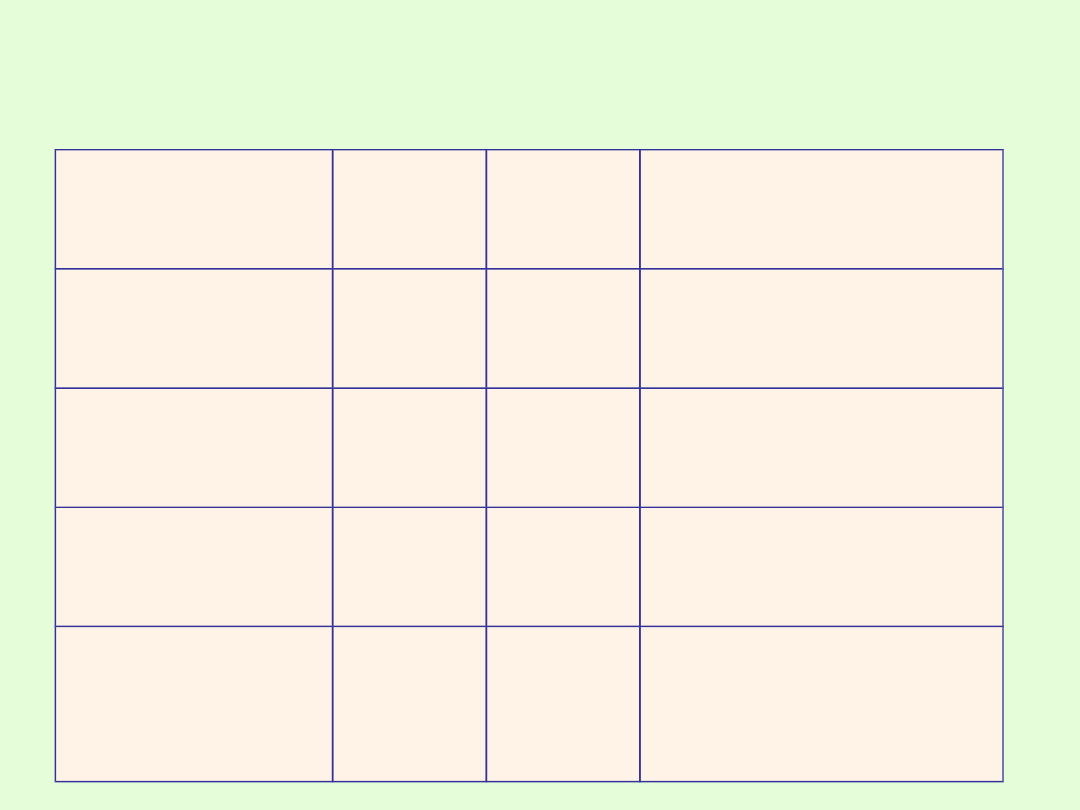
Nazwa
zwyczajowa
Nazwa
chemicz
na
Wzór
Zastosowanie
saletra
amonowa
azotan
(V)
amonu
NH
4
NO
3
nawóz, składnik
materiałów
wybuchowych
saletra
potasowa,
saletra indyjska
azotan
(V)
potasu
KNO
3
nawóz, składnik
czarnego prochu,
środek konserwujący
saletra sodowa,
saletra chilijska
azotan
(V)
sodu
NaNO
3
środek konserwujący
saletra
wapniowa,
saletra
norweska
azotan
(V)
wapnia
Ca(NO
3
)
2
nawóz
Ważniejsze azotany (V)

Bibliografia
Chemia - J. Kulawik, T. Kulawik, M. Litwin wyd. Nowa Era
Programu nauczania chemii autorstwa T. Kulawik i M. Litwin,
podręcznika „Chemia Nowej Ery1” napisanego przez J. Kulawika, T.
Kulawik, M. Litwin
www.uwec.edu/.../30October_files/image033.jpg
http://szkolne.eu/admin/produkty_pod/TAB_ROZPUSZCZALNOSCI.jpg
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
Wyszukiwarka
Podobne podstrony:
Sole wlasciwosci i otrzymywanie
Helowce – właściwości, otrzymywanie, występowanie(2)
sole spodoby otrzymywania, Chemia, Gimnazjum, kl2, Sole
Visual Basic Właściwości , Studia i nauka, Visual Basic
kartk sole reakcje otrzymywania
Otrzymywanie i?danie właściwości fizykochemicznych hydrolizatów skrobi 16
otrzymywanie i właściwości związków kompleksowych
Otrzymywanie i właściwości mydeł sprawozdanie
6 Tlenki azotu otrzymywanie, właściwości
Omów właściwości, odmiany, otrzymywanie i znaczenie najpopularniejszego pierwiastka na Ziemi czyli t
chemia, OTRZYM~1, SOLE:
8 - Warstwy Powierzchniowe O Specialnych Właściwościach, ZiIP, Semestr 2, Nauka o Materiałach z Elem
otrzymywanie weglowodorow, Nauka, Chemia
Metalurgia sciaga, Metalurgia - to nauka zajmująca się otrzymywaniem metali z rud, Ruda- utwory skal
3 - Struktura I Właściwosci Stali Po Obróbce Cieplno-Chemicznej, ZiIP, Semestr 2, Nauka o Materiałac
Sole (otrzymywanie), Chemia
Wpływ temperatury hartowania na strukturę i właściwości stali 40H, Nauka o materialach
Sole podwójne i związki kompleksowe. Preparatyka i właściwości, chemia nieorganiczna
8 - warstwy powierzchniowe o specjalnych wlasciwosciach, Politechnika Poznańska, Inżynieria Bezpiecz
więcej podobnych podstron