
WIEDZA O
ZWIERZĘTACH
LABORATORYJNYCH


ZWIERZĘTA LABORATORYJNE
• ZWIERZĘTA OKREŚLONEGO GATUNKU, KTÓRE
ZOSTAŁY WYHODOWANE W LICENCJONOWANYCH
HODOWLACH SPECJALNIE DO CELÓW
DOŚWIADCZALNYCH.
GATUNKI ZWIERZĄT UZNANE ZA DOŚWIADCZALNE
WYMIENIONE W KONWENCJI EUROPEJSKIEJ :
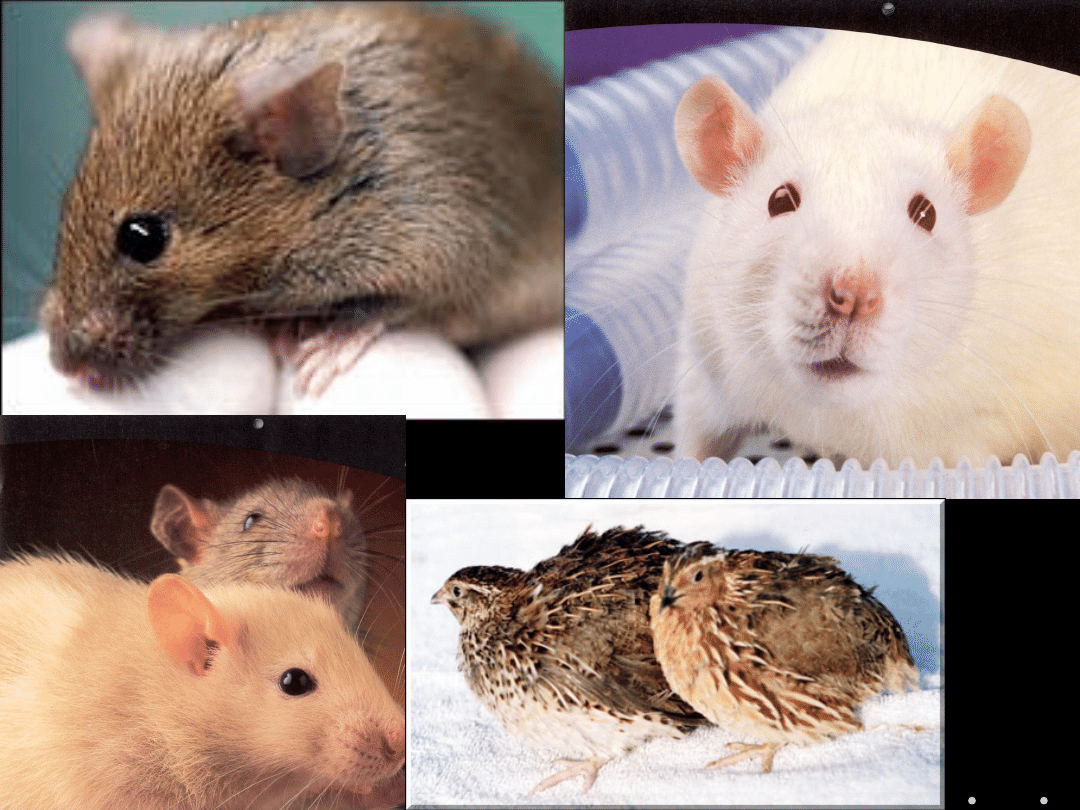
MYSZ, SZCZUR, ŚWINKA MORSKA, CHOMIK,
KRÓLIK, PIES, KOT, PRZEPIÓRKA JAPOŃSKA
/ inne gat. gryzoni, ssaki „wyższe” (małpy)/

ZWIERZĘTA LABORATORYJNE
Konwencja Europejska
• Zwierzęta muszą być „nabyte bezpośrednio lub [...]
pochodzić z zarejestrowanych ośrodków hodowlanych”
(art. 21, ust. 1)
• Konwencja zabrania używania do doświadczeń
bezpańskich zwierząt udomowionych
(art. 21, ust. 3)
• Statystyczne dane wykorzystania zwierząt muszą być
publicznie dostępne
(art. 27, ust. 1)

Rozwój ustawodawstwa o ochronie
zwierząt
• 1924 r. Anglia – pierwsza ustawa zawierająca
zasady ochrony zwierząt w związku
eksperymentowaniem na nich
• Polska 22.III.1928 r.
- rozporządzenie Prezydenta Rzeczpospolitej o
ochronie zwierząt, działające na mocy ustawy,
uzupełnione w 1959 r. rozporządzeniem
Ministra Szkolnictwa Wyższego
/
w całości
poświęcone zagadnieniom dokonywania
doświadczeń na zwierzętach/

– Stany Zjednoczone
• problemy doświadczeń na zwierzętach
laboratoryjnych unormowane od 1978 r. przez
Food and Drug Administration jako
postanowienia dobrej praktyki laboratoryjnej
(goog laboratory practice – GLP)
dotyczące badań nieklinicznych.
Przepisy stosowane w ramach
Europejskiego
Programu Badań
Biomedycznych.

Organizacje Międzynarodowe
– Międzynarodowy Komitet do Spraw Zwierząt
Laboratoryjnych ICLA 1956 r.
-
normy prawne eksperymentowania na zwierzętach
-
warunki utrzymania i hodowli zwierząt laboratoryjnych
-
sposób przeprowadzania doświadczeń
– Międzynarodowa Rada do Spraw Wiedzy o Zwierzętach
Laboratoryjnych -
ICLAS
1979 r.
– Europejska Konwencja w sprawie ochrony zwierząt
kręgowych, wykorzystywanych dla celów
doświadczalnych i innych celów naukowych
1986 r. Strasburg (11 państw założycieli Rady Europy)

USTAWA O OCHRONIE ZWIERZĄT
z dnia 21 sierpnia 1997 r.
Przepisy ogólne
Art. 1. 1.
Zwierzę, jako istota żyjąca, zdolna do odczuwania
cierpienia, nie jest rzeczą.
Człowiek jest mu winien poszanowanie, ochronę i
opiekę
.

Dziedziny, w których dopuszczalne
jest
wykorzystywanie żywych
zwierząt:
Konwencja Europejska (art. 2)
- zapobieganie chorobom i utracie
zdrowia ludzi i zwierząt
- edukacja chirurgiczna
(kształcenie i
szkolenie)
- fizjologiczne badania podstawowe
- ochrona środowiska
- badania naukowe
- medycyna sądowa (dochodzenia
sądowe)

Metody alternatywne
• Badania
epidemiologiczne
• Badania in vitro

Metody alternatywne
• Badania
epidemiologiczne
• Badania in vitro

EUTANAZJA ZWIERZĄT
DOŚWIADCZALNYCH
• EUTANAZJA
łagodna śmierć ; akt humanitarnego uśmiercenia
przy ograniczeniu do minimum bólu, strachu i
dyskomfortu

EUTANAZJA ZWIERZĄT
DOŚWIADCZALNYCH
• W laboratoriach i ośrodkach hodowlanych zwierzęta
uśmierca się z różnych powodów;
- na końcu doświadczenia lub, gdy mogą wystąpić
utrwalone niepożądane skutki;
- by uzyskać krew lub inne tkanki w celach
badawczych;
- kiedy ból, dyskomfort i cierpienie zbliżają się do
niedopuszczalnego poziomu;
- gdy zagrożone jest zdrowie lub dobrostan
zwierząt;
- kiedy nie są one dłużej zdolne do rozmnażania;
- gdy dana grupa zwierząt nie posiada
wymaganych cech, np. odpowiedniej płci

PODSTAWOWE KRYTERIA WYBORU METOD
EUTANAZJI
I ZACHOWANIA DOBROSTANU ZWIERZĄT:
- należy stosować taką metodę, która pozwala na
zminimalizowanie bólu
- błyskawiczne osiągnięcie nieprzytomności i śmierci
- ograniczenie do minimum braku swobody i
zdenerwowania zwierzęcia
- wybrana metoda powinna być odpowiednia do
wieku, gatunku i stanu zdrowia zwierzęcia
- ograniczać do minimum niepokój i fizjologiczny stres
- wybrana metoda powinna być skuteczna,
powtarzalna, nieodwracalna, łatwa w wykonaniu (w
niewielkich dawkach, jeśli to możliwe)
- bezpieczna dla osób wykonujących zabieg oraz
akceptowana z estetycznego punktu widzenia

CHARAKTERYSTYKA METOD EUTANAZJI
- Szybkość
- Skuteczność
- Łatwość wykonania
- Bezpieczeństwo personelu
- Ocena estetyczna
++ do przyjęcia + do przyjęcia przez większość osób
- nie do przyjęcia przez wiele osób
- Ocena ogólna
:
1 - 5 , przy czym 5 wysoce zalecana

EUTANAZJA ZWIERZĄT DOŚWIADCZALNYCH
ROZPOZNANIE I POTWIERDZENIE ŚMIERCI
-
zatrzymanie akcji serca i oddychania
-
brak odruchów
oraz u małych zwierząt laboratoryjnych,obniżenie
temperatury ciała poniżej 25
0
C

EUTANAZJA ZWIERZĄT DOŚWIADCZALNYCH
PODSTAWOWE MECHANIZMY WYWOŁANIA ŚMIERCI
1
BEZPOŚREDNIE LUB POŚREDNIE NIEDOTLENIENIE
2
BEZPOŚREDNIA BLOKADA FUNKCJI OŚRODKÓW
NERWOWYCH
ODPOWIEDZIALNYCH ZA CZYNNOŚCI
ŻYCIOWE
3
FIZYCZNE ZATRZYMANIE AKTYWNOŚCI MÓZGU ORAZ
ZNISZCZENIE OSRODKÓW NERWOWYCH
KONTROLUJĄCYCH
CZYNNOŚCI ŻYCIOWE
( Andrews i wsp. 1993, Lumb i Jones
1984 )

• PRZYTOMNOŚĆ
stan świadomości zwierzęcia, w którym może ono
odbierać bodźce ze środowiska zewnętrznego i
odpowiadać na nie normalnym zachowaniem,
typowym dla przytomnego osobnika
• BRAK PRZYTOMNOŚCI
stwierdzenie braku wrażliwości na bodźce
zewnętrzne, tak jak obserwuje się to w przypadku
śpiączki lub podczas znieczulenia ogólnego.
• Brak wrażliwości - to zarówno brak reakcji
fizycznej na stosowane bodźce, jak i brak reakcji
ze strony ośrodkowego układu nerwowego.

• BÓL
“negatywne odczucie, które wyzwala obronne
reakcje ruchowe, prowadzi do wyuczonego
unikania i może modyfikować gatunkowo swoiste
sposoby zachowania, włącznie z zachowaniem
socjalnym” (Zimmermann 1986)
Ból - dotyczy przytomnej reakcji na bodziec, a nie
odruchowej reakcji nieprzytomnego organizmu.

Oznaki bólu i stresu
• zależnie od gatunku są to następujące
objawy:
- wydawania odgłosów charakterystycznych dla
stanu niepokoju
(nie zawsze w zakresie dźwięków
odbieranych przez człowieka),
- walczenie,
- próby ucieczki,
- obronna lub ukierunkowana agresja,
- zastygnięcie w bezruchu,
- dyszenie,

Oznaki bólu i stresu
- ślinotok,
- oddawanie moczu, kału lub opróżnianie
torebek odbytniczych,
- rozszerzenie źrenic,
- częstoskurcz serca,
- pocenie się
- odruchowe skurcze mięśni szkieletowych
powodujące dreszcze lub inne reakcje
spazmatyczne
.


MAKROKLIMAT I MIKROKLIMAT
–
PORY ROKU
– TEMPERATURA
- gatunkowa strefa obojętności cielnej tzn.
zakres temperatury, w którym wytwarzanie i
oddawanie ciepła jest optymalne
/gryzonie labor. 20 – 22
o
C (+ 2
o
C)/
- zależność między temperaturą otoczenia a:
- toksycznością preparatów
- czasem trwania reakcji zwierząt
- efektem działania preparatów

MAKROKLIMAT I MIKROKLIMAT
– OŚWIETLENIE
Regulacja doby świetlnej w stały, zwykle 12-
godzinny rytm dzienno-nocny
– WILGOTNOŚĆ
Optymalna wilgotność pomieszczeń – ok. 55%
wilgotności względnej (+5%)
– CIŚNIENIE
– SKŁAD POWIETRZA
– ZAPACH
– DŹWIĘKI

PODSTAWOWE ELEMENTY PRAWIDŁOWEGO
ŻYWIENIA
Człowiek i większość zwierząt
skład pokarmu
jakość
urozmaicenie
Zwierzęta laboratoryjne
skład pokarmu
jakość
standaryzacja
ZASADY ŻYWIENIA

Standaryzacja diety
maksymalne ujednolicenie składników diet stosowanych w
żywieniu zwierząt laboratoryjnych
w skład diet mogą wchodzić tylko surowce paszowe, których skład podlega
najmniejszym sezonowym wahaniom i mogą być stosowane niezależnie od
pory roku i szerokości geograficznej, możliwie we wszystkich hodowlach,
laboratoriach i ośrodkach badawczych na świecie.
Brak urozmaicenia wyrównany przez wysoką wartość
pokarmową standaryzowanych diet
ZASADY ŻYWIENIA
ZASADY ŻYWIENIA
Diety dla zwierząt laboratoryjnych
DIETA
STANDARDOWA
(standard diet)
DIETA „CZYSTA”
(purifed diet)
DIETA CHEMICZNIE
ZDEFINIOWANA
(defined diet)
Z naturalnych
surowców paszowych
Półsyntetyczna z
surowców
oczyszczonych jak np.
kazeina, sacharoza
celuloza, gluten
pszenny itp.
Z chemicznie czystych ściśle
zdefiniowanych składników
np. aminokwasy, kwasy
tłuszczowe itp.
Klasyfikacja wg FDA (Food and Drug Administration) –
„zasady dobrej praktyki laboratoryjnej” – GLP

WYMAGANIA POKARMOWE
1.
Wszystkożerne – myszy, szczury, chomiki
2.
Roślinożerne – świnki morskie, króliki
3.
Mięsożerne – koty, psy
ZAPOTRZEBOWANIE POKARMOWE
–
BYTOWE
–
zwierzęta po zakończonym okresie wzrostu i rozwoju,
nie użyte do rozpłodu
–
HODOWLANE
–
zwierzęta młode, w okresie wzrostu; samice w
okresie ciąży i
laktacji; samce użyte do krycia
ZASADY ŻYWIENIA

ZASADY ŻYWIENIA
WODA
Przeciętne zużycie wody przez zwierzęta różnych gatunków
(wg Kohler et al. 1978)
GATUNEK
ZUŻYCIE WODY w ml / szt. / dzień w okresie
wzrostu
dojrzałości
Myszy
Szczury
Chomiki
Świnki
morskie
Króliki
Psy
Koty
3,0 – 10,0
5,0 – 80,0
8,0 – 10,0
100,0 – 250,0
100,0 – 400,0
ok. 30,0 / kg ciężaru
ciała
200,0 – 300,0
ok. 7,0
ok. 30,0
ok. 10,0
ok. 250,0
300,0 – 400,0
ok. 30,0 / kg ciężaru
ciała
ok. 300,0

PRZYGOTOWANIE ZWIERZĄT DO
DOŚWIADCZEŃ
– TRANSPORT
– ADAPTACJA
– DOBÓR ZWIERZĄT DO GRUP DOŚWIADCZALNYCH
- zminimalizowana zmienność między grupami
- zmienność w każdej grupie odpowiada
zmienności
w obrębie danej populacji (stada lub szczepu)

METODA TWORZENIA GRUP
DOŚWIADCZALNYCH
–
PRZYPADKOWA
–
LOSOWA
np. przy użyciu tabel liczb losowych - biometria
– SELEKCYJNA
Metoda doboru “genetycznie zbalansowanych
osobników”

WYTYCZNE OECD DO BADAŃ SUBSTANCJI
CHEMICZNYCH
- TOKSYCZNOŚĆ OSTRA
- TOKSYCZNOŚĆ KRÓTKOTERMINOWA PRZY
POWTARZALNYM DAWKOWANIU I PODPRZEWLEKŁA
- DZIAŁANIE MIEJSCOWE NA SKÓRĘ I OKO
- UCZULENIE ALERGICZNE
- TOKSYCZNOŚĆ ROZRODU
- ROZRÓD, PŁODNOŚĆ, TERATOGENNOŚĆ
- RAKOTWÓRCZOŚĆ
- TOKSYCZNOŚĆ PRZEWLEKŁA
- ŁĄCZNA TOKSYCZNOŚĆ PRZEWLEKŁA /
RAKOTWÓRCZOŚC
- TOKSYKOKINETYKA I METABOLIZM

WYTYCZNE OECD DO BADAŃ SUBSTANCJI
CHEMICZNYCH
• WARUNKI BADAŃ TOKSYCZNOŚCI
- WYBÓR ZWIERZĄT DOŚWIADCZALNYCH
- OPIEKA NAD ZWIERZĘTAMI
- LICZBA I WIELKOŚĆ GRUP
CZYNNIKI WPŁYWAJĄCE NA WYNIK
DOŚWIADCZENIA
CZYNNIKI ŚRODOWISKOWE
GENOTYP
FENOTYP
PRZYGOTOWANIE
DRAMATYP
METODYKA
DO DOŚWIADCZEŃ
DOŚWIADCZEŃ
WYNIKI DOŚWIADCZENIA

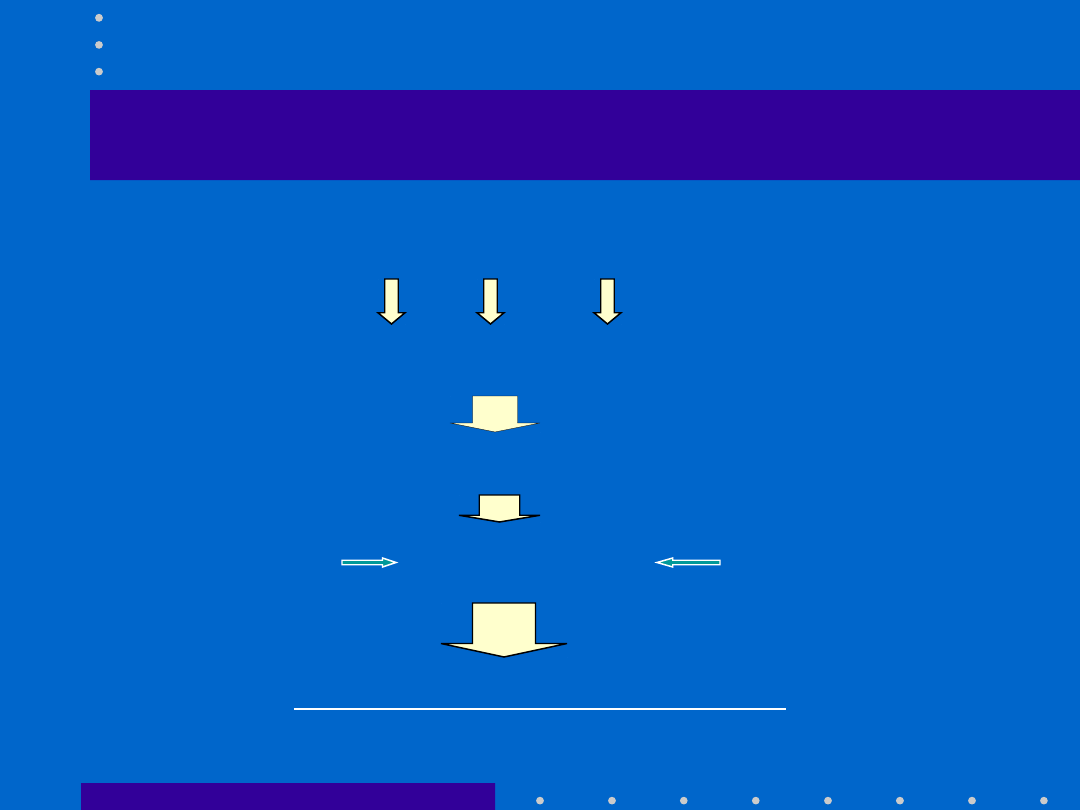
CZYNNIKI WPŁYWAJĄCE NA WYNIK DOŚWIADCZENIA
• Standaryzacja czynników środowiskowych dotyczy :
- metod i warunków hodowli zwierząt
doświadczalnych;
- okresu przygotowawczego do eksperymentu;
- metod i technik eksperymentalnych.
• Zwierzęta o ujednoliconym dramatypie
defined laboratory animals
– zwierzęta o ustalonej charakterystyce hodowane
pod stałą kontrolą genetyczną i zdrowotną, w ściśle
określonych warunkach środowiskowych


SKALA INWAZYJNOŚCI BADAŃ NA ŻYWYCH
KRĘGOWCACH
Przy określaniu stopnia inwazyjności należy uwzględnić
• Gatunek zwierzęcia
( poziom organizacji kognitywnej i
emocjonalnej)
– różna tolerancja tych samych procedur przez różne gatunki
• Zastosowanie humanitarnego zakończenia
(humane
endpoints)
• Możliwość kompensacji cierpień w przypadku
inwazyjnych doświadczeń, po których zwierzęta mają
pozostać przy życiu

SKALA INWAZYJNOŚCI BADAŃ NA ŻYWYCH
KRĘGOWCACH
•
STOPIEŃ
1
Procedury nieinwazyjne
•
STOPIEŃ
2
Procedury powodujące lekki chwilowy ból, stres lub
długotrwały lekki dyskomfort
•
STOPIEŃ
3
Procedury powodujące umiarkowany ból/stres
•
STOPIEŃ
4
Procedury powodujące silny ból/stres i zwykle
nieodwracalne uszkodzenie ciała i funkcji psychicznych
•
STOPIEŃ
X
Niedopuszczalne procedury powodujące skrajne
cierpienia


HODOWLA ZWIERZĄT LABORATORYJNYCH
HODOWLA
ZWIERZĄT
polega na dwóch podstawowych działaniach:
selekcji
i
doborze
osobników do kojarzeń,
Genetycznym efektem są zmiany w częstości
występowania określonych genów i genotypów w
populacji, w wyniku czego powstają nowe
szczepy,
rasy, stada i mieszańce
.

HODOWLA ZWIERZĄT LABORATORYJNYCH
• POKREWIEŃSTWO
prawdopodobieństwo posiadania takiego samego
genotypu przez osobniki mające wspólnych
przodków.
• WSOBNOŚĆ
współczynnik wsobności (inbredu) –
prawdopodobieństwo homozygotyczności
potomka wynikające z faktu pokrewieństwa
rodziców.

HODOWLA ZWIERZĄT LABORATORYJNYCH
• SZCZEP WSOBNY ( inbred )
grupa zwierząt reprezentujących jeden gatunek,
charakteryzujących się jednorodnością genotypową i
homozygotycznością.
“Szczep może być uważany za wsobny (inbred), jeśli był
hodowany systemem kojarzenia brata z siostrą przez 20
następujących po sobie pokoleń (F 20). Szczep tworzy linię
złożoną z pojedynczych rodzicielskich par hodowlanych,
obejmującą przynajmniej 20 kolejnych pokoleń.
Kojarzenia rodzic x potomek mogą zastąpić kojarzenia
brat x siostra pod warunkiem, że będzie do nich użyty
młodszy z dwojga rodziców.”
wg Committee on Standarized Genetic Nomenclature For Mice z
1994 r.

HODOWLA ZWIERZĄT LABORATORYJNYCH
• STADO NIEKREWNIACZE ( outbred )
populacje złożone z osobników o różnych genotypach
stado każdego gatunku ssaków laboratoryjnych
hodowane co najmniej przez 4 pokolenia w
zamkniętej populacji z maksymalnym unikaniem
kojarzeń krewniaczych.
Rejestracja i symbol*) możliwe tylko wtedy, kiedy system kojarzeń
gwarantuje utrzymanie zmienności biologicznej stada przez szereg lat
na takim samym poziomie.

HODOWLA ZWIERZĄT LABORATORYJNYCH
Za stado uważać można:
– uprzednio wsobny szczep po 4 pokoleniach hodowli
systemem kojarzeń z unikaniem pokrewieństwa
– mieszańce F
1
dwóch różnych szczepów wsobnych
– “syntetyczne”, heterozygotyczne populacje pochodzące
z mieszańców F
1
, względnie segregujące mieszańce F
2
,
pod warunkiem, że będą stale odtwarzane z
wyjściowych szczepów wsobnych.
Niedopuszczalne jest prowadzenie jakiejkolwiek kierunkowej selekcji.

HODOWLA ZWIERZĄT LABORATORYJNYCH
P
opulacje
mozaikowe
- złożone z osobników pochodzących zarówno ze
wsobnych szczepów,
jak i ich mieszańców F
1
w określonej proporcji.
Inne modele genetyczne
–
koizogeniczne
– linie szczepów wsobnych różniące się jednym
zmutowanym genem
–
kongeniczne
– różnią się krótkim odcinkiem jednego chromosomu,
–
konsomiczne
– przeniesienie całego chromosomu (X lub Y) na tło
genetyczne innego szczepu wsobnego
–
konplastyczne
– powtarzane krzyżowanie wsteczne w celu
wprowadzenia
genomu jądrowego pochodzącego z
jednego szczepu
wsobnego na tło cytoplazmatyczne innego
szczepu
–
transgeniczne

ZASADY OZNACZANIA STANU ZDROWOTNEGO
ZWIERZĄT LABORATORYJNYCH
Zwierzęta laboratoryjne, u których występują
łatwo wykrywalne objawy chorobowe oraz
bezobjawowi nosiciele zakażeń patogennych nie
nadają się do doświadczeń, szczególnie
doświadczeń biomedycznych.
Kategoryzacja zwierząt laboratoryjnych opracowana
przy udziale organizacji międzynarodowych:
WHO - World Health Organization, FAO - Food and
Agriculture Organization, ILAR - Institute for Laboratory
Animal Resources, ICLAS - International Council for
Laboratory Animal Science

STATUS HIGIENICZNY ZWIERZĄT LABORATORYJNYCH
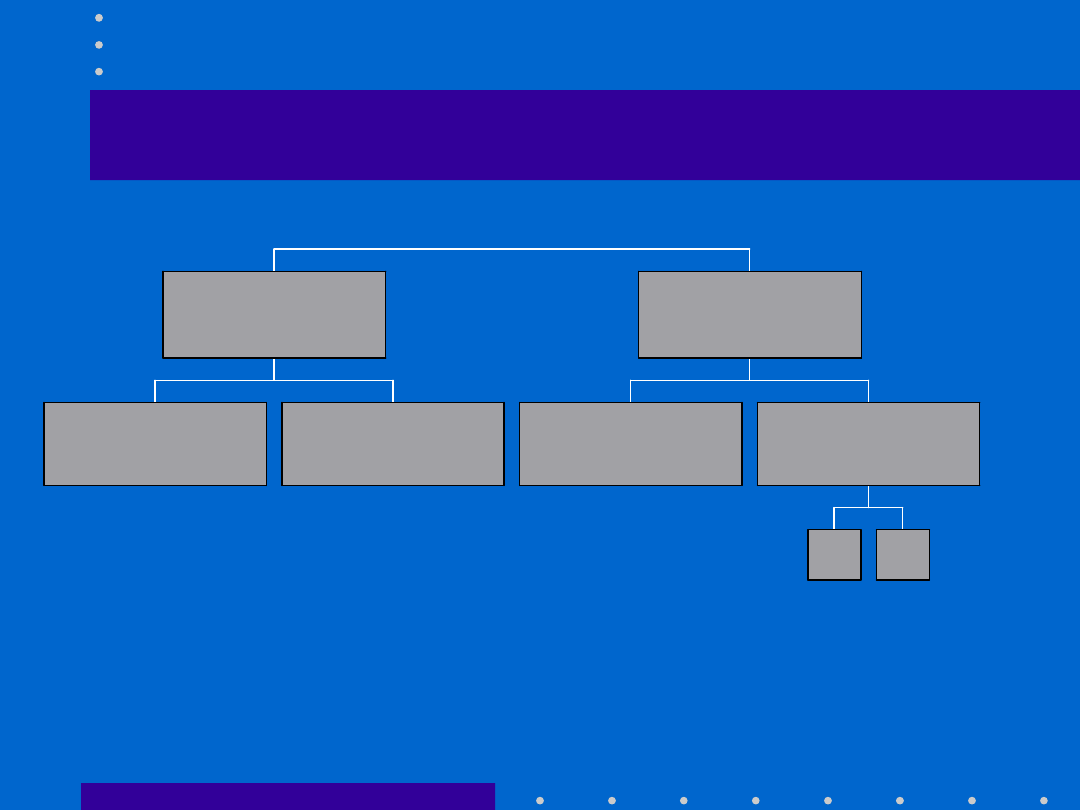
G F
M O N O - D I- P O L IB IO N T Y
Z W IE R Z Ę T A
G N O T O B IO T Y C Z N E
S P F
C V I
C V II
K O N W E N C J O N A L N E
C V
Z W IE R Z Ę T A
A G N O T O B IO T Y C Z N E

STATUS HIGIENICZNY ZWIERZĄT LABORATORYJNYCH
•
GNOTOBIOTYCZNE
GNOTOBIOTYCZNE
–
GF
(germ free)
wolne od wszystkich wykrywalnych
mikroorganizmów i pasożytów
–
MONO-, DI-, POLIBIONTY
zwierzęta GF celowo zasiedlone
jednym, dwoma lub wieloma określonymi
rodzajami mikroorganizmów

STATUS HIGIENICZNY ZWIERZĄT LABORATORYJNYCH
•
AGNOTOBIOTYCZNE
AGNOTOBIOTYCZNE
–
zwierzęta
SPF
(Specified Pathogen
Free)
–
zwierzęta konwencjonalne
•CV I
-
kontrolowane
,
utrzymywane
w warunkach częściowej izolacji
(semi barrier condition)
•CV
-
hodowla otwarta

PROGRAM KONTROLI ZDROWIA ZWIERZĄT
LABORATORYJNYCH
UWZGLĘDNIANE CZYNNIKI
• Kategoria zdrowotna i warunki hodowli zwierząt
• Rodzaj doświadczeń, do których będą służyły
zwierzęta
• Stopień zagrożenia przeniesienia infekcji z innych
populacji gryzoni
• Przewidywana rola danych patogenów w
określonym doświadczeniu
• Względy ekonomiczne
• Zaplecze techniczne - możliwość zastosowania
określonych technik diagnostycznych

MONITOROWANIE ZDROWIA ZWIERZĄT LABORATORYJNYCH
• KONTROLA WIRUSOLOGICZNA
metody serologiczne - test ELISA, test
immunofluorescencji
(IFA), test zahamowania
hemaglutynacji (HI), metody
biochemiczne i
molekularne
• KONTROLA BAKTERIOLOGICZNA
posiewy z wybranych narządów, badania
histopatologiczne
• KONTROLA PARAZYTOLOGICZNA
metody mikroskopowe, test ELISA i PCR
• KONTROLA MYKOLOGICZNA
• BADANIA ANATOMOPATOLOGICZNE

KONTROLA GENETYCZNA ZWIERZĄT
LABORATORYJNYCH
• MONITOROWANIE GENETYCZNE NA PODSTAWIE
MARKERÓW CECH JAKOŚCIOWYCH
– MARKERY IMMUNOLOGICZNE
- najczęściej stosowane są
antygeny zgodności tkankowej, kodowane przez geny głównego
kompleksu zgodności tkankowej MHC oraz antygeny zróżnicowania
limfocytów
– MARKERY BIOCHEMICZNE
– izoenzymy i białka
nieenzymatyczne kodowane przez polimorficzne, strukturalne
geny
– MARKERY CYTOGENETYCZNE
– MARKERY MORFOLOGICZNE -
geny umaszczenia
– MARKERY MIKROSATELITARNE
w kontroli genetycznej zwierząt
szczepowych

• MONITOROWANIE GENETYCZNE NA PODSTAWIE
ANALIZY CECH ILOŚCIOWYCH
– WSKAŹNIKI MORFOMETRYCZNE I REPRODUKCYJNE
• czas od skojarzenia do wydania pierwszego miotu
• odstępy czasowe między kolejnymi miotami
• liczba urodzonych młodych
• liczba odchowanych młodych
(dane do określenia wskaźników
reprodukcyjnych)
• wskaźniki osteomertryczne
– pomiary żuchwy, czaszki, kości udowej


Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
Wyszukiwarka
Podobne podstrony:
immunoprofilaktyka chorób zakaźnych zwierząt, Studia - materiały, Zwierzęta laboratoryjne
Zwierzęta laboratoryjne i procedury doświadczalne
IMMUNOPROFILAKTYKA CHOR B ZAKA NYCH ZWIERZ T, far, II rok III sem, zwierzęta laboratoryjne, z poprze
Zaliczenie 2014, far, II rok III sem, zwierzęta laboratoryjne
zaliczenie ze zwierząt(1), far, II rok III sem, zwierzęta laboratoryjne, z poprzednich lat
WIEDZA O ZWIERZETACH LABORATORYJNYCH mini, far, II rok III sem, zwierzęta laboratoryjne, z poprzedni
Zwierzęta laboratoryjne i procedury doświadczalne, far, II rok III sem, zwierzęta laboratoryjne, z p
zwierzęta, far, II rok III sem, zwierzęta laboratoryjne, z poprzednich lat
Zwierzęta laboratoryjne
Hodowla i użytkowanie zwierząt laboratoryjnych
zwierzeta laboratoryjne
Wykaz zwierzat laboratoryjnych hodowanych w Polsce
Nazewnictwo najczęściej używanych modeli zwierząt laboratoryjnych
WIEDZA O ZWIERZĘTACH LABORATORYJNYCH (Naprawiony)
Laboratorium 2 - Instrukcja - Obserwacja komorek zwierzecych w mikroskopie swietlnym, Semestr II, bi
Biologia komórki, Laboratoria,$ 11 2011 fizjologia zwierząt
Diagnostyka laboratoryjna chorob watroby u zwierzat
Diagnostyka laboratoryjna chorób wątroby u zwierząt
więcej podobnych podstron