
ODNAWIALNE ELEKTROCHEMICZNE
I EKOLOGICZNE ŹRÓDŁA ENERGII
ELEKTRYCZNEJ
Aleksandra Madaj
Zakład fizyki kwantowej
1
1. WPROWADZENIE
Konwencjonalne i odnawialne źródła energii,
Klasyfikacja generalna
1.1. Konwencjonalne, nieodnawialne źródła energii
Do
konwencjonalnych, nieodnawialnych źródeł
energii zalicza się te, które od wieków
wykorzystywane są przez ludzkość:
-węgiel kamienny i brunatny,
-ropa naftowa ze źródeł naturalnych,
-gaz ziemny ze źródeł naturalnych,
-paliwa jądrowe rozszczepiania,
-paliwa jądrowe syntezy.
Produktami spalania są tlenki węgla, siarki, azotu,
fosforu,popioły i szlamy odpadowe, odpady
radioaktywne
.
2

1.2. Odnawialne, ekologicznie przyjazne źródła
energii
Intensywne prace badawcze i ich szybka aplikacja pozwala
dzisiaj na wykorzystanie następujących naturalnych źródeł
energii:
-
energia wiatrów,
-energia słoneczna
,
-energia fal morskich,
-energia pływów morskich
– źródło w Polsce niemożliwe
do
wykorzystania: różnica poziomów pływów Bałtyku
nie
przekracza 30 cm,
-energia skorupy ziemskiej,
-energia pobierana ze źródeł geotermalnych,
-energia wód rzecznych
– elektrownie wodne i młyny
wodne
wszelkich typów,
-
energia powstająca w wyniku fermentacji biomasy i
bioodpadów, wykorzystanie produktów fermentacji
(metan) w ogniwach paliwowych lub systemach
grzewczych,
3

DYREKTYWA UNII EURPOEJSKIEJ NR 2001/77/EC
1. Promocja produkcji energii elektrycznej produkowanej
w krajowej
gospodarce energetycznej;
2. Podwyższenie do 22% udziału energii elektrycznej ze
źródeł odnawialnych w roku 2010 z obowiązkiem
zakupu energii z tego typu źródeł;
3. Stworzenie prawnych i organizacyjnych podstaw
rozwiązania tych problemów we wszystkich krajach
UE;
4. Organizacja systemów ochrony środowiska przed
niekorzystnym działaniem eksploatowanych
klasycznych źródeł energii.
4

1.3. ZADANIA DLA CHEMIKÓW,
ELEKTROCHEMIKÓW, TECHNOLOGÓW I
NANOTECHNOLOGÓW
1. Polepszanie pracy istniejących i opracowanie
nowych,
wydajnych i ekologicznie przyjaznych:
a) baterii elektrochemicznych i akumulatorów;
b) ogniw paliwowych z wykorzystaniem produktów
przetwarzania biomasy;
c) ogniw fotowoltaicznych (dawna nazwa:
fotoogniwa);
do bezpośredniego przetwarzania energii
słonecznej;
d) układów fotoelektrochromowych w sprzężeniu
z ogniwami fotowoltaicznymi i systemami
klimatyzacji
różnego typu;
e) konwertorów promieniowania słonecznego na
energię
termiczną
5

1.4. OGNIWA GALWANICZNE I POTENCJAŁY ELEKTROD.
AKUMULATORY
1.4.1. DEFINICJE PODSTAWOWE
OGNIWO ELEKTROCHEMICZNE (galwaniczne) wykonuje pracę
elektryczną kosztem zmiany energii układu zachodzącej w
wyniku
przemian chemicznych lub w wyniku zmian stężenia
roztworów
elektrolitów. Układ taki składa się z dwóch półogniw
zbudowanych
z elektrod metalicznych zanurzonych w odpowiednich
roztworach
elektrolitów. Bez połączenia zewnętrznego metali
elektrod
obydwu półogniw przebieg procesu jest niemożliwy
6

W ogniwie muszą być spełnione kryteria
odwracalności zachodzących reakcji redox.
Zarówno odwracalności materiałowej jak i odwracalności
energetycznej. Równocześnie zakłada się, że żadne
inne procesy nie mają wpływu na przebieg procesu po
zewnętrznym połączeniu półogniw
.
John F. DANIELL (1790 – 1845) King’s College,
London;
Jako pierwszy zaproponował ogniwo elektrochemiczne;
-po raz pierwszy zastosował klucz elektrolityczny;
-po raz pierwszy zastosował diafragmę do rozdzielenia
elektrolitów
.
7

1.4.2. OGNIWO DANIELLA (U = 1,23 V )
Schemat budowy ogniwa Daniella:
2e
Cu Cu
2+
¦¦
Zn
2+
Zn
SO
4
2-
Zachodzące procesy elektrodowe:
1) Anodowe utlenianie cynku
Zn
0
(stały)
Zn
2+
+ 2e
(1.1)
I dyfuzja jonów cynku od powierzchi elektrody w głąb
roztworu
8

2) Katodowa redukcja jonów Cu
2+
:
Cu
2+
+ 2e Cu
0
(1.2.)
W półogniwach zachodzą zatem dwa procesy
dodatkowe:
-na elektrodzie cynkowej : roztwarzanie się płytki
anodowej;
-w przestrzeni katodowej : zmniejsza się stężenie jonów
Cu
2+
w roztworze na skutek osadzania
się
metalicznej miedzi.
Tym samym w obydwu półogniwach zachodzą
nieodwracalne
procesy DEPOLARYZACJI ELEKTROD prowadzące do
zrównania
potencjałów termodynamicznych ogniwa i tym samym
do ustania
jego pracy
9

Dla uniknięcia ewentualnych niejasności co do znaków
przypisywanych elektrodom - przyjęto jako
podstawową zasadę określania znaku i wartości
potencjałów elektrod obydwu półogniw wobec
standardowej elektrody wodorowej w ogniwach:
(A) półogniwo: (Pt) H
2
H
+
¦¦ Zn
2+
Zn
reakcja anodowa:
Zn
0
(stały)
Zn
2+
+ 2e
(1.3.)
reakcja KATODOWA:
2H
3
O
+
+ 2e H
2(gaz)
+ 2H
2
O
(1.4.)
(B) Półogniwo Cu Cu
2+
¦¦ H
+
H
2
(Pt)
reakcja ANODOWA:
H
2(gaz)
+ 2 H
2
O 2 H
3
O
+
+ 2e
(1.5.)
reakcja katodowa:
Cu
2+
+ 2e Cu
0
(stały)
(1.6.)
10

Warto w tym miejscu przypomnieć różnice pomiędzy
pojęciami:
siła elektromotoryczna ogniwa (SEM) lub E
oraz
napięcie ogniwa na zaciskach (U):
Siła elektromotoryczna ogniwa
jest definiowana jako
różnica potencjałów na zaciskach ogniwa w warunkach
bezprądowych
,
to znaczy, że albo obwód jest otwarty,
albo opór obwodu zewnętrznego jest nieskończenie
wielki.
Napięcie na zaciskach ogniwa definiuje równanie:
U = E - E
k
- E
a
- Ir
wewn
.
(1.7.)
gdzie: E – teoretyczna siła elektromotoryczna ogniwa;
| E
k
|, |
E
a
| - polaryzacja katody i anody;
Ir
wewn.
– spadek napięcia na oporności
wewnętrznej
wynikającej m.in. z
oporności elektrolitu.
11

1.4.3. Ogniwo Leclanche’go (U = 1,50 V )
Jest to tzw. „suche ogniwo”, swego czasu
bardzo popularne (bateryjka 1,5 V), o budowie:
Zn | ZnCl
2
¦¦ NH
4
Cl ¦¦ MnO
2
| Grafit
< pasta krochmalowa >
Przebieg reakcji elektrodowych:
Anoda:
Zn
(stały)
Zn
2+
+ 2e
(1.8.)
Katoda:
MnO
2(stały)
+ Zn
2+
+ 2e ZnMn
2
O
4
(1.9.)
Reakcja sumaryczna:
Zn
(stały)
+ 2MnO
2(stały)
ZnMn
2
O
4(stały)
(1.10)
Praca ogniwa Leclanche jest stosunkowo
krótkotrwała
12

1.5. Ogniwo cynkowo-rtęciowe ( U = 1,34 V )
Budowa ogniwa:
Zn | KOH ¦¦ HgO | C
O sumarycznej reakcji elektrodowej:
Zn + HgO + 2 KOH K
2
ZnO
2
+ H
2
O + Hg
(1.11)
Jest to ogniwo, które można budować w postaci
zminiaturyzowanej. Obecnie ze względów
ekologicznych zamyka się produkcję tego typu
ogniw ze względu na
Toksyczne odpady rtęci !!
13

1.7. AKUMULATOR OŁOWIOWY (U = 2,23 V)
Jest to obecnie najbardziej popularne
odnawialne
źródło prądu elektrycznego o budowie:
Pb | H
2
SO
4
| PbO
2
| Pb
Przebieg reakcji elektrodowych:
ANODA:
Pb
(staly)
+ HSO
4
-
+ H
2
O PbSO
4(stały)
+2e + H
3
O
+
(1.12.)
KATODA:
PbO
2(stały)
+ HSO
4
-
+ 3 H
3
O
+
+ 2e PbSO
4stały)
+ 5 H
2
O
(1.13.)
Skąd wynika sumaryczna reakcja rozładowania –
ładowania:
rozładowanie
Pb + PbO
2
+ 2 H
2
SO
4
2 PbSO
4
+ 2 H
2
O
(1.14.)
ładowanie
14

Produkcja akumulatorów ołowiowych
zużywa ponad 60% światowej produkcji
metalicznego ołowiu mimo dobrze
opracowanego systemu regeneracji
zużytych akumulatorów.
WADĄ podstawową akumulatora
ołowiowego jest jego
wysoki ciężar.
Pozostałe mankamenty pierwotnej
konstrukcji akumulatora ołowiowego
udało się wyeliminować
i
przedłużyć jego pracę
. Zastosowano
kompozycje elektrolitu zawierające
odpowiednie inhibitory, poprawiono
obudowę i zaciski poboru prądu. Ale
przede wszystkim zmieniono system
ładowania: zamiast prądnicy prądu stałego
wprowadzono alternator, czyli prądnice
prądu zmiennego z przetwornicą.
15

1.8. AKUMULATOR ŻELAZOWO –
NIKLOWY
(U = 1,40 V)
Akumulator ten nosi również nazwę
akumulatora Edisona lub też NIFE.
Thomas Alva Edison (1847 – 1931) –
genialny samouk był wynalazcą i
właścicielem ponad stu patentów.
Powiadał on :
JEŚLI CZEGOŚ NIE MOŻNA SPRZEDAĆ,
TO NIE WARTO O TYM MYŚLEĆ
Akumulator zasadowy NIFE ma budowę:
Fe | KOH | NiOOH | Ni
16
Sumaryczna reakcja elektrodowa ma postać
rozładowanie
Fe + 2 NiOOH + 2 H
2
O
2Ni(OH)
2
+
Fe(OH)
2
(1.15.)
ładowanie
Wykorzystane tego akumulatora, przeważnie w
jego zminiaturyzowanej formie, jest ogromne,
m.in. do zasilania przenośnych urządzeń
elektronicznych, zegarów, itp..
No i proszę, stary Thomas Alva miał rację !!
17

1.9. AKUMULATOR KADMOWO – NIKLOWY
(U = 1,35 – 1,40 V)
Akumulator ten ma budowę:
Cd | KOH | NiOOH | Ni
i przebiega w nim sumaryczna reakcja
elektrodowa:
rozładowanie
Cd + 2 NiOOH + 2 H
2
O 2 Ni(OH)
2
+
Cd(OH)
2
(1.16)
ładowanie
ZE WZGLĘDU NA RAKOTWÓRCZE DZIAŁANIE
KADMU JEGO PRODUKCJA ZOSTAŁA ZANIECHANA
18

1.10. AKUMULATOR CYNKOWO – SREBROWY
(U = 1,85 V)
Budowa akumulatora jest następująca:
Zn | KOH + K
2
ZnO
2
| AgO lub Ag
2
O | Ag
I zachodzi w nim sumaryczna reakcja elektrodowa:
rozładowanie
2 Zn + 2Ag
2
O + 4 KOH 2 K
2
ZnO
2
+ 4 Ag +
+ 2 H
2
O
ładowanie
19

1.11. AKUMULATOR NIKLOWO – CYNKOWY
(U = 1,70 V)
Pracuje w układzie:
Zn | KOH + K
2
ZnO
2
| NiOOH | Ni
dając energię elektryczną na skutek
zachodzących reakcji:
rozładowanie
2 NiOOH + Zn + 2 KOH 2 Ni(OH)
2
+
K
2
ZnO
2
(1.18)
ładowanie
20
W ostatnich latach silnie rozwinęła się
produkcji ogniw,
w których reakcje połówkowe są wzięte z
krańców tablic wartości potencjałów
standardowych redox:
UKŁAD
E
0
, V
she
Li Li
+
+ e
- 3,045
Na Na
+
+ e
-
2,714
Mg Mg
2+
+ 2 e
- 2,363
----------------------------------------------------------------
-
Ag Ag
+
+ e
+
0,799
Cl
2
+ 2 e 2 Cl
-
+ 1,359
F
2
+ 2 e 2 F
-
+ 2,870
21
Daje to następujące możliwości zestawiania
ogniw:
2 Li + F
2
2 LiF
E
0
= 6,05 V (!!)
(1.19)
3Li + CoF
3
3 LiF + Co E
0
= 3,64 V
(1.20)
Ca + CuF
2
CaF
2
+ Cu
E
0
= 3,51 V
(1.21)
Takie zestawienie bardzo aktywnych
pierwiastków wymaga całkowicie niewodnego
środowiska i doskonałych złączy
elektrycznych. Zapewniają to hermetyczne
kapsuły i elektrolity na bazie
rozpuszczalników niewodnych takich jak
węglan propylenu (PC), dimetylosulfotlenek
(DMSO) itp.
22

1.12. BATERIE I AKUMULATORY LITOWE
Nazwa ta pochodzi z nazwy
kompozytów tlenków metali grupy d z
metalicznym litem. Jako elektrody
stosowane są przeważnie materiałóy o
strukturze
spineli
.
Spinele
są to niestechiometryczne tlenki
metali o ogólnej formule M
I
M
II
2
O
4
, gdzie M
I
i
M
II
są atomami różnych metali.
Spinele krystalizują w układzie regularnym.
W komórce elementarnej występują
oktaedryczne ilub oktaedryczne luki
kationowe.
23

W te luki wprowadza się kationy litowe lub inne
kationowe pary redox. Kilka przykładów:
1) Układy na bazie spineli Li-Mn-Cr-O
stosowane przeważnie jako materiały
anodowe:
a) Li
2
Mn
2
O
4
( Li
2
Cr
x
Mn
2-x
O
4
) – spinel
tetragonalny
b) Li
3
MnCrO
5
(Li
1,2
Cr
0,4
Mn
0,4
O
2
) – spinel
heksagonalny
c) Li
1-
Mn
x
Cr
1-x
O
2
2) Spinele innych grup:
a) LiAl
x
Mn
2-x
O
4
(0 x 0,6) zwany spinelem
właściwym
b) Li [Ni
x
Co
1-2x
Mn
x
] O
2
(0 x 0,5)
stosowany jako
materiał katodowy
24

3) Układy typu:
a) [ LiMn
2
O
4
| (Li, La) TiO
3
| Stały polimer
przewodzący | Li ]
b) [ LiMnO
4
| (Li, La) V
2
O
5
| stały polimer
przewodzący | Li ]
Stosowany elektrolit: najczęściej hexafosforan
(V) litu LiPF
6
w węglanie propylenu (PC).
Układy spinelowe charakteryzowane są w
miliamperogodzinach na gram kompozytu ( mAh
g
-1
)
W stanie naturalnym spinele występują w wielu
krajach i ze względu na swe barwy, twardość i
łatwość obróbki są używane jako kamienie
półszlachetne.
25

1.13. OGNIWA PALIWOWE
1.13.1. Podstawowe rodzaje ogniw paliwowych
a) Ogniwa oparte na reakcjach przebiegających
wroztworach silnie alkalicznych (AFC)
alcaline fuel
cell
b) Ogniwa oparte na reakcjach przebiegajacych w
elektrolitach polimerowych (PEFC)
polymer-
electrolyte fuel cell
c) Ogniwa z reakcjami przebiegającymi w kwasie orto-
fosforowym (V) (PAFC)
phosphoric acid fuel cell
d) Ogniwa pracujące w środowisku stopionych soli
(MCFC)
molten-carbonate fuel cell
26

e) Ogniwa wykorzystujące reakcje zachodzące z
udziałem stałych tlenków (SOFC)
solide-oxide fuel cell
f) Ogniwa wykorzystujące bezpośrednie spalanie
metanolu
(DMFC)
direct methanol fuel cell
Ogniwa paliwowe pracują zwykle w temperaturze
100 – 1000
o
C
27

1.13.2. Ogniwa paliwowe pracujące w
środowisku stopionych soli (MCFC)
Ogniwa paliwowe tego typu pracują z reguły w
stopionym elektrolicie K
2
CO
3
lub jego eutektykach z
innymi solami lub tlenkami (np..CaO). W ogniwie
zachodzi sumaryczna reakcja:
CH
4
(gaz) + 2 O
2
(gaz) CO
2
(gaz) + 2 H
2
O
(1.22)
Reakcja ta składa się z dwóch reakcji
połówkowych:
ANODA:
CH
4 (gaz)
+ 10 H
2
O CO
2 gaz
+ 8 H
3
O
+
+ 8e
(1.23)
28

Lub inaczej w stopionym elektrolicie:
CH
4 (gaz)
+ 10 OH
-
CO
3
2-
+ 7 H
2
O + 8e
(1.24.)
KATODA:
O
2 (gaz)
+ 4 H
3
O
+
+ 4e 6 H
2
O
(1.25.)
Lub inaczej:
O
2 (gaz)
+ 2 H
2
O + 4e 4 OH
-
(1.26.)
Schemat budowy ogniwa podaje rysunek:
29
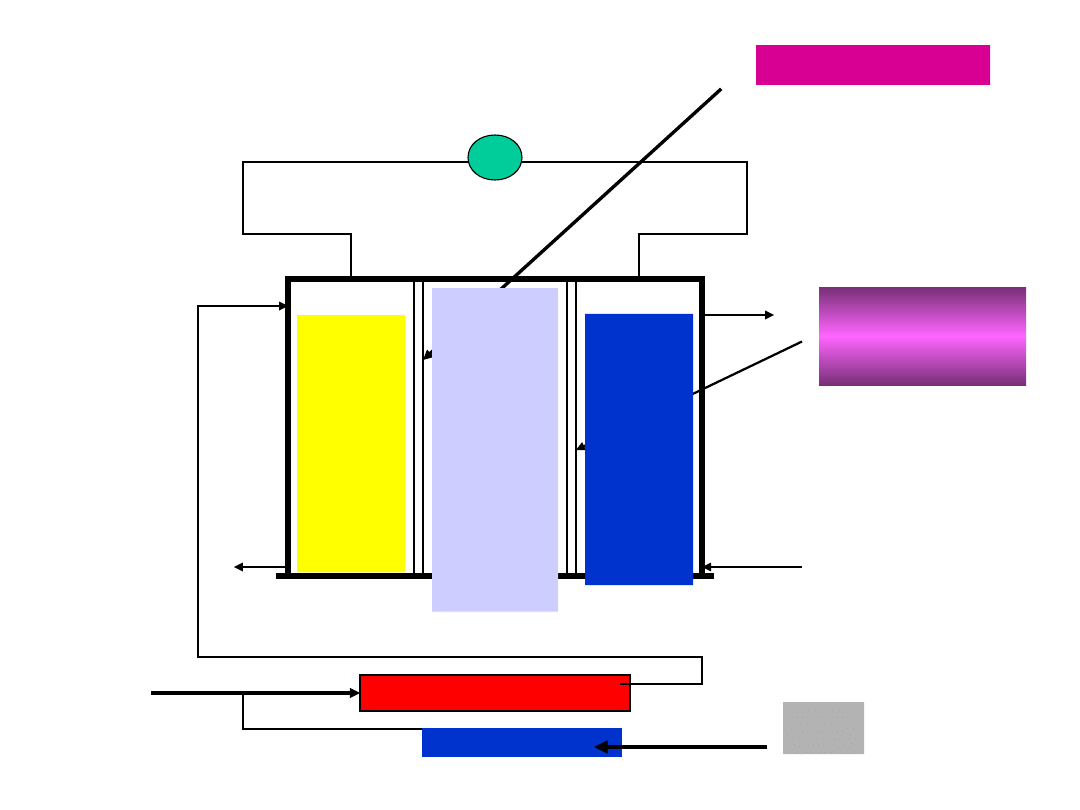
CH
4
Oczyszczanie
gazu
Katalizat
or
H
2
O
H
2
+
CO
2
Odbiornik
prądu
Anoda
ze
stali
Węglo
-wej
Nikiel porowaty
(K
2
CO
3
+
MgO )
stopiony
Powłoka z
porowatego
srebra
Katod
a ze
stali
nie-
rdzew
-nej
(CO + O
2
+
N
2
)
30

W ogniwie tym stosowane są, w zależności od
producenta, różne katalizatory do spalania
metanu i wytwarzania wodoru: sproszkowany
nikiel, sproszkowany pallad lub platyna,
domieszki CoO.
Rozwiązania technologii wytwarzania spieków
metalicznych, proszków metali, ich dobrej
przyczepności do metalicznych podłoży,
zwilżalności oraz dobrej przepuszczalności gazów
są pilnie strzeżonymi tajemnicami wytwórców.
31

1.13.3. Ogniwa paliwowe wykorzystujące
bezpośrednie spalanie metanolu
Elektrochemiczne utlenianie metanolu,
jednego z tańszych materiałów paliwowych,
badane było od ponad 40 lat.
Podstawowe trudności: - niska reaktywność
tlenu,
- niska reaktywność
metanolu,
- dobór materiału
elektrodowego,
- obniżenie temperatury
pracy do
100 – 150
0
C;
- usuwanie CO
2
(ekologia).
32
Radykalnym rozwiązanie okazało się
zastosowanie NAFIONU
®
- jonowymiennej
membrany selektywnie przepuszczającej protony,
która umieszczona jest pomiędzy dwoma
elektrodami ze stopów platyny.
33

ANODA:
przebiega reakcja:
CH
3
OH + H
2
O CO
2
+ 6 H
+
+ 6e
(1.27)
E
0
= 0,016 V
she
Usuwa się dwutlenek węgla do pochłaniaczy, protony
migrują przez membranę do przestrzeni katodowej,
w której zachodzi reakcja typowa dla elektrody
tlenowej:
KATODA:
przebiega reakcja:
O
2
+ 4 H
+
+ 4e 2 H
2
O
(1.28)
E
0
= 1,229 V
she
34

Reakcja sumaryczna:
2 CH
3
OH + 3 O
2
2 CO
2
+ 4 H
2
O
(1.29)
E = 1,21 V
która przy średniej wydajności 95 %
charakteryzuje się gęstością energetyczną:
1
3
0
09
,
6
32
,
0
3600
10
702
3600
)
(
kg
kWh
M
G
W
Ogniwa DMFC często pracują w układach
hybrydowych skojarzone z silnikami
spalinowymi
35

Platynowe lub palladowe katalizatory mogą być
zatruwane
przy niepełnym spalaniu metanolu do aldehydu
mrówkowego lub kwasu mrówkowego HCOOH.
Przyczyną tego jest adsorpcja CO na powierzchni
katalizatora
Trwają prace badawcze na zastosowaniem
nowych
katalizatorów metaloorganicznych na bazie
ligandów
makrocyklicznych, ftalocyjaniny, dotowanych
nano-
cząstkami metali polipirolu lub polianiliny.
36

1.13.4. Tlenowo – wodorowe ogniwa paliwowe
Wymagania przemysłu kosmicznego zmusiły do
opracowania „czystego” ogniwa paliwowego.
Po raz pierwszy zastosowano je w czasie lotu
statku kosmicznego „SOJUZ – APOLLO” w roku
1974.
ANODA:
H
2(gaz)
+ 2 OH
-
2 H
2
O + 2e
(1.31)
KATODA:
O
2(gaz)
+ 2 H
2
O + 4e 4 OH
-
(1.32)
37

38
„Wierzę, że pewnego dnia woda będzie
wykorzystywana jako paliwo, wodór i tlen
które ją
tworzą, używane razem bądź oddzielnie, będą
stanowiły niewyczerpalne źródło ciepła i
światła, na
dużo większą skalę niż dzisiaj węgiel. Woda
stanie się
węglem przyszłości...”
–
w roku 1874 w powieści „Tajemnicza Wyspa”
napisał Jules Verne- jeden z twórców
literackiego nurtu Science Fiction.
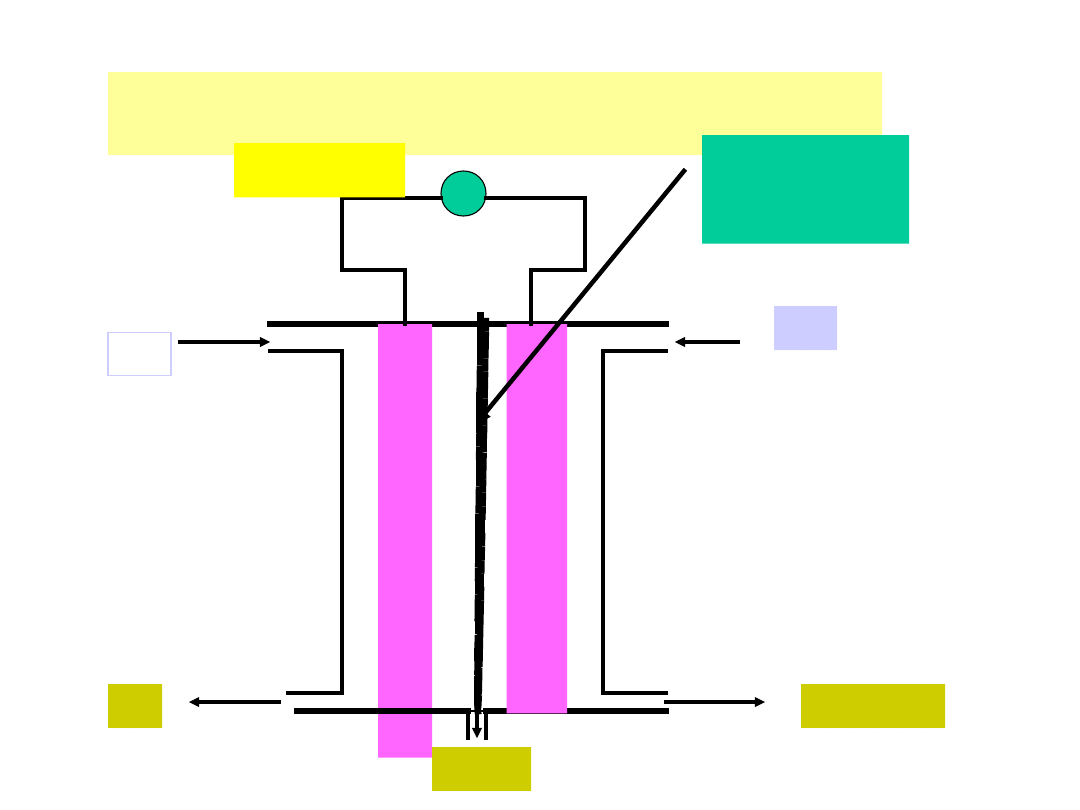
SCHEMAT OGNIWA TLENOWO -
WODOROWEGO
Ti
+
P
t
Ti
+
Pt
Membrana
jonowymienna
(polistyren
sulfonowany)
Odbiornik
prądu
O
2
O
2
+ H
2
O
H
2
H
2
H
2
O
39

39
Wodór ma kilka ważnych właściwości chemicznych,
które warunkują jego użycie jako paliwa:
największe rozpowszechnienie we wszechświecie-
na Ziemi występuje w postaci różnych związków
chemicznych ale najczęściej w związkach z tlenem i
z węglem;
niska energia zapłonu i łatwopalność;
najwyższa wartość energii spalania z jednostki
masy w porównaniu z innymi paliwami – w procesie
spalania powstaje woda, a nie szkodliwe produkty
reakcji;
niska gęstość tak w temperaturze standardowej
(278 K), jak i pod ciśnieniem;
zdolność do wnikania w struktury metali (np.
palladu, żelaza) lub kompozytowych związków o
porowatej strukturze.
najwyższa efektywność energetyczna: do 80% ,
konwencjonalne
paliwa
stałe
i
płynne
nie
przekraczają 35%.
Bardzo ważnym zagadnieniem w wykorzystaniu
energii spalania wodoru jest jego wielkotonażowa
produkcja i co równie ważne: składowanie i
przesyłanie.
40

Magazynowanie i transport wodoru, ze względu na
jego
lotność, wybuchowość i możliwość przenikania
przez metale
jest zadaniem dość trudnym. Wodór może być
skraplany
(wysokie nakłady energetyczne dla procesów
skraplania
Wodoru podnoszą koszty eksploatacji) i przesyłany
rurociągami lub przewożony w cysternach.
Narzuciło to
konieczność produkcji rurociągów i zbiorników z
materiałów
kompozytowych na bazie włókien węglowych.
41

42
Magazynowanie wodoru w metalach hybrydowych,
różnego
typu materiałach chemicznych o nanostrukturalnej
budowie
stanowią nowy kierunek badań wielu zespołów
naukowych i
technologicznych. Konwencjonalne metale
hybrydowe
zawierają związki międzymetaliczne typu AB, AB
2
,
AB
5
lub A
2
B i
magazynują 1,4 do 3.6 % wag. wodoru (np. TiFe,
ZrMn
2
, LaNi
5
lub Mg
2
Ni. Mieszane materialy hybrydowe o
nanostrukturalnej
budowie typu LiAlH
4
, NaBH
4
lub różnego typu
połączenia
imidów z hybrydami metalicznymi, mogą
magazynować do 18%
wag. wodoru łatwo wyzwalanego w temperaturze
poniżej 430 K

Materiały nanostrukturalne magazynujące wodór
można
podzielić na dwie kategorie:
•
tzw. atomowe materiały magazynujące wodór,
które
wymagają
odwracalnej
dysocjacji
wodoru
cząsteczko-
wego na atomy i wiązanie tych atomów z siecią
ośrodka
magazynującego (np. kompleksy wodorkowe) oraz
2) tzw. molekularne materiały
magazynujące wodór cząsteczkowy poprzez słabe
oddziaływanie cząsteczka-powierzchnia na drodze
fizycznej adsorpcji i pułapkowania atomów
wodoru w swej
rozwiniętej strukturze.
Do tej grupy materiałów należą np.
nanorurki
węglowe, nanorogi i ich modyfikacje.
43

1.13.5. Ogniwa na bazie kwasu fosforowego (V)
a) pracują na bazie kwasu fosforowego (PAFC) w
temperaturze ok. 200
0
C;
b) paliwem jest metan (CH
4
) lub węglowodory
nasycone (C
n
H
2
)
n + 2
;
c) anoda: Pt
d) katoda : Pt
e) Wartości użytkowe: 10 – 60 mA cm
-2
; U = 0,4 –
0,5 V
44

1.13.6. Ogniwa paliwowe pracujące w silnie
alkalicznych elektrolitach
a) pracuje na bazie 6 M KOH w temp. 20 – 80
0
C;
b) paliwo: alkohole alifatyczne;
c) anoda: Pt lub Pd lub Ni;
d) katoda: C lub Ag lub Pt lub PtO lub Pt/C
(nanokrystaliczny diament);
e) wartości użytkowe: 20 – 100 mA cm
-2
, U = 0,6
– 0,7 V
45

a
1
) pracuje na bazie elektrolitu 6 – 12 M KOH
w temp. 20 – 60
0
C;
b
1
) paliwo: hydrazyna NH
2
– NH
2
;
c
1
) anoda: stopy Ni-Co;
d
1
) katoda: C, Ag;
e
1
) wartości użytkowe: 60 – 200 mA cm
-2
;
U = 0,8 – 0,9 V;
Równanie reakcji podstawowej:
N
2
H
4
+ 4 H
+
4 H
2
O + 4e (1.33.)
46

a
2
) pracuje w stopionych wodorotlenkach
alkalicznych;
b
2
) paliwo: amoniak NH
3
w temp. 200 – 400
0
C;
c
2
) anoda: Pt lub stopy Ni-Co-P dotowane TiO
2
;
d
2
) katoda: NiO + Li;
e
2
) wartości użytkowe: 100 – 200 mA cm
-2
,
U = 0,7 –0,8 V;
Reakcja podstawowa:
2 NH
3
+ 6 OH
-
N
2
+ 6 H
2
O + 6e (1.34.)
47

a
3
) pracuje w środowisku elektrolitu 6 – 12 M
KOH
w temp. 20 – 60
0
C;
b
3
) paliwo: substancje specjalne dotowane
metalami
alkalicznymi;
c
3
) anoda: stal lub stopy Ni – Co - P;
d
3
) katoda: C, Pt/C (diament
nanokrystaliczny) lub Ag:
e
3
) wartości użytkowe: 100 – 300 mA cm
-2
,
U = 1,0 – 1,2 V;
48

1.13.7. Ogniwa paliwowe na bazie
stałych tlenków metali (SOFC) –
temp. pracy
700 – 1000
0
C
a) Materiały elektrodowe: stałe tlenki
o przewodnictwie jonowym i
wodór gazowy;
b) woda generowana jest w procesie
anodowym, co jednocześnie
wprowadza parę wodną do
reaktora;
c) Wysokie wymagania materiałowe:
ceramika na bazie tlenków itrowo /
cyrkonowych lub cerowo /
lantanowych;
49

1.13.8. Perspektywy rozwoju technologii
ogniw paliwowych
1. Zastosowanie w napędach
hybrydowych: napęd spalinowy +
ogniwo paliwowe lub naped elektryczny
(klasyczny akumulator) + ogniwo
paliwowe;
2. Do zasilania autonomicznych systemów
alarmowych ( wielkie banki, budynki
rządowe);
3. Farmy hodowlane o wielkiej produkcji i
stałej produkcji metanu z fermentującej
biomasy
50

1.13.9. Przewidywane kierunki badań rozwoju
technologii ogniw paliwowych
CEL DZIAŁAŃ: zwiększenie wydajności
elektrycznej
i w konsekwencji – wydajności
energetycznej;
1) Opracowanie nowych, bezpiecznych
generatorów
wytwarzania wodoru i sposobów jego
magazynowania;
2) Zmniejszenie rozmiarów i ciężaru ogniw;
3) Opracowanie nowych, wydajnych
materiałów
elektrodowych i katalitycznych systemów
membranowo – jonowymiennych;
W EFEKCIE: większa czystość ekologiczna,
obniżenie
ceny i tym samym zwiększenie
popytu.
4) Obniżenie temperatury pracy ogniw
paliwowych;
51

1.14. Ogniwa fotowoltaiczne, dawniej zwane
ogniwami słonecznymi
„skrzydła” satelitów kosmicznych, to nic
innego jak płaszczyzny ogniw
fotowoltaicznych zasilających elektroniczne
systemy sztucznych satelitów Ziemi.
Przemysł kosmicznej eksploracji, nie liczący
się z kosztami, wymusił rozwój technologii
tzw. ogniw słonecznych.
W ciągu 14 dni Słońce dostarcza
Ziemi zasób energii wystarczający na
roczne zapotrzebowanie całej
energetyki na naszej planecie;
52

Nie jest konieczne wysokie nasłonecznienie
kraju w
zależności od szerokości geograficznej. W
Europie
Północnej największe wykorzystanie energii
słonecznej
jest w Szwecji, kraju północnym !
Półprzewodnikowe elektrody są jednym z trzech
strategicznych elementów wykorzystania światła
słonecznego, obok produkcji i fermentacji
BIOMASY i naturalnych procesów fotosyntezy.
Największa wydajność elektryczna w tej
dziedzinie mają półprzewodniki o paśmie
przewodzenia w granicach od 1,1 do 1,7 eV, ale
w zetknięciu z wodnymi roztworami są mało
stabilne i ulegają FOTOKOROZJI lub FOTO –
PASYWACJI. Jest to problem technologiczny.
53
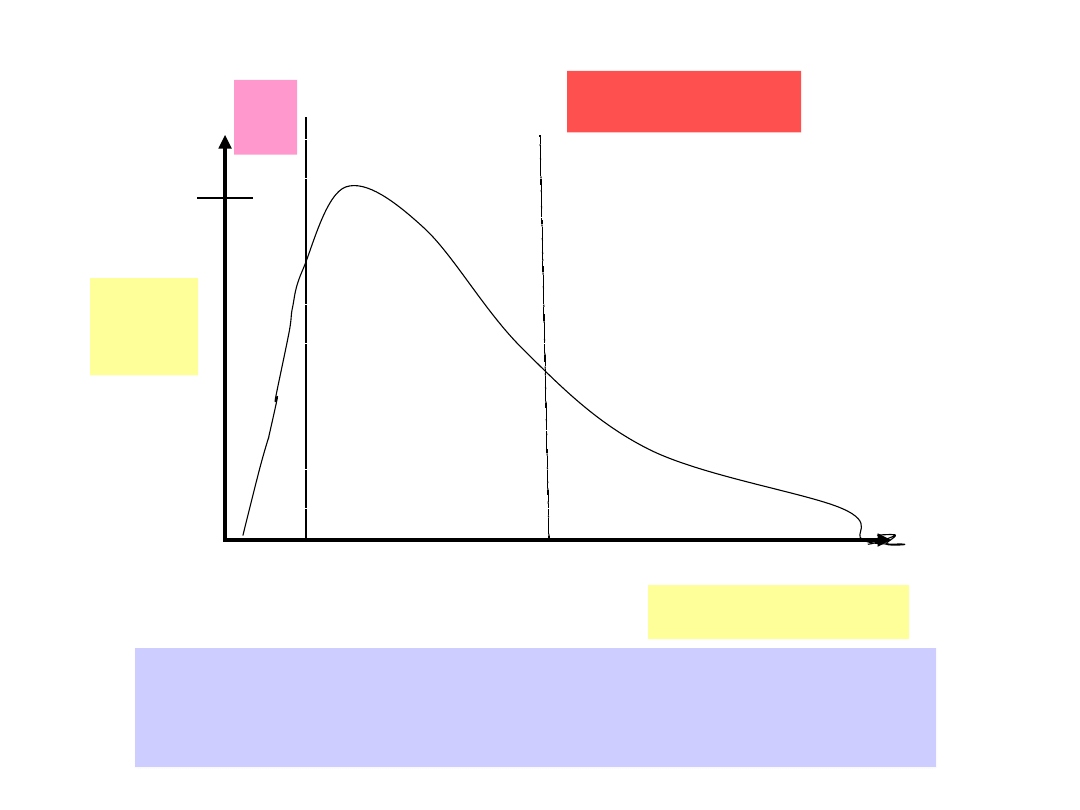
1,0
Względ
na
gęstość
energii
Długość fali świetlnej /
m
O,4
0,8
UV
9%
Widmo
widzialne,
44%
Podczerwień,
47%
Rozkład względnej gęstości energii światła
słonecznego w zależności od długości fali
świetlnej
54

Sprawność konwersji energii słonecznej na
energię elektryczną wyraża zależność (1.35.);
%
100
A
E
U
I
gdzie: I – natężenie prądu modułu fotowoltaicznego
/A;
U – napięcie na zaciskach modułu / V;
A – powierzchnia geometryczna modułu /
cm
2
;
E – natężenie oświetlenia;
Przeciętna sprawność fotoogniwa opartego
na amorficznych materiałach nie przekracza
20 %
55

Sprawność ogniw fotowoltaicznych obniżają
następujące czynniki:
1) Prawie połowa fotonów nie ma
wystarczającej energii do wytworzenia pary
dziura – elektron;
kierunek działania: poszukiwanie nowych
materiałów
(czysty krzem, monokryształy As/Ga/Si,
siarczek kadmu CdS);
2)
2) Promieniowanie słoneczne odbija się od
gładkiej powierzchni modułu;
kierunek działania: odpowiednie fakturowanie
powierzchni, powłoki przeciwodblaskowe;
56

3) Zbyt duża oporność elektryczna ogniwa;
kierunek działania: jakość styków i
montażu;
4) Podwyższenie temperatury pracy ogniwa
zwiększa szybkość rekombinacji par dziura –
elektron.
Spadek sprawności ogniwa jest w zasadzie
liniowy, a jej zanik zależy od materiału warstw
(150 – 300
0
C).
Najbardziej korzystne parametry ma arsenek
galu (GaAs).
57

ZASADA DZIAŁANIA I PODSTAWY
BUDOWY OGNIW FOTOWOLTAICZNYCH
Zasada działania ogniw fotowoltaicznych
oparta jest na wykorzystaniu właściwości
złącza półprzewodników typu
p
i
n
:
na granicy faz półprzewodników typu
p
(przewaga dziur) i typu
n
(nośnika
elektronów) powstaje różnica potencjałów w
polu elektrycznym na tejże granicy faz.
Inwazja fotonów o odpowiedniej energii
wywołuje powstanie dodatkowej
pary
nośników elektron – dziura
o przeciwnych
ładunkach elektrycznych, które następnie są
rozdzielone przez pole elektryczne i następuje
przejście elektronów do obszaru o dodatnim
ładunku
58
Dołączenie zewnętrznego obciążenia ( np.
oporu) powoduje powstanie napięcia
pomiędzy elektrodami.
59
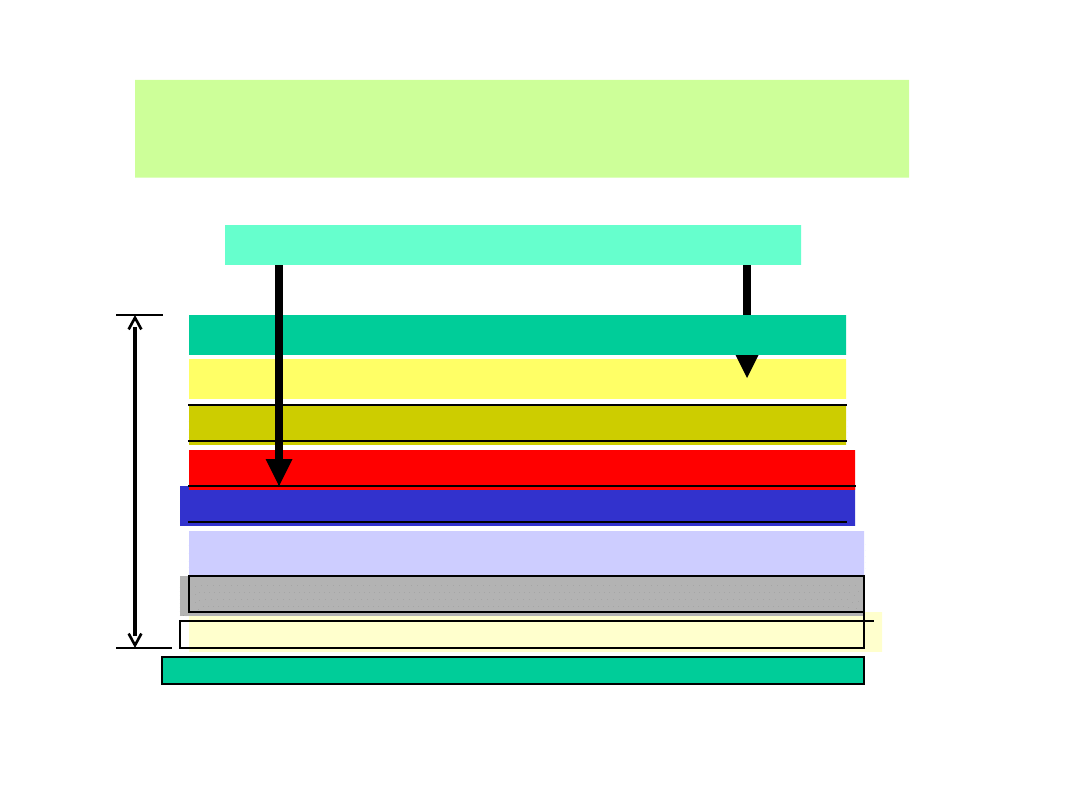
PODSTAWOWY SCHEMAT BUDOWY
OGNIWA FOTOWOLTAICZNEGO
Podłoże szklane
Laminat ECV (octan etylo-winylowy
Folia aluminiowa
Warstwa SiO
2
Warstwa inwersyjna
PÓŁPRZEWODNIK TYPU p
Roztwór elektrolitu lub elektrolit stały
PÓŁPRZEWODNIK TYPU n
Laminat przeciwodblaskowy
Metalowe elektrody zbiorcze
2-3
mm
60

TECHNOLOGICZNE ZASADY WYKONANIA OGNIWA
FOTOWOLTAICZNEGO
1. Niezwykle wysokie wymagania czystości pracy;
2. Nanoszenie warstw o grubości rzędu
mikrometrów;
3. Chemiczne oczyszczanie, trawienie i
aktywowanie
powierzchni ;
4. Napylanie dyfuzyjne;
5. Osadzanie katodowe warstw metalicznych;
6. Anodowe wytwarzanie tlenków metali i
niemetali;
7. Nanoszenie polimerowych warstw izolujących
i przeciwodblaskowych;
8. Laserowe trawienie warstw polimerowych dla
odsłony warstw metalicznych lub
półprzewodnikowych;
61

9. Łączenie pojedyńczych fotoogniw we wstążki;
10. Łączenie wstążek w moduły;
11. Sprawdzanie efektywności pracy modułów;
12. Montaż płyty ogniw ( modułów)
fotowoltaicznych i jej
wprowadzenie do zintegrowanego obwodu
elektrycznego .
PARAMETRY EKSPLOATACYJNE
STANDARDOWYCH 36- cio CZŁONOWYCH
MODUŁÓW FOTOWOLTAICZNYCH
1. Maksymalne napięcie mocy: 16 V;
2. Wartość napięcia na rozwartych zaciskach:
20,9 V
62

3. Maksymalna moc: 6,9 A;
4. Prąd zwarcia: 7,6 A;
5. Maksymalne napięcie pracy: 840 V;
NOWE KIERUNKI w TECHNOLOGII OGNIW
FOTOWOLTAICZNYCH
1. Zastosowanie nanokrystalicznych
warstw
półprzewodnikowych (np. Au / Ni / CdS /
Na
2
SO
3
;
2. Zastosowanie nanokrystalicznego TiO
2
(absorbującego fotony i emitującego
elektrony do pasma przewodnictwa
półprzewodnikowej elektrody) .
Współczynnik konwersji wzrasta do 15%.
63

3. Zastosowanie ultracienkich warstw z
nanomicelli
układów typu:
TiO
2
/ SnO
2
; CdS / TiO
2
;
CdS / ZnO;
4. Wprowadzenie granic fazowych
półprzewodników
typu
p
:
p
- InP // 1 M H
2
SO
4
;
p
- InP /
p
- GaP // 0,5 M
H
2
SO
4
;
5. Wprowadzenie granic fazowych
półprzewodników
typu
n
:
n
– Si / CH
3
CN;
n
– Si // Fc
+
/ Fc;
n
– GaAs //
1M EDTA;
n
– GaAs // 1 M H
2
SO
4
;
n –
GaAs // H
2
SO
4
(Fe
2+
);
n
– GaAs // Se
2-
/ Se
2
2-
;
n
– GaP // 1 M H
2
SO
4
;
64

1.15. ELEKTROCHROMIZM I JEGO
WYKORZYSTANIE
ELEKTROCHROMIZM jest zmianą barwy
układu redox pod wpływem zmian potencjału
układu.
PRZYKŁADY:
[Fe (CN)
6
]
3-
[Fe (CN)
6
]
4-
Błękit pruski
Błękit metylenowy
Silnie zdyspergowany WO
3
65

W Y K OR Z Y S T A N I E
1. Aktywne optycznie szyby samochodowe;
2. Szyby w wielkich biurowcach i domach
mieszkalnych - ich układ elektryczny
sprzężony jest z systemem klimatyzacji i
współpracuje z systeme ogniw
fotowoltaicznych i bateriami akumulatorów
klasycznych
Zasady budowy szyb elektrochromowych:
SZKŁO „ITO” – Indium Tin Oxide (warstwa
InO
2
-SnO
2
na szkle kryształowym)
WO
2
/ TiO
2
Spinel
litowy
66
K O N I E C
DZIĘKUJĘ ZA UWAGĘ
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
Wyszukiwarka
Podobne podstrony:
ALTERNATYWNE ELEKTROCHEMICZNE ppt
Elektrownie geotermalne – alternatywa w produkcji energii elektrycznej
Alternatywne metody pozyskiwania energii elektrycznej
Elektrownie geotermalne – alternatywa w produkcji energii elektrycznej
Elektron regulator prądu wzbudnicy alternatora
Elektrownie jądrowe są alternatywą dla tradycyjnych elektrowni
Dariusz Sielicki Elektroniczne moitorowanie przestepców nowoczesna alternatywa pozbawienia wolnosci
Napęd Elektryczny wykład
Podstawy elektroniki i miernictwa2
elektryczna implementacja systemu binarnego
urządzenia elektrotermiczn
Podstawy elektroniki i energoelektroniki prezentacja ppt
Fwd dydaktyka, Metody alternatywne
więcej podobnych podstron