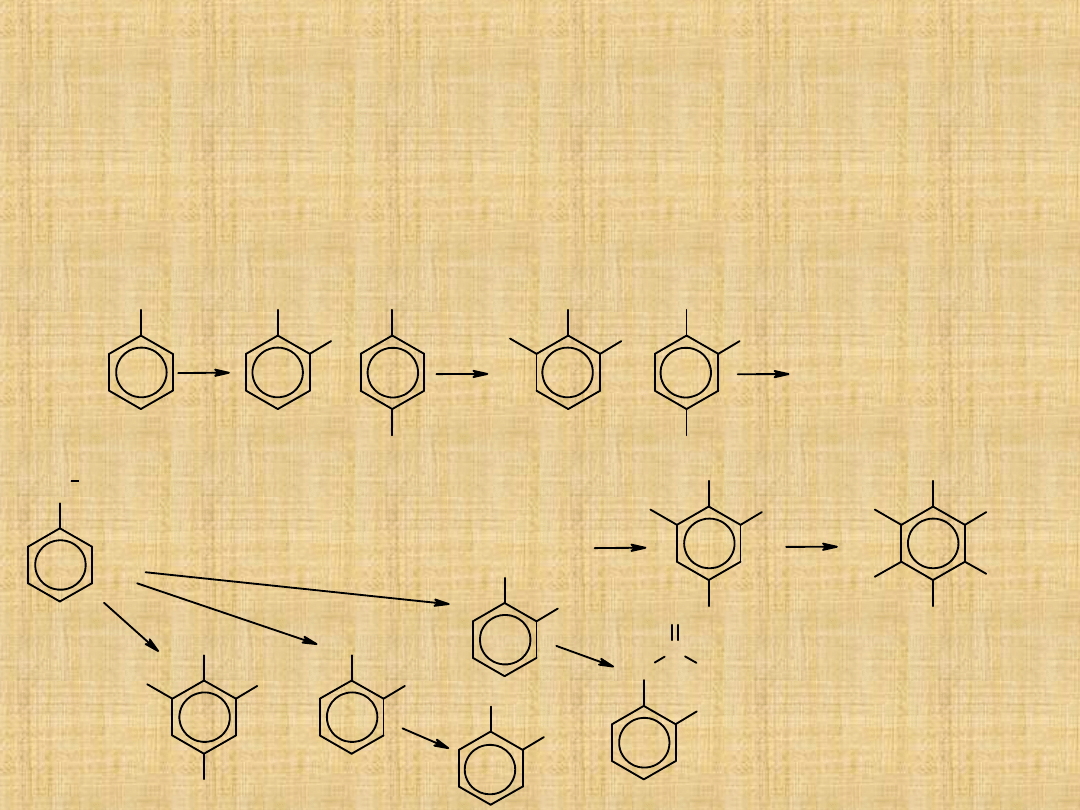
Reakcje fenoli
Reakcje substytucji w pierścieniu są jednymi z głównych reakcji fenoli.
Ze względu na silne aktywujące działanie grupy hydroksylowej, niską
energię aktywacji reakcje podstawienia elektrofilowego dla fenoli
przebiegają inaczej niż dla innych związków aromatycznych.
OH
Cl
Cl
Cl
OH
Cl
Cl
Cl
Cl
Cl
Cl
2
Cl
2
FeCl
3
pentachlorofenol
środek stosowany
do ochrony
drewna
O
OH
Br
Br
Br
OH
CHCl
2
OH
COOH
OH
CHO
CO
2
CHCl
3
Br
2
O
COOH
C
O
CH
3
aspiryna
OH
OH
Cl
OH
Cl
OH
Cl
Cl
OH
Cl
Cl
Cl
2
Cl
2
+
+
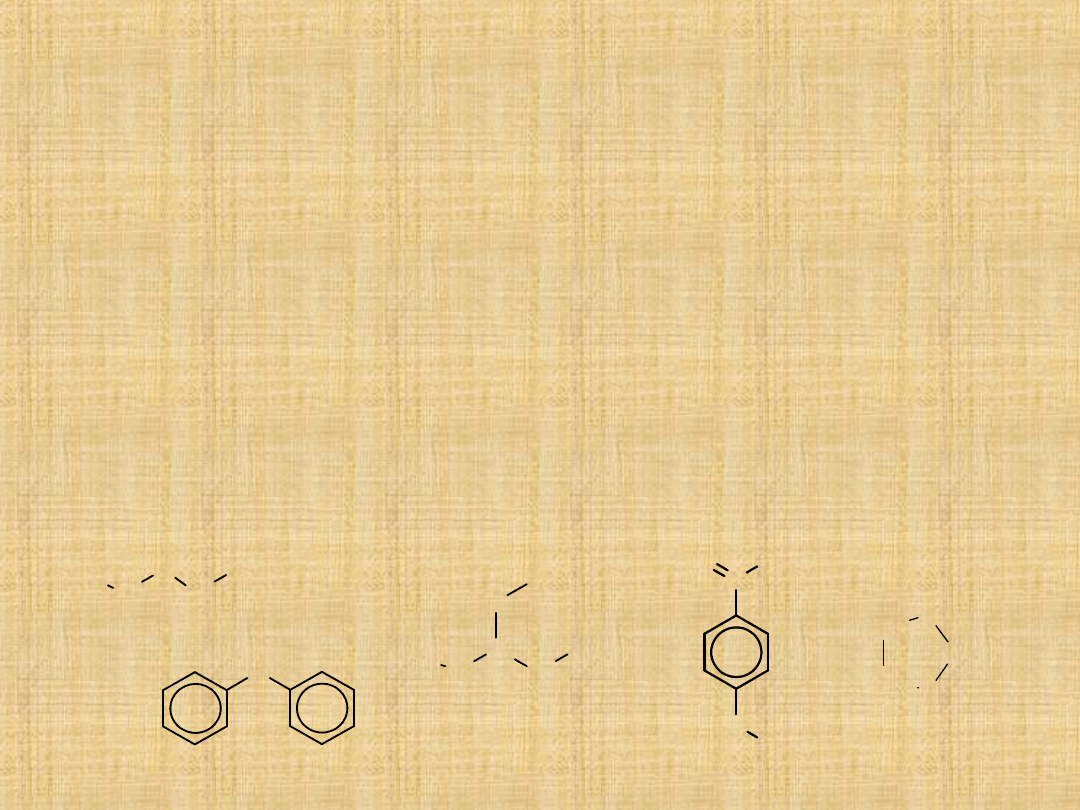
Etery
Etery są związkami o wzorze ogólnym R-O-R
‘
,gdzie symbole R i
R
‘
oznaczać mogą zarówno podstawnik alifatyczny jak i
aromatyczny.
Nazewnictwo
-Nazwę eteru tworzy się zwykle w ten sposób ,że po słowie eter
podaje się w kolejności alfabetycznej nazwy dwóch grup, które
są przyłączone do atomu tlenu.
-Jeżeli jedna z grup nie ma prostej nazwy,to związek można
traktować jako pochodną alkoksylową.
Wśród eterów łańcuchowych rozróżniamy etery proste
(symetryczne) oraz etery mieszane (niesymetryczne).
W eterach cyklicznych atom tlenu stanowi jeden z elementów
pierścienia.
CH
2
CH
2
O
CH
3
CH
3
eter
dietylowy
3-metoksy
pentan
CH
2
CH
2
CH
O
CH
3
CH
3
CH
3
eter
difenylowy
O
aldehyd p-
metoksybenzoesowy
O
C
CH
3
H
O
tetrahydrofu
ran
CH
2
O
CH
2
CH
2
CH
2

Właściwości eterów
Właściwości fizyczne
Etery są związkami polarnymi i
niezasocjowanymi (brak kwasowych
atomów wodoru) stąd etery
charakteryzują się niską temperatura
wrzenia
Mogą natomiast tworzyć wiązania
wodorowe z innymi posiadającymi
„kwaśne” atomy wodoru cząsteczkami.
Właściwości chemiczne
Etery należą do substancji biernych chemicznie. Wiązanie
eterowe jest odporne na działanie zasad oraz odczynników
utleniających i redukujących.
Obecność wolnych par elektronów na atomie tlenu
czyni
z
eterów
dogodnymi
rozpuszczalnikami
do wielu reakcji.
CH
3
CH
2
O
+
CH
3
CH
2
B
F
F
F
CH
2
CH
3
O
H
CH
3
CH
2
O
CH
2
CH
3
CH
3
CH
2
O
CH
3
CH
2
Mg
Br
CH
2
CH
2
CH
3
CH
3
CH
2
O
CH
3
CH
2
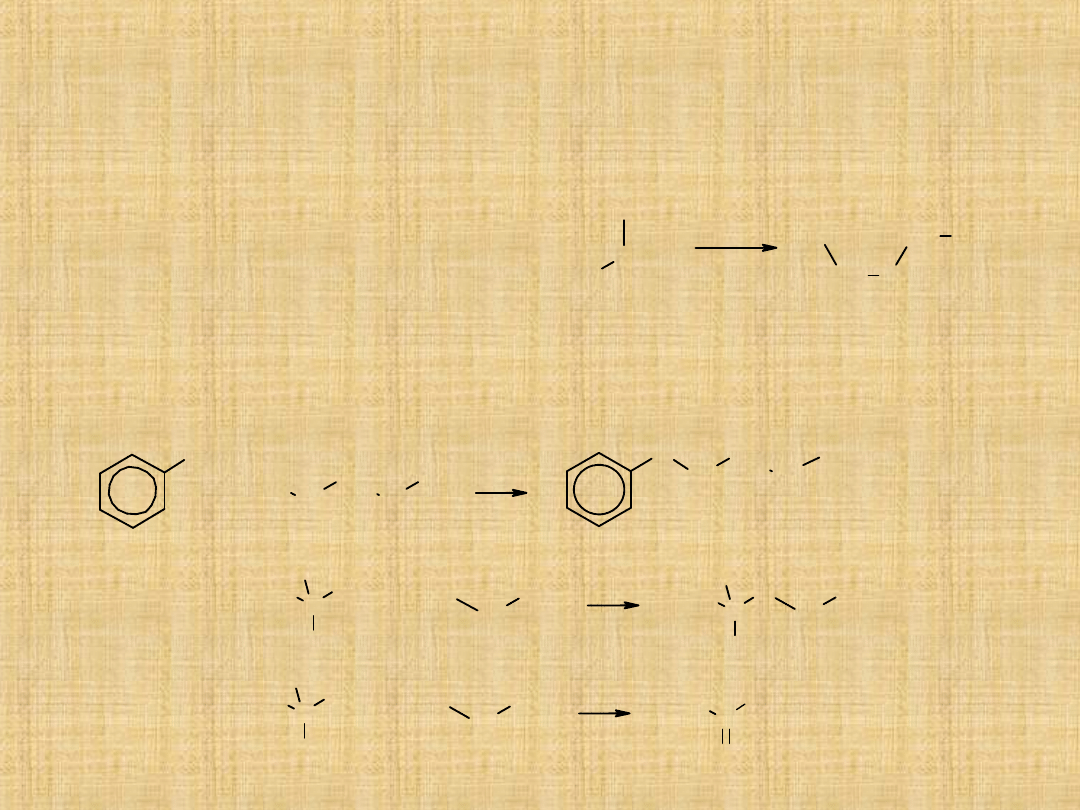
Otrzymywanie eterów
Międzycząsteczkowa dehydratacja alkoholi
Niższe etery symetryczne(głównie dimetylowy i dietylowy) otrzymuje
się w wyniku reakcji alkoholu z kwasem
(najczęściej siarkowym),
w podwyższonej temperaturze.
Synteza Williamsona
Jest to reakcja alkilowania alkoholanów lub fenolanów za pomocą
pierwszorzędowych odczynników alkilujących.
CH
3
CH
2
OH
CH
3
CH
2
O
CH
3
CH
2
2
H
2
SO
4
ONa
O
CH
2
CH
2
CH
2
CH
3
CH
2
CH
2
CH
2
CH
3
Br
+
CH
2
CH
3
Cl
CH
3
CH
3
ONa
C
CH
3
CH
2
CH
3
O
CH
3
CH
3
C
CH
3
+
CH
2
CH
3
NaO
CH
3
CH
3
Cl
C
CH
3
CH
3
CH
2
C
CH
3
+
!
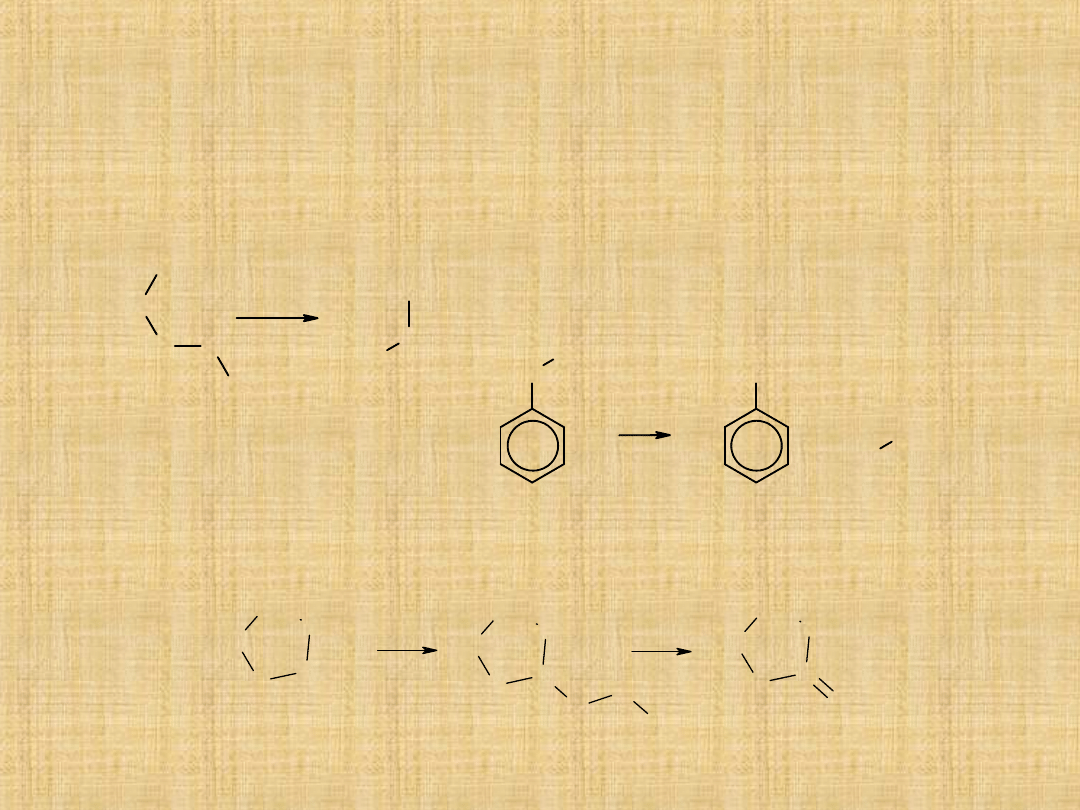
Główne reakcje eterów
Praktyczne znaczenie ma właściwie jedna reakcja:
-Rozszczepienie eterów pod wpływem silnych kwasów (np.:HI,
HBr) .
W wyniku reakcji powstaje alkohol i halogenek alkilowy .
-
Utlenianie eterów do nadtlenków (reakcja nie ma znaczenia
syntetycznego)
O
CH
3
OH
Br
C
H
3
+
HBr
CH
3
CH
2
I
CH
3
CH
2
O
CH
3
CH
2
2
HI
CH
2
CH
2
CH
2
CH
2
O
CH
2
CH
2
CH
CH
2
O
O
O
H
CH
2
CH
2
C
CH
2
O
O
O
2
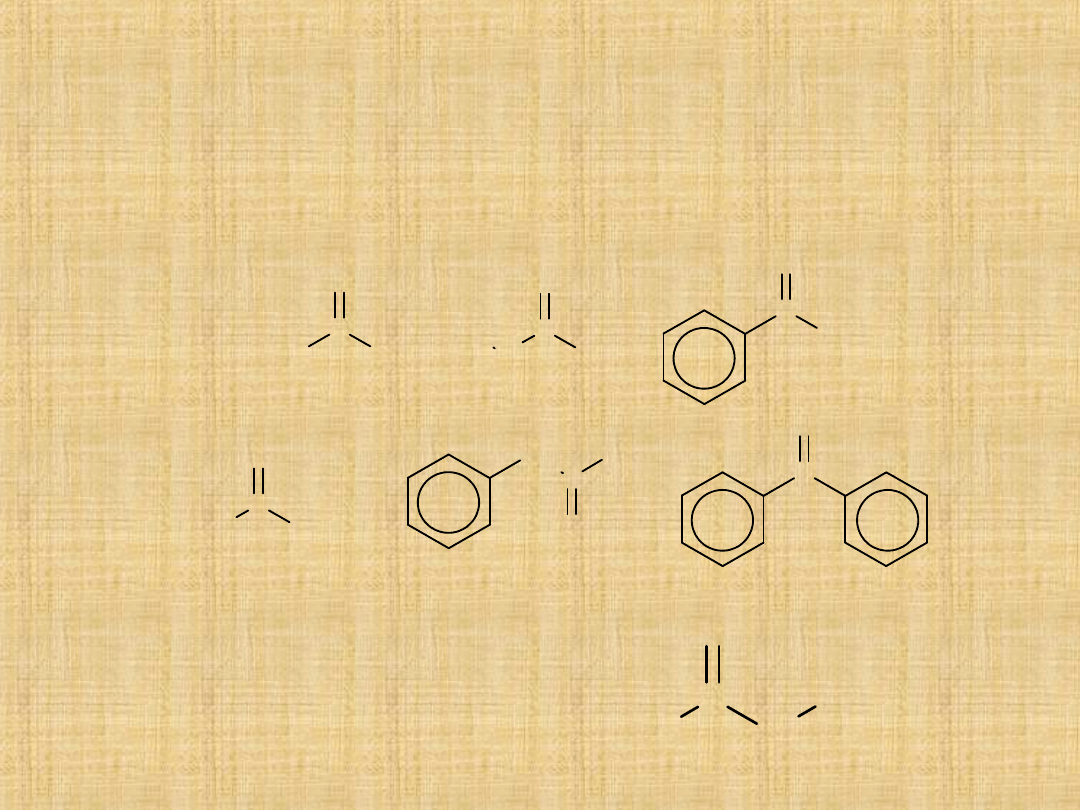
Aldehydy i ketony
Aldehydy i ketony łącznie stanowią klasę związków
określonych
jako
związki
karbonylowe.
Wspólnym
elementem ich budowy jest grupa karbonylowa
>C=O ona w znacznym stopniu określa właściwości
chemiczne aldehydów i ketonów.
Aldehydy:
Wiązanie jest spolaryzowane w
stronę bardziej
elektroujemnego atomu tlenu
i w ten sposób na atomie węgla
występuje cząstkowy ładunek
dodatni.
CH
3
CH
2
C
O
CH
3
H
H
C
O
H
C
O
CH
3
CH
2
H
C
O
CH
3
C
O
CH
2
CH
3
CH
3
C
O
C
O
Ketony:
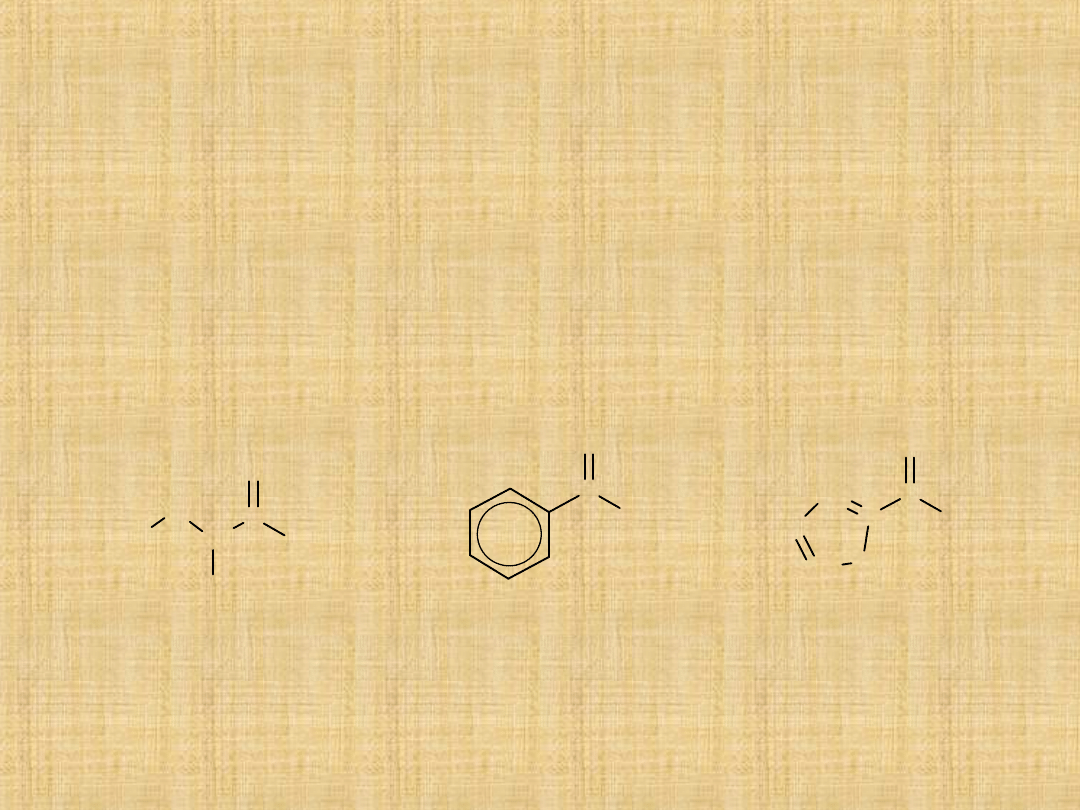
Nazewnictwo aldehydów
Nazwę systematyczną tworzy się dodając przyrostek –al do
nazwy najdłuższego węglowodoru zawierającego tę
samą,co aldehyd liczbę atomów węgla.
Atom węgla grupy karbonylowej określa się jako C-1.
Atom węgla C-2 w nazewnictwie systematycznym
odpowiada położeniu w nazewnictwie zwyczajowym.
Przykłady:
2-furylometanal
(2-furaldehyd,
2-furfural)
C
O
CH
CH
CH
H
C
O
Cl
CH
3
CH
2
CH
H
C
O
2-chlorobutanal
(aldehyd -
chloromasłowy)
fenylometanal
(benzaldehyd)
H
C
O

Metanal (HCHO)
Aldehyd mrówkowy(HCHO) w temperaturze pokojowej jest
to gaz.łatwo rozpuszczalny w wodzie.
Formalina (40% roztwór wodny metanalu)ma silne
właściwości bakteriobójcze działa denaturująco na substancje
białkowe. To decyduje ,że jest stosowany do przechowywania
preparatów anatomicznych.
Paraformaldehyd HO-CH
2
O-( CH
2
O )
n
-CH
2
OH n~8 stały
produkt polimeryzacji liniowej metanalu. Nietrwały pod
wpływem temperatury(180-200°C)
Trioksymetylen (trioksan)-stały trimer cykliczny,produkt
połączenia trzech cząsteczek metanalu w pierścień.(t.t
62°C)
O
O
O
Żywice fenolowo-formaldehydowe
Duże znaczenie praktyczne ma zdolność łączenia się metanalu
z fenolem lub mocznikiem.
Następuje tworzenie fenoplastów (najstarsza odmiana
syntetycznego tworzywa sztucznego) i aminoplastów.
HCHO
OH
OH
CH
2
OH
CH
2
OH
OH
OH
OH
OH
CH
2
+
CH
2
OH
CH
2
OH
CH
2
OH
CH
2
OH
CH
2
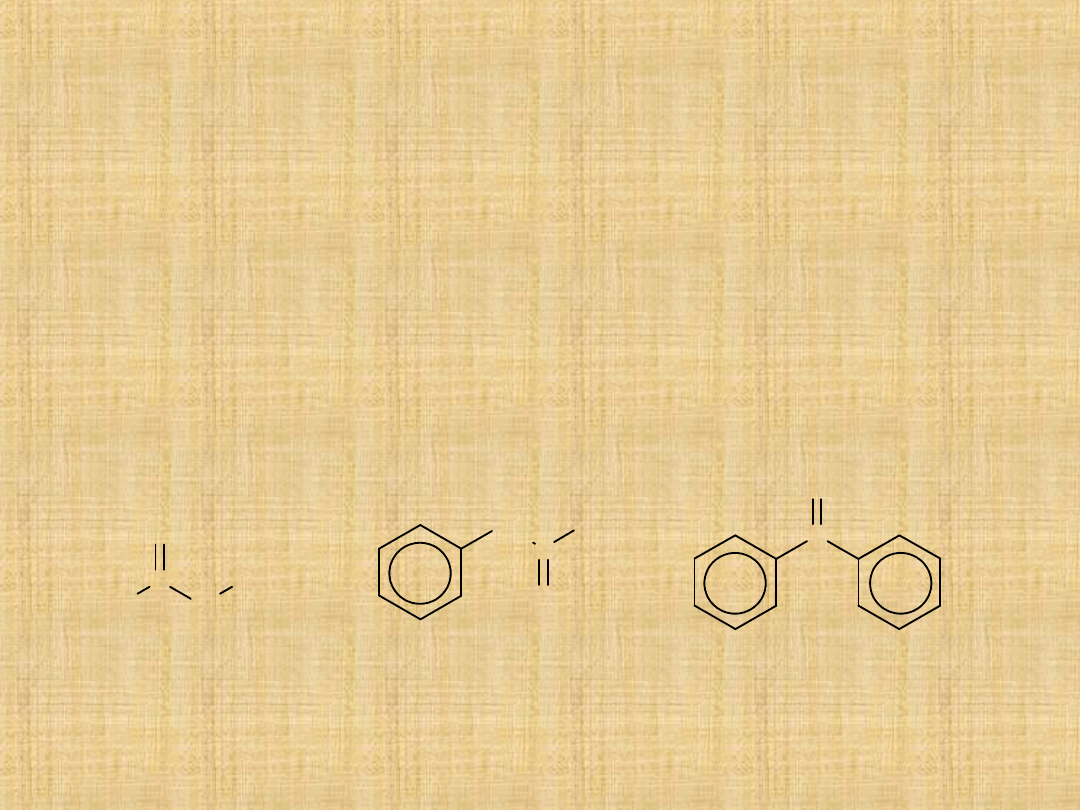
Nazewnictwo ketonów
Ketony –nazewnictwo wg systemu IUPAC
-najdłuższy łańcuch z grupą karbonylową uznaje się za strukturę
podstawową.Nazwę ketonu tworzy się przez dodanie do nazwy
alkanu końcówki –on.
-położenie poszczególnych grup określa się liczbami. Atom węgla
grupy karbonylowej powinien być określony jak najmniejszą liczbą.
Czasem nazwy tworzy się przez wymienienie w kolejności
alfabetycznej nazw obu grup obok grupy karbonylowej.
Przykłady:
CH
3
CH
2
C
O
CH
3
butanon
(metyloetyloke
ton,
MEK)
CH
3
C
O
CH
2
1-fenylo-2-propanon
(benzylometyloketon,
BMK)
C
O
difenylometan
on
(benzofenon)
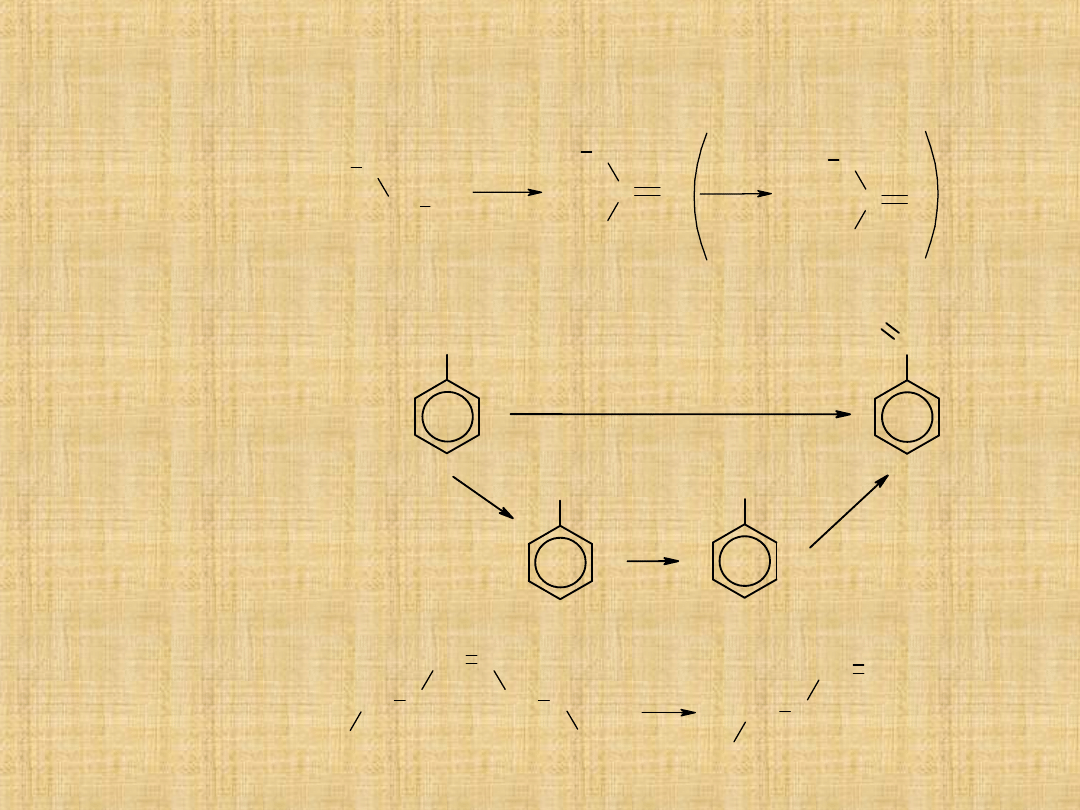
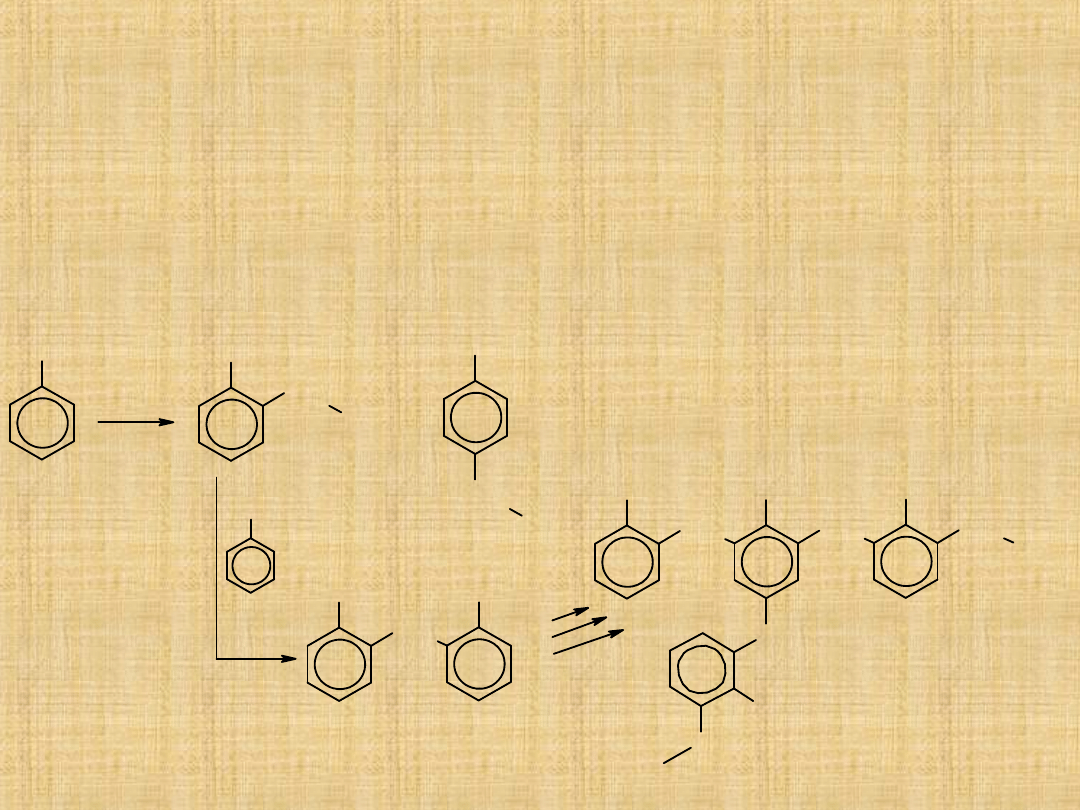
Metody otrzymywania aldehydów
-Selektywne
utlenianie
1°alkoholi
( łagodne
utleniacze)
-Selektywne utlenianie
metylowych
pochodnych benzenu
lub przez hydrolizę
dichlorometylobenzenu
CH CH
CH
2
CH
2
CH
2
CH
3
CH
2
CH
3
O
3
CH O
CH
2
CH
2
CH
3
-w procesie ozonolizy
CH
3
CH
2
Cl
CHCl
2
Cl
2
h
CH
O
H
2
O
CrO
3
h
Cl
2
CH
3
CH
2
C
O
H
CH
3
CH
2
CH
2
OH
CH
3
CH
2
C
O
OH
[O]
[O]
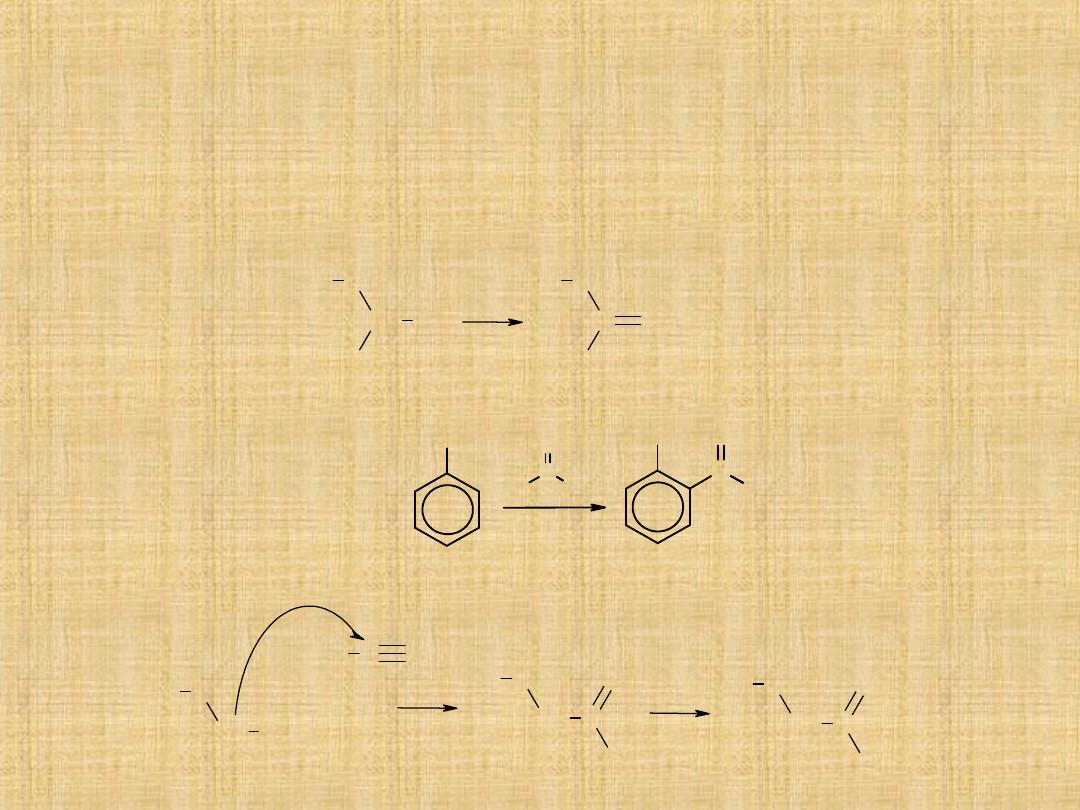
Otrzymywanie ketonów
Utlenianie alkoholi 2°-rzędowych
Drugorzędowe alkohole utleniają się na ketony za pomocą mieszaniny
K
2
Cr
2
O
7
i rozcieńczonego kwasu siarkowego lub za pomocą CrO
3
.
CH
3
CH
2
C
O
CH
3
CH
3
CH
2
CH OH
CH
3
[O]
Acylowanie metodą Friedla -Craftsa
W reakcji odczynnika Grignarda z nitrylami
CH
3
C
CH
3
C
O
CH
3
C
Cl
CH
3
C
O
AlCl
3
CH
3
CH
2
CH
2
MgBr
CH
3
C
N
CH
3
NH
C
CH
3
CH
2
CH
2
CH
3
O
C
CH
3
CH
2
CH
2
+
H
2
O
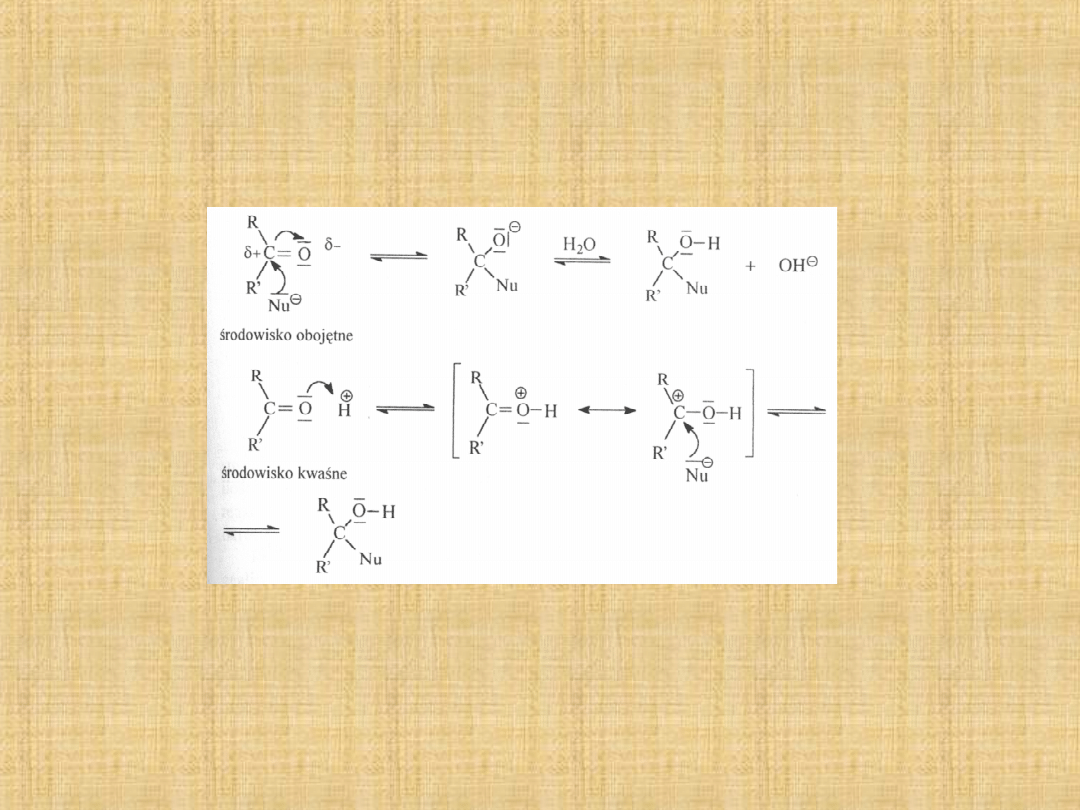
Addycja nukleofilowa do grupy
karbonylowej
Najważniejszą reakcją grupy karbonylowej jest reakcja addycji
nukleofilowej.
Reakcje zachodzą zwykle samoczynnie, choć w niektórych
przypadkach przyspiesza się ich przebieg zakwaszając
środowisko reakcji. W wyniku tworzy się ładunek dodatni na
atomie węgla grupy karbonylowej,łatwiejszy jest atak nukleofila.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
Wyszukiwarka
Podobne podstrony:
Enzymatyczna redukcja związków karbonylowych i zawierających wiązania C=C
pochodne związków karbonylowych zadania
14 %20Zwiazki%20karbonylowe
Związki karbonylowe(13)gohar
zwiazkikarbonylowe[1], Związki karbonylowe
instrukcja enzymatyczna redukcja zwiazkow karbonylowych i wiazan CC, Biotechnologia Enzymatyczna
W -- Zwiazki karbonylowe cz. II, podstawy chemii organicznej
W -- Zwiazki karbonylowe cz. I, podstawy chemii organicznej
ZWIĄZKI KARBONYLOWE
Związki karbonylowe
Enzymatyczna redukcja związków karbonylowych i zawierających wiązania C=C
pochodne związków karbonylowych zadania
Rodzaj alkoholu otrzymywanego w syntezie metodą Grignarda zależy od typu użytego związku karbonylowe
związki karbonylowe
Rodzaj alkoholu otrzymywanego metoda a zalezyuzytego zwiazku karbonylowego(1)
Rodzaj alkoholu otrzymywanego metoda a zalezyuzytego zwiazku karbonylowego
Związki karbonylowe(13)gohar
więcej podobnych podstron