Związki karbonylowe
Związki karbonylowe - związki organiczne zawierające w swych cząsteczkach grupę, w której atom tlenu połączony jest z atomem węgla podwójnym wiązaniem =C=O. Taki układ atomów nazywamy grupą karbonylową. Jest ona grupą funkcyjną dwóch ważnych związków: aldehydów (np. formaldehyd, etanal )
i ketonów (np. aceton).
Uwaga - grupa karbonylowa - grupa funkcyjna aldehydów i ketonów, ponadto wchodzi w skład złożonych grup funkcyjnych charakterystycznych dla kwasów karboksylowych, estrów i amidów. Jej budowa elektronowa podobna jest do wiązania podwójnego C=C. Pary tworzące wiązanie C=O nie są równocenne. Jedna z nich jest trwałą parą typu σ, druga zaś jest znacznie bardziej podatną na rozerwanie parą typu π.
Właściwości chemiczne - aldehydy i ketony dają szereg reakcji uwarunkowanych obecnością grupy karbonylowej C=O. Jest to grupa silnie spolaryzowana. Aldehydy i ketony podlegają reakcjom
utleniania i redukcji
addycji związków Grignarda, alkoholi i wody, pochodnych amoniaku, wodorosiarczanu, hydroksyloaminy, hydrazyny, cyjanków
kondensacja aldolowa
reakcji Cannizaro.
Utlenianie aldehydów i ketonów - utleniaczem może być KMnO4, K2Cr2O7 lub (Ag(NH3)2)+
RCHO lub ArCHO --> RCOOH lub ArCOOH
najbardziej znana reakcja jest reakcja "lustra srebrnego", wykorzystywana do wykrywania aldehydów:
CH3CHO + 2Ag(NH3)2+ + 3OH- --> 2Ag + CH3COO- + 4NH3 + H2O
Redukcja aldehydów i ketonów - produktami reakcji mogą być alkohole lub węglowodory
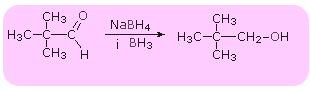
Redukcja do alkoholi - reakcja przebiega z udziałem katalizatorów Ni, Pt lub Pd, LiAlH4 lub NaBH4
RCHO + H2 --> RCH2OH
Redukcja do węglowodorów - reakcja przebiega z udziałem katalizatorów Zn + stęż. HCl lub NH2NH2 (hydrazyna).
C6H5-CO-CH2CH3 ----> C6H5-CH2-CH2CH3
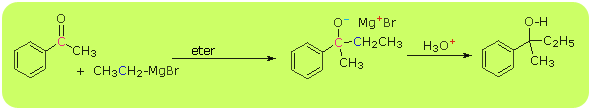
Addycja związków Grignarda - addycja związków była już prezentowana przy metodach otrzymywania alkoholi.
Związki karbonylowe
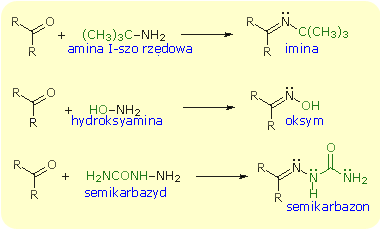
Addycja pochodnych amoniaku - Niektóre pochodne amoniaku przyłączają się do grupy karbonylowej. tworzą się wówczas połączenia, których znaczenie polega głównie na tym, że można je wykorzystać do charakterystyki
i identyfikacji aldehydów i ketonów. Połączenia te zawierają w cząsteczce podwójne wiązanie węgiel-azot, które tworzy się skutek eliminacji cząsteczki wody z początkowo utworzonych produktów addycji.
Addycja wodorosiarczanu - wodorosiarczan przyłącza się do większości aldehydów i do wielu ketonów, tworząc produkty addycji:
=C=O + NaHSO3 --> =C(OH)SO3Na
Reakcję przeprowadza się przez zmieszanie aldehydu lub ketonu ze stężonym roztworem wodorosiarczanu sodowego, a następnie oddziela się produkt w postaci krystalicznego ciała stałego.
Reakcja ta pozwala na oddzielenie ketonów i aldehydów (w postaci nierozpuszczalnej soli) od innych związków organicznych.
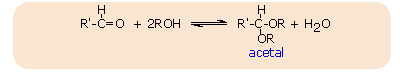
Addycja alkoholi - alkohole w obecności bezwodnego kwasu przyłączają się do grupy karbonylowej aldehydów, wskutek czego tworzą się acetale
CH3CHO + 2C2H5OH <=> CH3CH(OC2H5)2 + H2O
Acetale mają strukturę eterów i podobnie jak etery ulegają rozszczepieniu przez kwasy, natomiast są odporne na działanie zasad.
Kondensacja aldolowa - Pod wpływem rozcieńczonej zasady lub rozcieńczonego kwasu dwie cząsteczki aldehydu lub ketonu mogą łączyć się, w wyniku czego tworzy się beta-hydroksyaldehyd albo beta-hydroksyketon
CH3CHO + CH3CHO --> CH3-CH(OH)-CH2-CHO
Reakcja ta nie zachodzi jeżeli cząsteczka aldehydu lub ketonu nie zawiera atomu wodoru (alfa). Z tego wynika, że reakcji nie będzie podlegać: ArCHO, HCHO, ArCOAr, ArCOCH3
Reakcja Cannizaro - Aldehydy nie zawierające atomów wodoru (alfa) ulegają w obecności stężonych roztworów zasad (NaOH) reakcji samoutlenienia-redukcji prowadzącej do mieszaniny alkoholu i soli kwasu karboksylowego
2HCHO ---> CH3OH + HCOO-Na+
Aldehydy
Aldehydy - związki organiczne, w których cząsteczkach grupa karbonylowa połączona jest jednym wiązaniem pojedynczym z atomem wodoru, a drugim z resztą węglowodorową cząsteczki. Grupą funkcyjną aldehydów jest grupa aldehydowa -CHO. R to rodnik alkilowy lub arylowy. Symbol - RCHO
Grupa karbonylowa - w aldehydach grupa C=O występuje na końcu łańcucha węglowego, łączy się z nim pojedynczym wiązaniem C-C, czwarte wiązanie jest wysycone atomem wodoru.
Przykłady związków -
metanal, aldehyd mrówkowy - HCHO
etanal, aldehyd octowy - CH3-CHO
aldehyd benzoesowy (aromatyczny) - C6H5-CHO
Nazewnictwo - Systematyczne nazwy aldehydów tworzymy dodając końcówkę -al do nazwy macierzystego węglowodoru. Powszechnie stosuje się nomenklaturę aldehydów wywodzącą się od nazwy odpowiadającego im kwasu.
Szereg homologiczny -
metanal - HCHO - aldehyd mrówkowy, formaldehyd
etanal - CH3CHO - aldehyd octowy, acetaldehyd
propanal - CH3-CH2-CHO - aldehyd propionowy
butanal - CH3-CH2-CH2-CHO - aldehyd masłowy
pentanal - CH3-CH2-CH2-CH2-CHO - aldehyd walerianowy
Otrzymywanie -
utlenianie alkoholi I-szo rzędowych w obecności K2Cr2O7
utlenianie metylowych pochodnych benzenu
redukcja chlorków kwasowych
synteza Reimera-Tlemanna (otrzymywanie fenolo-aldehydów)
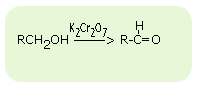
- utlenianie alkoholi I-szo rzędowych: RCH2OH --> RCHO
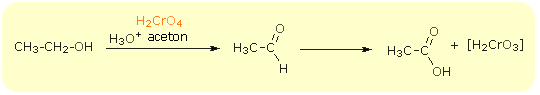
Pogłębione utlenianie alkoholi I-szo rzędowych daje nam produkt końcowy - kwas karboksylowy
- utlenianie metylowych pochodnych benzenu:
ArCH3 + Cl2 --> ArCHCl2
ArCHCl2 + H2O --> ArCHO
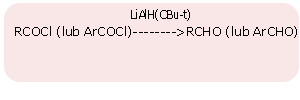
- redukcja chlorków kwasowych:
- synteza Reimera-Tiemanna (otrzymywanie fenolo-aldehydów):
W wyniku działania chloroformu i wodnego roztworu wodorotlenku na fenol grupa aldehydowa -CHO zostaje wprowadzona do pierścienia aromatycznego, na ogół w położenie orto do grupy -OH.
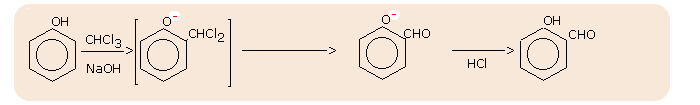
C6H5OH + (CHCl3, NaOH) --> HOC6H4CHO
Proces polimeryzacji, proces polikondensacji - Obecność wiązania podwójnego C=O powoduje, że aldehydy, podobnie jak związki nienasycone, mają zdolność do polimeryzacji i polikondensacji
Zastosowanie - w procesie polikondensacji fenolu z formaldehydem powstają żywice fenolowo- formaldehydowe stosowane do wyrobu lakierów, klejów , laminatów, tworzyw sztucznych
- etanal znalazł zastosowanie m.in. do produkcji kwasu octowego, alkoholu etylowego, chloroformu i wielu tworzyw sztucznych
- aldehyd benzoesowy stosuje się przy wyrobach cukierniczych jako składnik sztucznego olejku migdałowego
Właściwości fizyczne:
- stan skupienia
C1 - występuje w stanie gazowym
> C2 - występują w stanie ciekłym
- charakterystyczny zapach
C1 - C3 - mają nieprzyjemny zapach
C4 - C7 - mają odrażającą woń
> C8 - mają przyjemny zapach
Ketony
Ketony - związki organiczne zawierające grupę karbonylową, która jest połączona z dwiema grupami węglowodorowymi. Symbol - RCOR1
Grupa karbonylowa - W ketonach grupa C=O występuje wewnątrz łańcucha węglowego cząsteczek, atom węgla grupy karbonylowej jest drugorzędowy
Przykłady związków -
propanon, aceton - CH3 - CO - CH3
2-butanon, keton etylo-metylowy - C2H5COCH3
acetofenon (aromatyczny) - C6H5COCH3
Nazewnictwo - Systematyczne nazwy ketonów tworzymy dodając końcówkę -on do nazwy macierzystego węglowodoru. Stosuje się też nazwy wywodzące się od nazw grup funkcyjnych w formie przymiotnikowej
z poprzedzającym je słowem ,,keton''.
Otrzymywanie -
utlenianie alkoholi II-go rzędowych
acylowanie metodą Friedla-Craftsa
reakcja chlorków kwasowych ze związkami kadmoorganicznymi
Przykłady:
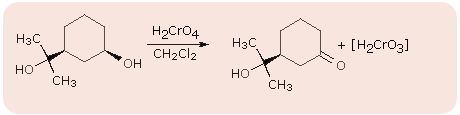
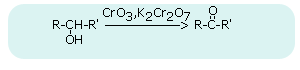
Utlenianie alkoholi II-go rzędowych
Acylowanie metodą Friedla-Craftsa
Jest to reakcja chlorków kwasowych - RCOCl. W tej reakcji grupa acylowa RCO- zostaje przyłączona do pierścienia aromatycznego, w wyniku czego tworzy się keton. proces ten nazywany jest acylowaniem.
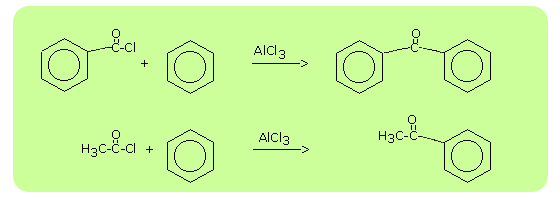
R-CO-Cl + Ar-H --> R-CO-Ar + HCl
Reakcja acylowania Friedla-Craftsa jest jedną z najważniejszych metod otrzymywania ketonów z grupą karbonylową połączoną bezpośrednio z pierścieniem aromatycznym.Ketony te można następnie w wyniku redukcji przekształcić w alkohole drugorzedowe lub w wyniku reakcji ze związkami Grignarda - w alkohole trzeciorzędowe oraz w związki przynależne do wielu innych ważnych klas.
Proces polimeryzacji - nie ulegają
Proces polikondensacji - pod wpływem silnych utleniaczy w cząsteczkach ketonów następuje rozerwanie wiązania C-C przy grupie karbonylowej i powstanie mieszaniny kwasów karboksylowych o krótszych łańcuchach.
Właściwości redukujące - ketony nie wykazują właściwości redukujących (negatywny wynik prób Tollensa
i Trommera). Wynika to z braku atomu wodoru związanego bezpośrednio z grupą karbonylową.
Grupa karbonylowa występująca w ketonach położona jest wewnątrz łańcucha węglowego, brak też przy niej wiązania C-H. Powoduje to, że ketony utleniają się znacznie trudniej niż aldehydy. Dopiero pod wpływem silnych utleniaczy w cząsteczkach ketonów następuje rozerwanie wiązania C-C przy grupie karbonylowej i powstanie mieszaniny kwasów karboksylowych o krótszych łańcuchach.
Zastosowanie - aceton jest dobrym rozpuszczalnikiem tłuszczów , żywic, lakierów dlatego tez znalazł zastosowanie przy produkcji farb, lakierów niektórych tworzyw sztucznych np.: szkła organicznego
Właściwości fizyczne -
- są cieczami.
- są lotniejsze niż odpowiadające im alkohole.
- rozpuszczają się w wodzie i w rozpuszczalnikach organicznych w tym samym stopniu co alkohole.
- są dobrymi rozpuszczalnikami organicznymi.
- mają małą zdolność do krystalizacji.
Iwona Król - nauczyciel chemii VIII LO
„Notatki ucznia”
www.viii-lo.krakow.pl
Wyszukiwarka
Podobne podstrony:
Enzymatyczna redukcja związków karbonylowych i zawierających wiązania C=C
pochodne związków karbonylowych zadania
14 %20Zwiazki%20karbonylowe
Związki karbonylowe(13)gohar
instrukcja enzymatyczna redukcja zwiazkow karbonylowych i wiazan CC, Biotechnologia Enzymatyczna
W -- Zwiazki karbonylowe cz. II, podstawy chemii organicznej
W -- Zwiazki karbonylowe cz. I, podstawy chemii organicznej
wyk 7 etery,związki karbonylowe
ZWIĄZKI KARBONYLOWE
Związki karbonylowe
Enzymatyczna redukcja związków karbonylowych i zawierających wiązania C=C
pochodne związków karbonylowych zadania
Rodzaj alkoholu otrzymywanego w syntezie metodą Grignarda zależy od typu użytego związku karbonylowe
związki karbonylowe
Rodzaj alkoholu otrzymywanego metoda a zalezyuzytego zwiazku karbonylowego(1)
Rodzaj alkoholu otrzymywanego metoda a zalezyuzytego zwiazku karbonylowego
Związki karbonylowe(13)gohar
więcej podobnych podstron