
1
ZAGADNIENIA:
• Jak atomy rozmieszczone są w ciałach stałych?
(w metalach)
• Jak gęstość zależy od struktury krystalicznej?
• Kiedy własności zależą od orientacji próbki?
Struktura krystaliczna ciał
stałych
2
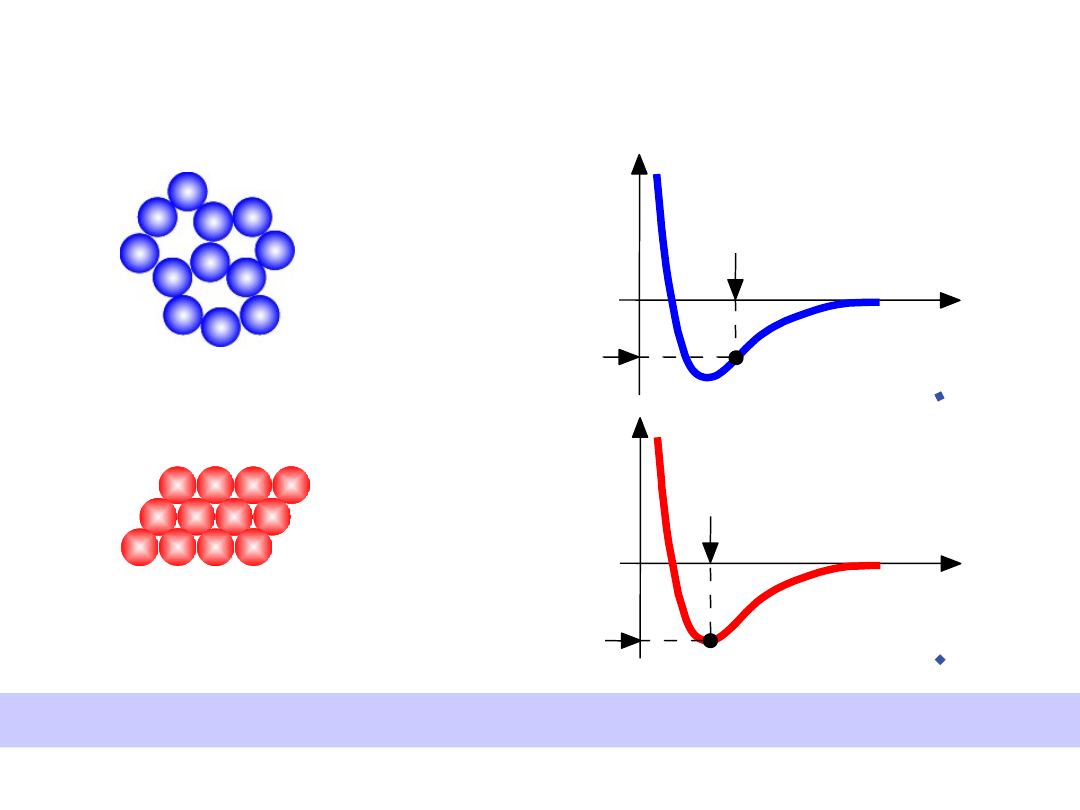
• Mała gęstość,
przypadkowe
• Gęste,
uporządkowane
Struktury o gęstym wypełnieniu przestrzeni mają mniejsze energie
Energia i Upakowanie
Energy
r
typowa długość
wiązania
typowa energia
wiązania
Energy
r
typowa długość
wiązania
typowa energia
wiązania
3
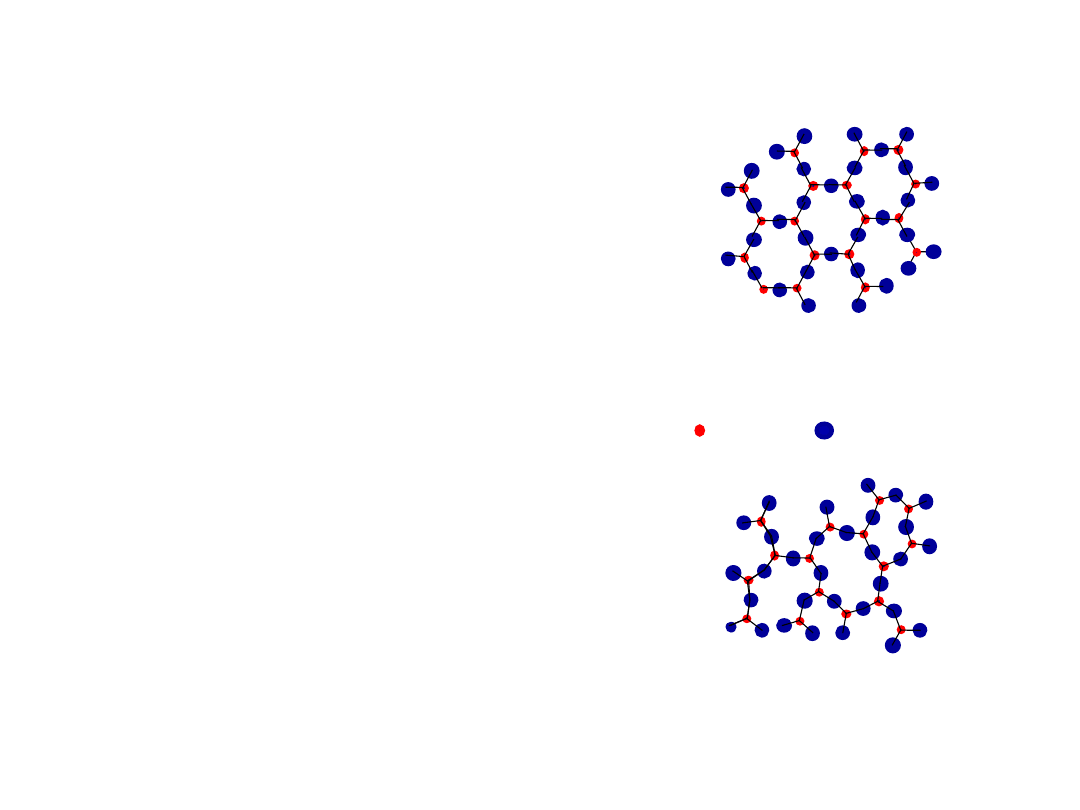
• atomy ułożone periodycznie
Materiały krytaliczne
-metali
-wielu ceramik
-niektórych polimerów
• brak periodycznego ułożenia
Niekrystaliczne
materiały
-złozonych strukturach
-po gwałtownym chłodzeniu
crystaliczny SiO
2
niecrystaliczny SiO
2
"
Amorficzny
" = Niekrystaliczny
Energia i Upakowanie
Si
Oxygen
• typowe dla:
• wystepują w:
4
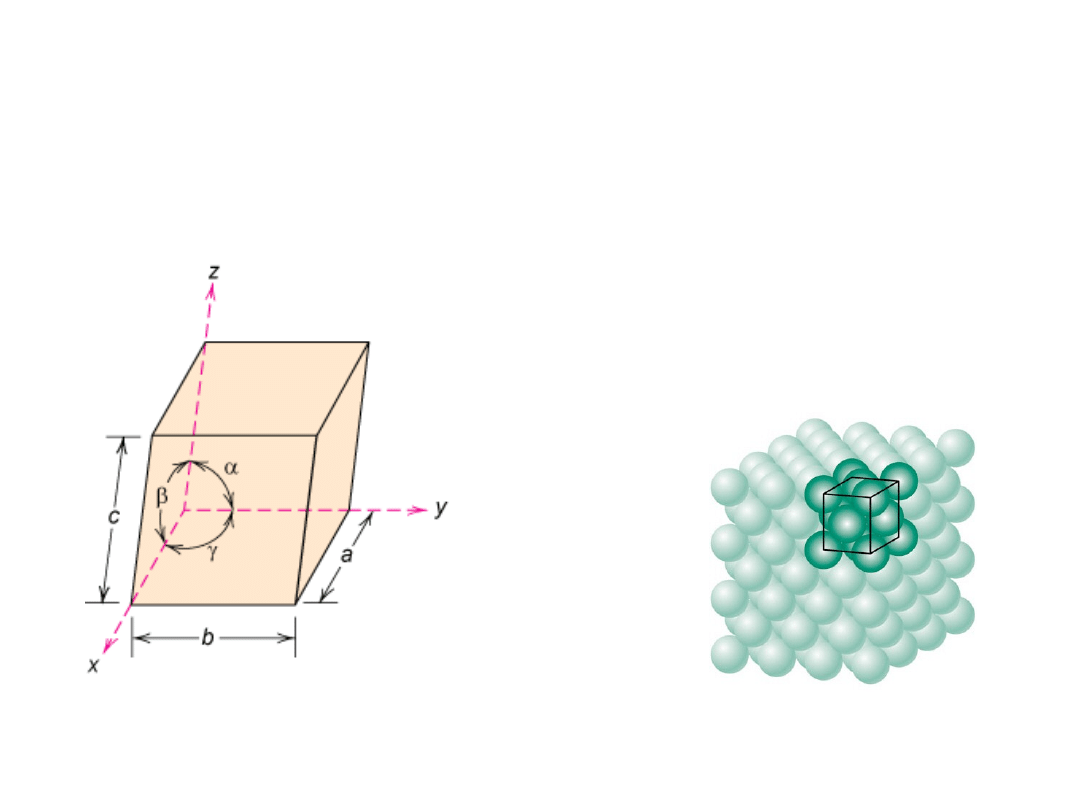
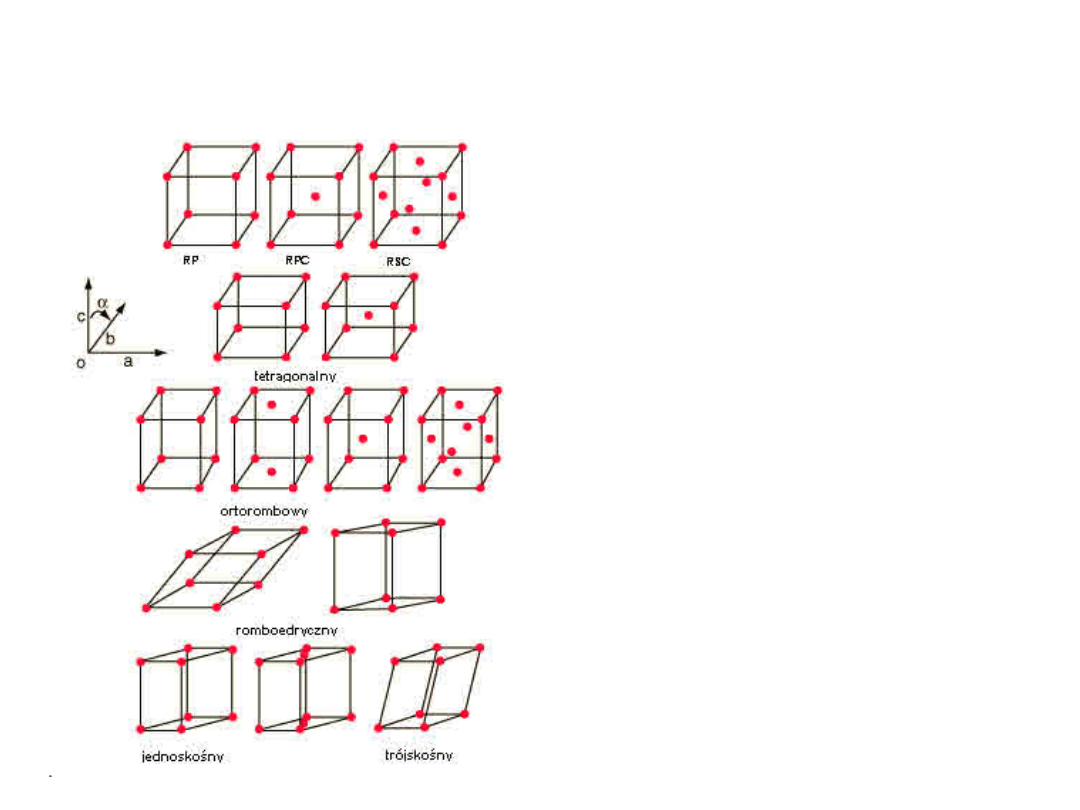
Elementy Krystalografii
7 układów
krystalograficznych
14 typów sieci
Komórka elementarna:
najmniejsza
powtarzalna objętość kryształu zawierająca pełną
informację o rozmieszczeniu atomów (wzorzec).
a, b,
i
c
są
stałymi
sieciowymi
a, b, c,
oraz
, ,
są
parametra
mi
sieciowymi
Komórki elementarne są
równoległościanami

5
Charakteristyka kryształów
• Liczba atomów w komórce
elementarnej
• Liczba koordynacyjna
Liczba najbliższych sąsiadów
• Współczynnik wypełnienia
Atomy (lub jony) w strukturze krystalicznej
można traktować jako sztywne kule o określonej
średnicy. Jest to tzw.
model sztywnych
kul
Ważne parametry:
6
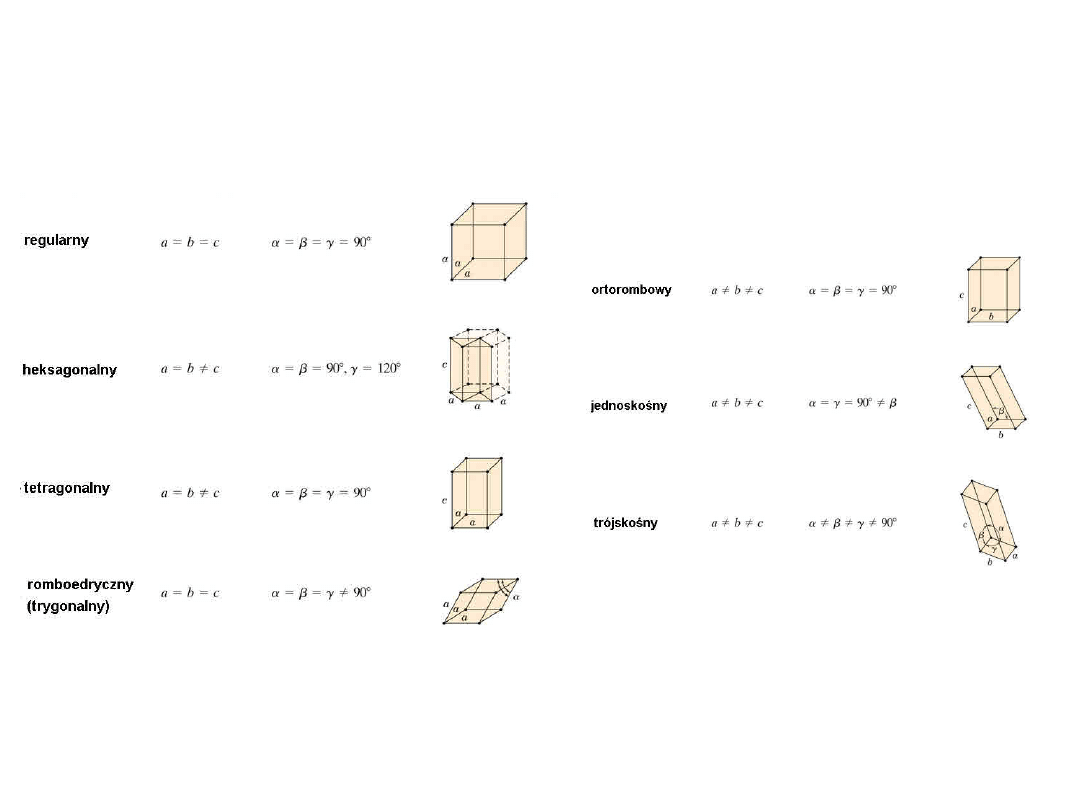
Siedem Systemów
Krystalograficznych
7
Czternaście typów sieci
• P – Prymitywna (prosta)
• F – Ściennie centrowana:
dodatkowy
punkt na
środku każdej ściany
• I - Przestrzennie centrowana:
dodatkowy punkt w środku
komórki
• C - Centerowana: dodatkowy punkt
na przeciwległych ścianach
• R - Romboedryczna
8
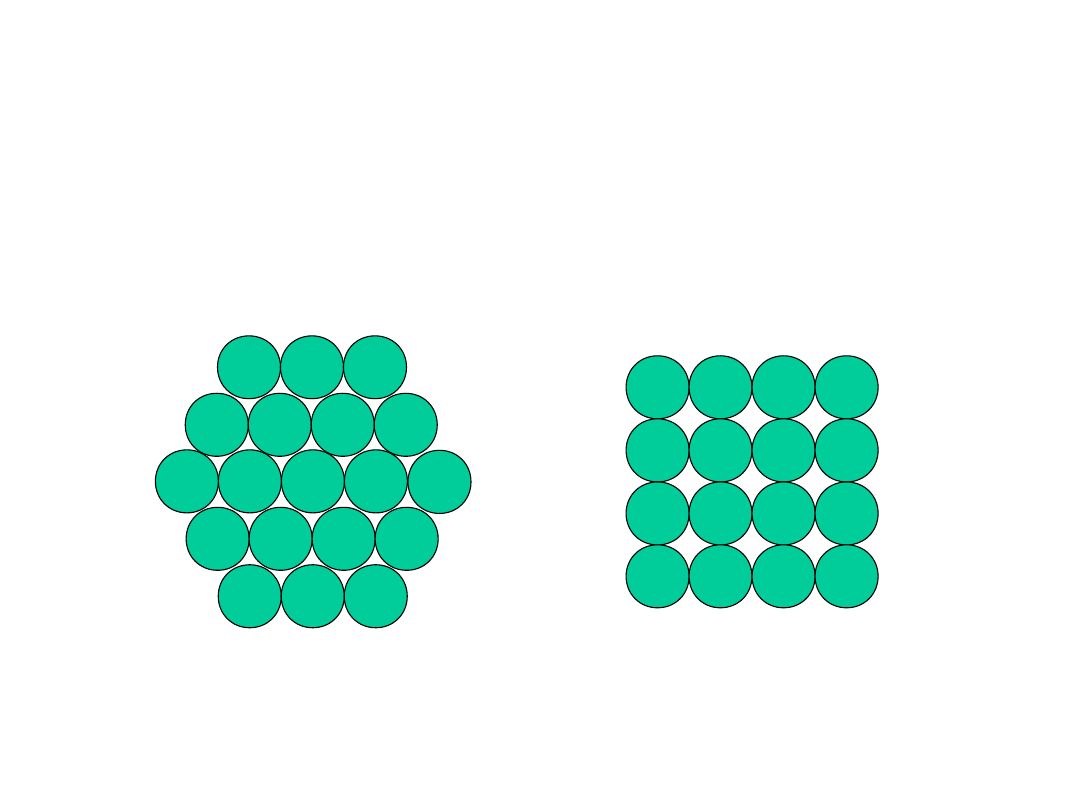
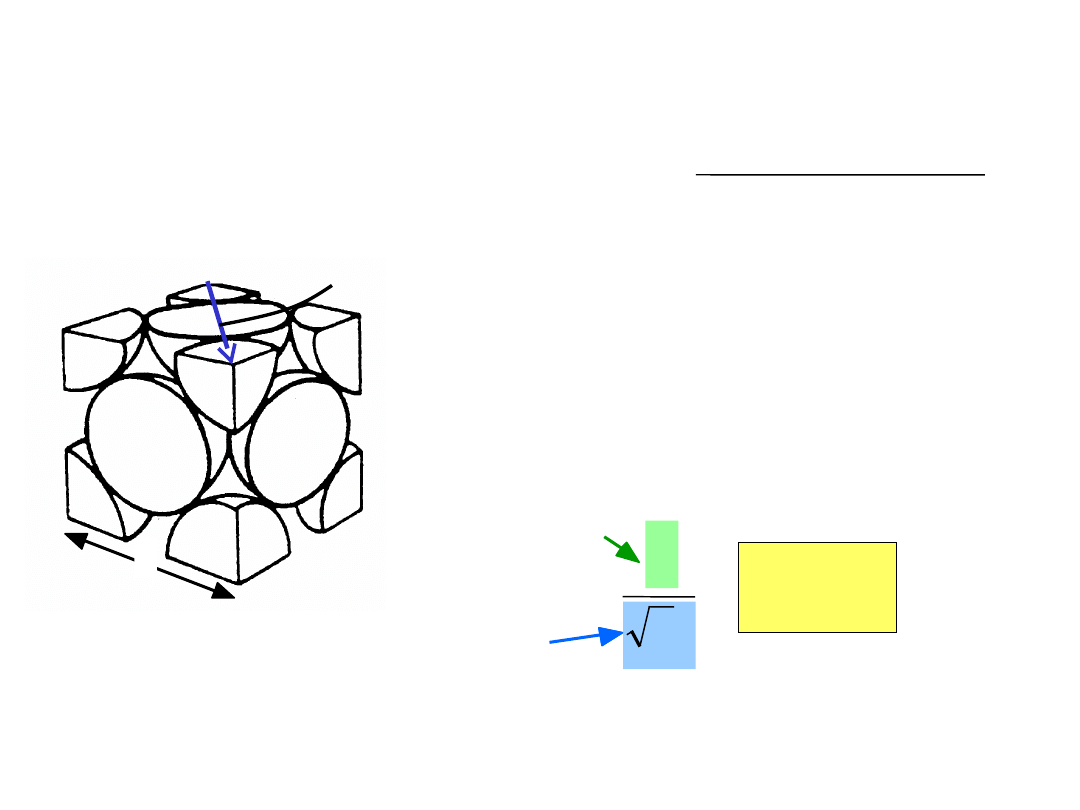
Struktura krystaliczna metali
• J
ak rozmieścić atomy, aby zminimalizować
zajmowaną przestrzeń?
2-wymiary
vs.
Nałóżmy teraz drugą warstwę aby uzyskać
strukturę trójwymiarową

9
• Tendencja do gęstego upakowania
• Przyczyny:
- Zazwyczaj, tylko jeden pierwiastek, promienie
wszystkich atomów są jednakowe
- Wiązanie metaliczne jest bezkierunkowe
- Odległości pomiędzy sąsiednimi atomami są małe,
gdyż to minimalizuje energię wiązań
- Chmura elektronowa jest wspólna dla wszystkich
jonów
• Mają najprostsze struktury krystaliczne
Rozpatrzymy trzy takie struktury...
Struktura krystaliczna metali
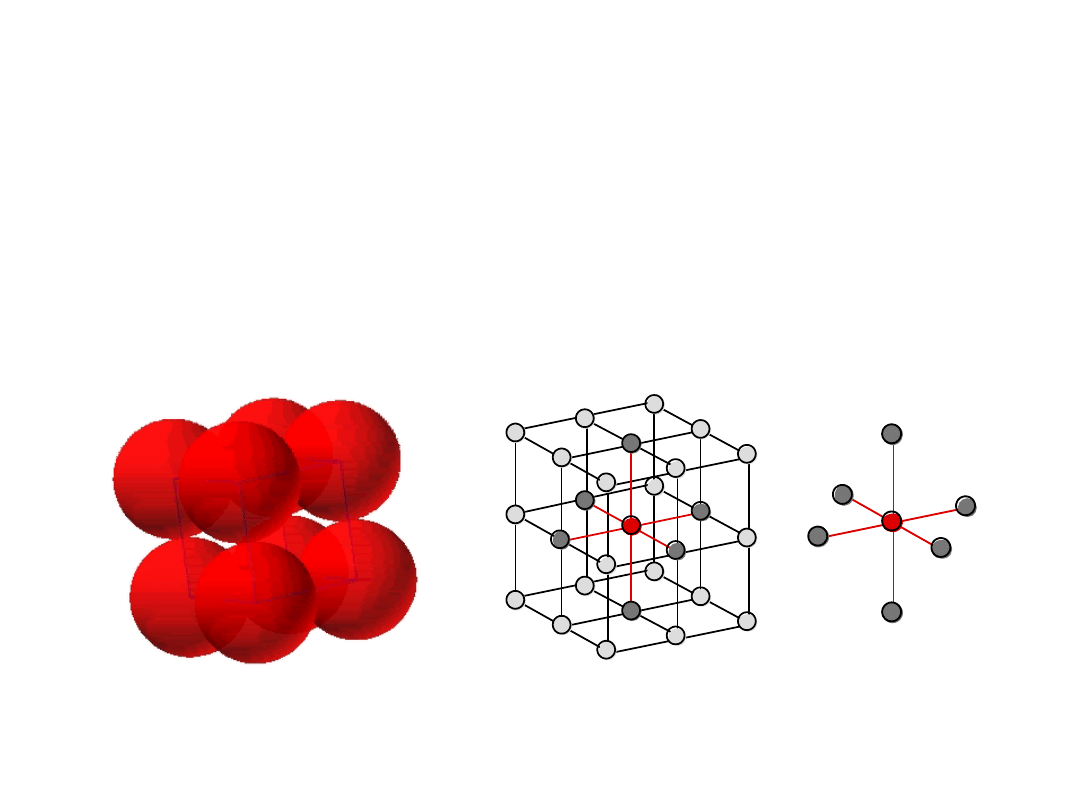
10
• B. rzadka, bo mała gęstość upakowania atomów
(tylko Po
•
Kierunki o najgęstszym ułożeniu;
krawędzie sześcianu
•
# koordynacyjna
= 6
(# najbliższych sąsiadów)
Struktura Regularna
Prymitywna (RP)
11
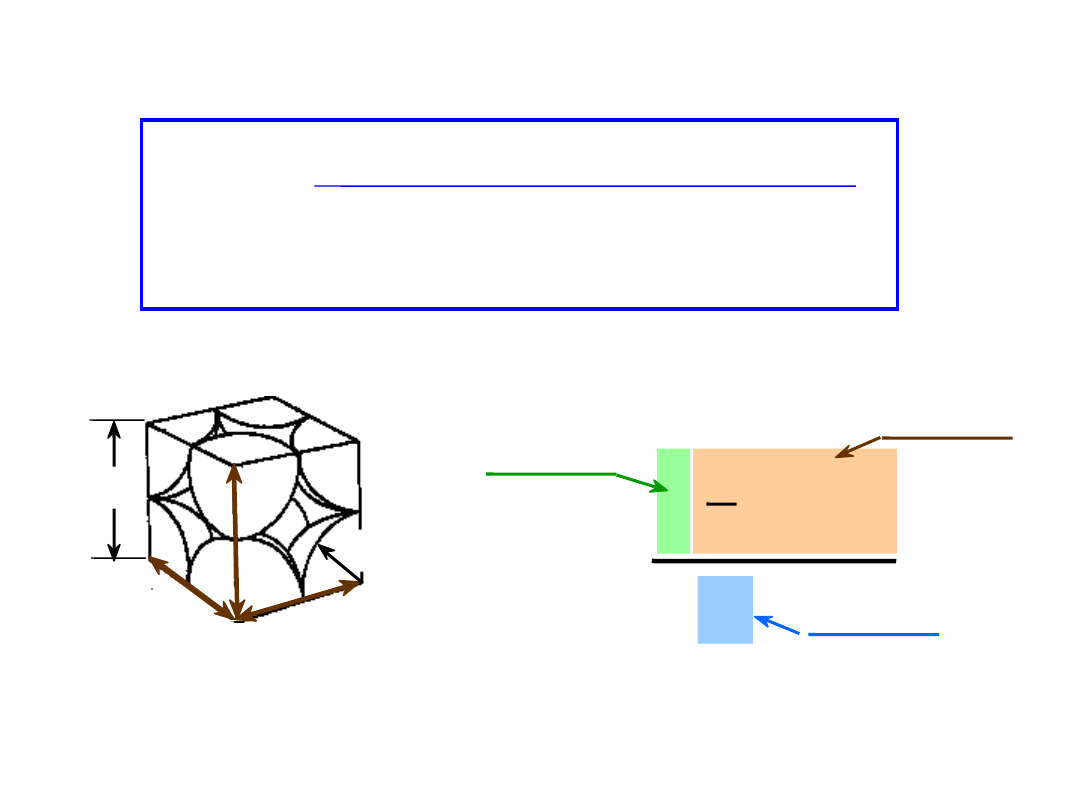
• WWP dla struktury regularnej prymitywnwej = 0.52
APF =
a3
4
3
(0.5a)3
1
atomy
kom. el.
atom
objętość
kom. el.
objętość
Współczynnik Wypełnienia
Przestrzeni
WWP =
Objętość atomów w komórce el.*
Objętość komórki el.
* w modelu sztywnych kul
kierunki o najgęstszym ułożeniu
a
R=0.5a
zawiera 8 x 1/8 =
1
atom/kom. el.
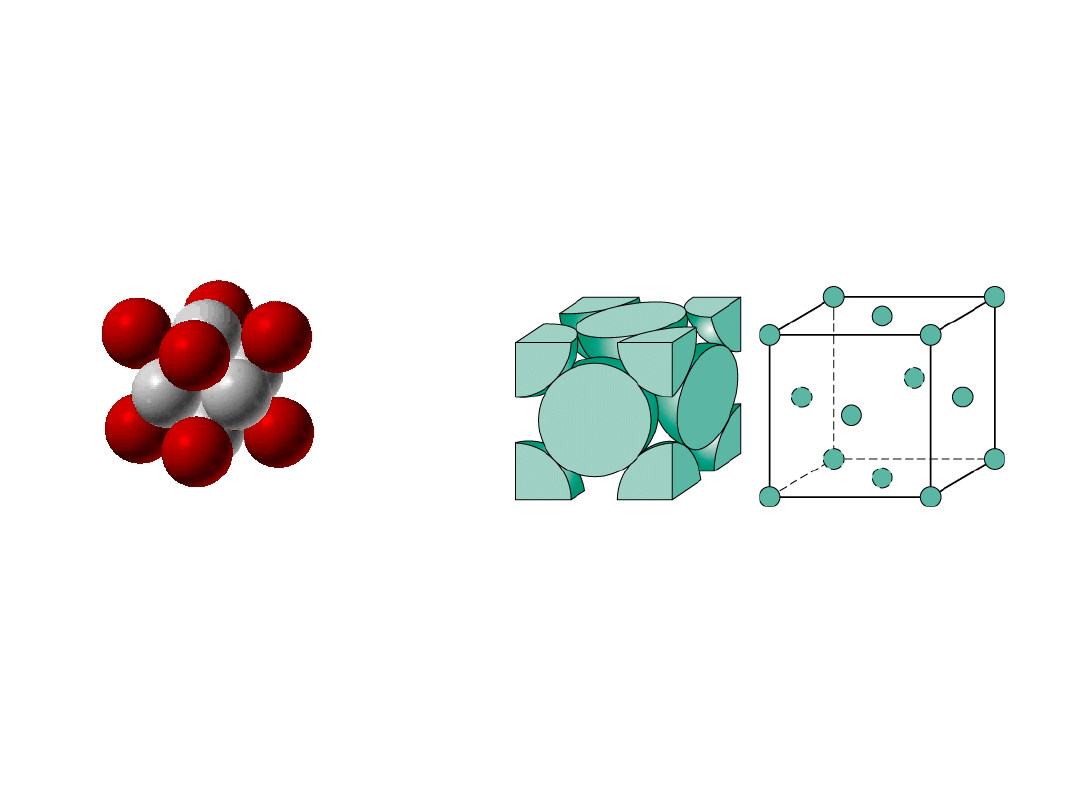
12
• # K
oordynacyjna = 12
• Atomy stykają się wzdłuż przekątnych ścian
Struktura regularna ściennie
centrowana
np.: Al, Cu, Au, Pb, Ni, Pt, Ag
4 atomy/kom. el.: 6 ścian x 1/2 + 8 naroży x 1/8
Uwaga: Wszystkie
atomy są jednakowe;
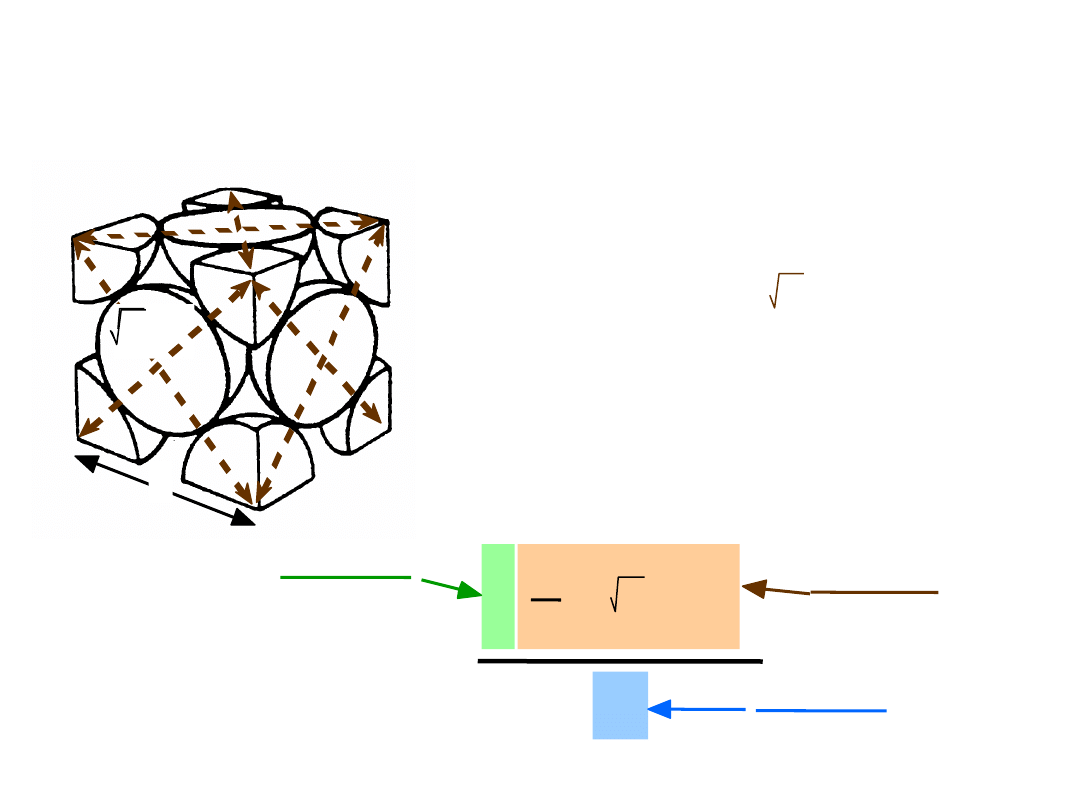
13
• Wsp. wypełnienia przestrzeni = 0.74
Współczynnik Wypełnienia Przestrzeni:
RSC
maksymalny
WW =
4
3
( 2a/4)3
4
atomy
kom. el.
atom
obj.
a3
kom. el.
obj.
Kierunki najgęstszego ulożenia:
długość = 4R =
2 a
Kom. el. zawiera:
6 x
1/2 + 8 x
1/8
=
4 atomy/kom. el.
a
2 a
14
A
B
B
B
B
B
B
B
C
C
C
C
A
B
B
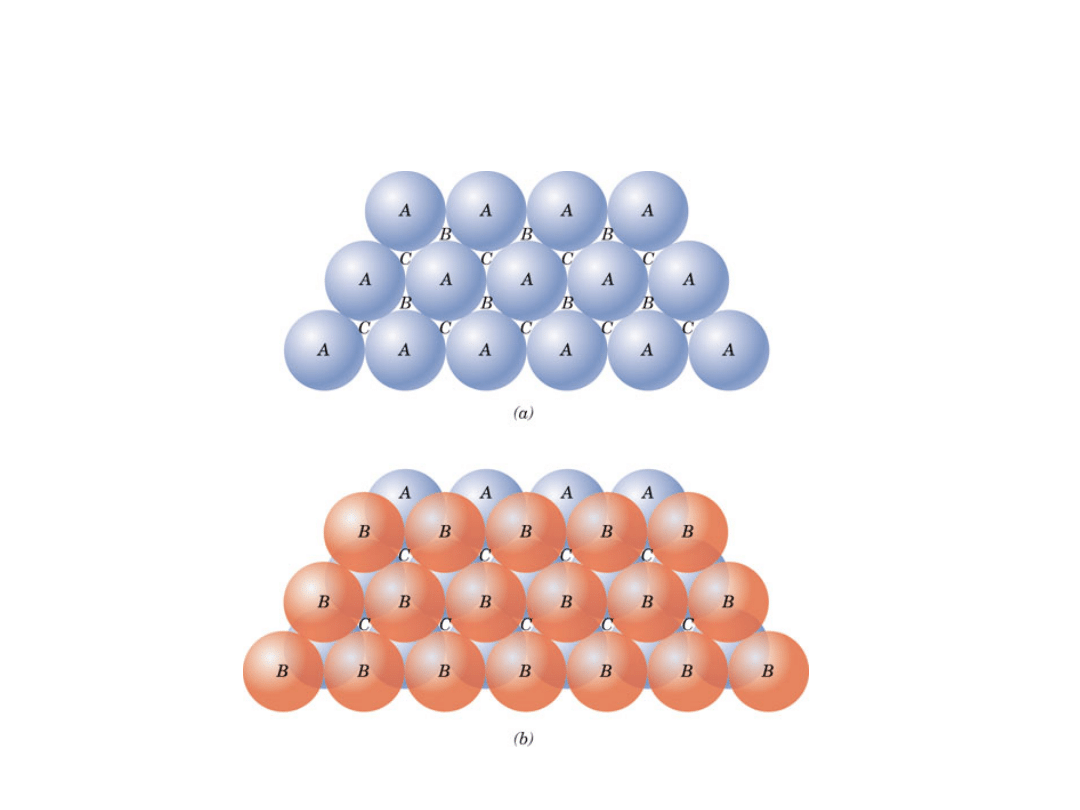
• ABCABC... Sekwencja ułożenia
Komórka
elementarna
RSC
Ułożenie atomów w strukturze RSC
B
B
B
B
B
B
B
C
C
C
A
C
C
C
A
A
B
C
15
Struktury o najgęstszym ułożeniu
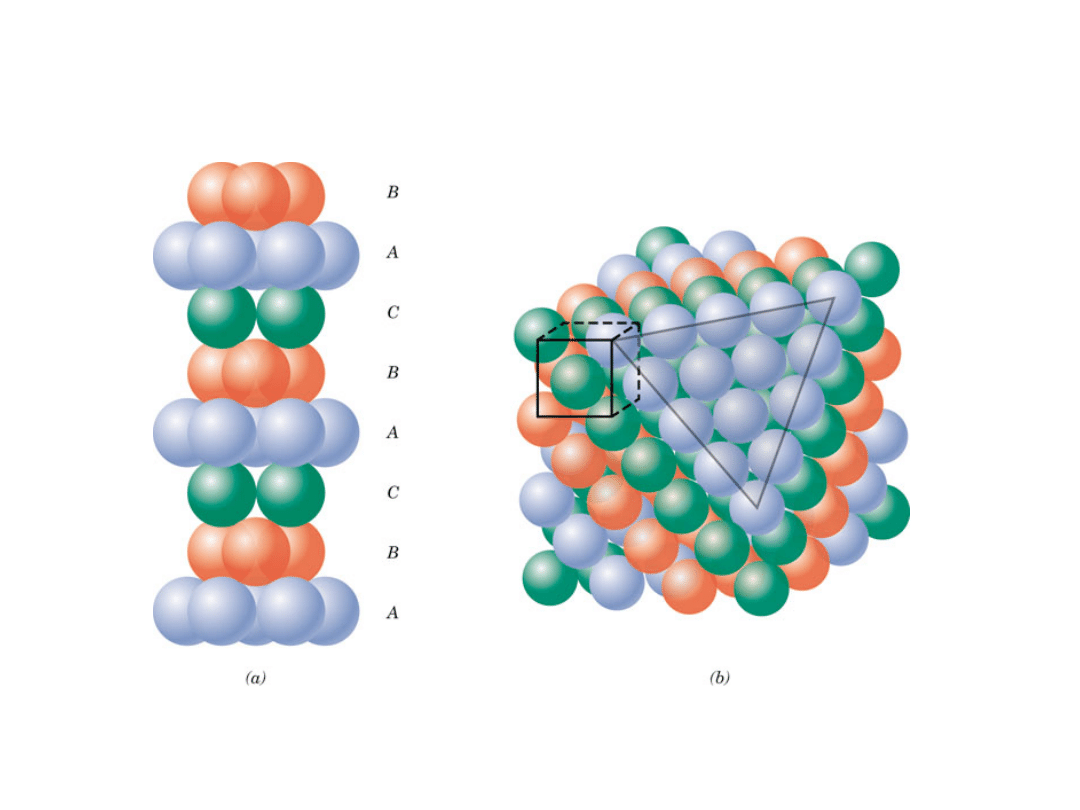
16
Regularna Ściennie
Centrowana
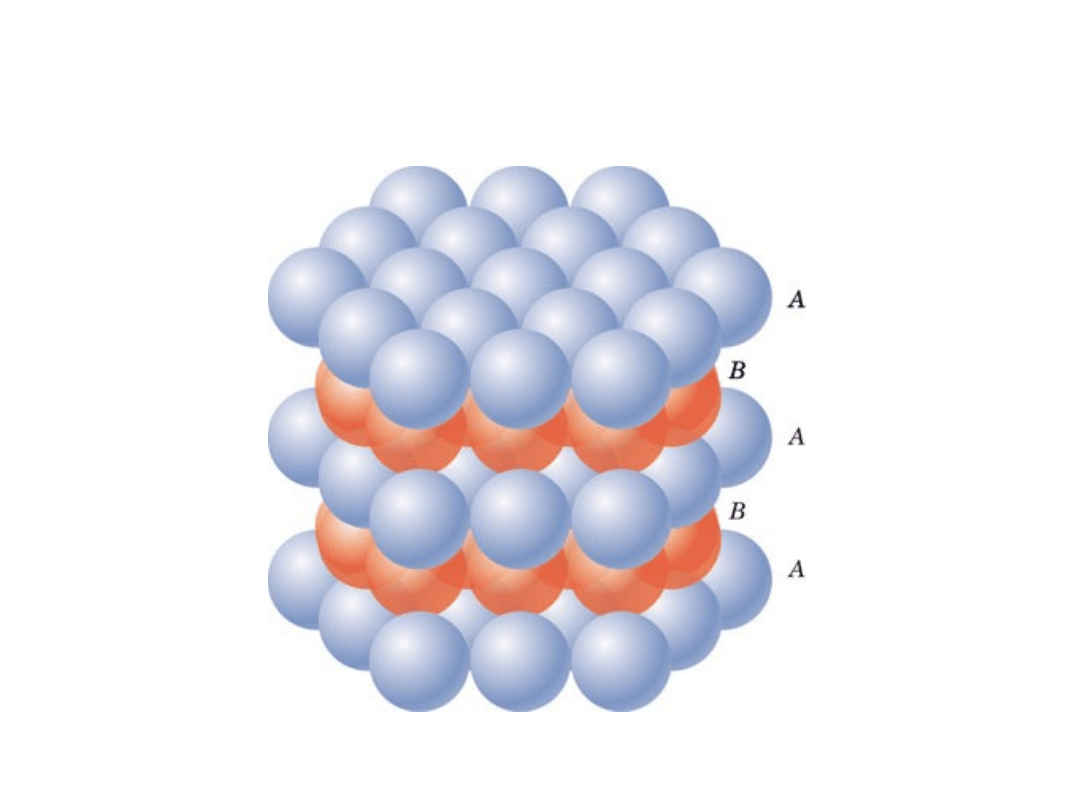
17
Heksagonalna Zwarta
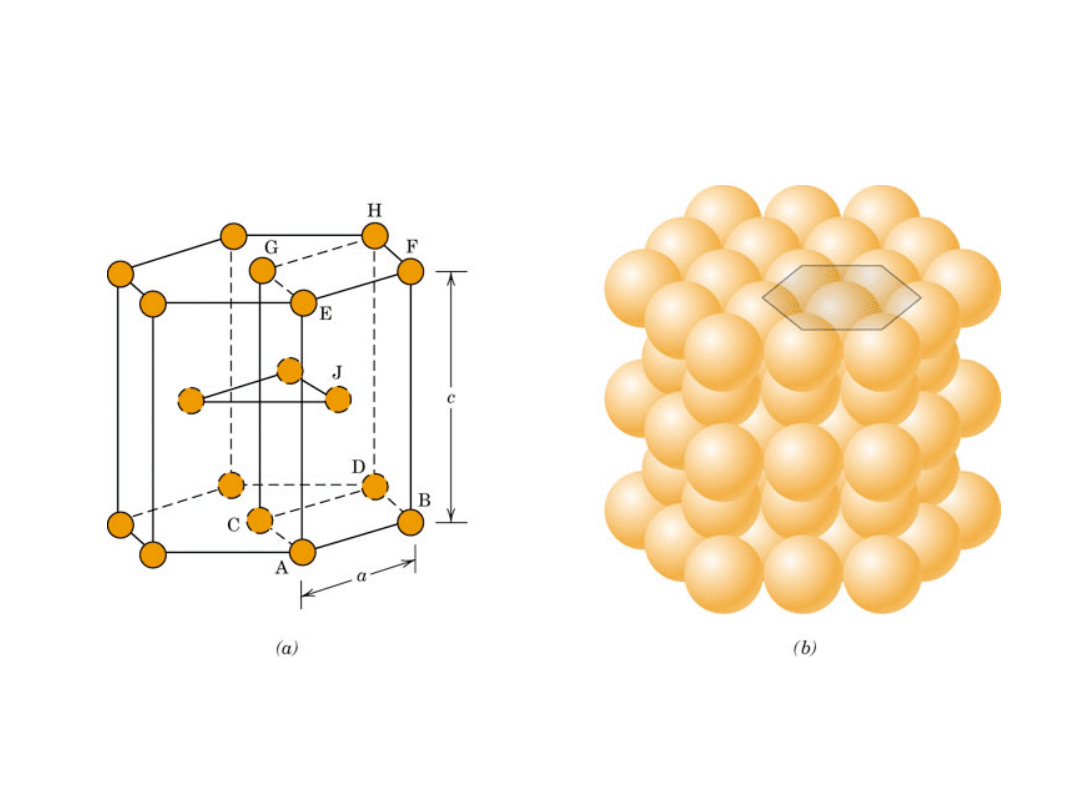
18
Heksagonalna Zwarta
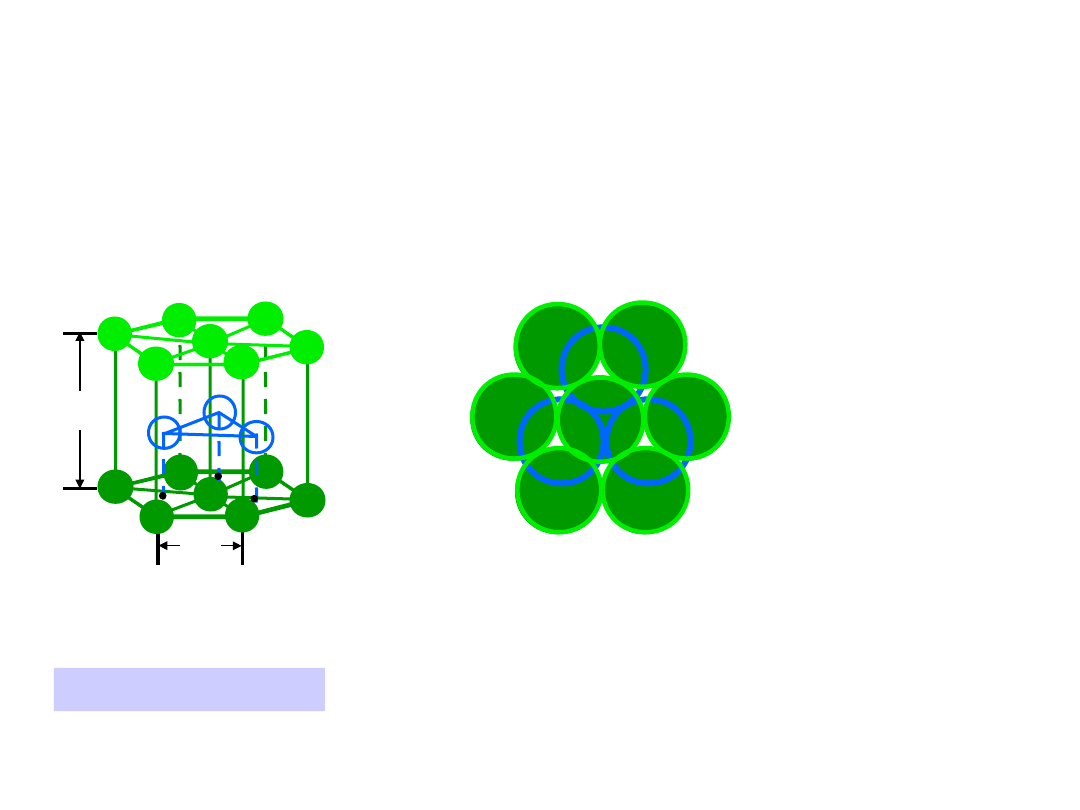
19
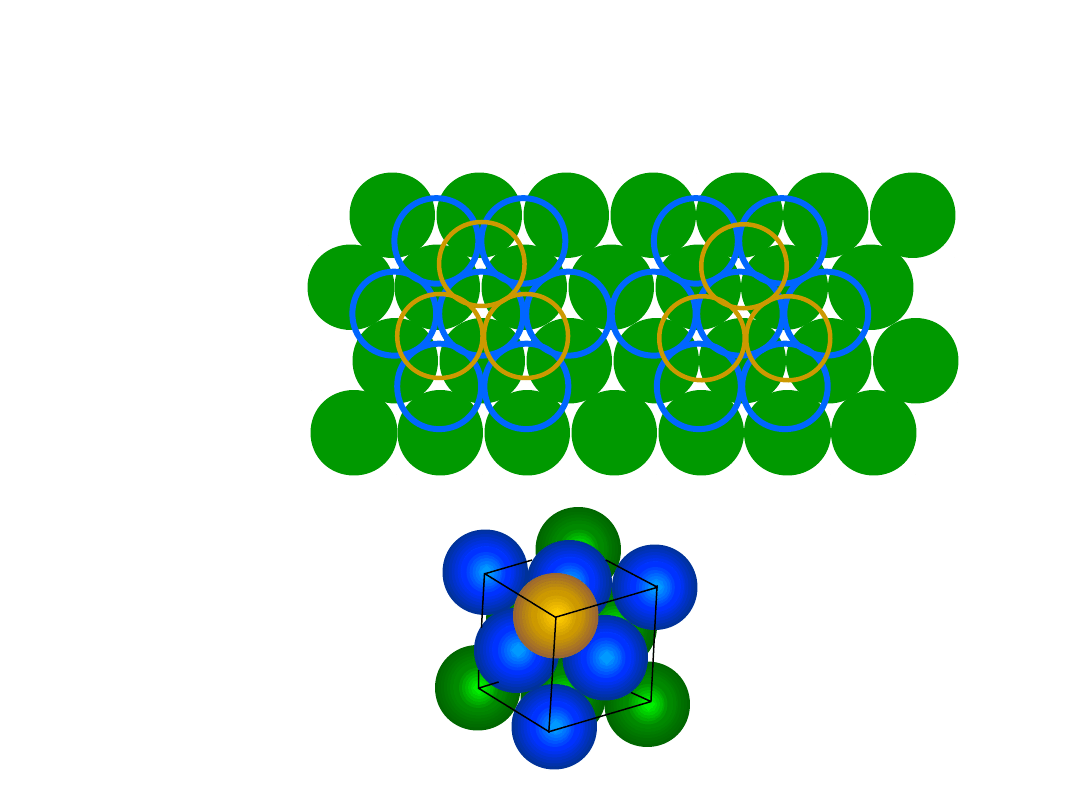
• # Koordynacyjna = 12
• ABAB... Sekwencja ułożenia
• WWP = 0.74
• 3D
• 2D
Heksagonalna Zwarta (HZ)
6 atomów/kom. el.
np.: Cd, Mg, Ti,
Zn
• c/a = 1.633
c
a
A
B
A
Dolna warstwar
Środkowa warstwa
Górna warstwa
r
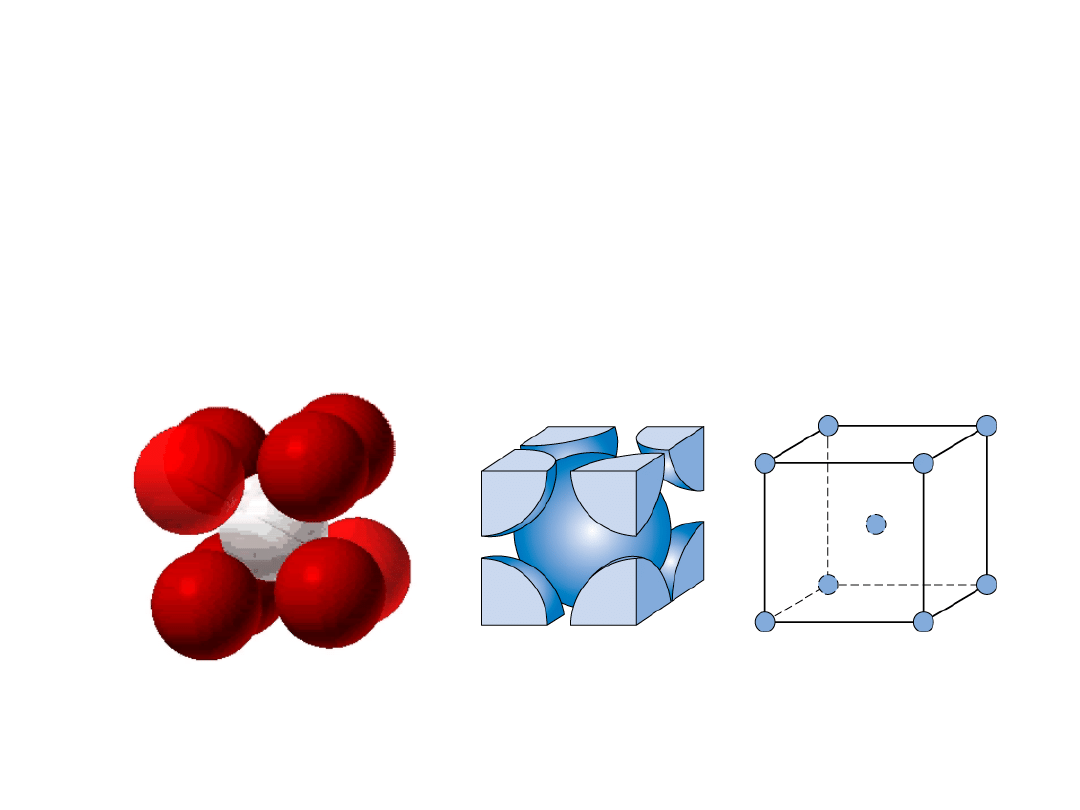
20
• # Koordynacyjna = 8
• Atomy stykają się wzdłuż przekątnej sześcianu
Struktura regularna przestrzennie
centrowana
np.: Cr, W, Fe (), Ta, Mo
2 atomy/kom. el.: 1 środek + 8 naroży x 1/8
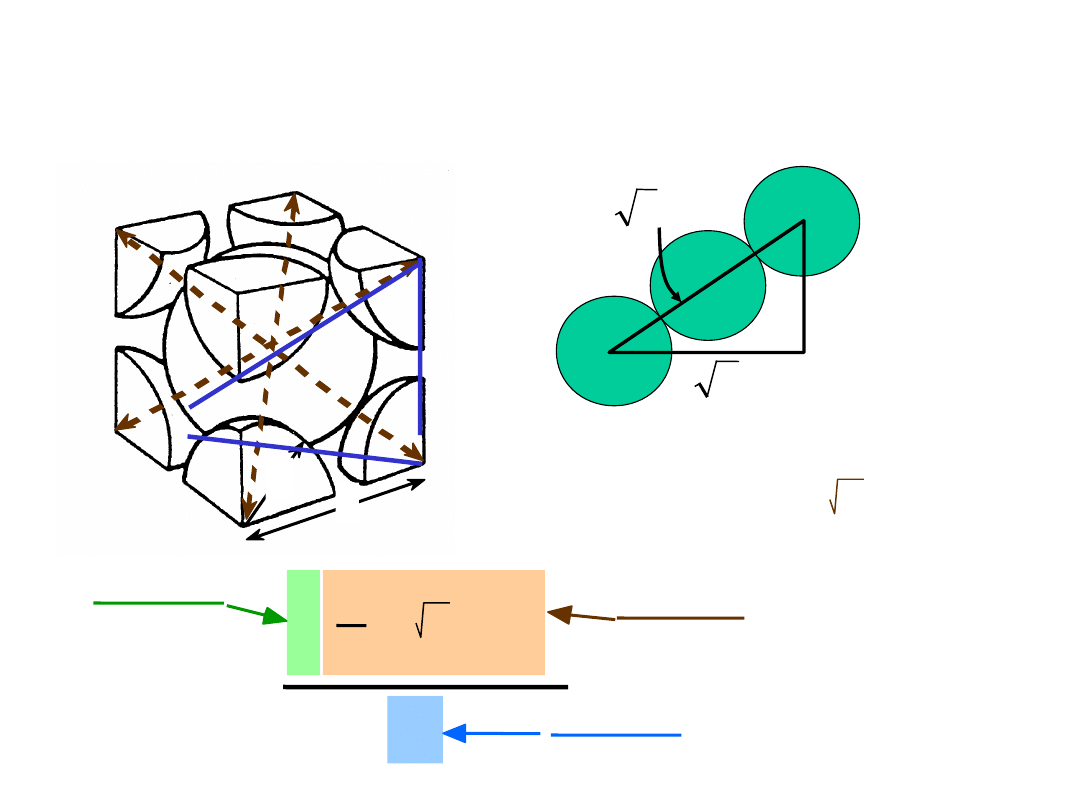
21
Współczynnik Wypełnienia
Przestrzeni
a
WWP =
4
3
( 3a/4)3
2
atomy
kom. el.
atom
objętość
a3
kom. el.
objętość
długość = 4R =
Kierunek najgęstszego ułożenia:
3 a
• WWP dla struktury RPC = 0.68
a
R
a
2
a
3

22
Gęstość Teoretyczna,
gdzie
n = liczba atomów/kom. el.
A =
masa
atomowa
V
C
= Objętość kom. el. = a
3
for cubic
N
A
= Liczba Avogadra
= 6.023 x 10
23
atomów/mol
Gęstość = =
V
C
N
A
n
A
=
Całkowita obj. kom. el.
el.
kom.
w
Atomów
Masa
23
• Np.: Cr (RPC)
A =
52.00 g/mol
R = 0.125 nm
n = 2
teoret
a = 4R/ 3 = 0.2887
nm
rzecz.
a
R
=
a3
52.00
2
atomy
kom. el.
mol
g
kom. el.
objętość
atomy
mol
6.023
x
10
23
Gęstość Teoretyczna,
= 7.18 g/cm
3
= 7.19 g/cm
3
24
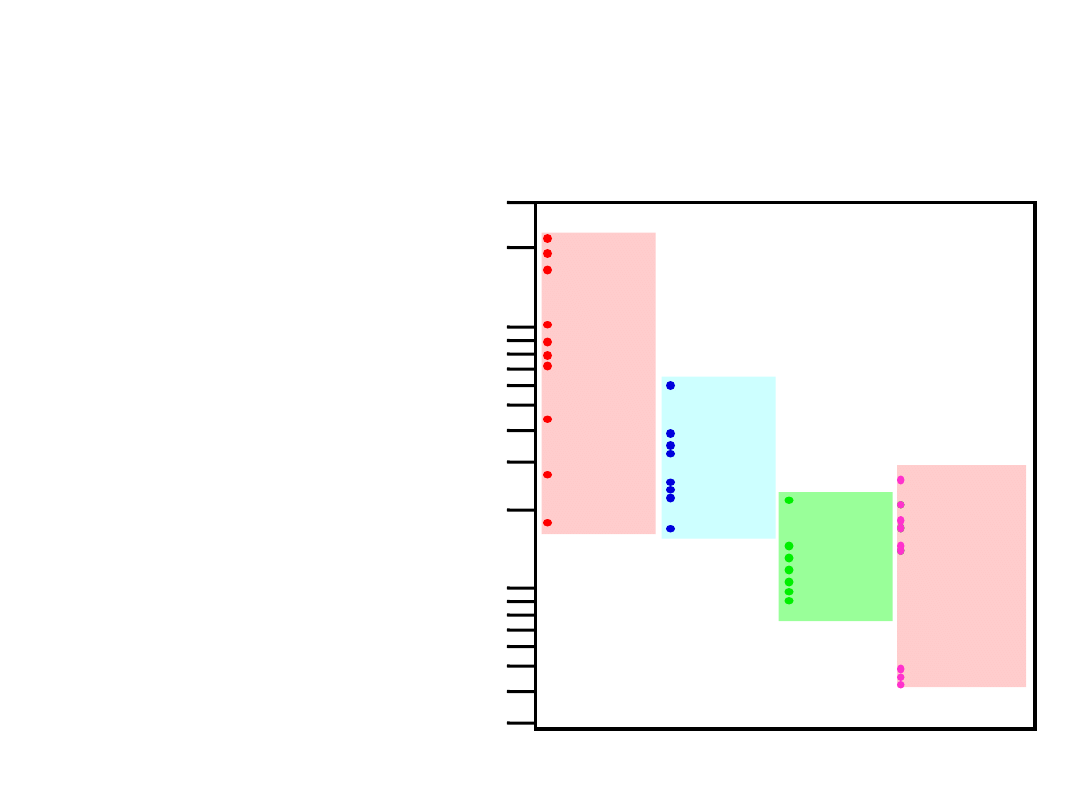
Gęstości różnych materiałów
metali
>
ceramik
>
polimerów
(g
/c
m
)
3
Grafite/
Ceramiki/
Półprzewod.
Metale/
Stopy
Kompozyty/
Włókna
Polimery
1
2
20
30
B
ased on data in Table B1, Callister
*GFRE, CFRE, & AFRE are Glass,
Carbon, & Aramid Fiber-Reinforced
Epoxy composites (values based on
60% volume fraction of aligned fibers
in an epoxy matrix).
10
3
4
5
0.3
0.4
0.5
Magnesium
Aluminum
Steels
Titanium
Cu,Ni
Tin, Zinc
Silver, Mo
Tantalum
Gold, W
Platinum
Graphite
Silicon
Glass-soda
Concrete
Si nitride
Diamond
Al oxide
Zirconia
HDPE, PS
PP, LDPE
PC
PTFE
PET
PVC
Silicone
Wood
AFRE*
CFRE*
GFRE*
Glass fibers
Carbon fibers
Aramid fibers
Metale
mają:
• gęste upakowanie
(wiązanie metaliczne)
• często duże masy atomowe
Ceramiki
mają:
• mniej gęste upakowanie
• często lekkie pierwiastki
Polimery
mają:
• małą gęstość upakowaia
(często niekrystaliczne)
• lekkie pierwiastki (C,H,O)
Compozyty
mają:
• wartości pośrednie
Ogólnie:

25
• Niektóre zastosowania wymagają monokryształóws:
• Własności zależą od
struktury krystalicznej
-diament, do
cięcia,
szlifowania
- łopatki turbin
Zastosowanie Kryształów
Kwarc
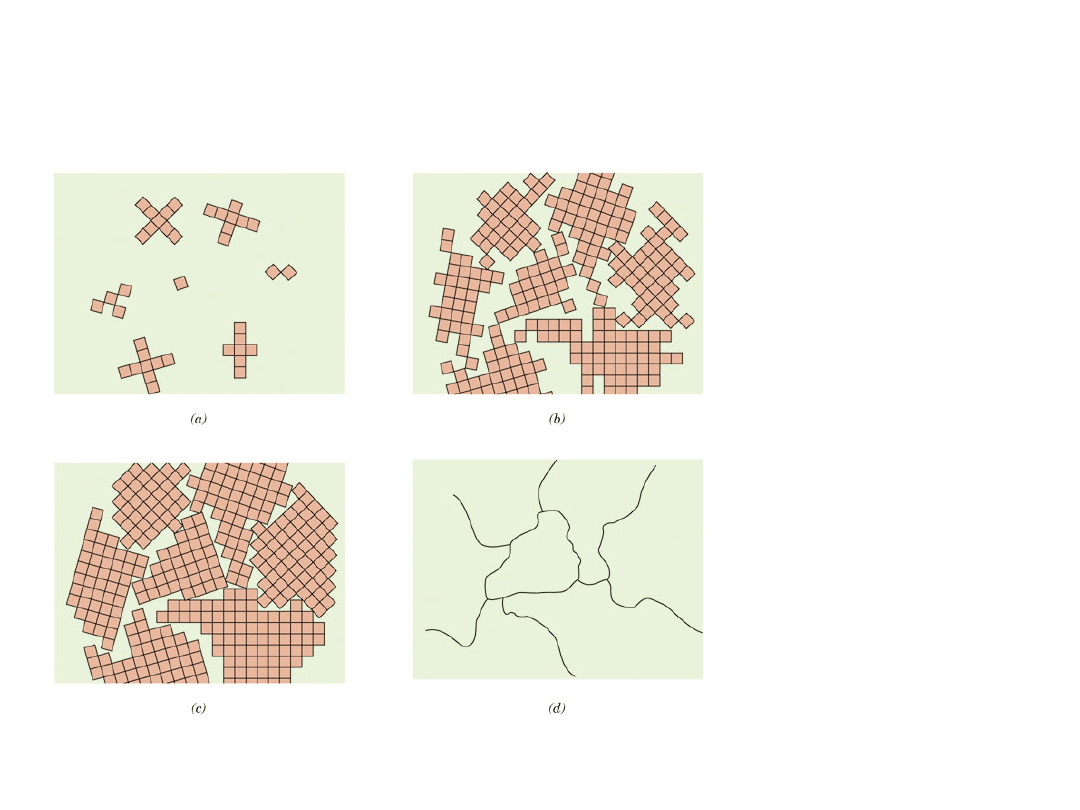
26
Polikryształy
Stadia
krzepnięcia
polikrystaliczne
go materiału

27
• Większość materiałów inżynierskich to
polikryształy
•
Każde „ziarno" jest monokryształem
• Gdy ziarna są zorientowane przypadkowo, to
własności nie zależą od kierunku
• Wielkości ziarn: od 1 nm do 2 cm
1 mm
Polikryształy
Izotropowy
Anizotropowy
Spoina stopu Nb-Hf-W
28
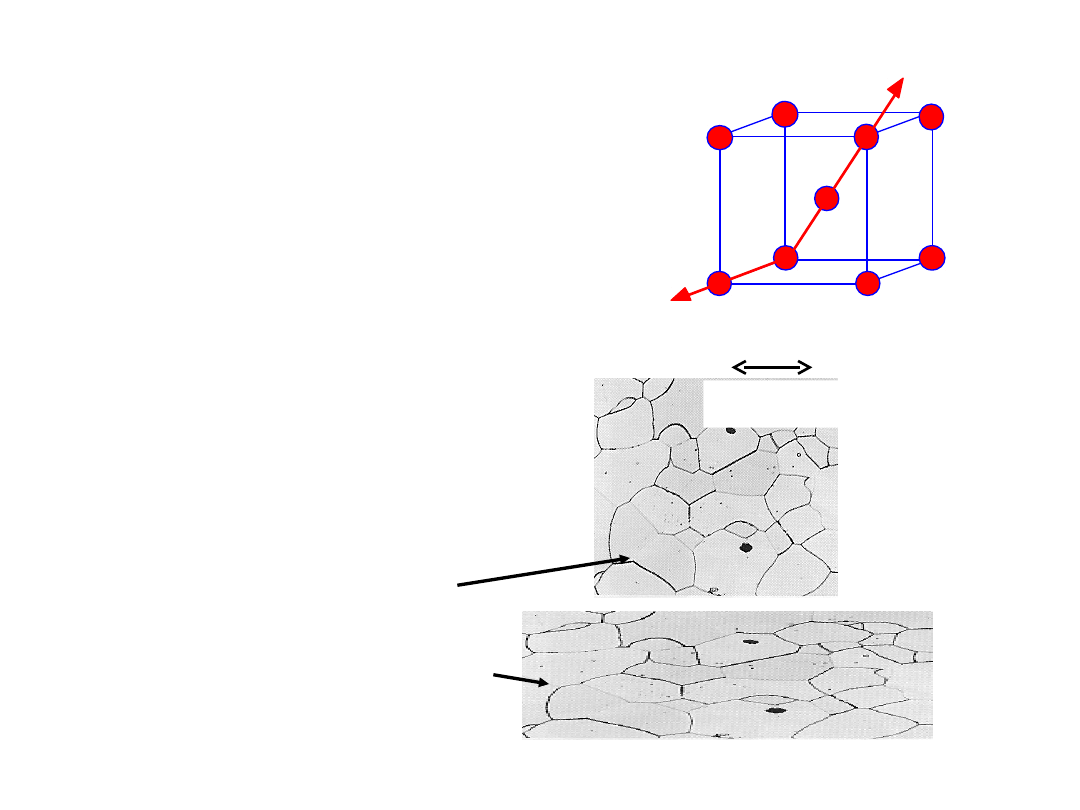
• Monokryształy
-Własności zależą od
kierunku:
anizotropia
-Przykład: moduł
Younga (E) w Fe-
• Polikryształy
-Własności mogą lub nie
zależeć od kierunku
-Gdy ziarna są
zorientowane
przypadkowo:
isotropowe
.
(E
poli iron
= 210 GPa)
-Gdy ziarna mają
uprzywilejowaną
orientację (
texturę
),:
anizotropowe
200 m
Mono- vs.
Polikryształy
E (przekątna) = 273 GPa
E (krawędź) = 125 GPa
29
Polimorfizm
• Dwie lub więcej struktur krystalicznych dla
tego samego pierwiastka (alotropia)
•
tytan
, -Ti
carbon
diamond, graphite
BCC
FCC
BCC
1538ºC
1394ºC
912ºC
-Fe
-Fe
-Fe
ciecz
Żelazo
30
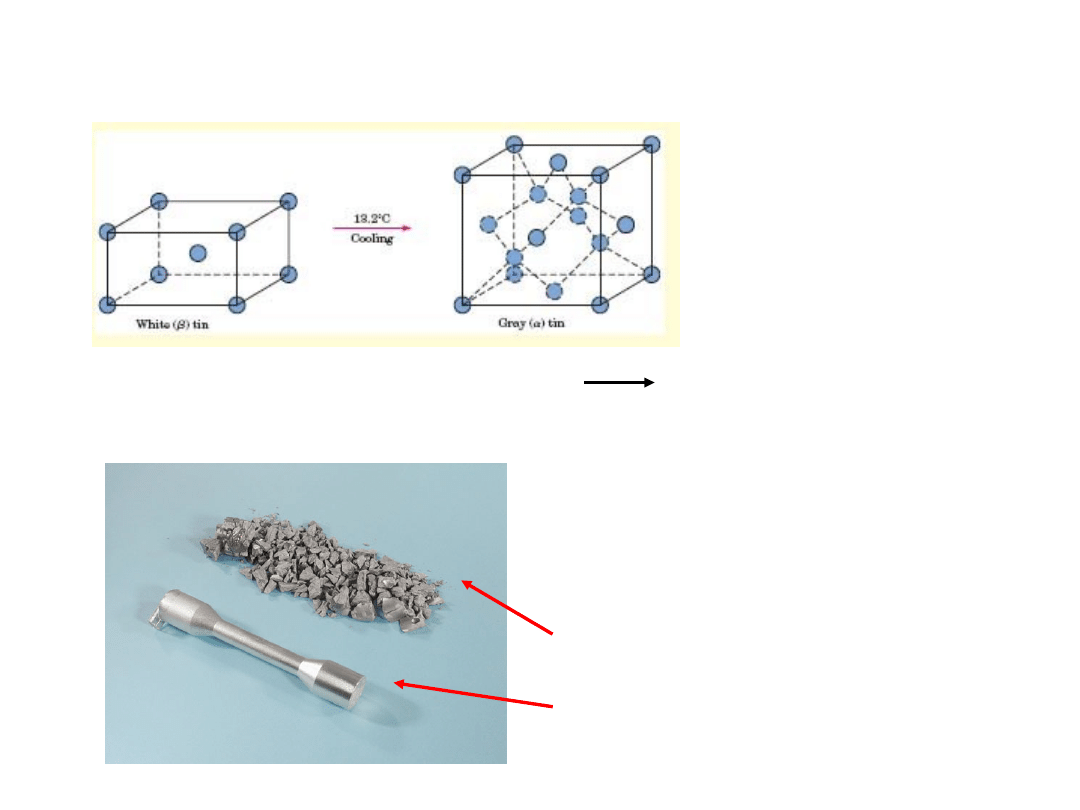
Przemiana Alotropowa w cynie
Tetragonalna Przestrzennie centrowana diamond
cubic
Szara
cyna
Biała
cyna
Wzrost objętości (27%) i
spadek gęstości z 7.30
g/cm
3
do 5.77 g/cm
3
31
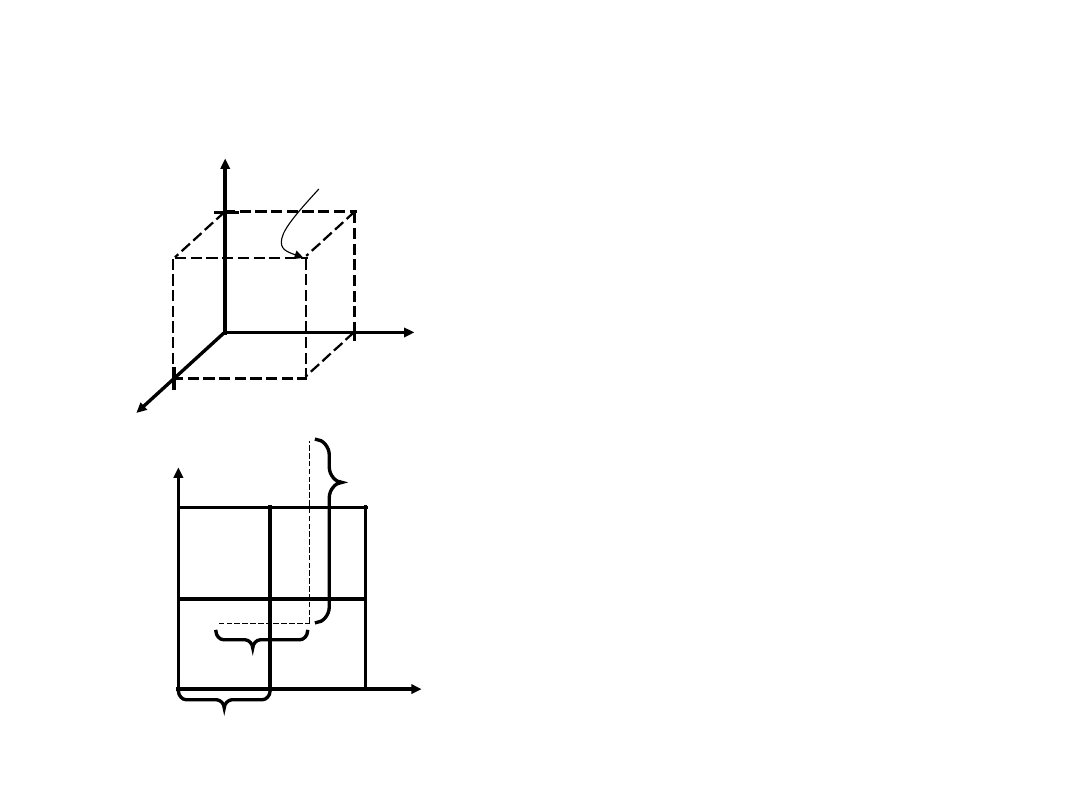
Współrzędne Punktu
Współrzędne punktu dla
komórki elementarnej
a/2, b/2, c/2 ½
½
½
Współrzędne punktu dla
naroża 111
Translacja: integer multiple
of lattice constants
identical position in
another unit cell
z
x
y
a
b
c
000
111
y
z
2c
b
b
32
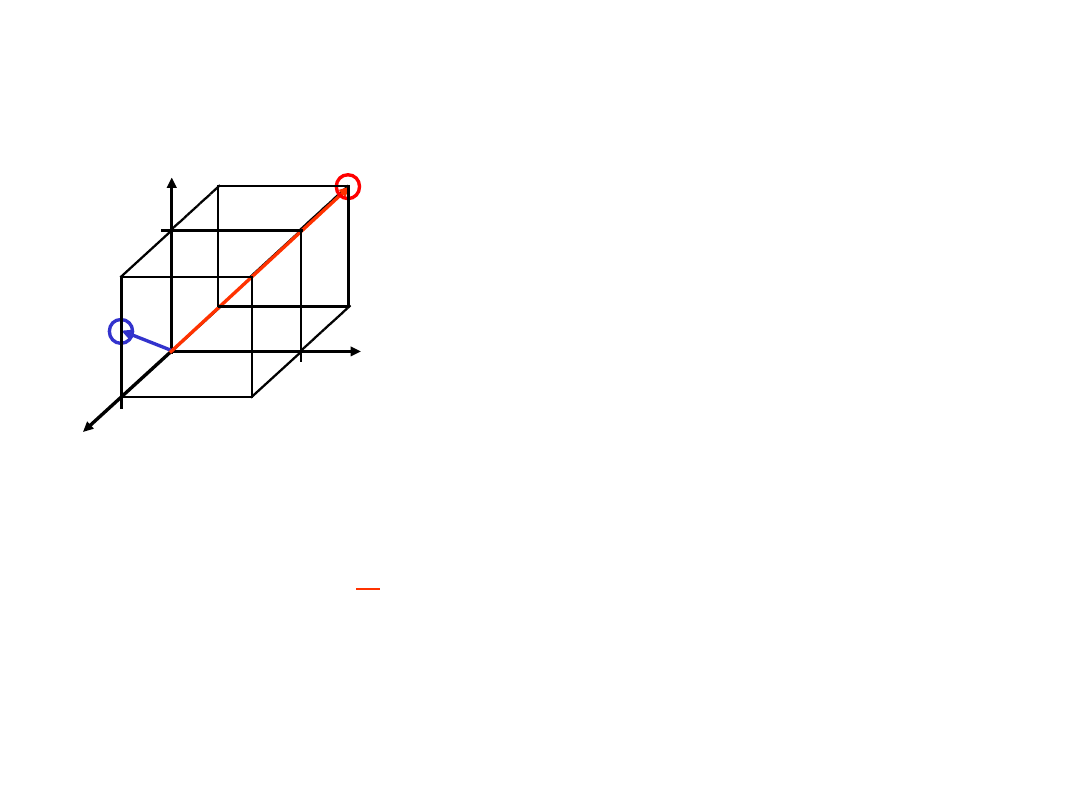
Kierunki Krystalograficzne
1. Przesunąć wektor (gdy to konieczne)
tak aby przechodził przez początek
układu wsp.
2. Odczytać położenia w jednostkach
komórki elementarnej a, b, i c
3. Sprowadzić do najminiejszych liczb
całkowitych
4. Umieścić w nawiasach kwadratowych,
bez przecinków
[uvw]
np.:
1, 0,
½
=> 2, 0,
1
=> [
201
]
-1, 1,
1
rodzina kierunków <uvw>
z
x
Algorytm
gdzie „minus” nad cyfrą
oznacza wskaźnik ujemny
[
111
]
=>
y
33
np.: gęstość liniowa Al w
kierunku [110]
a = 0.405 nm
Gęstość Liniowa
• Gęstość Liniowa Atomóws GL =
a
[110]
Długość wektora jedn.
Liczba atomów
# atomów
długość
1
3.5 nm
a
2
2
LD
34
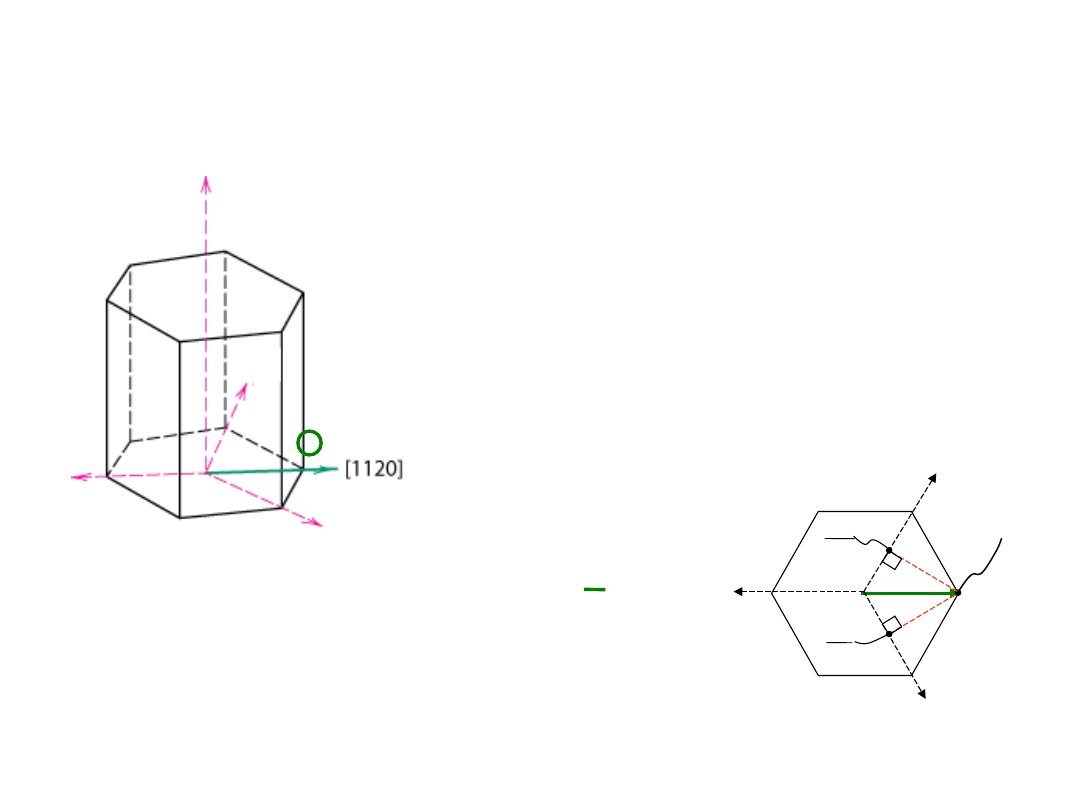
Kierunki w strukturze HZ
1. Przesunąć wektor (gdy to
konieczne) tak aby przechodził przez
początek układu wsp.
2. Odczytać położenia w jednostkach
komórki elementarnej a
1
, a
2
, a
3
, lub c
3. Sprowadzić do najminiejszych liczb
całkowitych
4. Umieścić w nawiasach
kwadratowych, bez przecinków
[uvtw]
[
1120
]
np.:
½, ½, -1, 0
=>
linie przerywane
pokazują rzuty na osie a
1
i a
2
a
1
a
2
a
3
-a
3
2
a
2
2
a
1
-
a
3
a
1
a
2
z
Algorytm
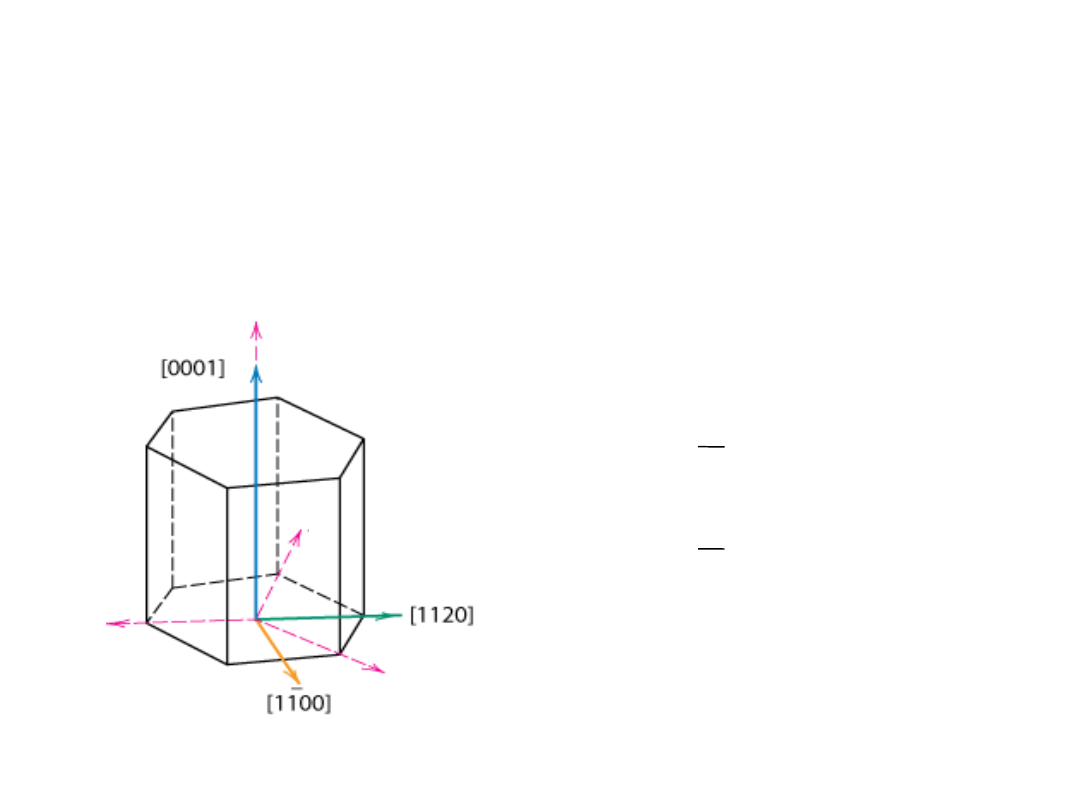
35
Kierunki w strukturze HZ
Cztery wskaźniki mają odpowiednik w trzech
wskaźnikiach sieci Bravais’go (u'v'w'):
'
w
w
t
v
u
)
v
u
( +
-
)
'
u
'
v
2
(
3
1
-
)
'
v
'
u
2
(
3
1
-
]
uvtw
[
]
'
w
'
v
'
u
[
-
a
3
a
1
a
2
z
36
Płaszczyzny
Krystalograficzne

37
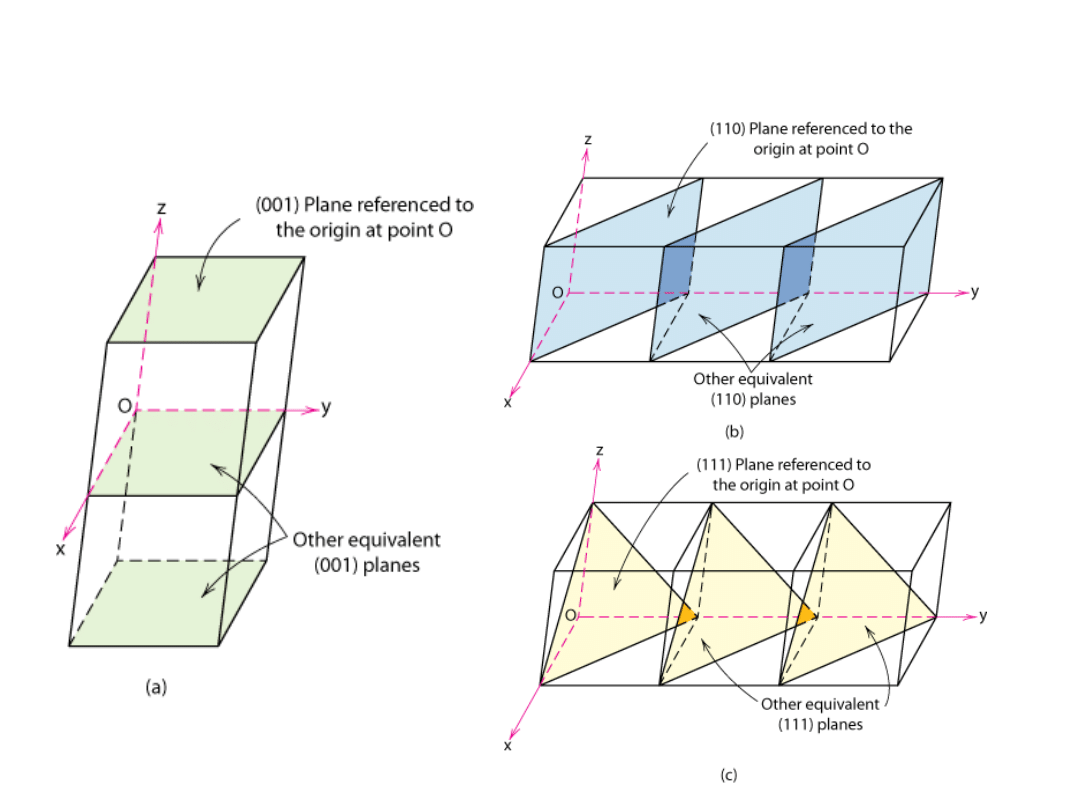
Płaszczyzny Krystalograficzne
• Wskaźniki Millera:
odwrotności
długości odcinków odciętych na osiach
układu przez rozpatrywaną płaszczyznę,
sprowadzone do najmniejszych liczb
całkowitych. Wszystkie płaszczyzny
równoległe mają te same wskaźniki
• Algorytm
1. Odczytać współrzędne przecięć płaszczyzny
z osiami w jednostkach a, b, c
2. Obliczyć odwrotności
3. Sprowadzić do liczb całkowitych
4. Umieścić w nawiasach okrągłych, bez
przecinków
(hkl)
38
Płaszczyzny Krystalograficzne
z
x
y
a
b
c
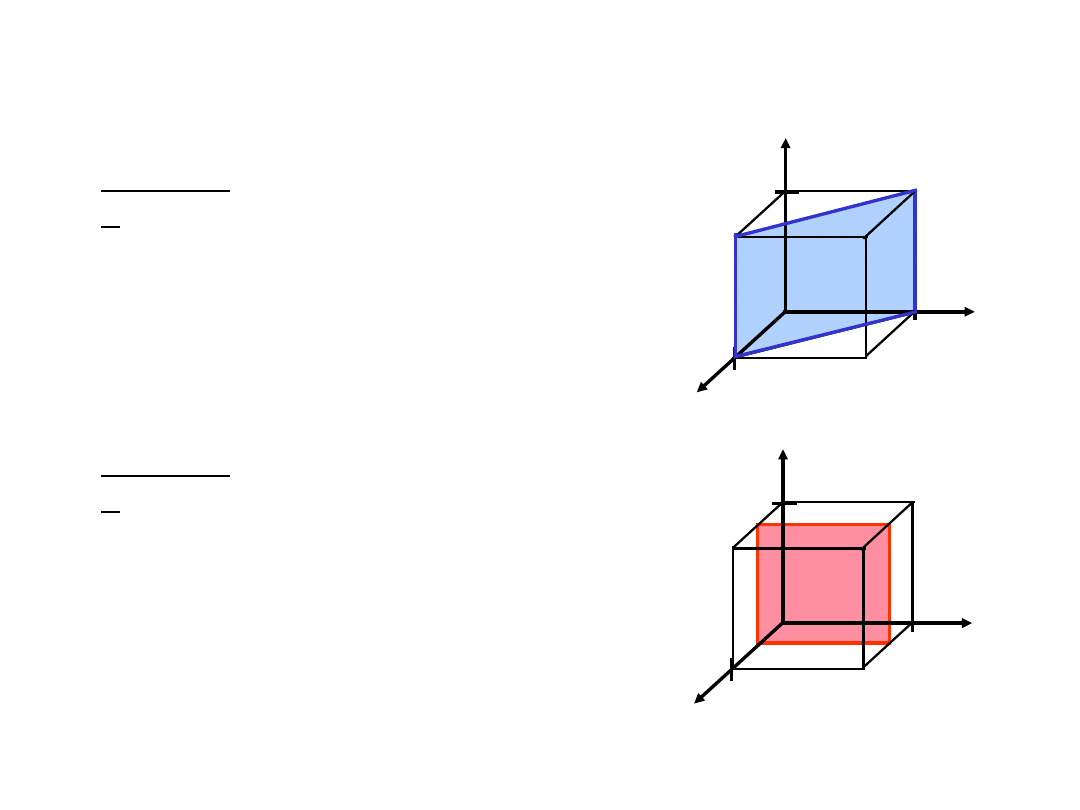
4. Wskaźniki Millera
(110)
przykład
2
a b c
z
x
y
a
b
c
4. Wskaźniki Miller (100)
1. Przecięcia
1 1
2.
Odwrotności
1/1 1/1 1/
1 1 0
3. Redukcja
1 1 0
1.
Przecięcias
1/2
2.
Odwrotności
1/½ 1/ 1/
2 0
0
3. Redukcja 2 0
0
przykład
1
a b c
39
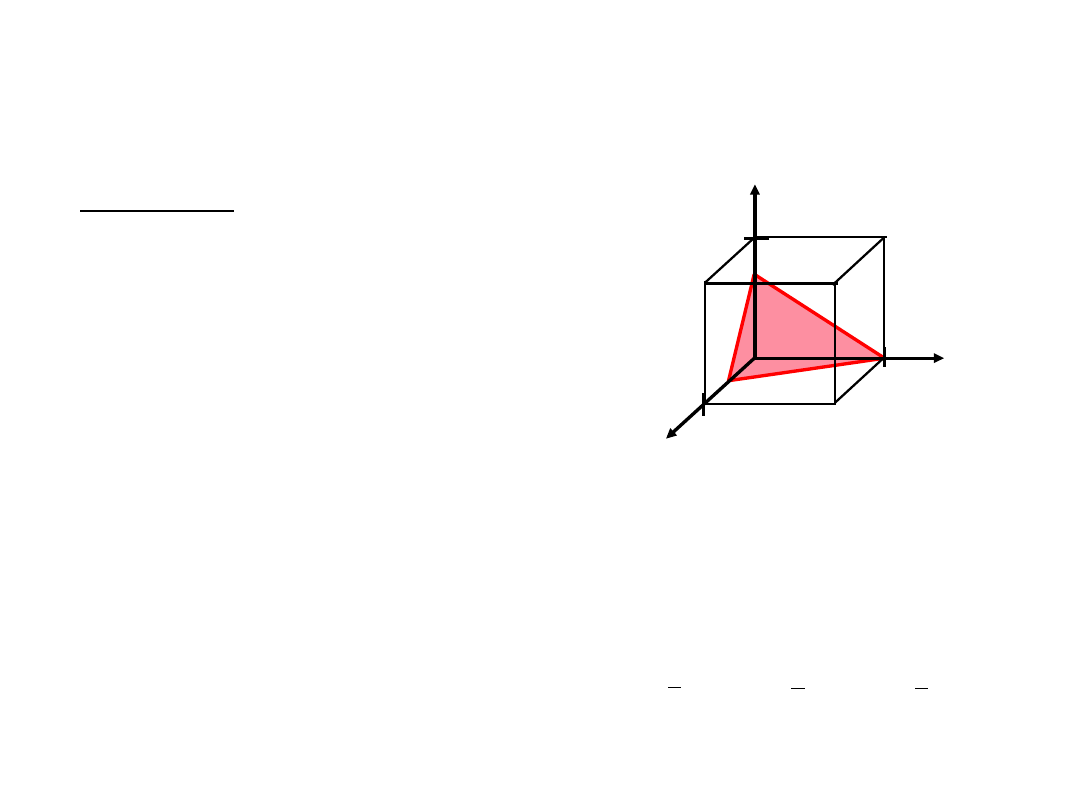
Płaszczyzny Krystalograficzne
z
x
y
a
b
c
4. Wskaźniki Millera
(634)
przykład
1. Przecięcia
1/2
1
3/4
a b c
2.
Odwrotności
1/½ 1/1 1/¾
2
1
4/3
3. Redukcja
6
3 4
(001)
(010),
Rodzina płaszczyzn
{hkl}
(100),(010),
(001),
Np.: {100} = (100),
40
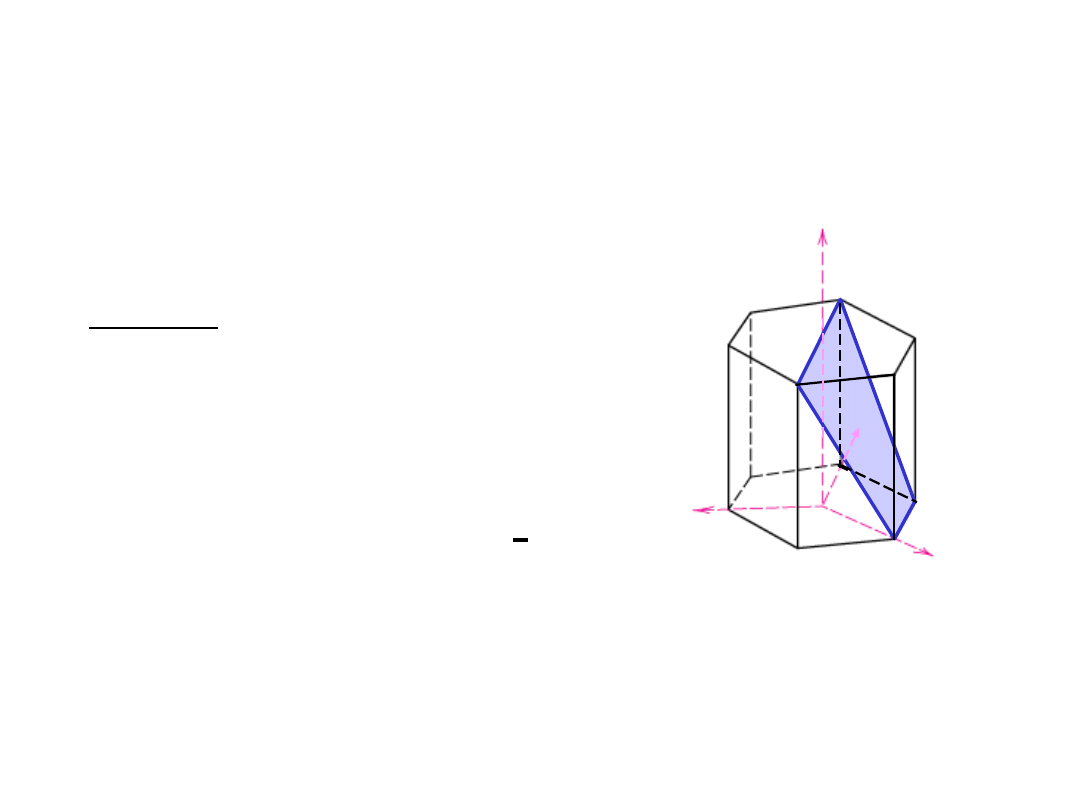
Płaszczyzny Krystalograficzne (HZ)
• W strukturze heksagonalnej ta sama
procedura
przykład
a
1
a
2
a
3
c
4. Wskaźniki Millera
(1011)
1. Przecięcia
1
-1
1
2. Odwrotności
1 1/
1 0
-1
-1
1
1
3. Redukcja
1 0
-1
1
a
2
a
3
a
1
z
41
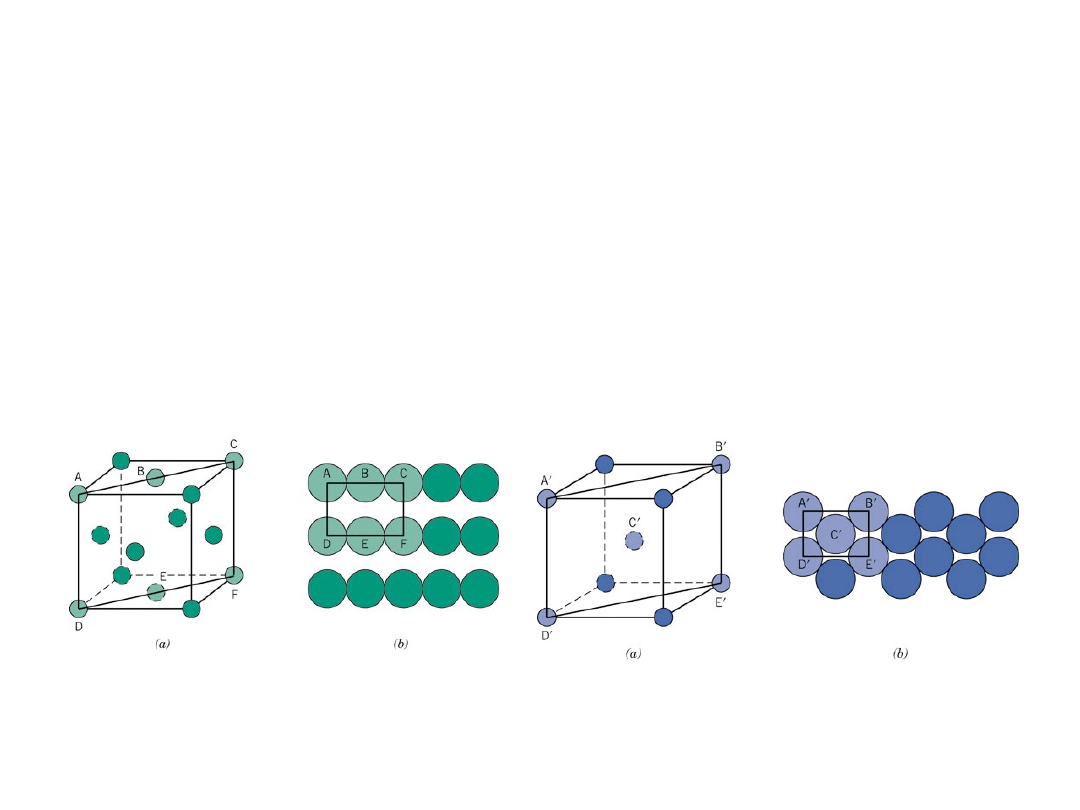
Ułożenia atomów
Ułozenie atomów na płaszczyźnie
krystalograficznej zależy od struktury
krystalicznej
Przykład:
płaszcyzna (110) w kryształach RSC i RPC
RSC
RPC

42
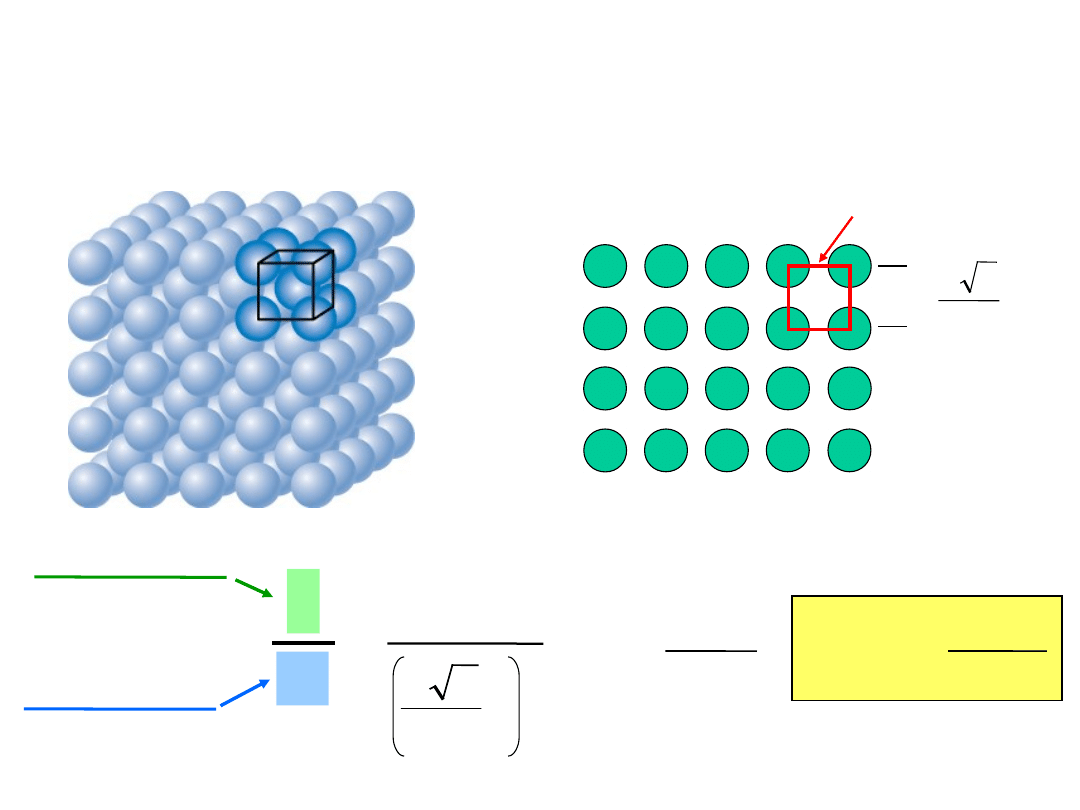
Gęstość płaszczyznowa
• We want to examine the atomic
packing of crystallographic planes
• Iron foil can be used as a catalyst. The
atomic packing of the exposed planes
is important.
a) Draw (100) and (111) crystallographic
planes
for Fe.
b) Calculate the planar density for each of
these planes.
43
Gęstość płaszczyznowa (100) Fe
Rozwiązanie: W T < 912C Fe ma strukturę RPC
(100
)
Promień at. Fe R = 0.1241
nm
R
3
3
4
a
2D komórka
=
Gęstość pow. =
a
2
1
atomy
2D komórka
=
nm
2
atomów
12.1
m
2
atomów
= 1.2 x 10
19
1
2
R
3
3
4
pow.
2D komórka
44
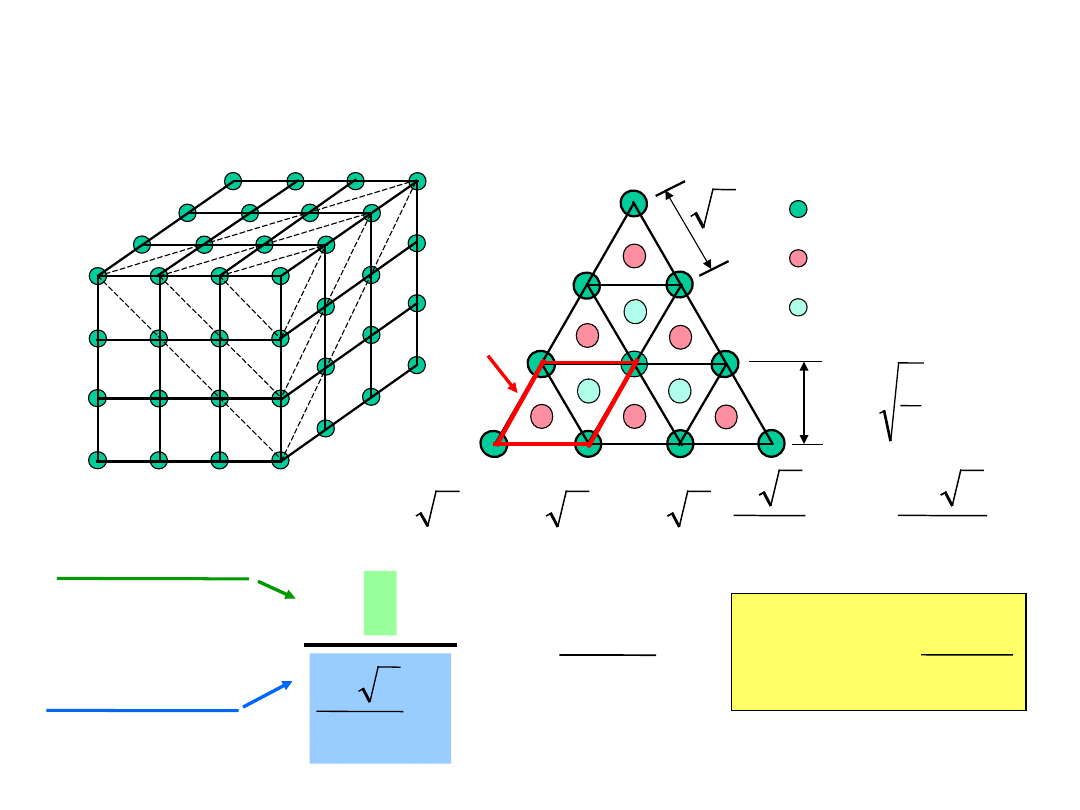
Gęstość Płaszczyznowa (111) Fe
(111) plane
1 atom w pł./ jedn. pow.
kom.
3
3
3
2
2
R
3
16
R
3
4
2
a
3
ah
2
pow.
atomy w pł.
atomy powyżej
pł.
atomy poniżej
pł.
a
h
2
3
a
2
2D
k
om
ór
ka
1
=
=
nm
2
atom
7.0
m
2
atom
0.70 x 10
19
3
2
R
3
16
Gęstość pow. =
atoms
2D komórka
pow.
2D komórka
45
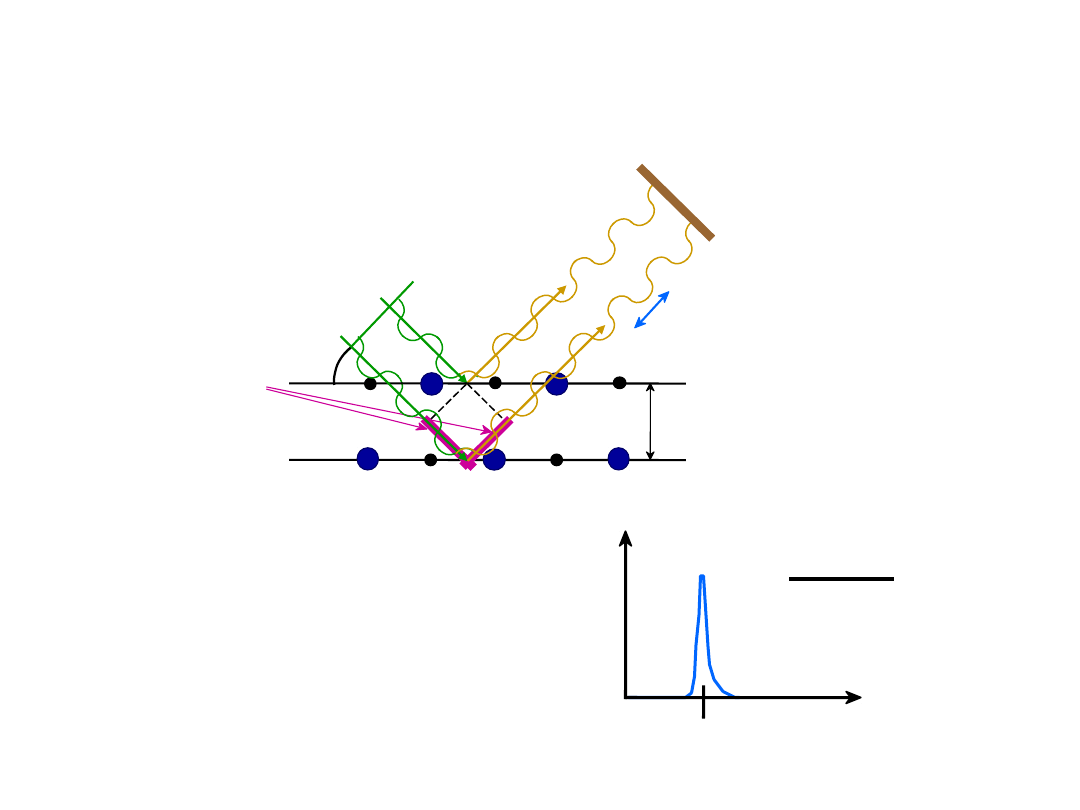
Wyznaczanie Struktury Kryształu
intensywność
c
d
n
2
sinc
Pomiar kąta
c
, pozwala
na obliczenie odległości
międzypłaszczyznowych
, d.
Padające promieniowanie X ulega
dyfrakcji
na pł. kryształu
odbite promienie
muszą być w fazie
odległość
pomiędzy
płaszczyznami
d
Pa
da
jąc
e
pr.
X
pr
om
ie
ni
e
X
de
tek
tor
extra
odległość
pokonana
przez “2”
“1
”
“2
”
“1
”
“2
”
46
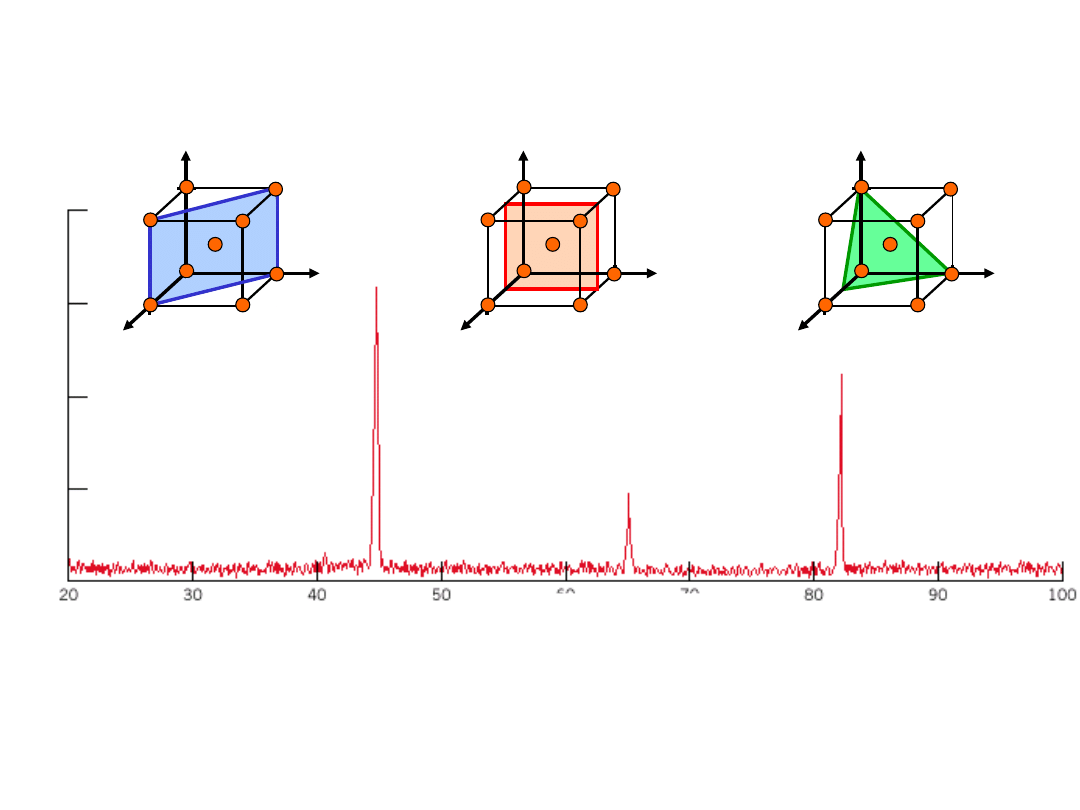
Dyfraktogram rentgenowski
(110)
(200)
(211)
z
x
y
a
b
c
Kąt Odbicia 2
Dyfraktogram polikrystalicznego Fe- (RPC)
In
te
n
sy
w
n
o
ść
(
w
zg
lę
d
n
a
)
z
x
y
a
b
c
z
x
y
a
b
c
Document Outline
- Struktura krystaliczna ciał stałych
- Energia i Upakowanie
- Slide 3
- Elementy Krystalografii
- Charakteristyka kryształów
- Siedem Systemów Krystalograficznych
- Czternaście typów sieci
- Struktura krystaliczna metali
- Struktura krystaliczna metali
- Struktura Regularna Prymitywna (RP)
- Współczynnik Wypełnienia Przestrzeni
- Struktura regularna ściennie centrowana
- Współczynnik Wypełnienia Przestrzeni: RSC
- Slide 14
- Struktury o najgęstszym ułożeniu
- Regularna Ściennie Centrowana
- Heksagonalna Zwarta
- Slide 18
- Heksagonalna Zwarta (HZ)
- Struktura regularna przestrzennie centrowana
- Slide 21
- Gęstość Teoretyczna, r
- Slide 23
- Gęstości różnych materiałów
- Zastosowanie Kryształów
- Polikryształy
- Slide 27
- Mono- vs. Polikryształy
- Polimorfizm
- Przemiana Alotropowa w cynie
- Współrzędne Punktu
- Kierunki Krystalograficzne
- Gęstość Liniowa
- Kierunki w strukturze HZ
- Slide 35
- Płaszczyzny Krystalograficzne
- Slide 37
- Slide 38
- Slide 39
- Płaszczyzny Krystalograficzne (HZ)
- Ułożenia atomów
- Gęstość płaszczyznowa
- Gęstość płaszczyznowa (100) Fe
- Gęstość Płaszczyznowa (111) Fe
- Wyznaczanie Struktury Kryształu
- Dyfraktogram rentgenowski
Wyszukiwarka
Podobne podstrony:
Wyklad 2 crystals
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
WYKŁAD VII
Wykład 1, WPŁYW ŻYWIENIA NA ZDROWIE W RÓŻNYCH ETAPACH ŻYCIA CZŁOWIEKA
Zaburzenia nerwicowe wyklad
Szkol Wykład do Or
Strategie marketingowe prezentacje wykład
Wykład 6 2009 Użytkowanie obiektu
wyklad2
wykład 3
więcej podobnych podstron