
1
ZAGADNIENIA:
• Jak atomy rozmieszczone są w ciałach stałych?
(w metalach)
• Jak gęstość zależy od struktury krystalicznej?
• Kiedy własności zależą od orientacji próbki?
Struktura krystaliczna ciał
stałych
2
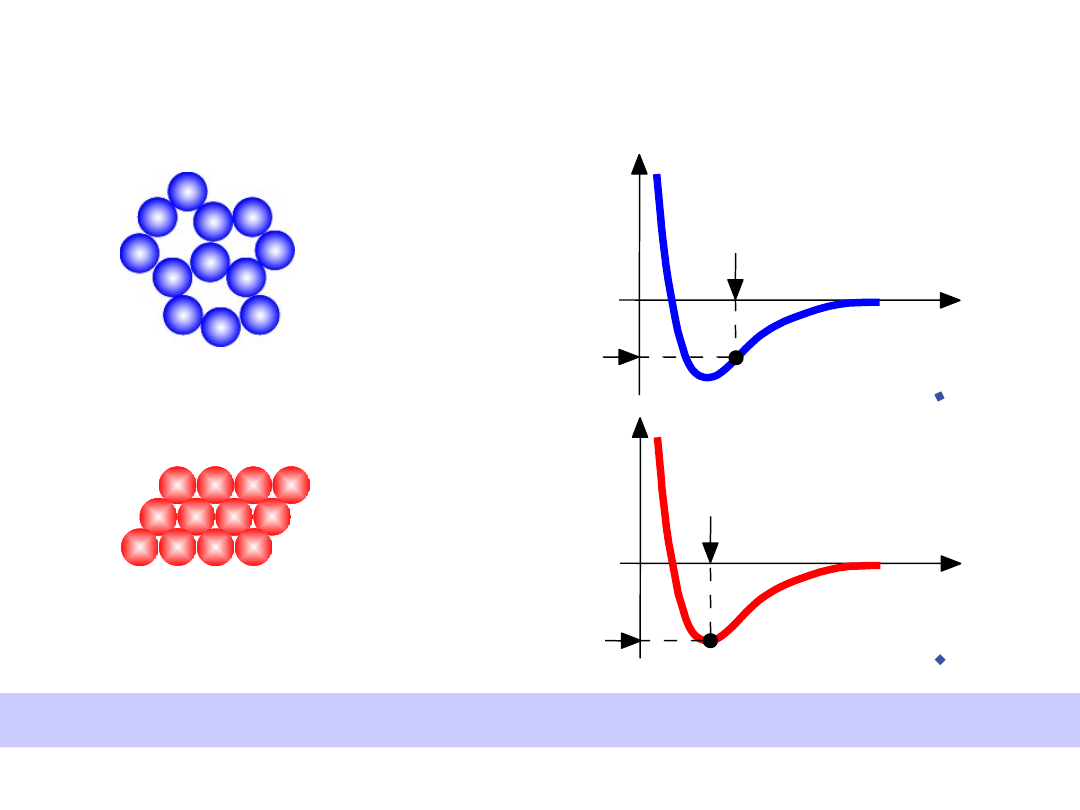
• Mała gęstość,
przypadkowe
• Gęste,
uporządkowane
Struktury o gęstym wypełnieniu przestrzeni mają mniejsze energie
Energia i Upakowanie
Energia
r
typowa długość
wiązania
typowa energia
wiązania
Energia
r
typowa długość
wiązania
typowa energia
wiązania
3
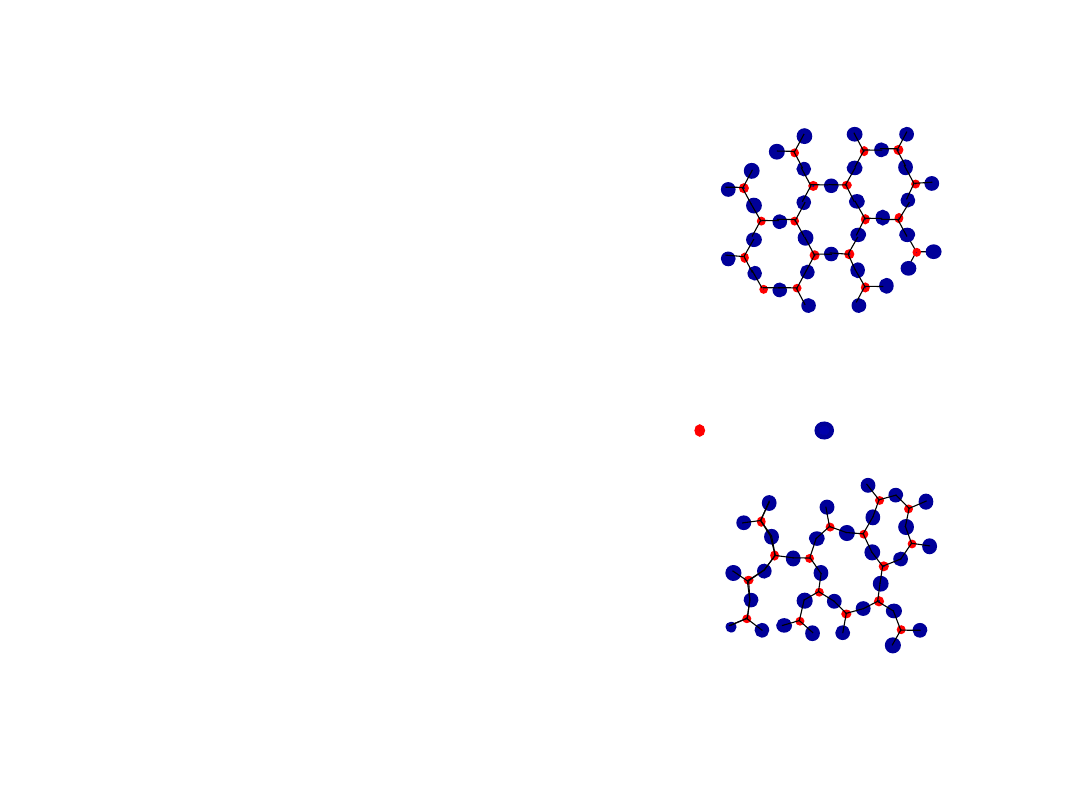
• atomy ułożone periodycznie
Materiały krystaliczne
-metali
-wielu ceramik
-niektórych polimerów
• brak periodycznego ułożenia
Niekrystaliczne
materiały
-złożonych strukturach
-po gwałtownym chłodzeniu
krystaliczny SiO
2
niekrystaliczny SiO
2
"
Amorficzny
" = Niekrystaliczny
Energia i Upakowanie
Si
Tlen
• typowe dla:
• wystepują w:
4
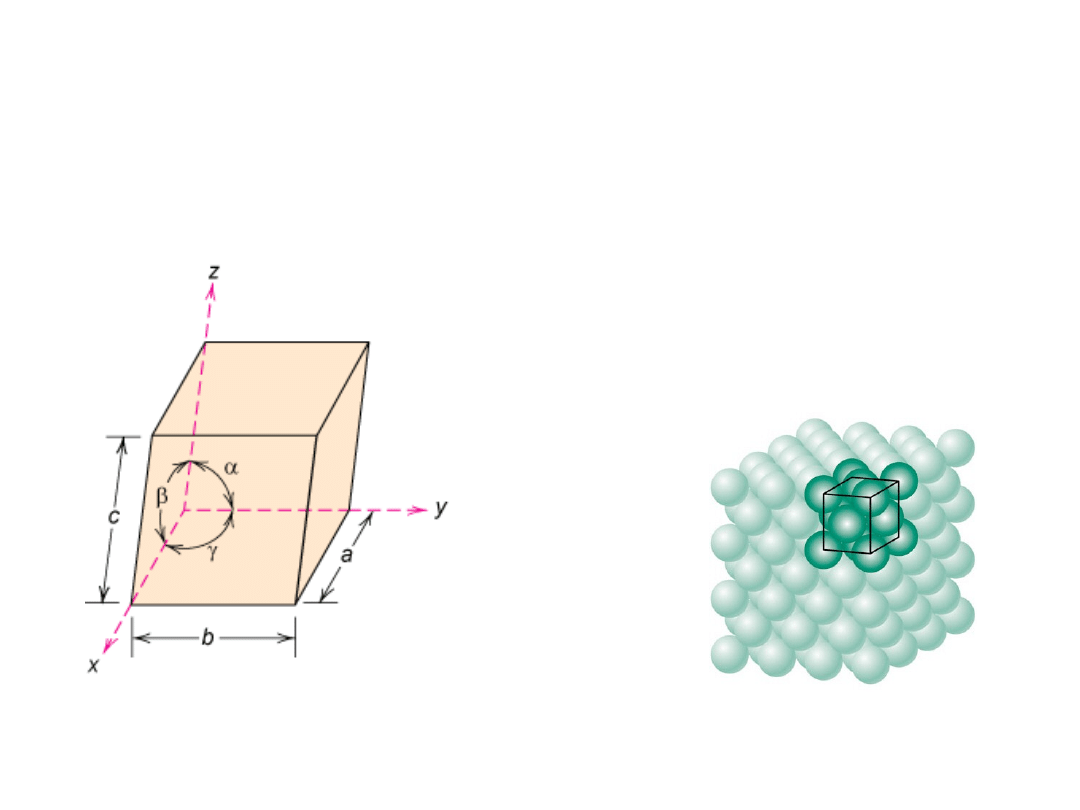
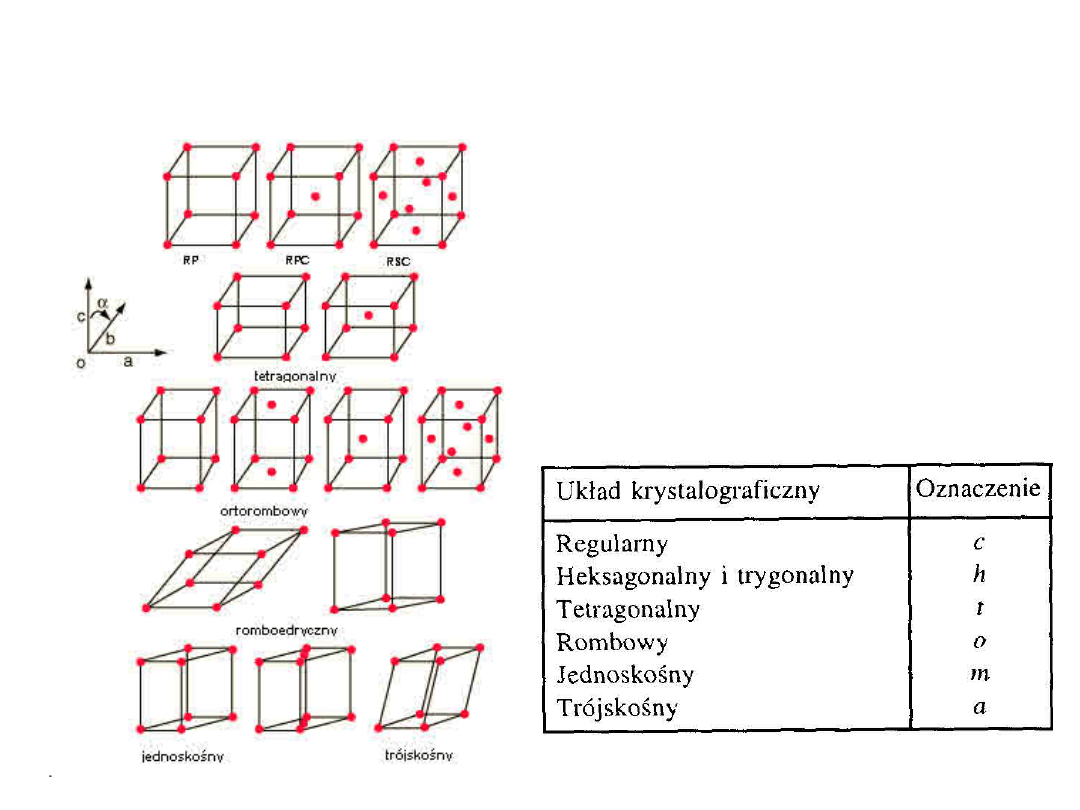
Elementy Krystalografii
7 układów
krystalograficznych
14 typów sieci
Komórka elementarna:
najmniejsza
powtarzalna objętość kryształu zawierająca pełną
informację o rozmieszczeniu atomów (wzorzec).
a, b,
i
c
są
stałymi
sieciowymi
a, b, c,
oraz
, ,
są
parametra
mi
sieciowymi
Komórki elementarne są
równoległościanami

5
Charakterystyka kryształów
• Liczba atomów w komórce
elementarnej
• Liczba koordynacyjna
Liczba najbliższych sąsiadów
• Współczynnik wypełnienia
Atomy (lub jony) w strukturze krystalicznej
można traktować jako sztywne kule o określonej
średnicy. Jest to tzw.
model sztywnych
kul
Ważne parametry:
6
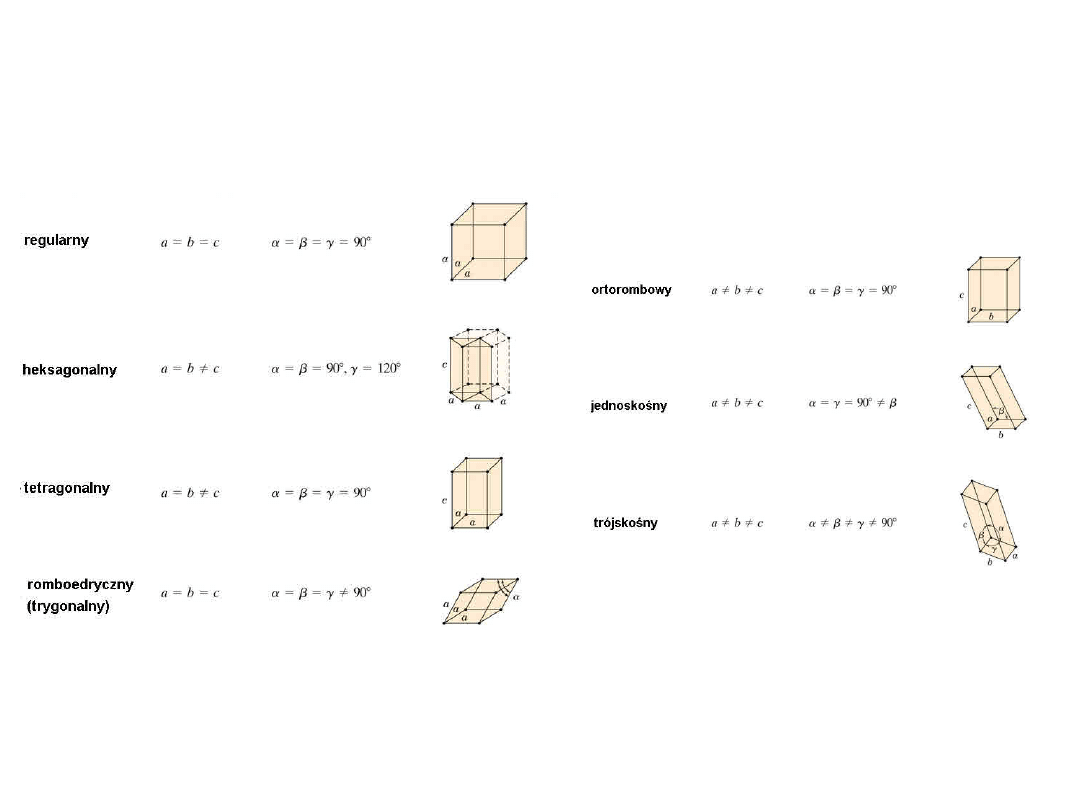
Siedem Systemów
Krystalograficznych
7
Czternaście typów sieci
• P – Prymitywna (prosta)
• F – Ściennie centrowana:
dodatkowy
punkt
na środku każdej ściany
• I - Przestrzennie centrowana:
dodatkowy punkt w środku
komórki
• C - Centerowana: dodatkowy
punkt na przeciwległych ścianach
• R -
Romboedryczna

8
Oznaczanie struktur
krystalicznych
Obecnie do oznaczania struktur krystalicznych jest zalecana
symbolika Pearsona.
Symbol Pearsona struktury krystalicznej składa się z dwóch
liter i liczby:
- pierwsza litera (mała) c, h, t, o, m lub a oznacza układ
krystalograficzny i jest nią pierwsza litera angielskich nazw
układów krystalograficznych, odpowiednio cubic, hexagonal
(i trigonal), tetragonal, orthorhombic, monoclinic i anorthic
(triclinic),
- druga litera duża P, I, F, C lub R oznacza typ sieci
Bravais’go, odpowiednio: prymitywną, przestrzennie
centrowaną, ściennie centrowaną, centrowaną na
podstawie i romboedryczną,
- symbol dopełnia liczba atomów przypadająca na komórkę
elementarną.
9
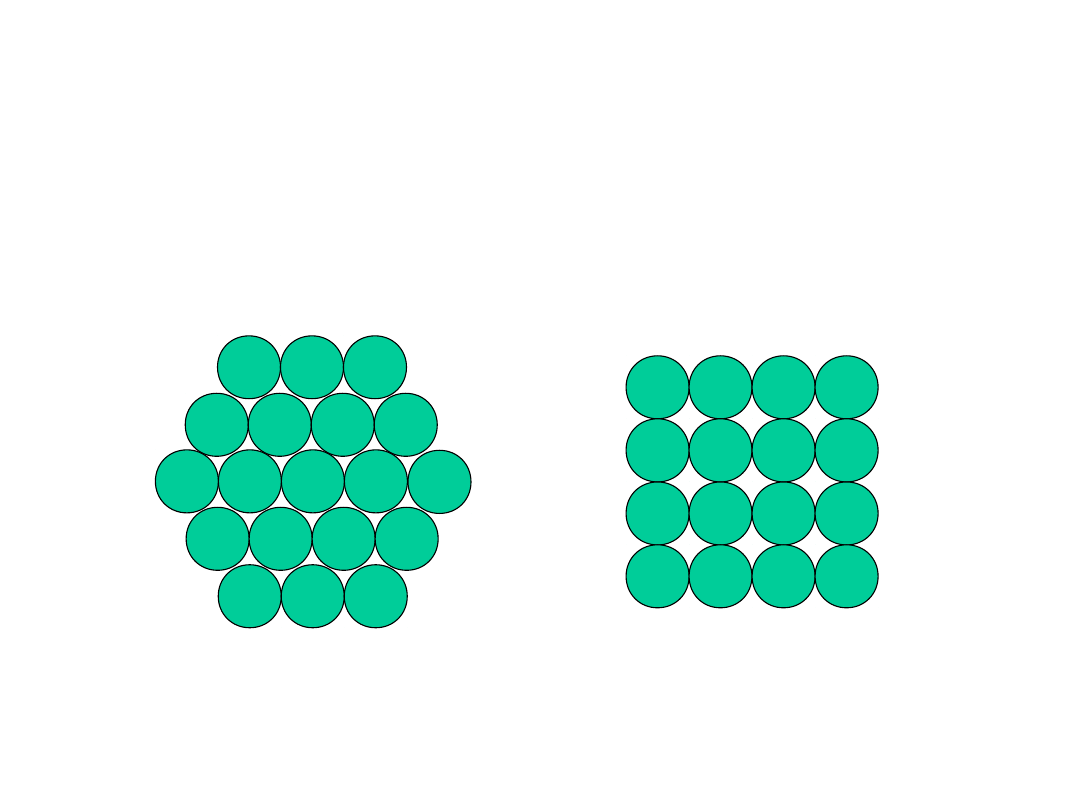
Struktura krystaliczna metali
• J
ak rozmieścić atomy, aby zminimalizować
zajmowaną przestrzeń?
2-wymiary
vs.
Nałóżmy teraz drugą warstwę aby uzyskać
strukturę trójwymiarową

10
• Tendencja do gęstego upakowania
• Przyczyny:
- Zazwyczaj, tylko jeden pierwiastek, promienie
wszystkich atomów są jednakowe
- Wiązanie metaliczne jest bezkierunkowe
- Odległości pomiędzy sąsiednimi atomami są małe,
gdyż to minimalizuje energię wiązań
- Chmura elektronowa jest wspólna dla wszystkich
jonów
• Mają najprostsze struktury krystaliczne
Rozpatrzymy trzy takie struktury...
Struktura krystaliczna metali
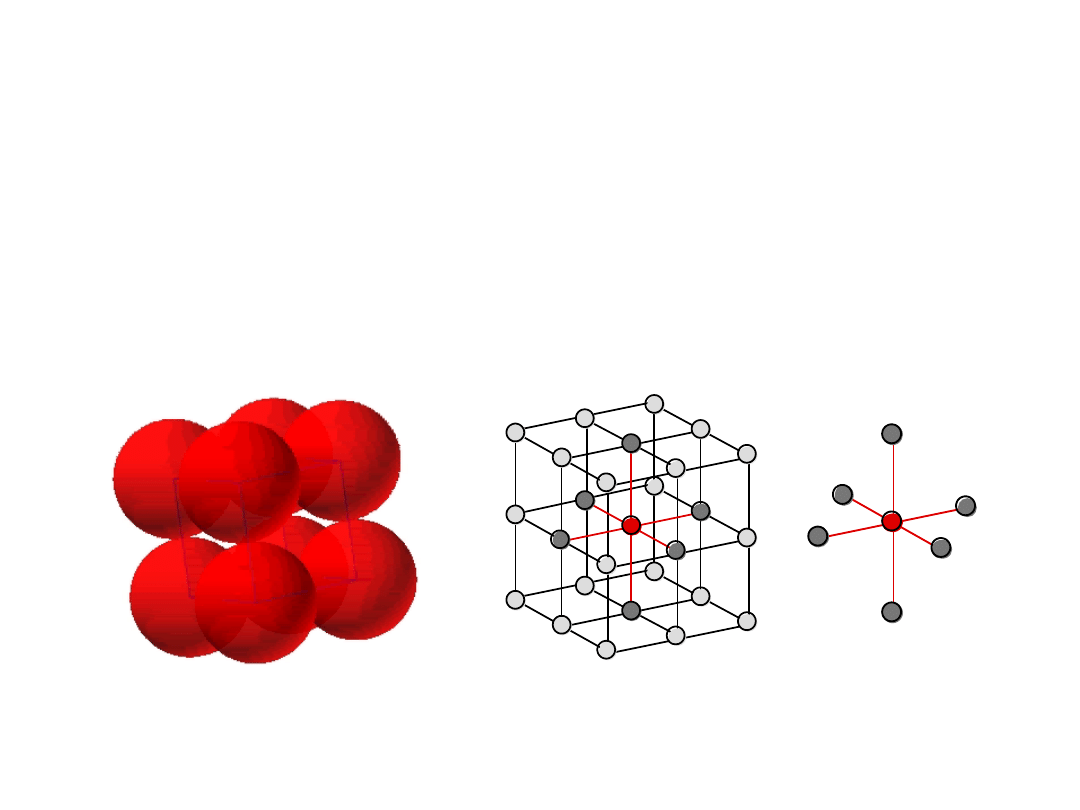
11
• B. rzadka, bo mała gęstość upakowania atomów
(tylko Po
•
Kierunki o najgęstszym ułożeniu;
krawędzie sześcianu
•
# koordynacyjna
= 6
(# najbliższych sąsiadów)
Struktura Regularna
Prymitywna (RP)
12
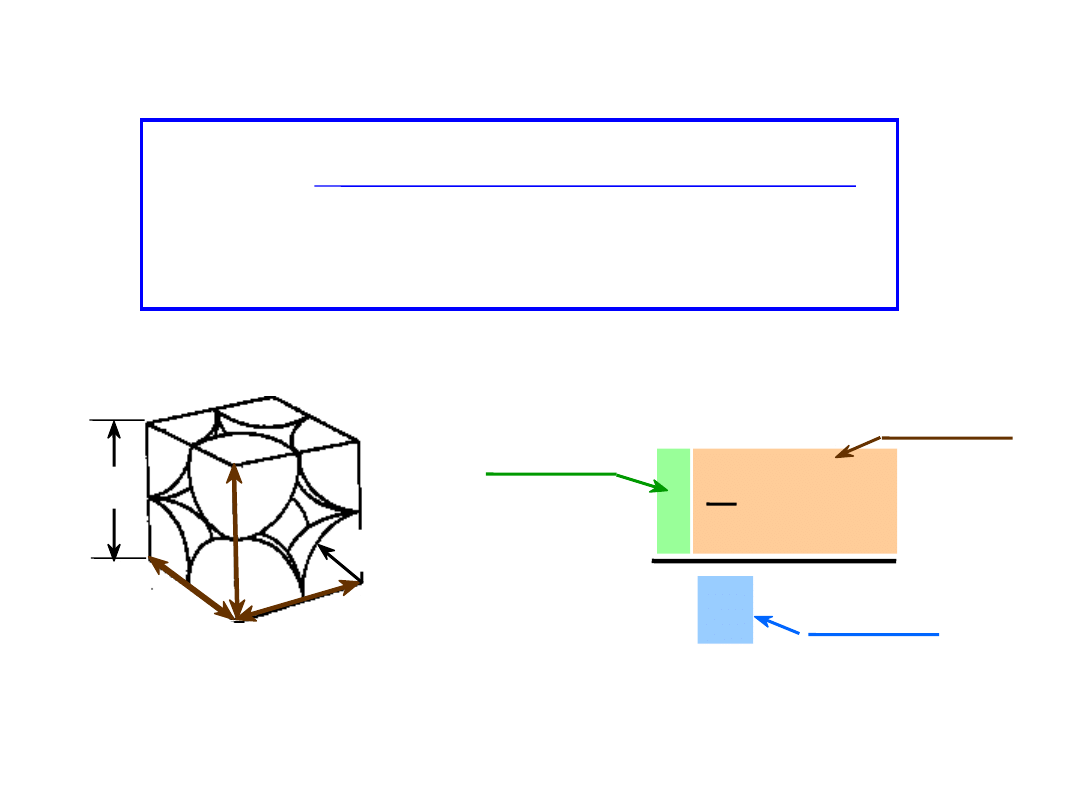
• WWP dla struktury regularnej prymitywnwej = 0.52
APF =
a3
4
3
(0.5a)3
1
atomy
kom. el.
atom
objętość
kom. el.
objętość
Współczynnik Wypełnienia
Przestrzeni
WWP =
Objętość atomów w komórce el.*
Objętość komórki el.
* w modelu sztywnych kul
kierunki o najgęstszym ułożeniu
a
R=0.5a
zawiera 8 x 1/8 =
1
atom/kom. el.
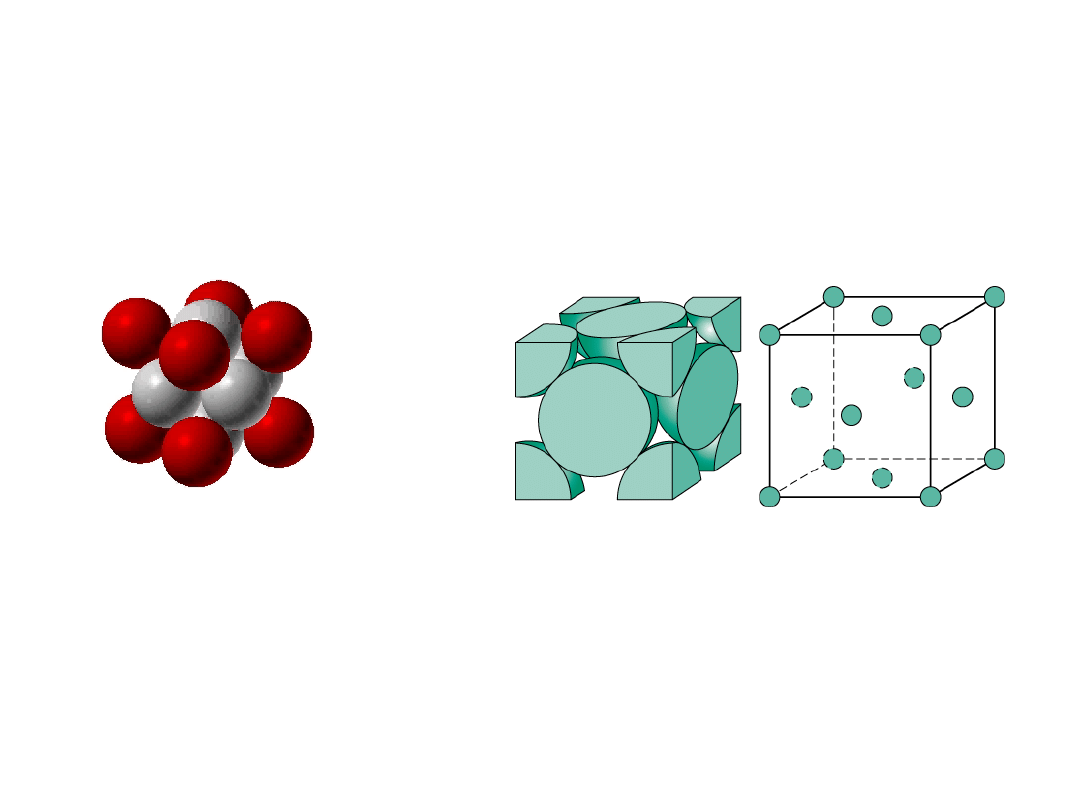
13
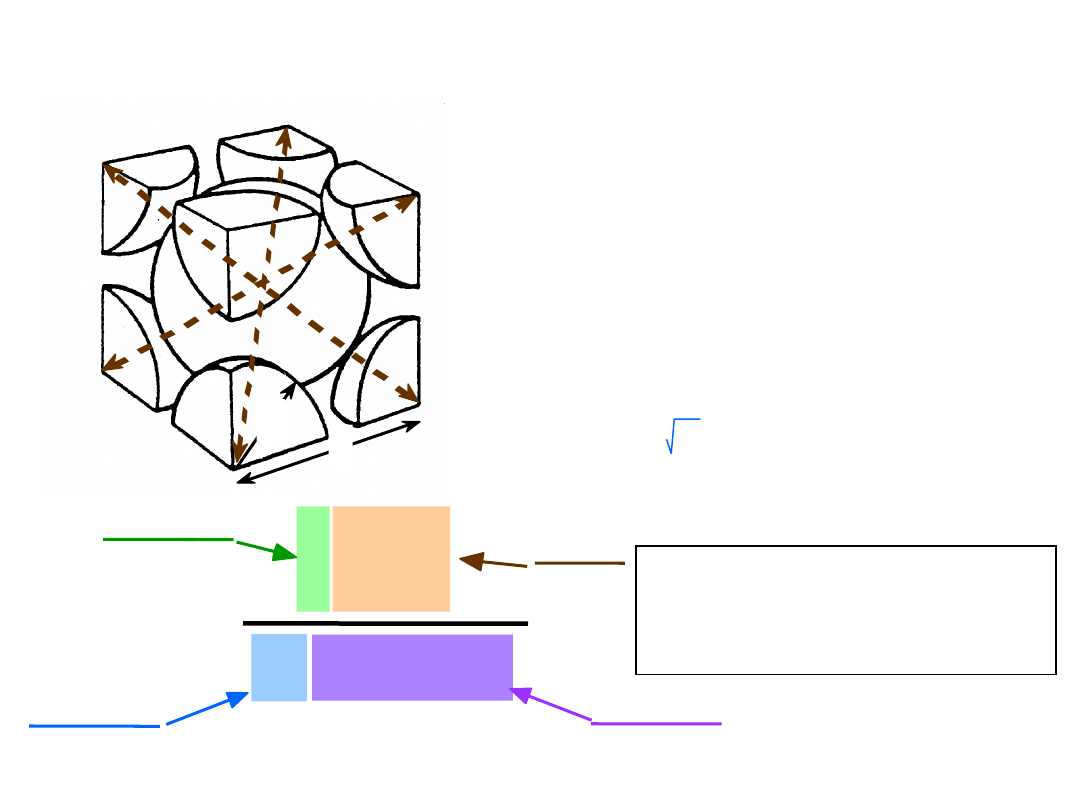
• # k
oordynacyjna = 12
• Atomy stykają się wzdłuż przekątnych ścian
Struktura regularna ściennie
centrowana
np.: Al, Cu, Au, Pb, Ni, Pt, Ag
4 atomy/kom. el.: 6 ścian x 1/2 + 8 naroży x 1/8
Uwaga: Wszystkie
atomy są jednakowe;
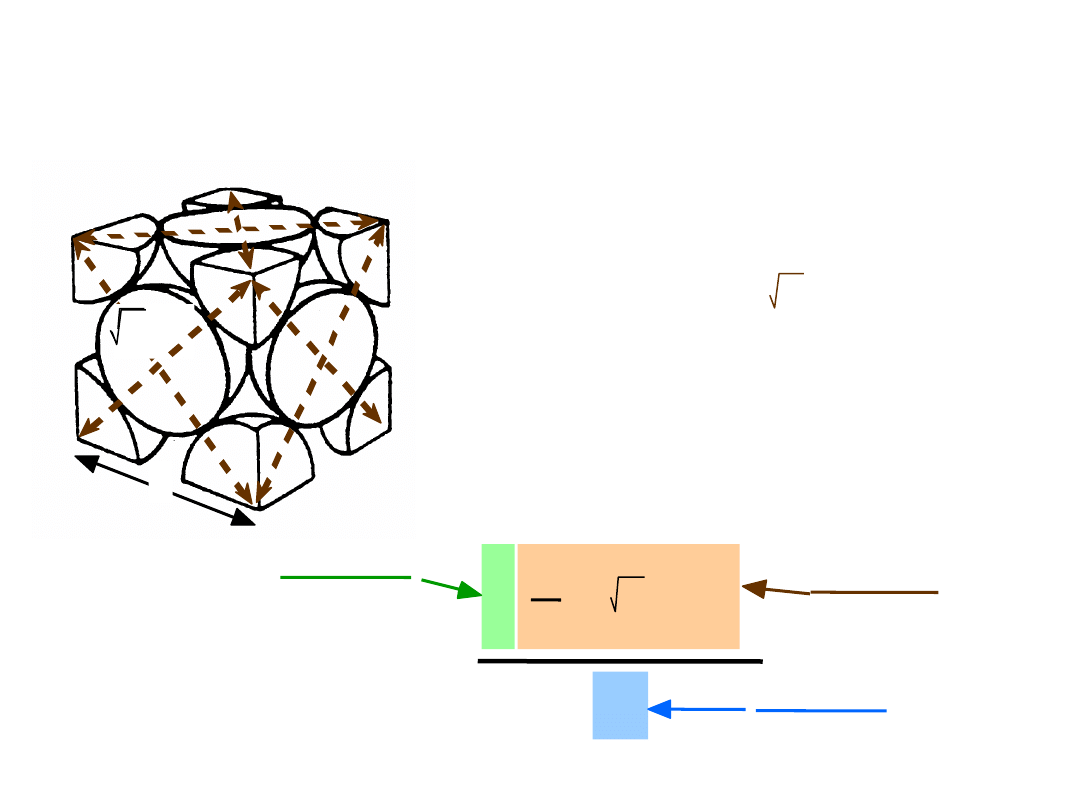
14
• Wsp. wypełnienia przestrzeni = 0.74
Współczynnik Wypełnienia Przestrzeni:
RSC
maksymalny
WW =
4
3
( 2a/4)3
4
atomy
kom. el.
atom
obj.
a3
kom. el.
obj.
Kierunki najgęstszego ulożenia:
długość = 4R =
2 a
Kom. el. zawiera:
6 x
1/2 + 8 x
1/8
=
4 atomy/kom. el.
a
2 a
15
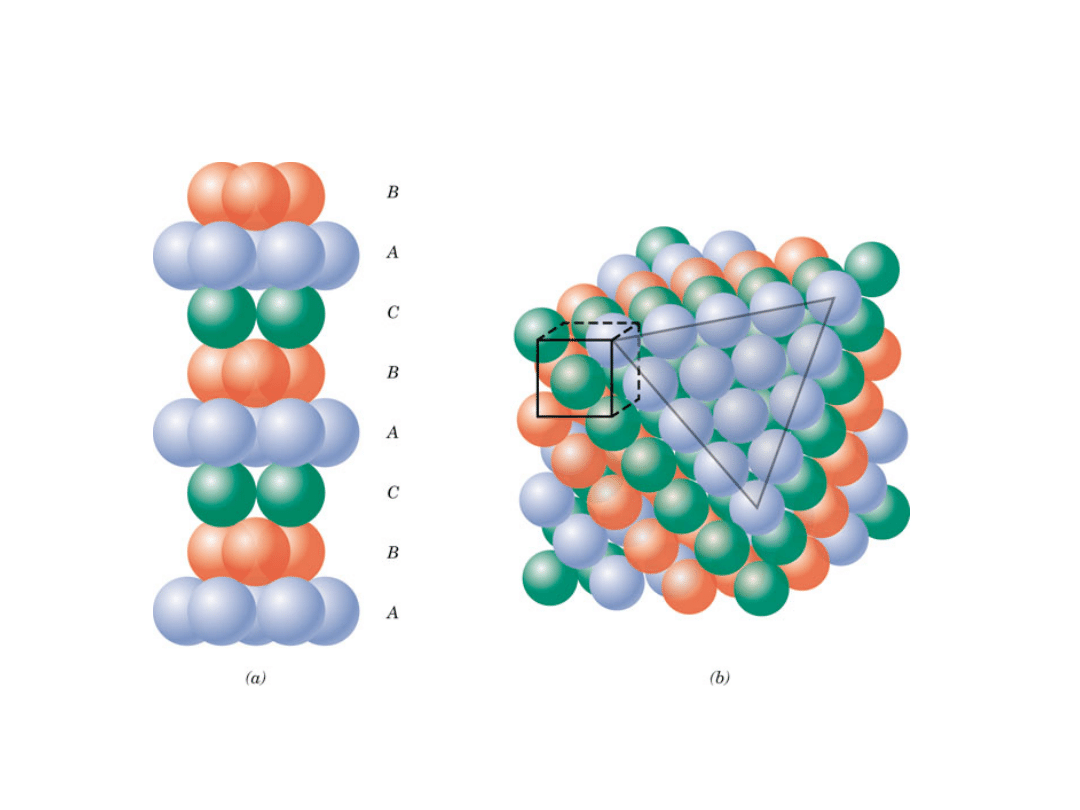
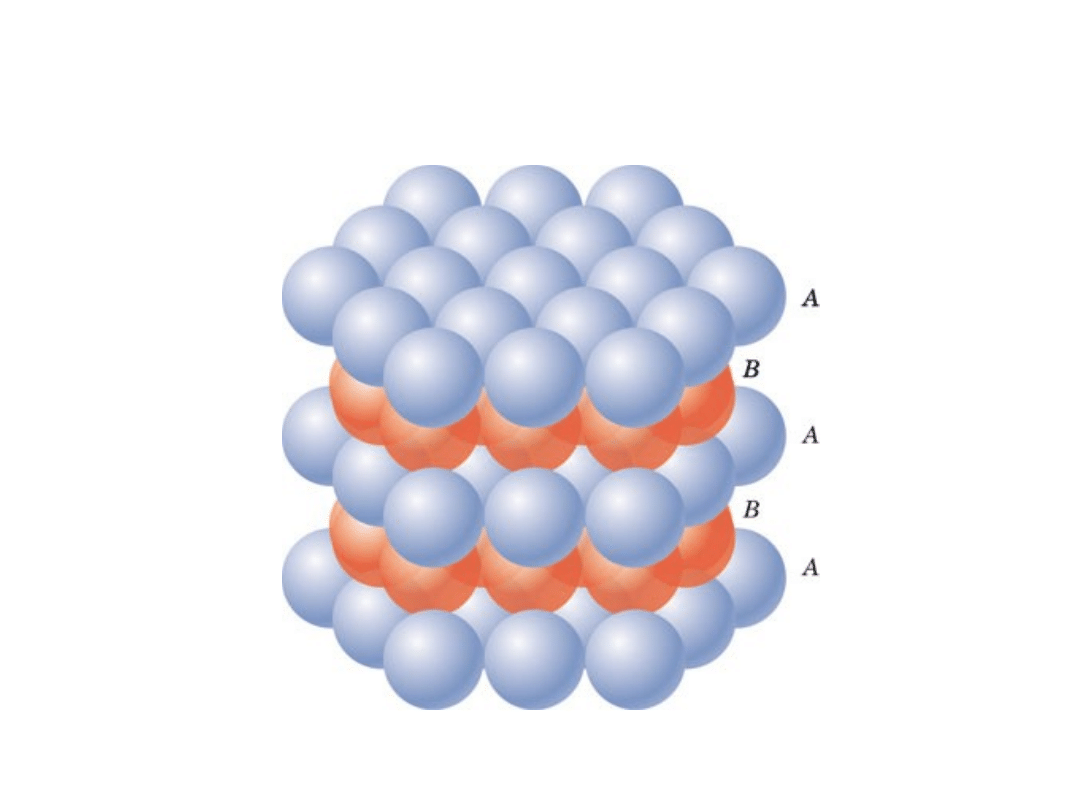
A
B
B
B
B
B
B
B
C
C
C
C
A
B
B
• ABCABC... Sekwencja ułożenia
Komórka
elementarna
RSCl
Ułożenie atomów w strukturze RSC
B
B
B
B
B
B
B
C
C
C
A
C
C
C
A
A
B
C
16
Regularna Ściennie
Centrowana
17
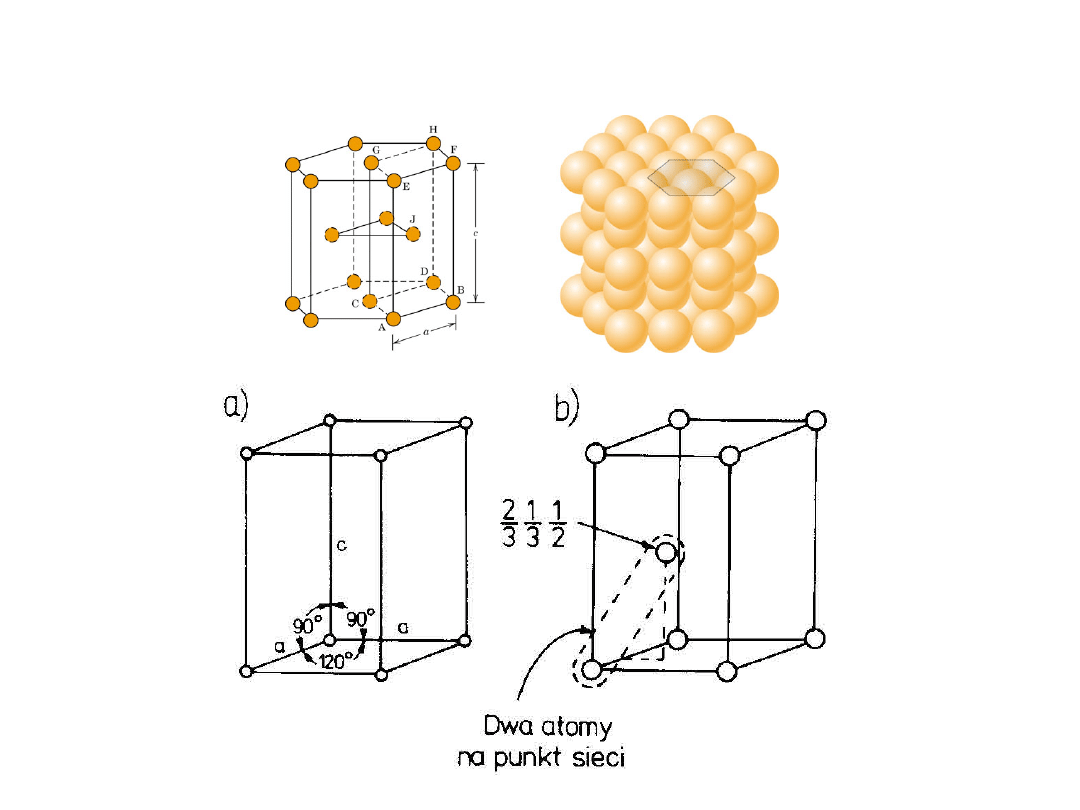
Heksagonalna Zwarta
18
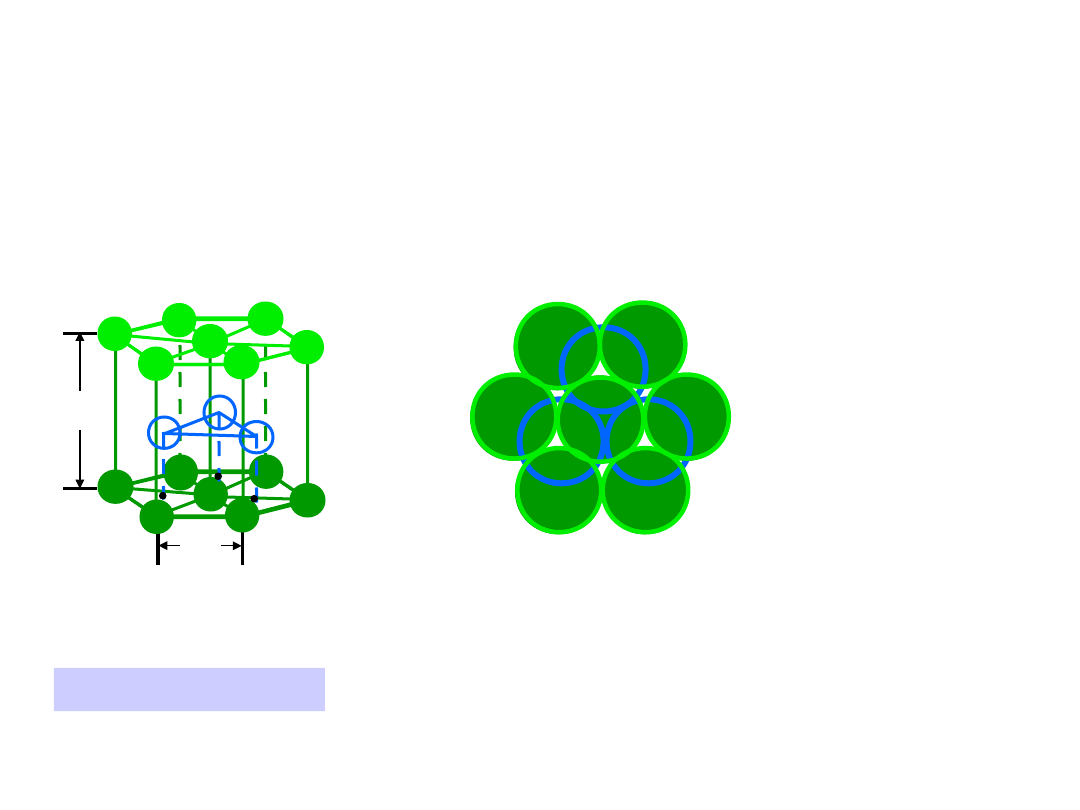
Heksagonalna Zwarta
19
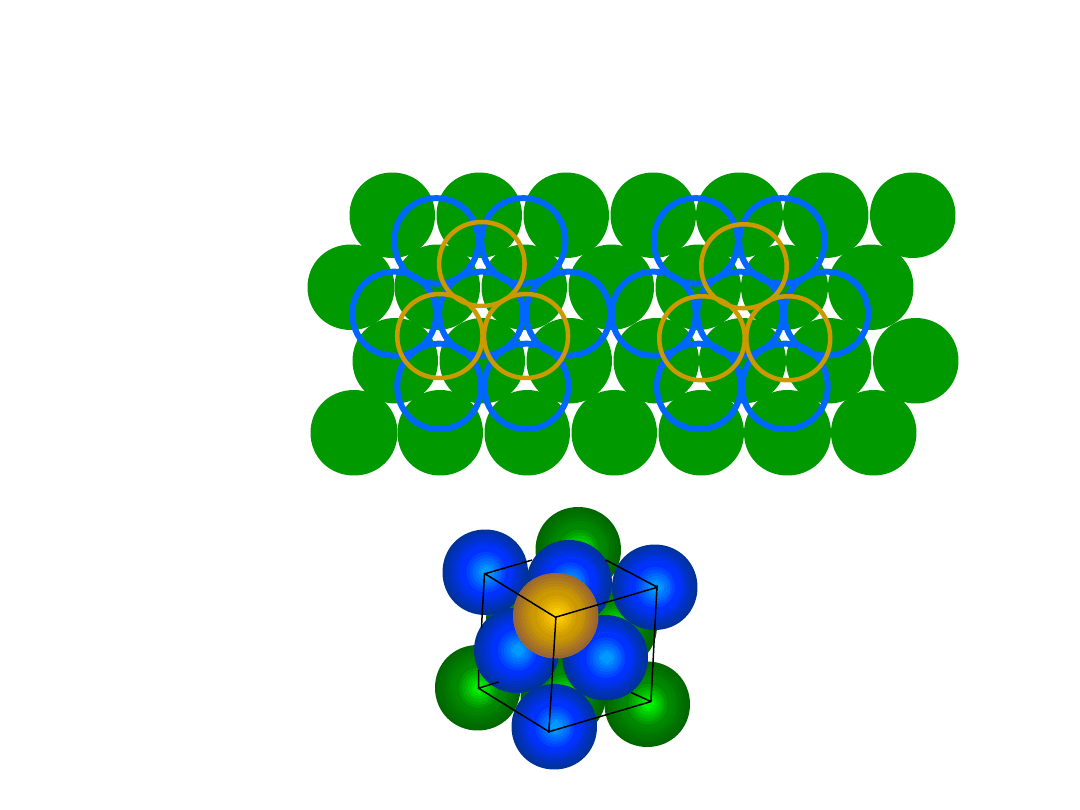
• # Koordynacyjna = 12
• ABAB... Sekwencja ułożenia
• WWP = 0.74
• 3D
• 2D
Heksagonalna Zwarta (HZ)
6 atomów/kom. el.
np.: Cd, Mg, Ti,
Zn
• c/a = 1.633
c
a
A
B
A
Dolna warstwa
Środkowa warstwa
Górna warstwa
r
20
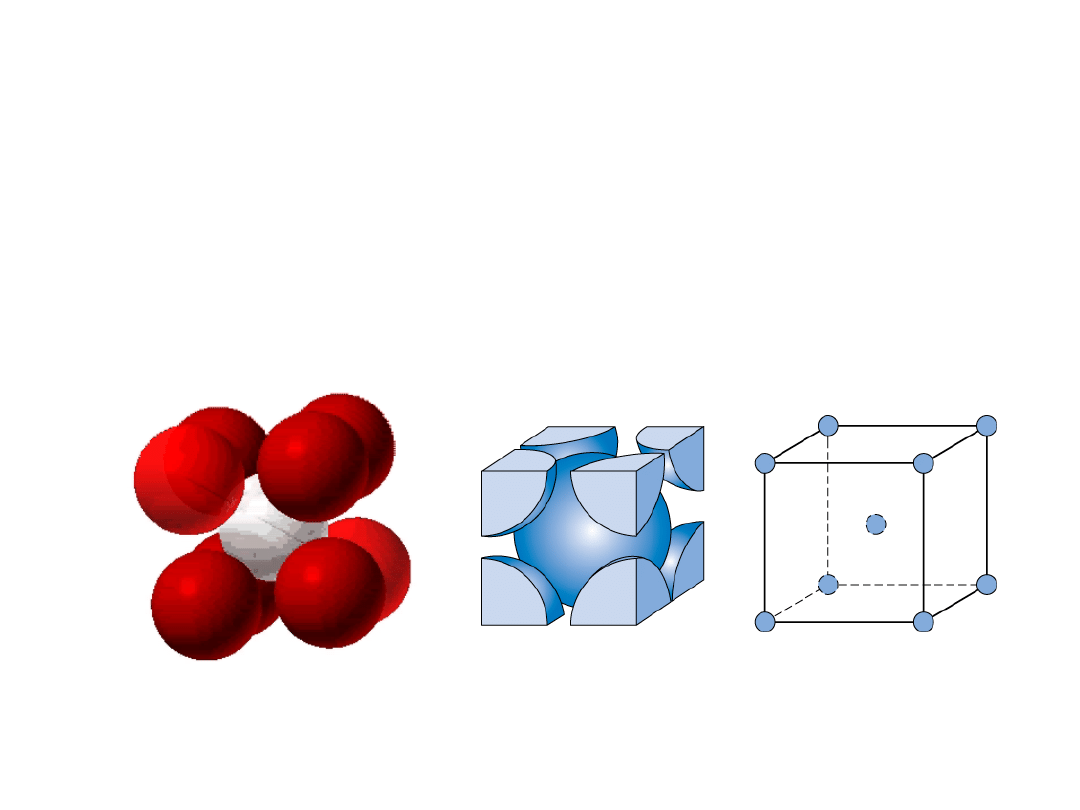
• # koordynacyjna = 8
• Atomy stykają się wzdłuż przekątnej sześcianu
Struktura regularna przestrzennie
centrowana
np.: Cr, W, Fe (), Ta, Mo
2 atomy/kom. el.: 1 środek + 8 naroży x 1/8
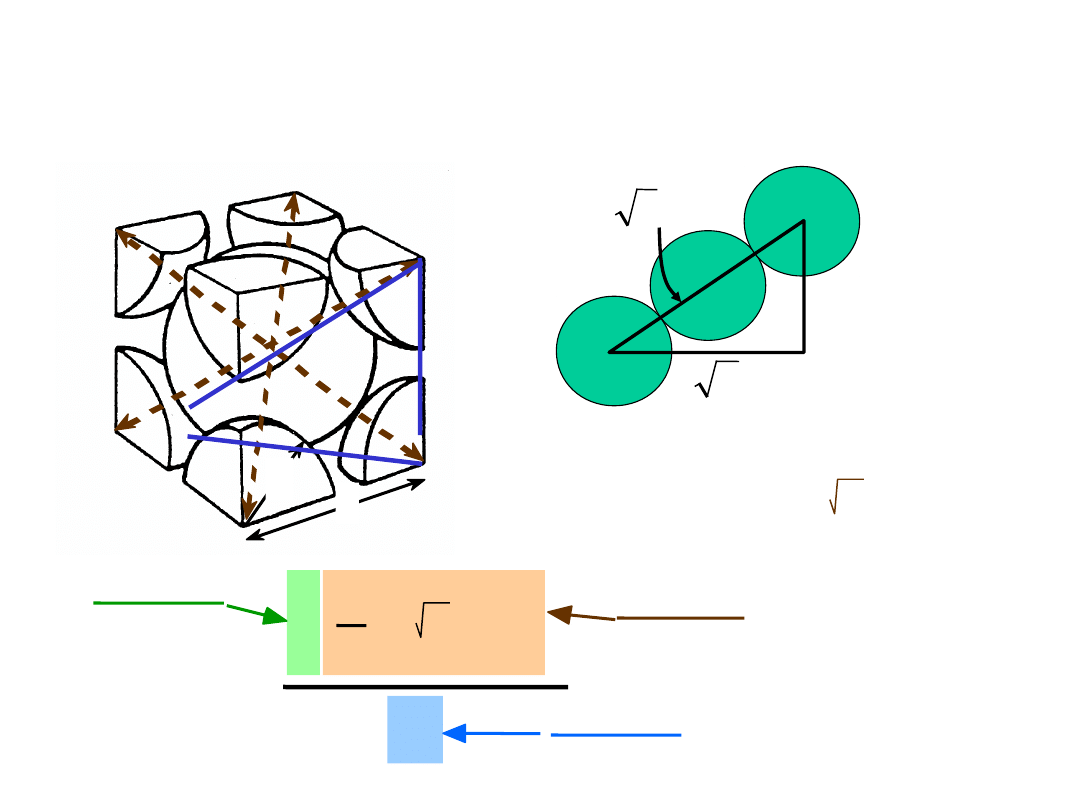
21
Współczynnik Wypełnienia
Przestrzeni
a
WWP =
4
3
( 3a/4)3
2
atomy
kom. el.
atom
objętość
a3
kom. el.
objętość
długość = 4R =
Kierunek najgęstszego ułożenia:
3 a
• WWP dla struktury RPC = 0.68
a
R
a
2
a
3

22
Gęstość Teoretyczna,
gdzie
n = liczba atomów/kom. el.
A =
masa
atomowa
V
C
= Objętość kom. el. = a
3
(
dla strukt.
regularnej)
N
A
= Liczba Avogadra
= 6.023 x 10
23
atomów/mol
Gęstość = =
V
C
N
A
n
A
=
Całkowita obj. kom. el.
el.
kom.
w
Atomów
Masa
23
• Np.: Cr (RPC)
A =
52.00 g/mol
R = 0.125 nm
n = 2
teoret
a = 4R/ 3 = 0.2887
nm
rzecz.
a
R
=
a3
52.00
2
atomy
kom. el.
mol
g
kom. el.
objętość
atomy
mol
6.023
x
10
23
Gęstość Teoretyczna,
= 7.18 g/cm
3
= 7.19 g/cm
3
24
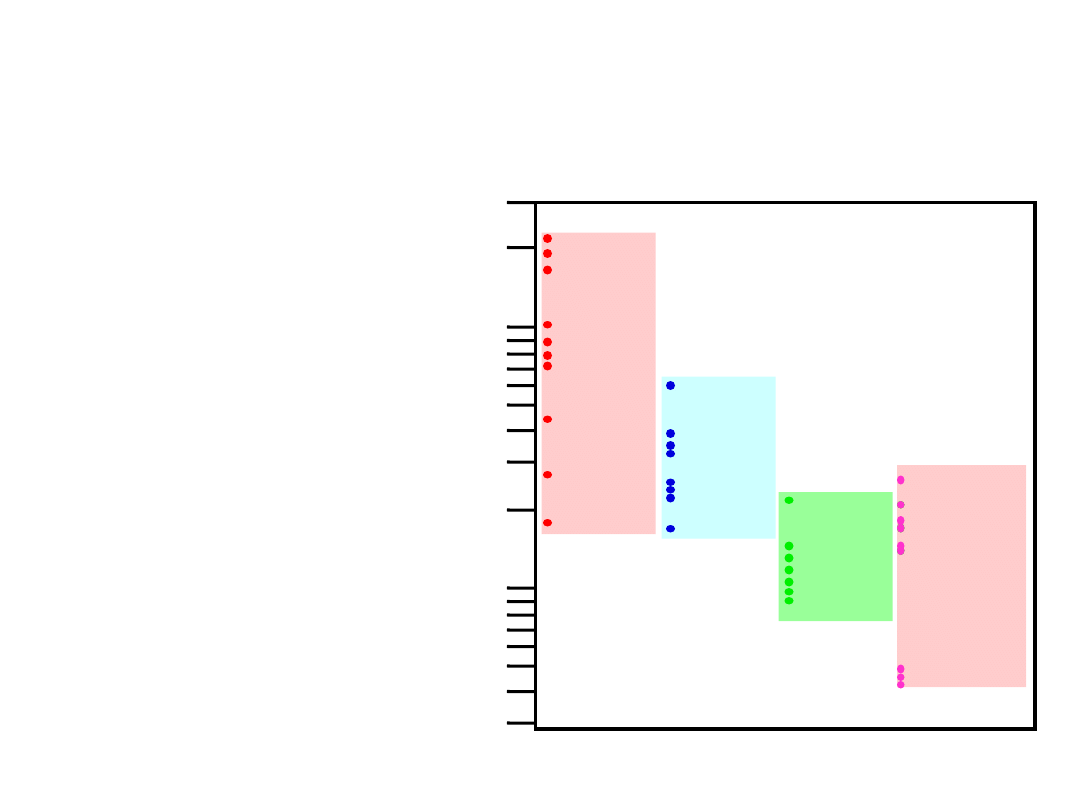
Gęstości różnych materiałów
metali
>
ceramik
>
polimerów
(g
/c
m
)
3
Grafite/
Ceramiki/
Półprzewod.
Metale/
Stopy
Kompozyty/
Włókna
Polimery
1
2
20
30
B
ased on data in Table B1, Callister
*GFRE, CFRE, & AFRE are Glass,
Carbon, & Aramid Fiber-Reinforced
Epoxy composites (values based on
60% volume fraction of aligned fibers
in an epoxy matrix).
10
3
4
5
0.3
0.4
0.5
Magnesium
Aluminum
Steels
Titanium
Cu,Ni
Tin, Zinc
Silver, Mo
Tantalum
Gold, W
Platinum
Graphite
Silicon
Glass-soda
Concrete
Si nitride
Diamond
Al oxide
Zirconia
HDPE, PS
PP, LDPE
PC
PTFE
PET
PVC
Silicone
Wood
AFRE*
CFRE*
GFRE*
Glass fibers
Carbon fibers
Aramid fibers
Metale
mają:
• gęste upakowanie
(wiązanie metaliczne)
• często duże masy atomowe
Ceramiki
mają:
• mniej gęste upakowanie
• często lekkie pierwiastki
Polimery
mają:
• małą gęstość upakowaia
(często niekrystaliczne)
• lekkie pierwiastki (C,H,O)
Compozyty
mają:
• wartości pośrednie
Ogólnie:

25
• Niektóre zastosowania wymagają monokryształów:
• Własności zależą od
struktury krystalicznej
-diament, do
cięcia,
szlifowania
- łopatki turbin
Zastosowanie Kryształów
Kwarc
26
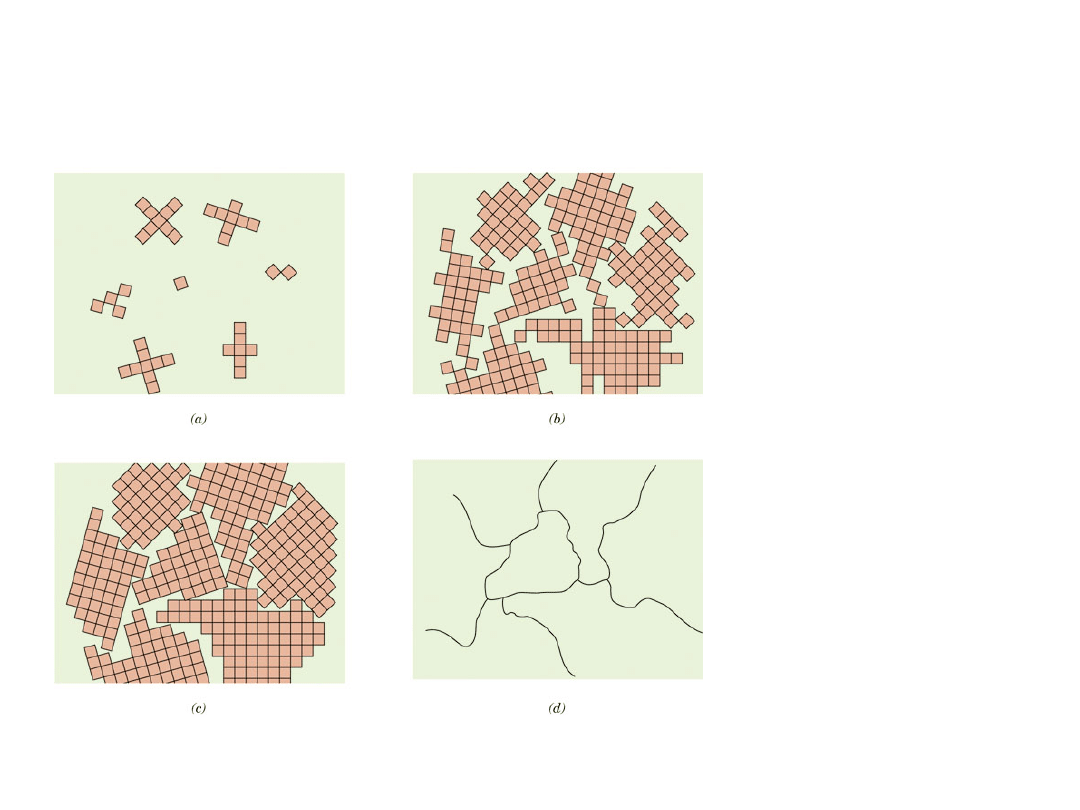
Polikryształy
Stadia
krzepnięcia
polikrystaliczne
go materiału

27
• Większość materiałów inżynierskich to
polikryształy
•
Każde „ziarno" jest monokryształem
• Gdy ziarna są zorientowane przypadkowo, to
własności nie zależą od kierunku
• Wielkości ziarn: od 1 nm do 2 cm
1 mm
Polikryształy
Izotropowy
Anizotropowy
Spoina stopu Nb-Hf-W
28
• Monokryształy
-Własności zależą od
kierunku:
anizotropia
-Przykład: moduł
Younga (E) w Fe-
• Polikryształy
-Własności mogą lub nie
zależeć od kierunku
-Gdy ziarna są
zorientowane
przypadkowo:
isotropowe
.
(E
poli Fe
= 210 GPa)
-Gdy ziarna mają
uprzywilejowaną
orientację (
texturę
),:
anizotropowe
200 m
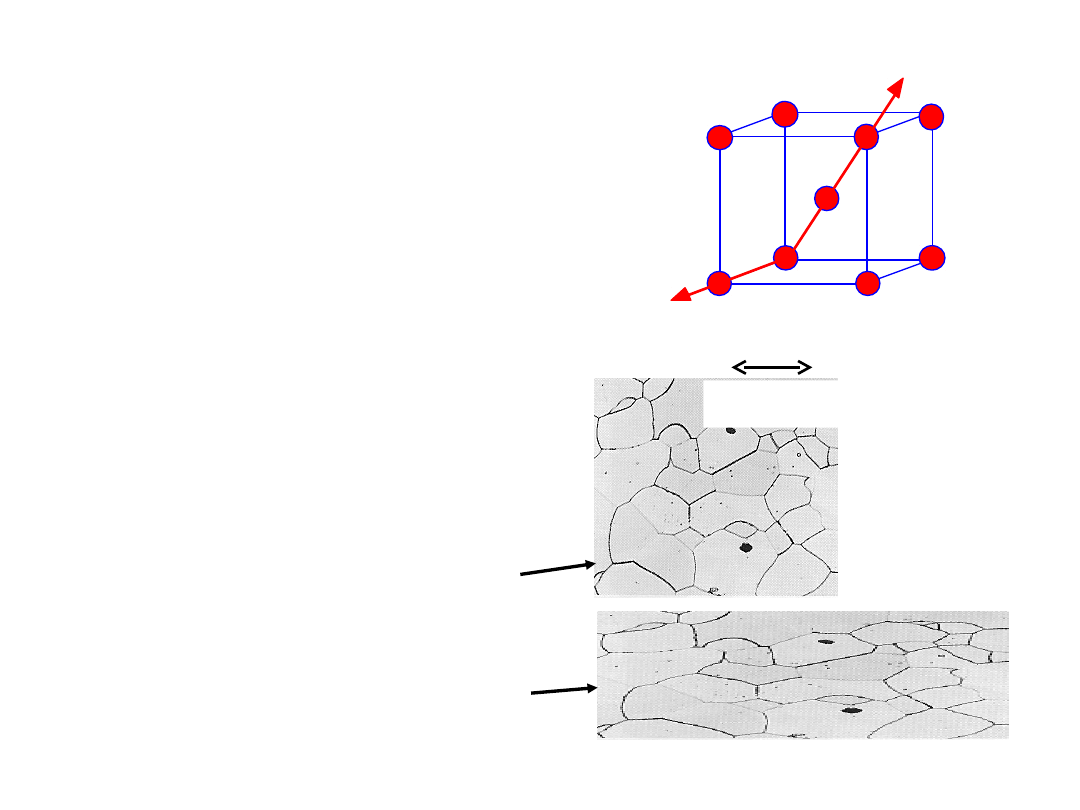
Mono- vs.
Polikryształy
E (przekątna) = 273 GPa
E (krawędź) = 125 GPa
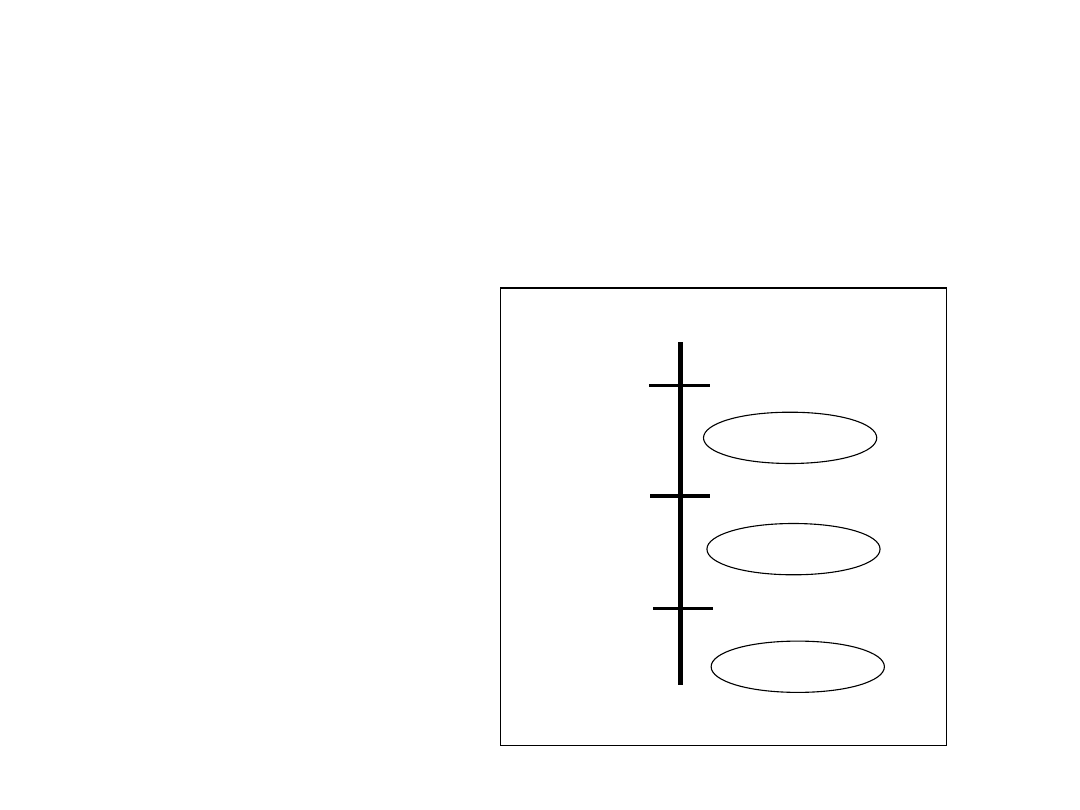
29
Polimorfizm
• Dwie lub więcej struktur krystalicznych dla
tego samego pierwiastka (alotropia)
tytan
, -Ti
węgiel
diament, grafit
RPC
RSC
RPC
1538ºC
1394ºC
912ºC
-Fe
-Fe
-Fe
ciecz
Żelazo
30
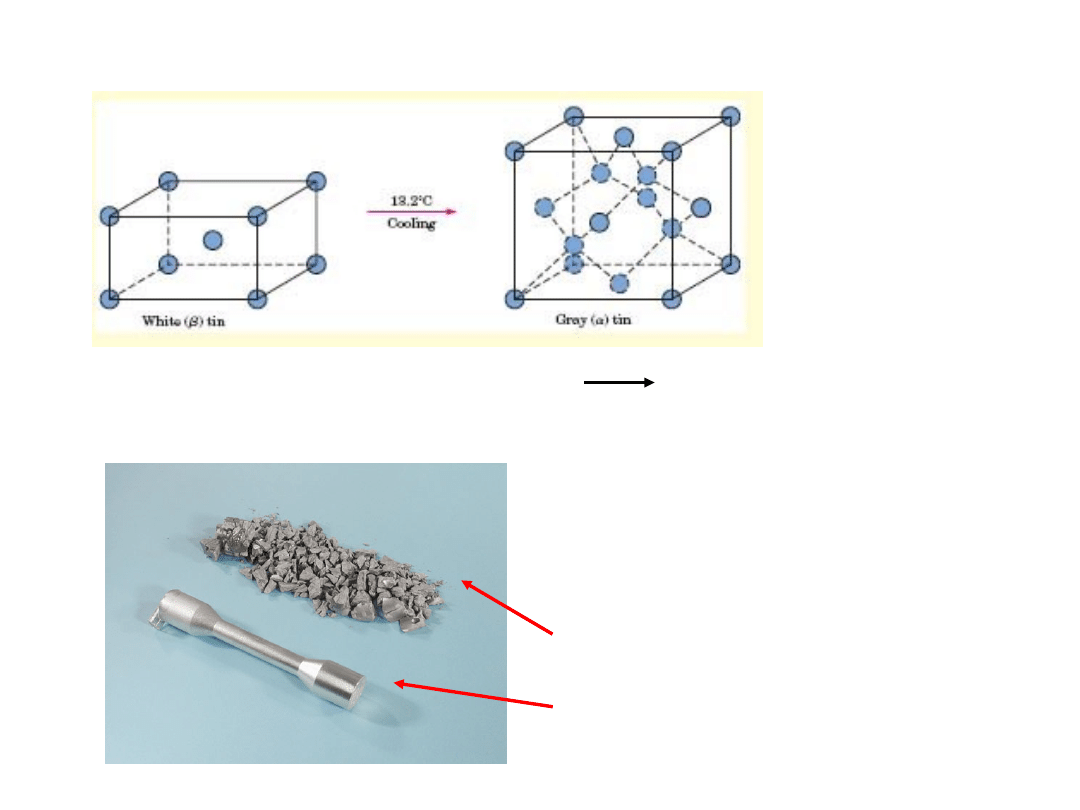
Przemiana Alotropowa w cynie
Tetragonalna Przestrzennie Centrowana RSC (dwa
atomy na punkt
sieciowy
- typu diamentu)
Szara
cyna
Biała
cyna
Wzrost objętości (27%) i spadek
gęstości z 7.30 g/cm
3
do 5.77
g/cm
3
Document Outline
- Struktura krystaliczna ciał stałych
- Energia i Upakowanie
- Slide 3
- Elementy Krystalografii
- Charakterystyka kryształów
- Siedem Systemów Krystalograficznych
- Czternaście typów sieci
- Oznaczanie struktur krystalicznych
- Struktura krystaliczna metali
- Struktura krystaliczna metali
- Struktura Regularna Prymitywna (RP)
- Współczynnik Wypełnienia Przestrzeni
- Struktura regularna ściennie centrowana
- Współczynnik Wypełnienia Przestrzeni: RSC
- Slide 15
- Regularna Ściennie Centrowana
- Heksagonalna Zwarta
- Slide 18
- Heksagonalna Zwarta (HZ)
- Struktura regularna przestrzennie centrowana
- Slide 21
- Gęstość Teoretyczna, r
- Slide 23
- Gęstości różnych materiałów
- Zastosowanie Kryształów
- Polikryształy
- Slide 27
- Mono- vs. Polikryształy
- Polimorfizm
- Przemiana Alotropowa w cynie
Wyszukiwarka
Podobne podstrony:
Wyklad 2 crystals
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
WYKŁAD VII
Wykład 1, WPŁYW ŻYWIENIA NA ZDROWIE W RÓŻNYCH ETAPACH ŻYCIA CZŁOWIEKA
Zaburzenia nerwicowe wyklad
Szkol Wykład do Or
Strategie marketingowe prezentacje wykład
Wykład 6 2009 Użytkowanie obiektu
wyklad2
wykład 3
więcej podobnych podstron