
Nazwy zwyczajowe aldehydów pochodzą od nazw zwyczajowych
odpowiednich kwasów karboksylowych, w których słowo "kwas"
zastąpiono słowem"aldehyd", np. aldehyd mrówkowy.
W nazwach systematycznych nazwy wyprowadzamy od nazwy
węglowodoru dodając końcówkę
-al
Przykłady:
metanal, aldehyd mrówkowy
HCHO
etanal, aldehyd octowy
CH
3
-CHO
aldehyd benzoesowy (aromatyczny)
C
6
H
5
-CHO

Właściwości fizyczne
Właściwości fizyczne aldehydów i ketonów zależne są od liczby atomów
węgla w cząsteczce;
Aldehydy
1. Stan skupienia
C1 - występuje w stanie gazowym
> C2 - występują w stanie ciekłym
Charakterystyczny zapach
C1 - C3 - mają nieprzyjemny zapach
C4 - C7 - mają odrażającą woń
> C8 - mają przyjemny zapach

Otrzymywanie
Aldehydy otrzymuje się następującymi metodami
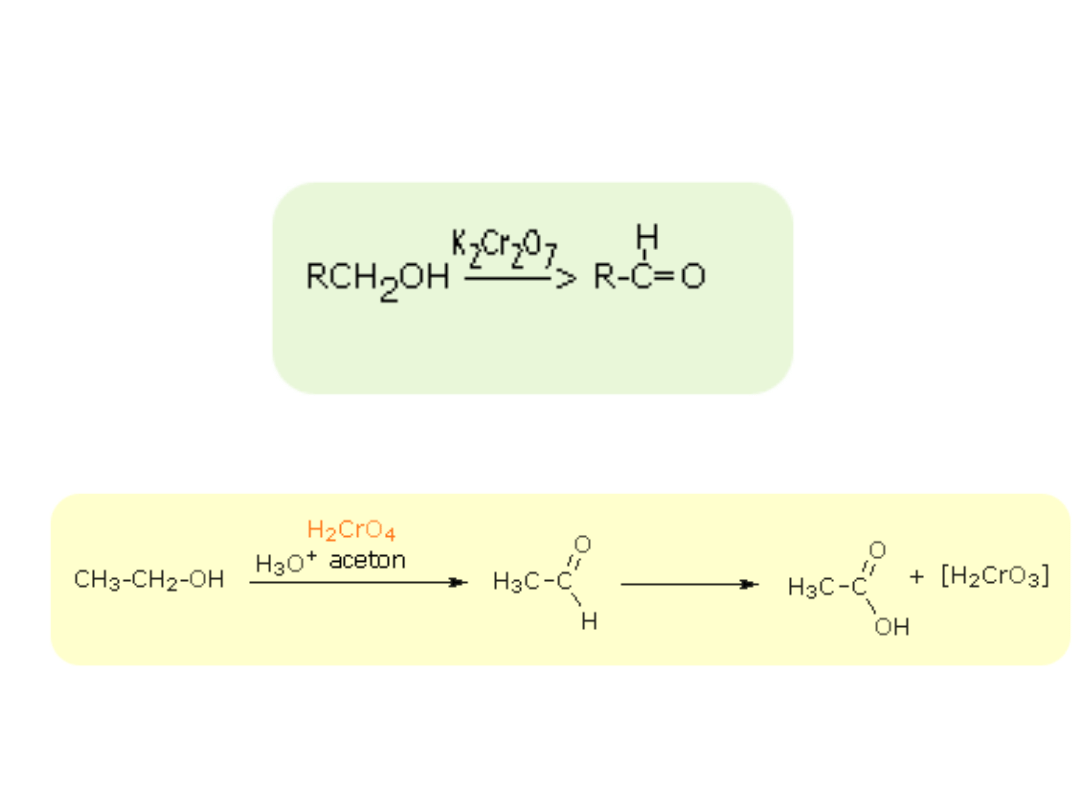
utlenianie alkoholi I-szo rzędowych w obecności K
2
Cr
2
O
7
utlenianie metylowych pochodnych benzenu
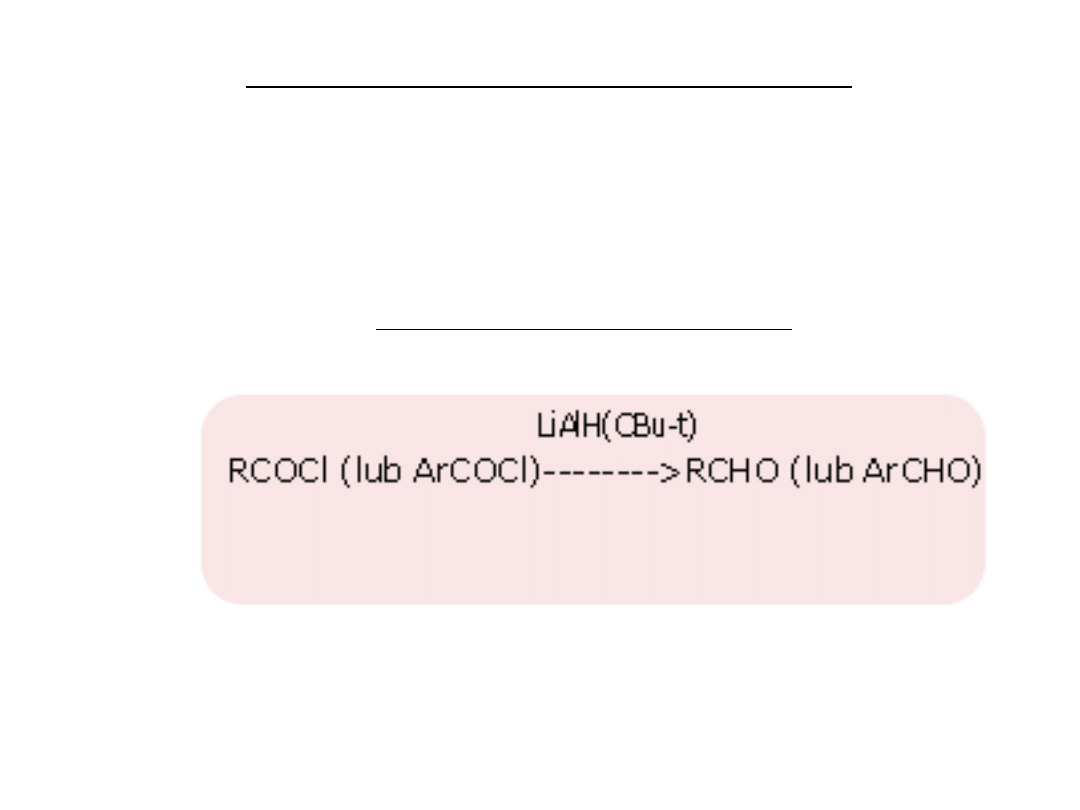
redukcja chlorków kwasowych
synteza Reimera-Tlemanna (otrzymywanie fenolo-aldehydów)
RCH
2
OH --> RCHO
Utlenianie metylowych pochodnych benzenu
ArCH
3
+ Cl
2
--> ArCHCl
2
ArCHCl
2
+ H
2
O --> ArCHO
Redukcja chlorków kwasowych
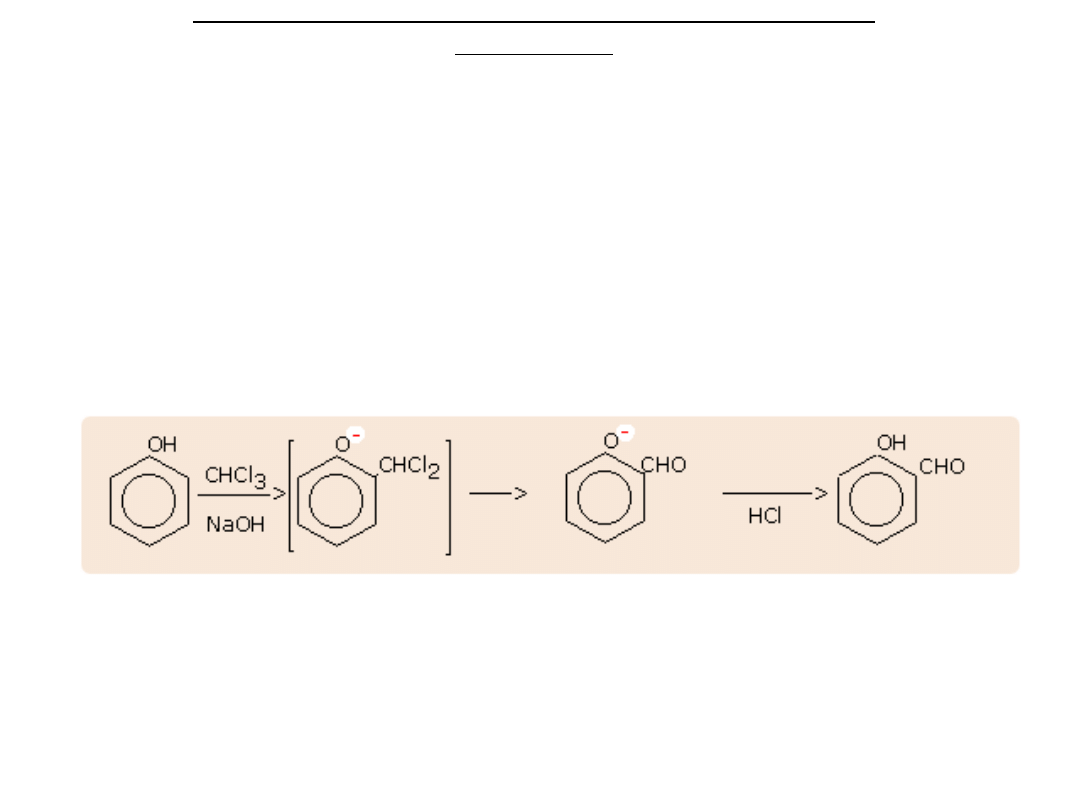
Synteza Reimera-Tiemanna (otrzymywanie fenolo-
aldehydów)
W wyniku działania chloroformu i wodnego roztworu
wodorotlenku na fenol grupa aldehydowa -CHO
zostaje wprowadzona do pierścienia
aromatycznego, na ogół w położenie orto do grupy
-OH.
C
6
H
5
OH + (CHCl
3
, NaOH) --> HOC
6
H
4
CHO
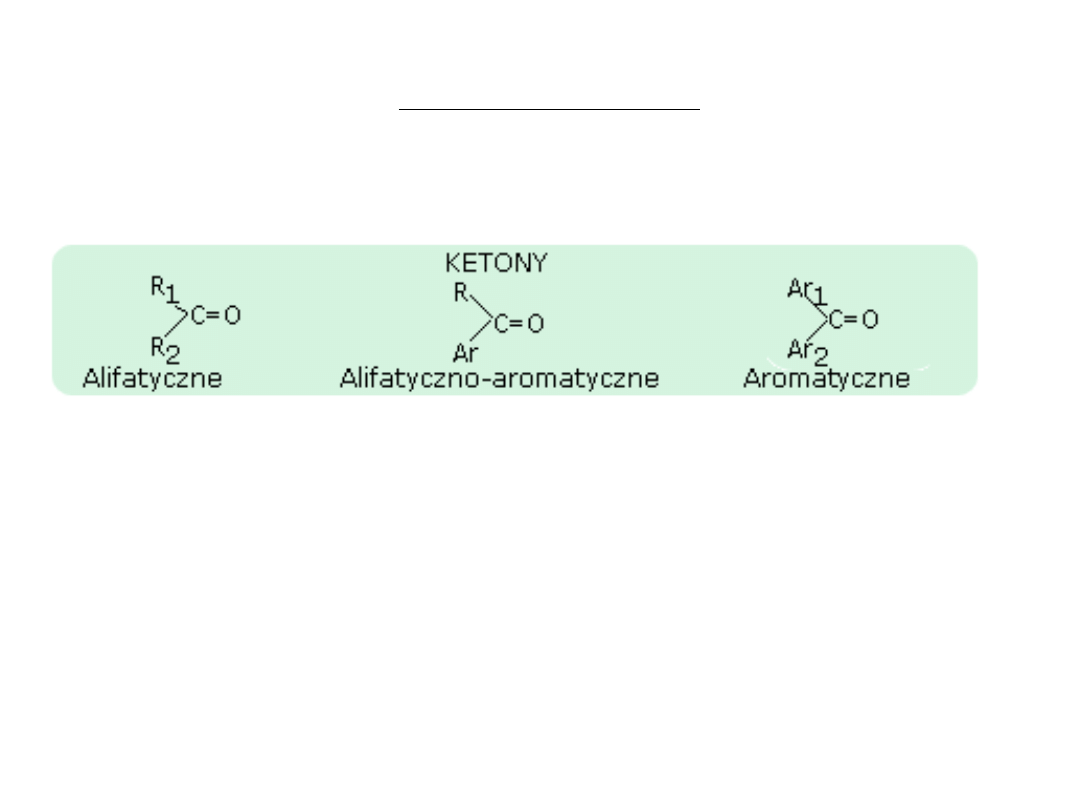
Nazewnictwo ketonów
Ketony mogą być; alifatyczne, alifatyczno-aromatyczne i aromatyczne.
Zasady nazewnictwa są podobne do tych które były opisywane przy aldehydach.
Nazwę ketonu tworzy się przez dodanie końcówki -on do nazwy węglowodoru.

propanon, aceton
2-butanon, keton etylo-metylowy
C
2
H
5
COCH
3
acetofenon (aromatyczny)
C
6
H
5
COCH
3

Ketony
1. Są cieczami
2. Są lotniejsze niż odpowiadające im alkohole
3. Rozpuszczają się w wodzie i w rozpuszczalnikach
organicznych w tym samym stopniu co alkohole
4. Są dobrymi rozpuszczalnikami organicznymi
5. Mają małą zdolność do krystalizacji

Ketony otrzymuje się w reakcjach
utlenianie alkoholi II-go rzędowych
acylowanie metodą Friedla-Craftsa
reakcja chlorków kwasowych ze związkami kadmoorganicznymi
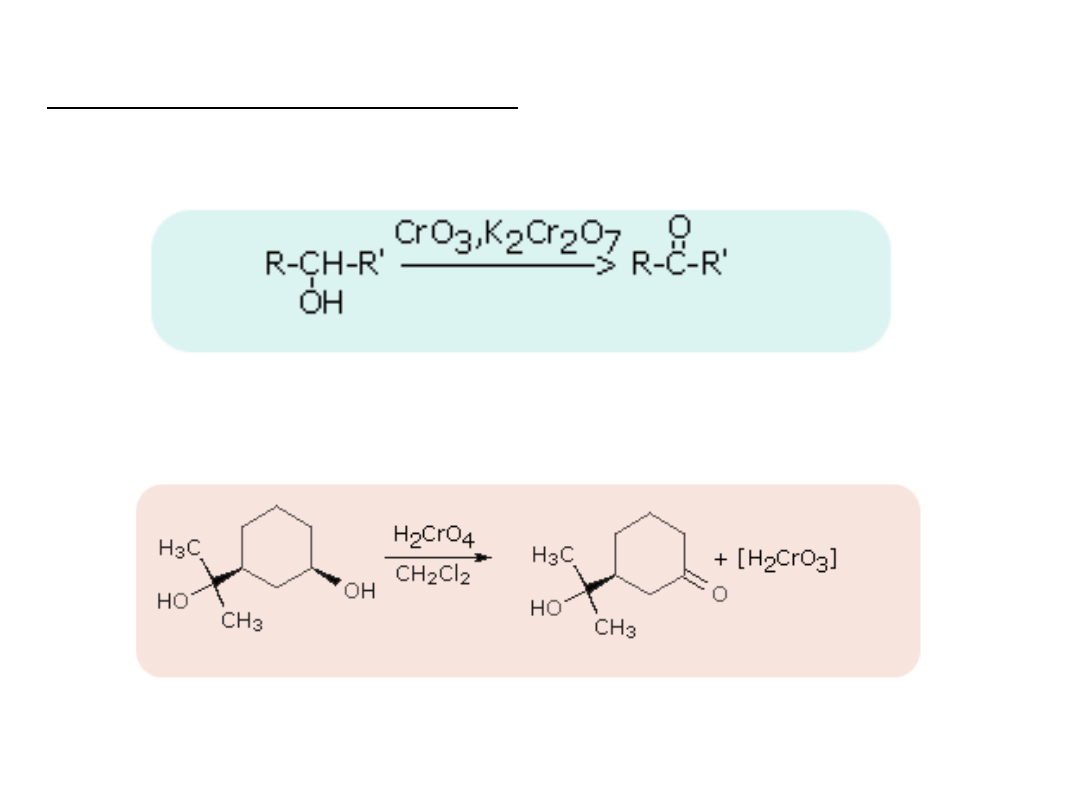
Utlenianie alkoholi II-go rzędowych
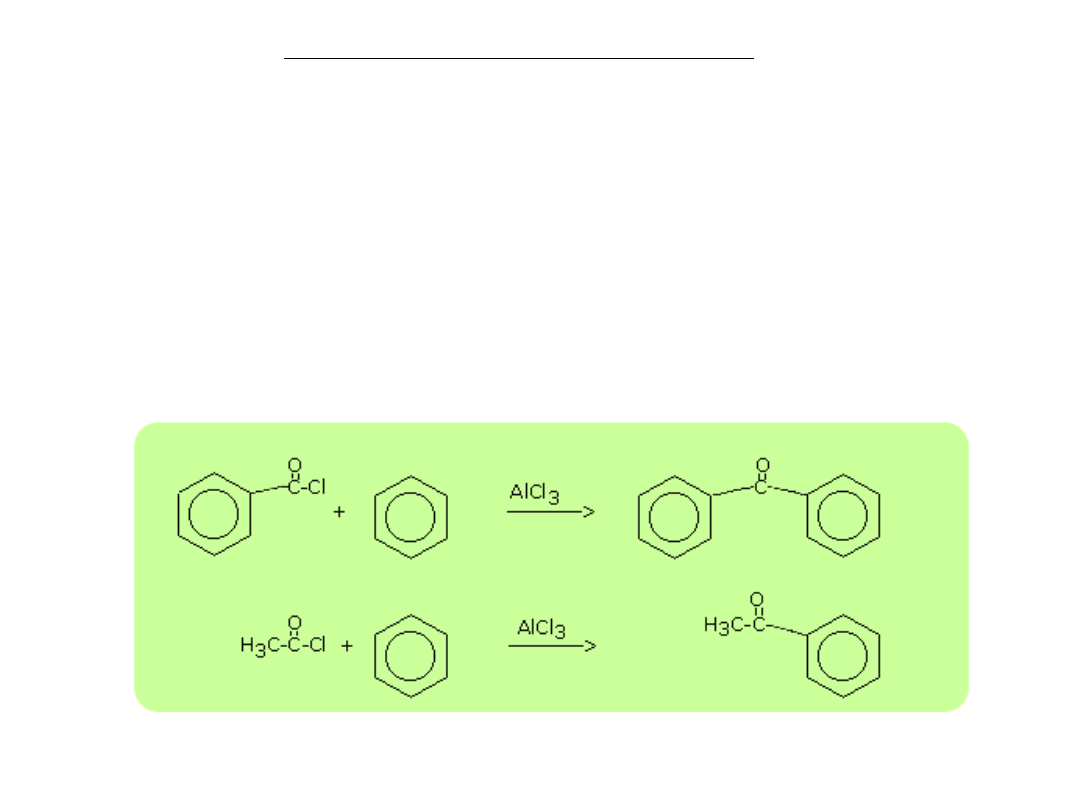
Acylowanie metodą Friedla-Craftsa
est to reakcja chlorków kwasowych - RCOCl. W tej reakcji grupa
acylowa RCO-
zostaje przyłączona do pierścienia aromatycznego, w wyniku czego
tworzy się keton.
Proces ten nazywany jest acylowaniem.
R-CO-Cl + Ar-H --> R-CO-Ar + HCl

Właściwości chemiczne
Aldehydy i ketony dają szereg reakcji uwarunkowanych obecnością
grupy karbonylowej C=O. Jest to grupa silnie spolaryzowana.
Aldehydy i ketony podlegają reakcjom
utleniania
redukcji
addycja związków Grignarda
addycji alkoholi i wody
addycja pochodnych amoniaku
addycji wodorosiarczanu, hydroksyloaminy, hydrazyny, cyjanków
kondensacja aldolowa
reakcji Cannizaro.

Utlenianie aldehydów i ketonów
Utleniaczem może być KMnO
4
, K
2
Cr
2
O
7
lub [Ag(NH
3
)
2
]
+
RCHO lub ArCHO --> RCOOH lub ArCOOH
najbardziej znana reakcja jest reakcja "lustra srebrnego",
wykorzystywana do wykrywania aldehydów
CH
3
CHO + 2[Ag(NH
3
)
2
]
+
+ 3OH
-
--> 2Ag + CH
3
COO- + 4NH
3
+ H
2
O
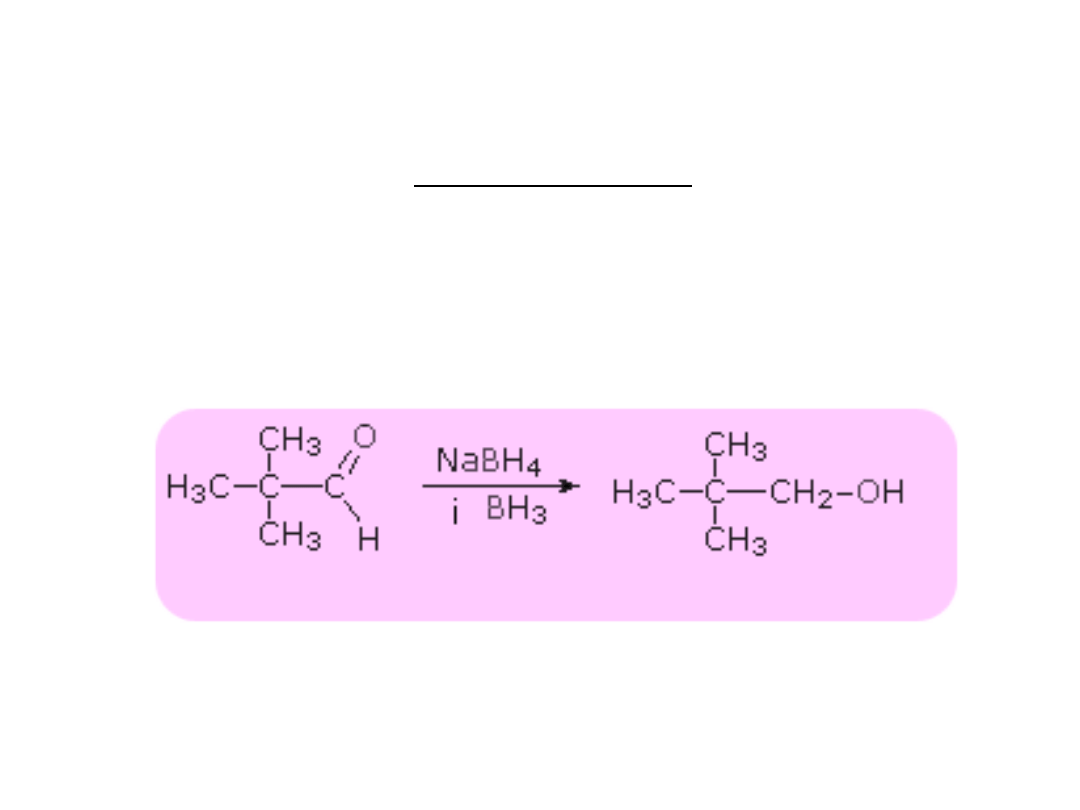
Redukcja aldehydów i ketonów
Produktami redukcji mogą być alkohole lub węglowodory.
Redukcja do alkoholi
Reakcja przebiega z udziałem katalizatorów Ni, Pt lub Pd, LiAlH
4
lub NaBH
4
.
RCHO + H
2
--> RCH
2
OH

Redukcja do węglowodorów
Reakcja przebiega z udziałem katalizatorów Zn + stęż.HCl lub NH
2
NH
2
.
C
6
H
5
-CO-CH
2
CH
3
----> C
6
H
5
-CH
2
-CH
2
CH
3
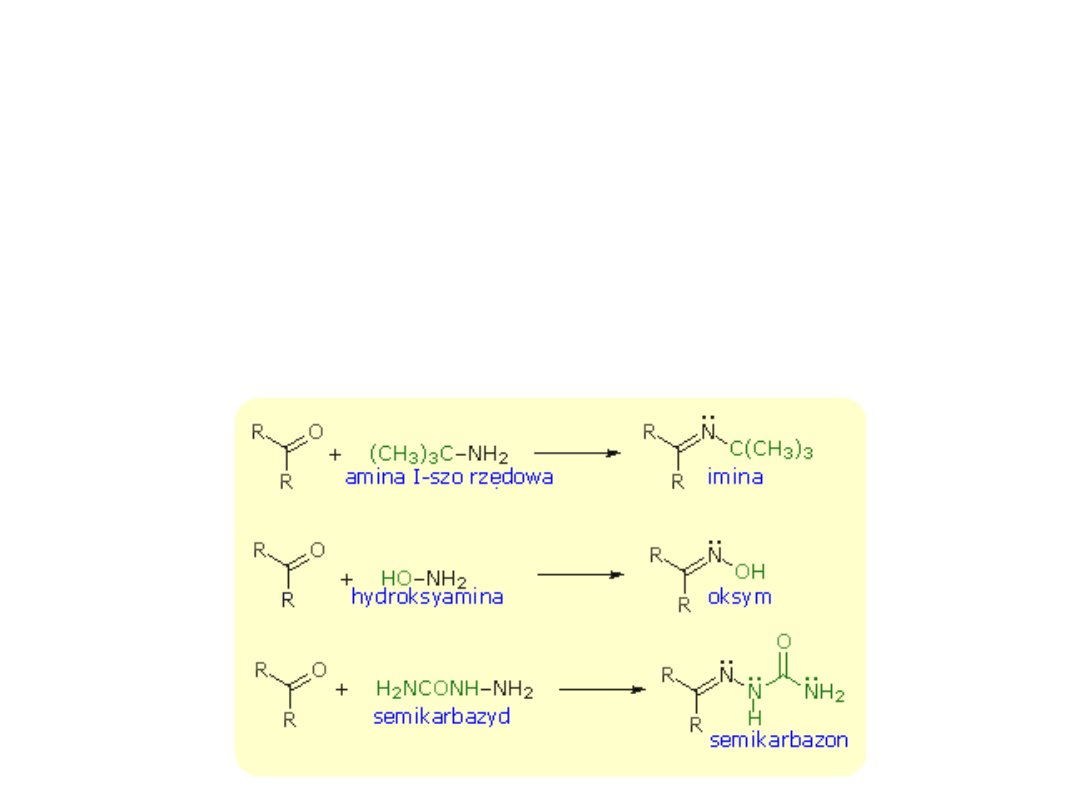
Addycja pochodnych amoniaku
Niektóre pochodne amoniaku przyłączają się do grupy karbonylowej.
Tworzą się wówczas połączenia, których znaczenie polega głównie na
tym, że można je wykorzystać do charakterystyki i identyfikacji
aldehydów i ketonów.
Połączenia te zawierają w cząsteczce podwójne wiązanie węgiel-azot,
które tworzy się skutek eliminacji cząsteczki wody z początkowo
utworzonych produktów addycji.

Addycja wodorosiarczanu
Wodorosiarczan przyłącza się do większości aldehydów i do wielu
ketonów, tworząc produkty addycji.
=C=O + NaHSO
3
--> =C(OH)SO
3
Na
Reakcję przeprowadza się przez zmieszanie aldehydu lub ketonu ze
stężonym roztworem wodorosiarczanu sodowego, a następnie oddziela
się produkt w postaci krystalicznego ciała stałego.
Reakcja ta pozwala na oddzielenie ketonów i aldehydów (w postaci
nierozpuszczalnej soli) od innych związków organicznych.
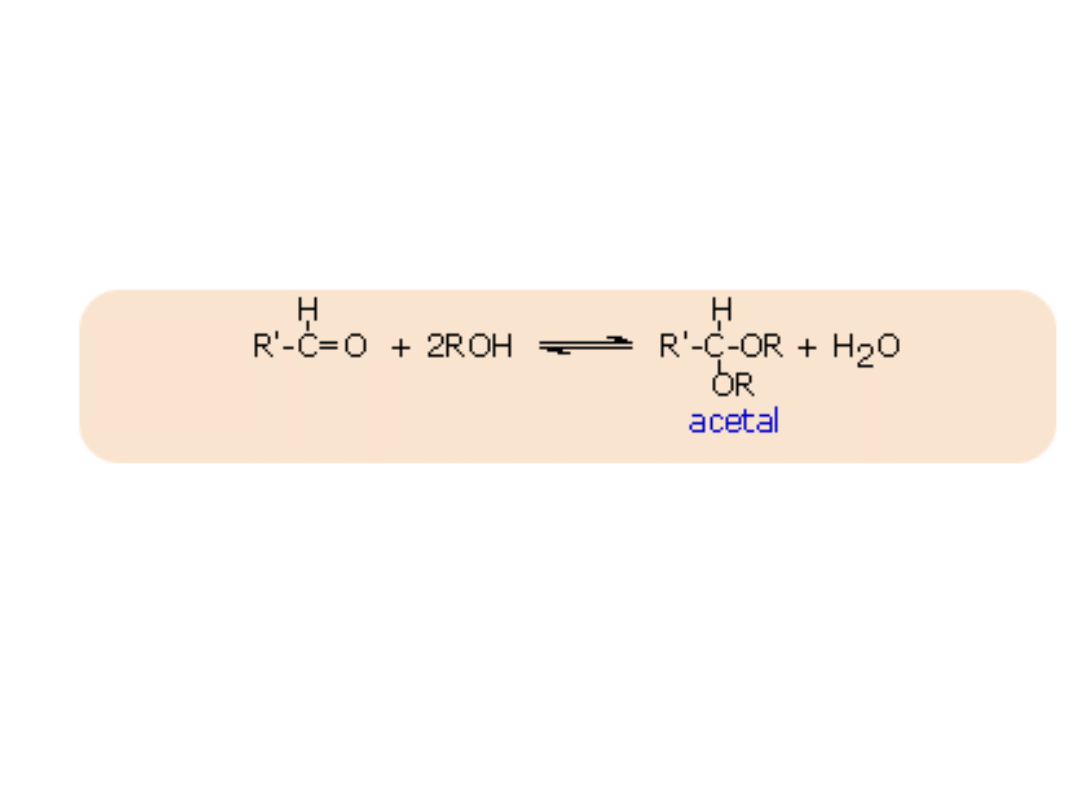
Addycja alkoholi - tworzenie acetali
Alkohole w obecności bezwodnego kwasu przyłączjaą się do grupy
karbonylowej
aldehydów, wskutek czego tworzą się
acetale
.
CH
3
CHO + 2C
2
H
5
OH <=> CH
3
CH(OC
2
H
5
)
2
+ H
2
O
Acetale mają strukturę eterów i podobnie jak etery ulegają rozszczepieniu
przez kwasy, natomiast są odporne na działanie zasad.

Kondensacja aldolowa
Pod wpływem rozcieńczonej zasady lub rozcieńczonego
kwasu dwie cząsteczki aldehydu lub ketonu mogą łączyć się,
w wyniku czego tworzy się
beta-hydroksyaldehyd albo
beta-hydroksyketon
CH
3
CHO + CH
3
CHO --> CH
3
-CH(OH)-CH
2
-CHO
Reakcja ta nie zachodzi jeżeli cząsteczka aldehydu lub ketonu
nie zawiera atomu wodoru (alfa). Z tego wynika, że reakcji
nie będzie podlegać
:
ArCHO, HCHO, ArCOAr, ArCOCH
3

Reakcja Cannizaro
Aldehydy nie zawierające atomów wodoru
(alfa)
ulegają w obecności stężonych
roztworów zasad (NaOH) reakcji
samoutlenienia-redukcji prowadzącej do
mieszaniny alkoholu i soli kasu
karboksylowego.
2HCHO ---> CH
3
OH + HCOO
-
Na
+
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
aldehydy i ketony addycja nukleofilowa
aldehydy i ketony
Aldehydy i ketony
Aldehydy i ketony
Aldehydy, ketony, kwasy, ALDEHYDY
Aldehydy, ketony i kwasy - test 2, 1p
ISE powtorka z chemii, ISE aldehydy i ketony, P 5
aldehydy i ketony zadania
13 Aldehydy i ketony kondensacja aldolowa
ketony ppt
(3wysł) polifenole, aldehydy, ketony,kwasy,mydła 2010 11(1)
Aldehydy i ketony
wyk 8 aldehydy,ketony cd
6 aldehydy,ketony
więcej podobnych podstron