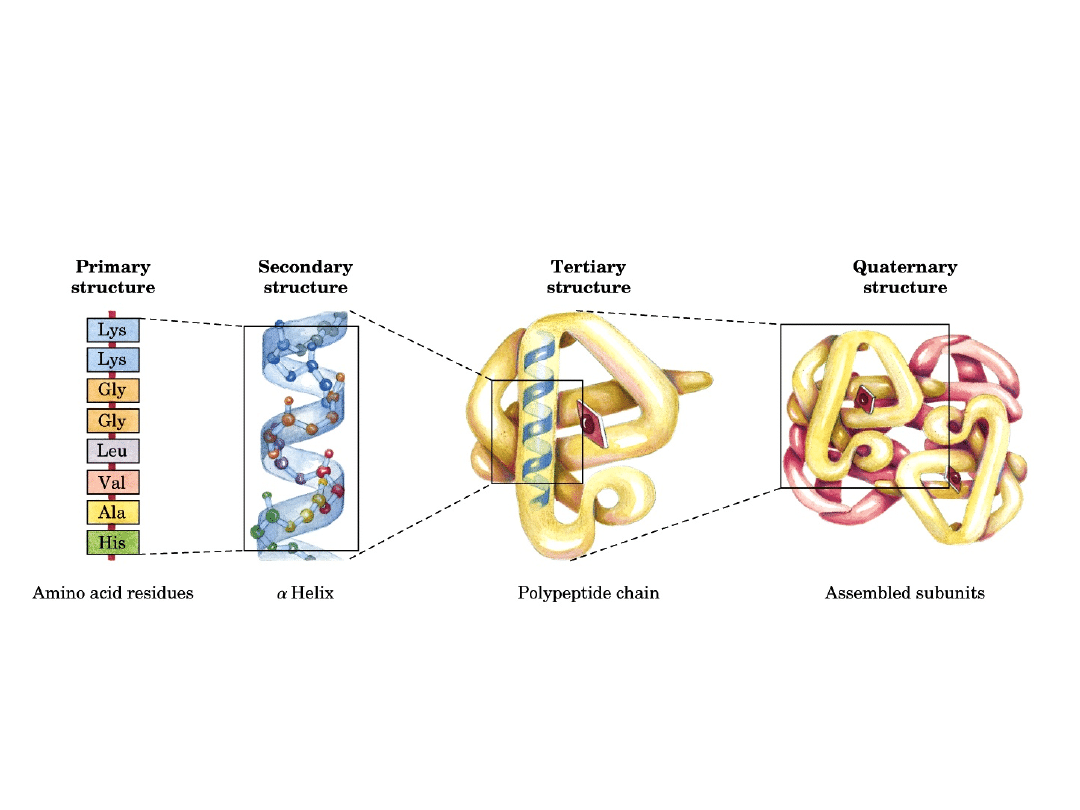
Fałdowanie białek
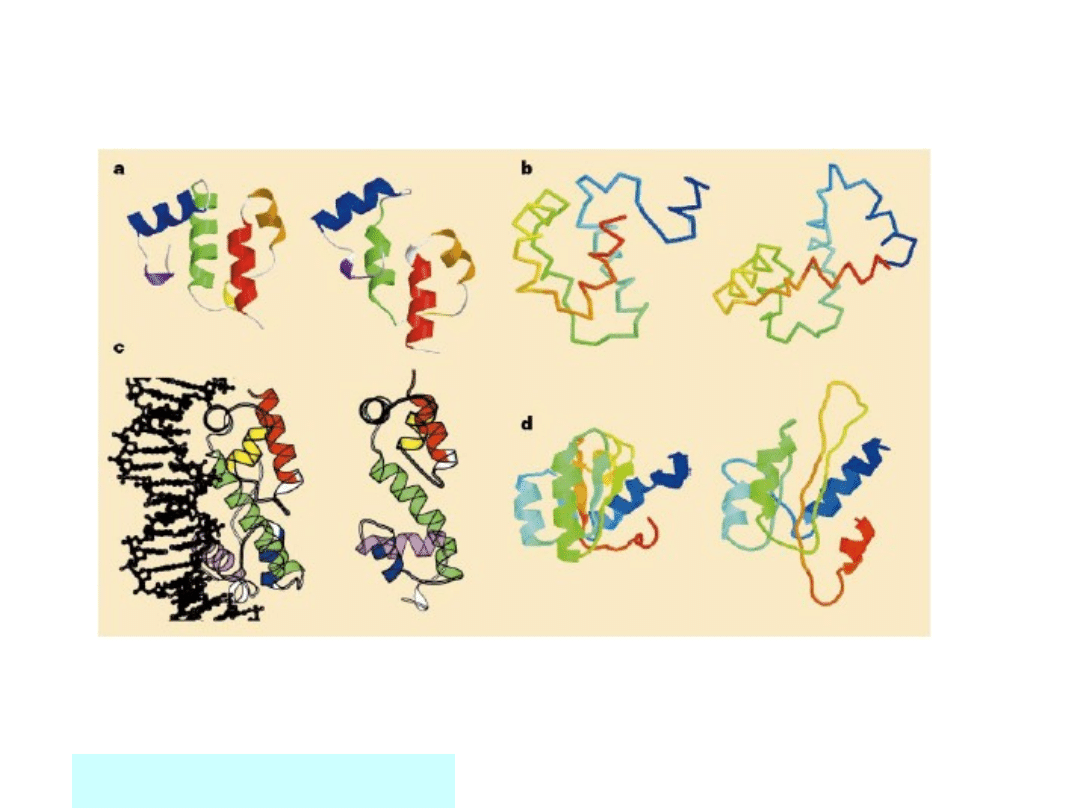
CASP3
a) Helikaza DNA forma B, b) Ets-1, c) MarA, d) rybosomalne białko
L30
David Baker (2000) NATURE, 405; 39 -
42
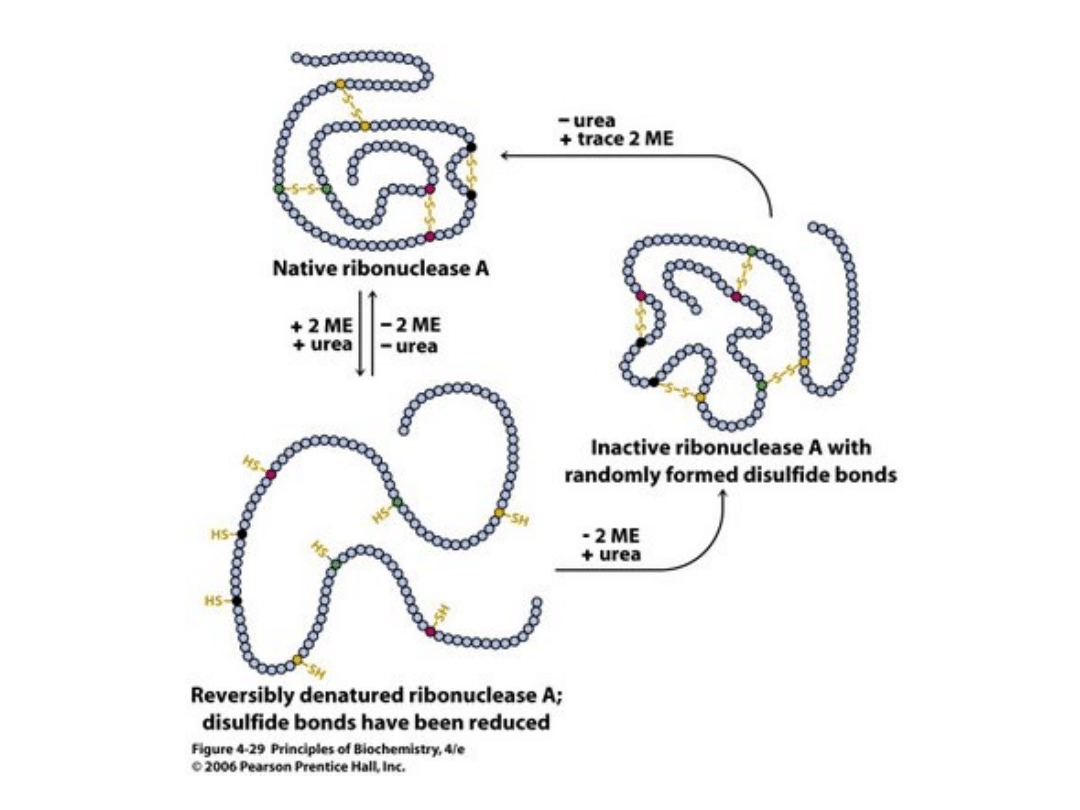

Ryc. z: Horton H.R., Moran L.A., Ochs R.S., Rawn D.J., K Gray Scrimgeour K.G, 2003, Principles of Biochemistry ,
Pearson Higher Education; Prentice-Hall, Inc. ISBN: 0130926434
Konformacja natywna rybonukleazy A

Struktura tunelu
• długość tunelu od miejsca
syntezy wiązania peptydowego do
jego wyjścia wynosi 100 Å
• jego szerokość waha się od 10 –
20 Å
• mieści polipeptyd o długości 50
reszt aminokwasowych
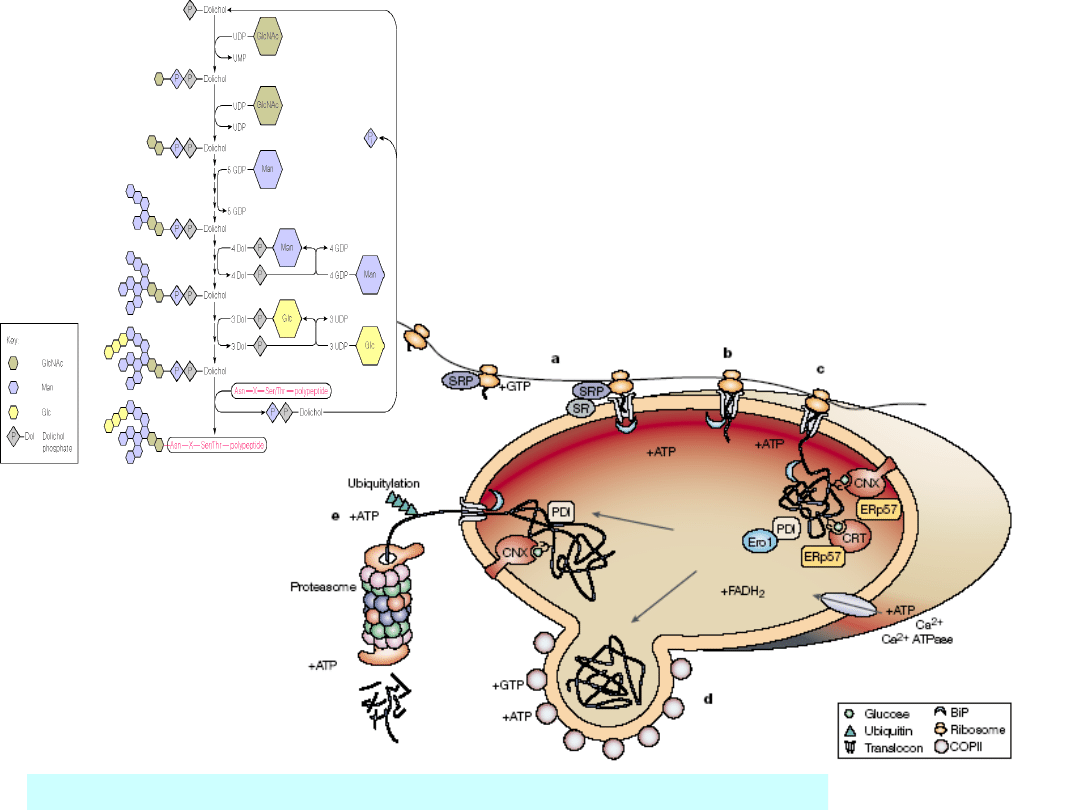
Kontrola jakości w ER
Randal J. Kaufman i wsp. (2002) NATURE REVIEWS| MOLECULAR
CELL BIOLOGY,
3; 411 - 421
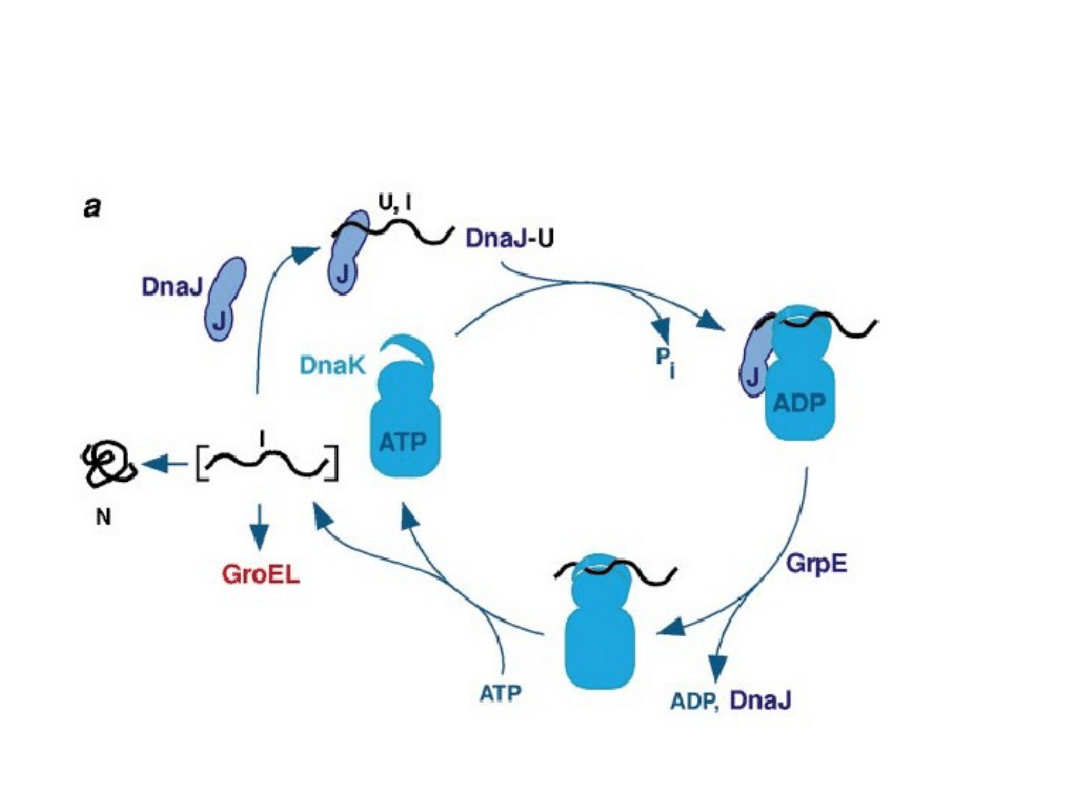
Model działania kompleksu
Hsp40/Hsp70
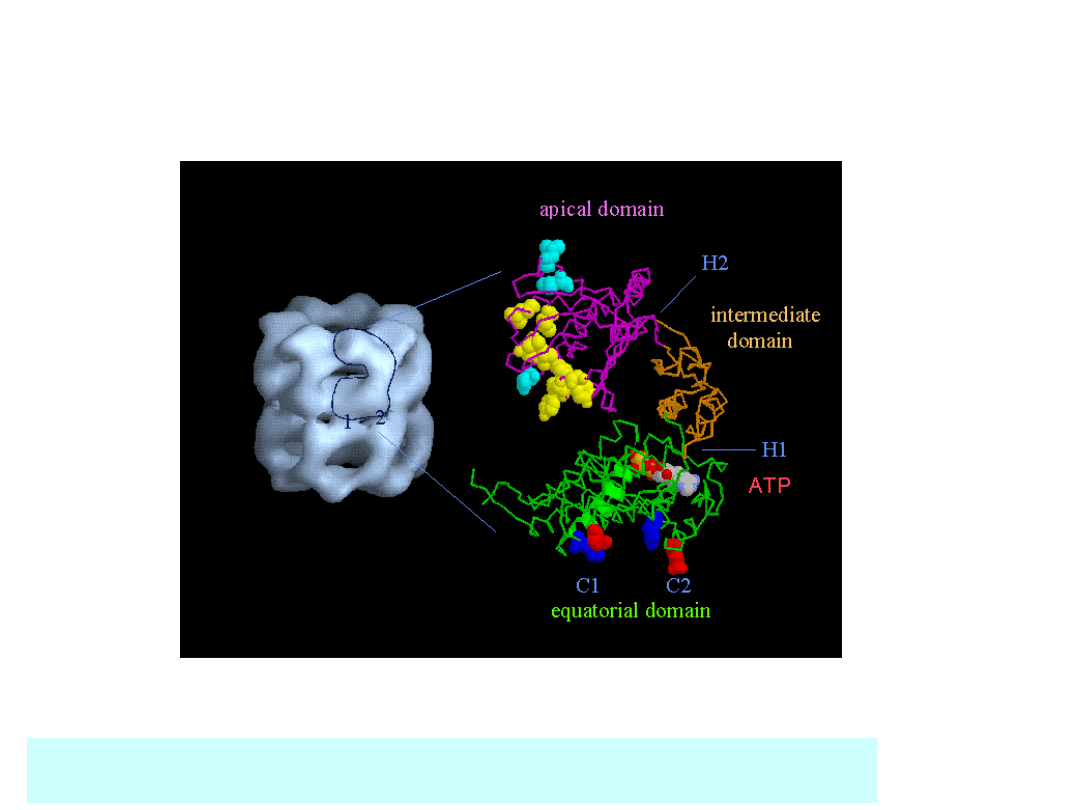
Struktura GroEL (Hsp 60)
Braig et al (1994) Nature 371, 578-586; Braig et al (1995) Nature Structural Biology 2,
1083-1094
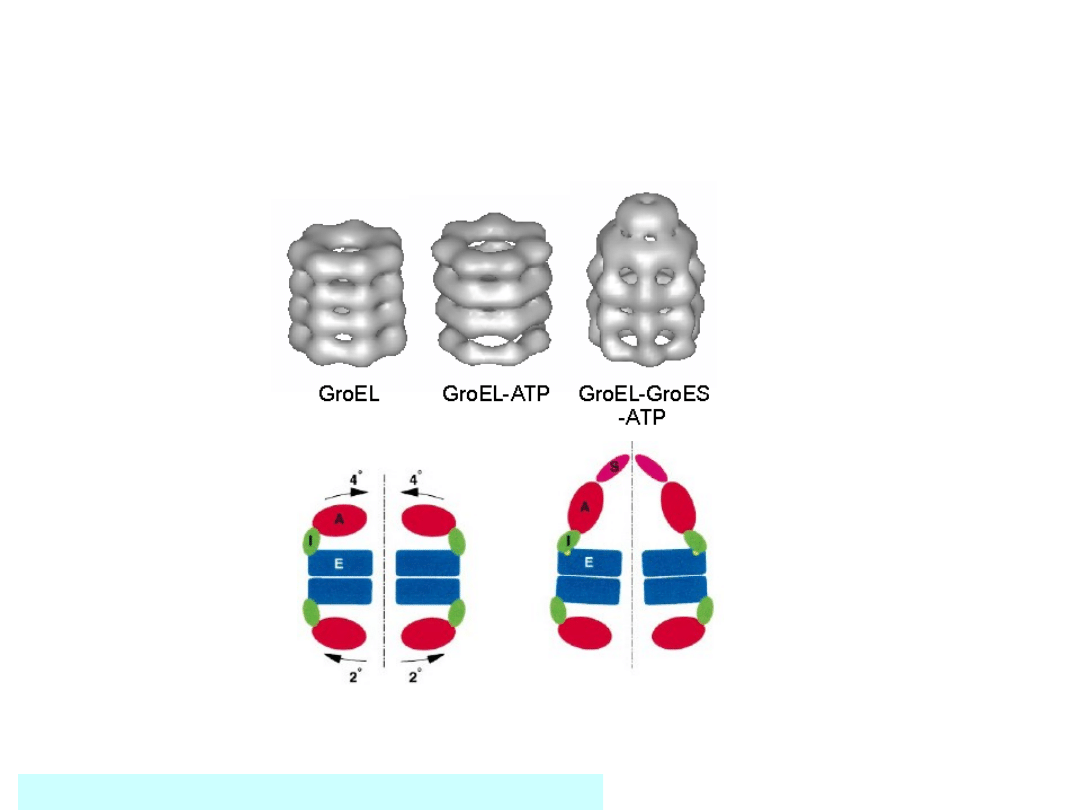
Zmiany w strukturze GroEL (Hsp
60)
Zhaohui Xu, Arthur L. Horwich, Paul B. Sigler (1997) Nature,
388; 741-750
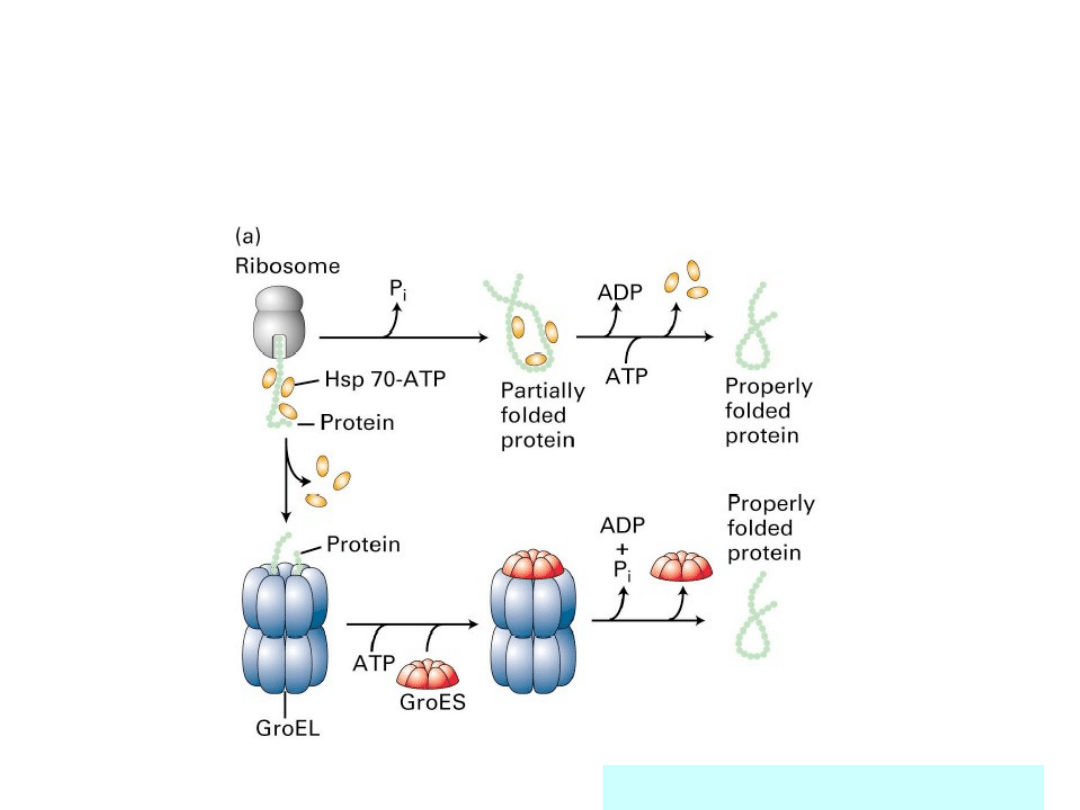
Działanie kompleksu
GroEL-
GroES
Sigler i wsp.(1998) Annual Rev of
Biochemistry 67; 581.
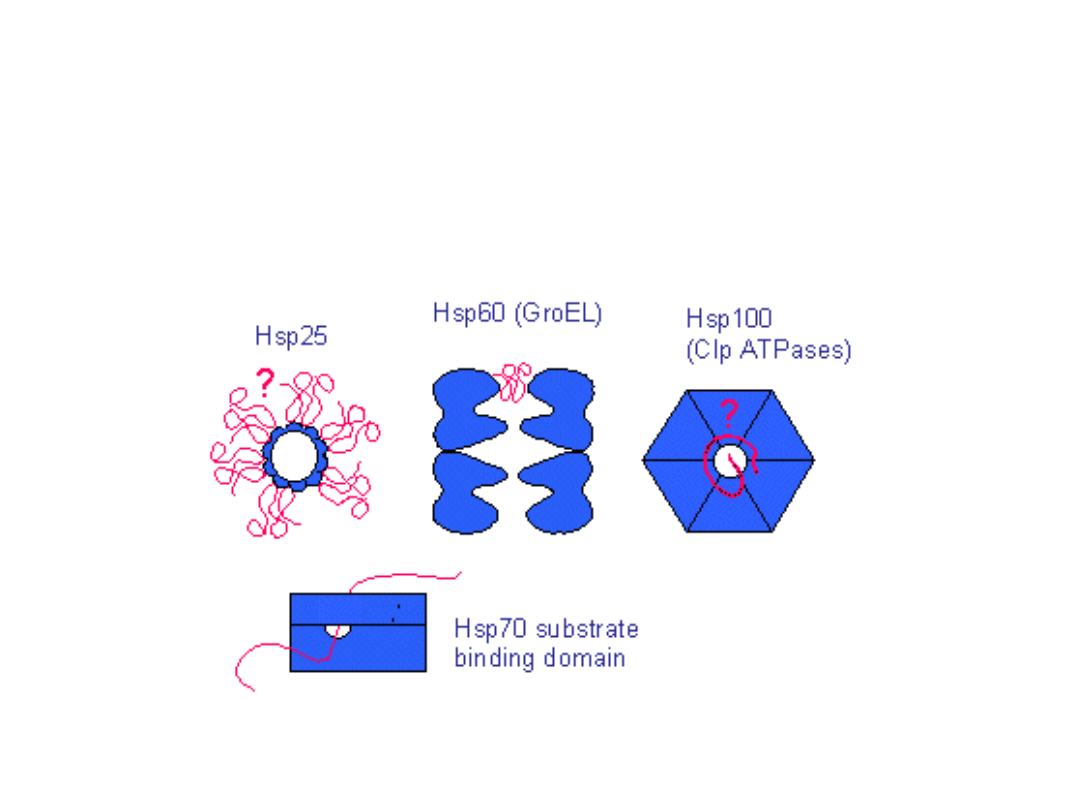
Sposoby oddziaływania
chaperonów z polipeptydami
Document Outline
Wyszukiwarka
Podobne podstrony:
Biochemia białek2
Funkcje białek, Biochemia
19.Budowa białek, Notatki AWF, Biochemia
BIOCHEMIA Metabolizm aminokwasów i białek
Sprawozdanie z białek, biochemia
OZNACZANIE ILOŚCI BIAŁEK W PRÓBKACH ŚRODOWISKOWYCH, Biochemia, BIOCHEMIA Z DC++
biochemia wiaz pept strukt bialek
biochemia wiaz pept strukt bialek
Biochemia(ŻCz)Ćw2 Właściwości fizyko chemiczne białek
Biochemia kliniczna białek osocza(1)
18.Podział białek, Notatki AWF, Biochemia
AMINOKWASY są jednostkami budowy białek, AWF KATOWICE, BIOCHEMIA, ŚCIĄGI
metabolizm aminokwasów i białek, Biologia, Biochemia
Biochemia odwzorowanie bialek metoda badawcza bis(1)
Komputerowe modelowanie białek 2012, medycyna, II rok, biochemia, ćwiczenia
BIOCHEMIA struktura i funkcje bialek
więcej podobnych podstron