
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie, publiczne odtwarzanie i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można
dowolnie modernizować na potrzeby własne oraz do wykorzystania w szkołach podczas zajęć dydaktycznych.
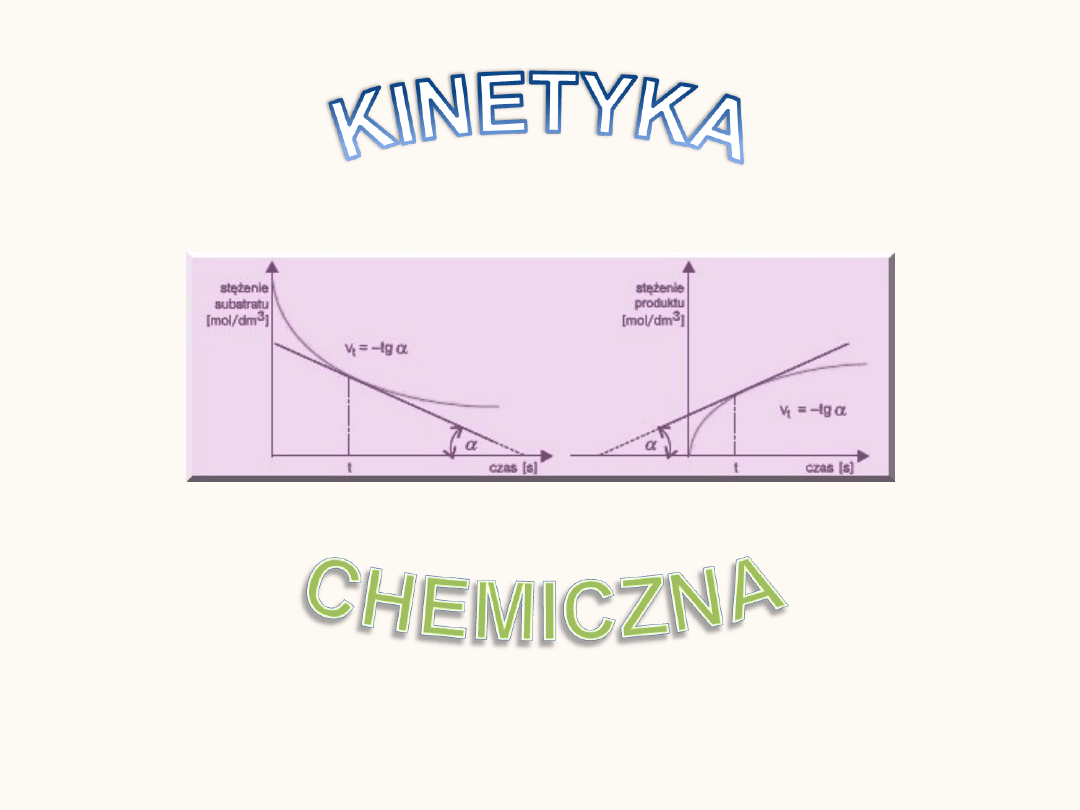







Szybkość reakcji chemicznej
Szybkość reakcji chemicznej
Szybkość reakcji można opisać przez zmianę stężenia substratu lub
produktu w czasie.
Szybkość reakcji = - zamiana stężenia substratu / przedział czasu
Szybkość reakcji = +zmiana stężenia produktu / przedział czasu
Jednostką szybkości reakcji jest mol/dm
3
∙s
Miarą szybkości reakcji chemicznej jest zmiana stężeń reagentów w
jednostce czasu:
gdzie: (+) dla produktów (przyrost stężenia molowego produktu)
(–) dla substratów ( ubytek stężenia molowego substratu) / znak
minus został dodany, aby szybkość miała wartość dodatnią
Δt
Δc
v
Reakcja zachodzi najszybciej na początku, natomiast z czasem, w miarę
wyczerpywania się substratów i zmniejszenia ich stężeń, szybkość
maleje.
Aby zmierzyć jak najdokładniej szybkość reakcji w danej chwili należy
zmianę stężenia substratu określać w jak najmniejszych odstępach czasu.
Gdy reakcja przebiega w kilku etapach o jej szybkości decyduje etap
najwolniejszy.


Od czego zależy szybkość reakcji?
Od czego zależy szybkość reakcji?
Szybkość reakcji jest cechą charakterystyczną dla danego
zespołu reagentów.
Zależy od wielu czynników.
Najważniejsze z nich to:
stężenie reagentów
temperatura
ciśnienie (gdy reakcja przebiega w fazie gazowej)
promieniowanie elektromagnetyczne (gdy reakcja jest
fotochemiczna)
· rozwinięcie powierzchni (w przypadku reakcji
powierzchniowych)
· obecność katalizatora lub inhibitora.
rodzaj rozpuszczalnika
rozdrobnienie reagentów
mieszanie

Zależność szybkości od temperatury
Zależność szybkości od temperatury
Wzrost temperatury zwiększa szybkość reakcji chemicznej.
Szybkość reakcji chemicznej rośnie wraz z temperaturą wykładniczo.
Ze wzrostem temperatury rośnie szybkość poruszających
się cząstek, a co za tym idzie, liczba i gwałtowność zderzeń, co zwiększa
prawdopodobieństwo zajścia reakcji,
Reguła van 't
Hoffa
Jest to empiryczna reguła wyrażająca zmianę szybkości reakcji w
zależności od temperatury.
Według tej reguły wzrost temperatury o 10 K powoduje 2-4-krotny wzrost
szybkości reakcji.
Reguła van 't Hoffa jest spełniona dla reakcji homogenicznych, w
temperaturze do 500°C.
współczynnik temperaturowy reakcji γ – liczba wyrażająca
zwiększenie stałej szybkości reakcji przy ogrzaniu o ok. 10K
10
T
T
k
gdzie
γ
v
v
1
2
k
1
2

Przykład
Szybkość pewnej reakcji wzrasta trzykrotnie po ogrzaniu o 10 stopni.
Ile razy zmieni się szybkość tej reakcji w temperaturze wyższej o 30
stopni?
Korzystamy z reguły van’t hoffa
10
T
T
k
gdzie
γ
v
v
1
2
k
1
2
T2 –T1 = 30K
γ = 3
27
3
1
2
3
1
2
v
v
v
v
Szybkość reakcji wzrośnie 27 razy.

Kataliza homogeniczna -
szeroko rozpowszechniony przypadek to
kataliza kwasowo-zasadowa, która polega na zmianie reaktywności
poprzez przyłączenie lub oderwanie protonu od cząsteczki.
Kataliza heterogeniczna
Przykład katalizatora stałego dla reakcji N
2
+ 3H
2
= 2NH
3
Energia aktywacji reakcji bez katalizatora 335 kJ/mol
z katalizatorem osmowym 195 kJ/mol
z katalizatorem wolframowym 165 kJ/mol
Kataliza mikroheterogeniczna
Dotyczy układów w których katalizator występuje w stanie rozdrobnienia
koloidalnego.
Typowymi takimi katalizatorami są enzymy, które charakteryzują się
ogromną aktywnością katalityczną w niskich temperaturach oraz
wrażliwością na działanie elektrolitów i pH środowiska.
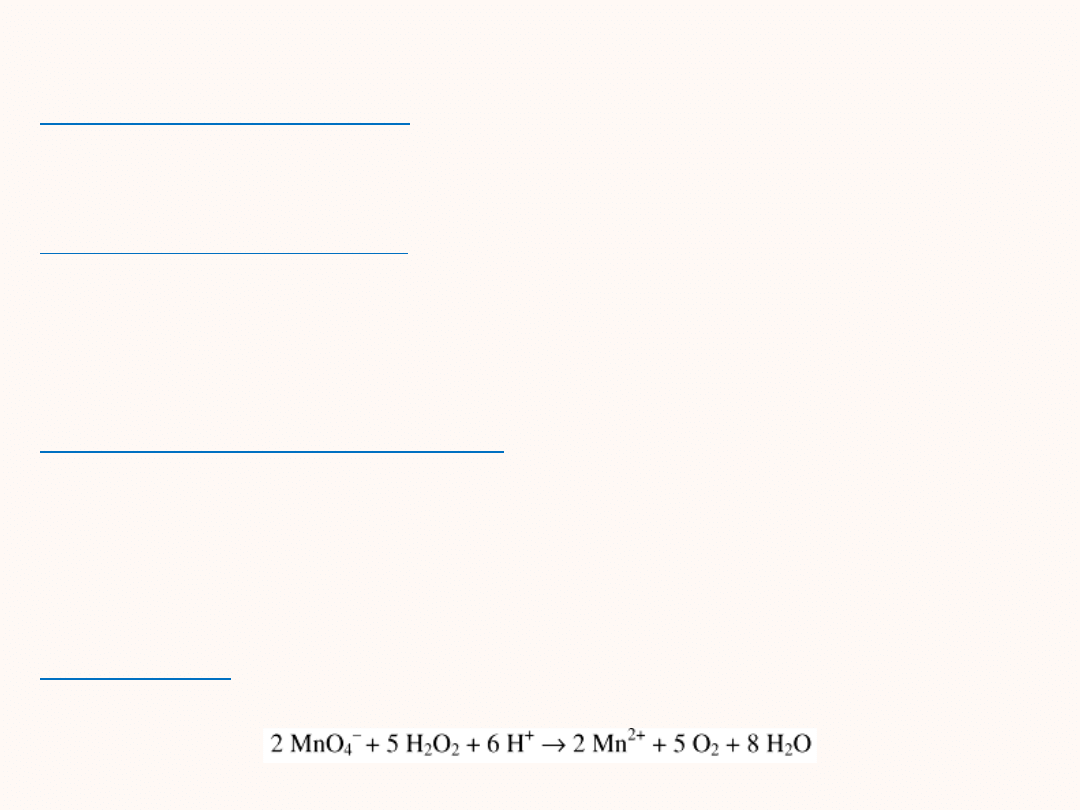
Autokataliza
- produkt reakcji jest katalizatorem np. reakcja KMnO
4
z wodą utlenioną w środowisku kwaśnym. Powstające jony Mn
2+
działają katalitycznie.

Równanie kinetyczne jest to doświadczalnie (empirycznie)
wyznaczona
zależność szybkości reakcji od stężeń reagentów uczestniczących w
reakcji,
Zależność ta nie zawsze jest zgodna z zależnością stechiometryczną
zbilansowanego równania chemicznego – może być bardziej
skomplikowana ze względu na mechanizm, według którego zachodzi.
Stałe szybkości reakcji (k) są współczynnikami proporcjonalności w
równaniu
kinetycznym, łączącymi szybkość reakcji ze stężeniami reagentów. Stałe
te są zależne od temperatury i mają jednostkę zależną od postaci
równania kinetycznego.
Stała szybkości jest charakterystyczna dla danej reakcji i nie zależy od
stężenia reagentów.
Zakładając, że reakcja przebiega bez etapów pośrednich, można w
niektórych przypadkach przyjąć, że szybkość reakcji zależy wyłącznie od
stężenia substratów i tylko w tych warunkach można napisać równanie
kinetyczne wprost w oparciu o równanie reakcji:
β
α
[B]
[A]
k
v
produkty
B
A
k – stała szybkości
[A]; [B] chwilowe molowe stężenia
substratów
α, β – współczynniki zwane rzędami
reakcji względem odpowiednich
substratów
Równanie kinetyczne
Równanie kinetyczne


Rzędowość reakcji
Rzędowość reakcji
W rzeczywistości zdarza się, że wyznaczone doświadczalnie
współczynniki potęgowe nie wynoszą a, b i c lecz przyjmują inne
wartości, które określamy: α, β, γ -
rzędy reakcji w stosunku do
reagentów
A, B i C.
produkty
cC
bB
aA
Cząsteczkowość reakcji wynosi
a+b+c
Równanie kinetyczne:
Rząd ogólny reakcji określamy jako sumę rzędów reakcji
w stosunku do reagentów A, B i C.
n = α + β + γ ogólny rząd reakcji
γ
β
α
[C]
[B]
[A]
k
v
Pamiętaj!
Z racji doświadczalnego wyznaczania zarówno stałej szybkości reakcji, jak i
rzędów reakcji względem określonych substratów, równanie kinetyczne jest
równaniem empirycznym.

n może być: 0, 1, 2
↑ ↑ ↑
reakcja rzędu: „0" "1" "2"
Rząd reakcji może też być ułamkowy lub nawet ujemny
Jeżeli substancja występuje w zbilansowanym równaniu reakcji, lecz
nie
pojawia się w równaniu kinetycznym, to
reakcja jest zerowego rzędu
względem
tej substancji.
Człony stężeniowe do zerowej potęgi nie są uwzględniane w równaniu
kinetycznym ze względu na fakt, że dowolna liczba (tu wartość
stężenia) podniesiona do potęgi zerowej daje wynik równy 1.
Jeżeli wykładnik potęgi lub suma wykładników wynosi 1, reakcja
jest
pierwszego rzędu względem danego reagenta lub jej całkowity
rząd wynosi
jeden.
Jeżeli wykładnik lub suma wykładników wynosi 2, reakcja jest
drugiego rzędu
lub jej rząd całkowity jest równy dwa.
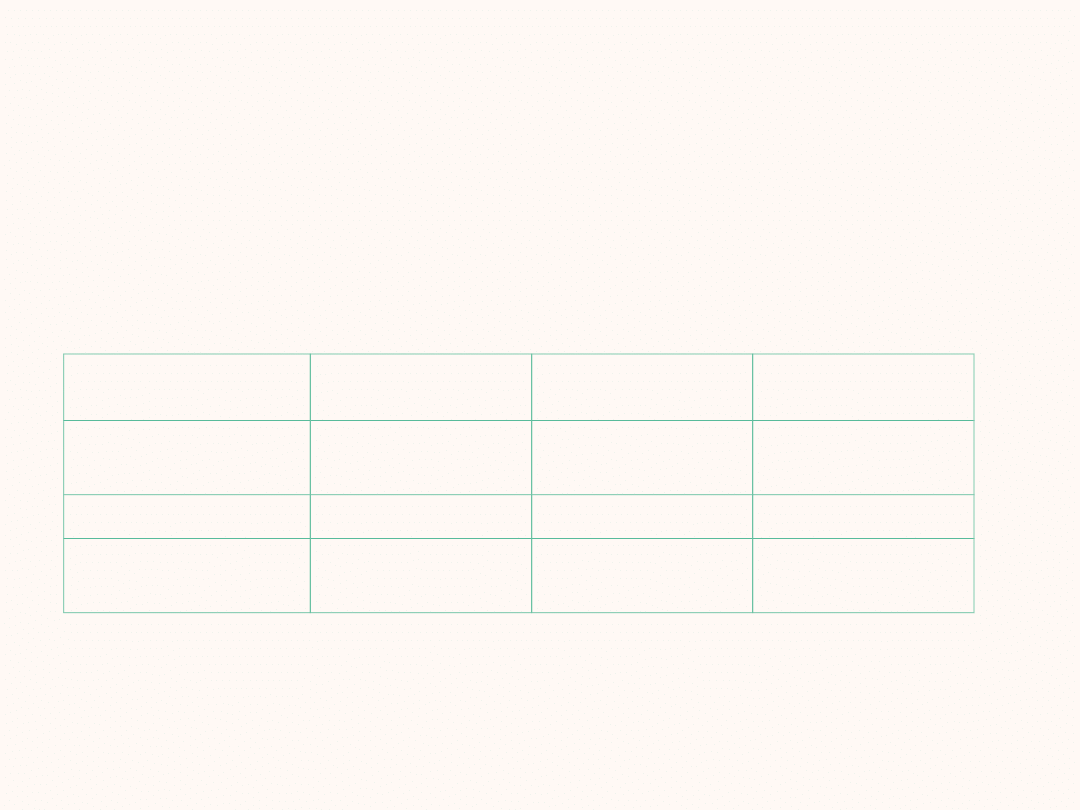
równanie
stechiometryczne
równanie
kinetyczne
rząd reakcji
jednostka stałej
szybkości
N
2
O
5
--> 2 NO
2
+
½ O
2
v = k [N
2
O
5
]
I
1/s
H
2
+ I
2
--> 2 HI
v = k [H
2
]·[I
2
]
II
dm
3
/(mol · s)
2 NO + O
2
→ 2
NO
2
v = k [NO]
2
[O
2
]
III
(dm
3
)
2
/(mol
2
· s)
Przykłady
Oba równania kinetyczne:
v
1
= k
1
[A]
2
oraz v
2
= k
2
[A][B]
wskazują na sumaryczny rząd reakcji 2,
lecz z pierwszego równania wynika drugi rząd reakcji względem A,
a z drugiego – pierwszy względem A i B.


Szybkość reakcji I rzędu
zależy od stężenia jednego substratu w potędze pierwszej
v = k∙[A]
Jeśli chcemy wiedzieć jak zmieni się stężenie substratu w czasie
reakcji korzystamy z zależności:
t
k
C
C
ln
0
Szybkość reakcji II rzędu
-
dla reakcji 2A → produkty zależy od stężenia substratu w drugiej
potędze
v = k∙ [A]
2
-dla reakcji typu A + B → produkty od stężenia dwóch substratów w
potędze pierwszej:
v = k∙ [A] ∙ [B]
Jeśli chcemy wiedzieć jak zmieni się stężenie substratu w czasie
reakcji korzystamy z zależności:
t
k
C
1
C
1
0
t= czas
k = stała
C
0
= stężenie
początkowe

BIBLIOGRAFIA
„Chemia ogólna i nieorganiczna 1” M. Litwin
„ Chemia od A do Z” M. Klimaszewska”
„ Chemia 3” S.Hejwowska
„ Kinetyka i termodynamika chemiczna” K. Pazdro
Chemia Ogólna, kurs WPC 1002w - Władysław Walkowiak
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
Kinetyka Chemiczna
kinetyka chemiczna
4) Kinetyka chemiczna
10 Kinetyka chemicznaid 10897 ppt
Kinetyka chemiczna, CHEMIA, semestr 1, chemia ogólna, wykłady
10 wykad Statyka kinetyka chemiczna[F 2006]
chemia, kinetyka chemiczna, KINETYKA CHEMICZNA- 1
Kinetyka chemiczna
kinetyka chemiczna id 235068 Nieznany
10 Kinetyka chemiczna i kataliza
KINETYKA CHEMICZNA, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
ELEMENTY KINETYKI CHEMICZNEJ, NAUKA, WIEDZA
3 1 Elementy kinetyka chemicznej reakcji prostych
Sprawozdanie - Kinetyka chemiczna. Wyznaczenie stałej szybkości, Studia, Chemia
3.kinetyka chemiczna, Politechnika Rzeszowska Budownictwo, IBD, Chemia
Kinetyka chemiczna, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
więcej podobnych podstron