
Szybkość reakcji chemicznych
Układ w stanie równowagi – informacje
uzyskujemy na drodze
termodynamicznej
Odpowiedź na pytanie czy dana reakcja
zachodzi samorzutnie oraz w jakim
kierunku
Ile energii zostaje zużyte lub ile
powstaje
Inne bardzo ważne zagadnienie
dotyczące wszechświata – to szybkość z
jaką zachodzą różne procesy

W jakim stopniu reakcja w danym
kierunku zajdzie
Dlaczego reakcja zachodzi
Jak szybko reakcja
zachodzi?

Jeżeli wszystkie reakcje samorzutne
zachodziłyby natychmiast – z olbrzymią
prędkością – wszechświat byłby w
stanie równowagi wiele lat temu.
Wiele reakcji zachodzi wolno, inne
bardzo szybko – wpływając na nasze
codzienne decyzje.

Np. architekci muszą zadecydować o
jakości stosowanych materiałów w
konstrukcji budynków uwzględniając
ich zdolność do reakcji z tlenem i
wodą(wilgocią) –mając na względzie
szybkość zachodzących procesów.

Jeżeli przedmiot wykonany z metalu
znajdzie się w środowisku korozyjnym to
tym metalem powinna być
wysokogatunkowa stal ponieważ jej
utlenianie zachodzi znacznie wolniej w
porównaniu do zwykłej.

Szybkość reakcji
Czyszczenie blatów w kuchni za pomocą
środków chemicznych (podchlorynów
ClO
-
)
Plamy kolorowe znikają
Środek bardziej stężony czyści szybciej
(stężenie)
Reakcja jest przykładem reakcji
wieloetapowej

Szybkość reakcji
ClO
-
+ brud Produkt (P)
Stężenie P wzrasta
Szybkość = [produkt]/dt
Wartość liczbową uzyskamy z równania
szybkości reakcji

Nauka o szybkości
reakcji chemicznej i
czynnikach
kontrolujących
szybkość.

Czynniki kontrolujące szybkość można
zaliczyć do czterech kategorii:
Charakter chemiczny substratów i
produktów (F1)
Stężenia reagentów(F2)
Temperatura (F3)
Wpływ substancji dodatkowych (F4)
zwanych katalizatorami lub inhibitorami

F1 – jak cząsteczki lub jony są
zbudowane
F2 – wzrost prawdopodobieństwa
zderzenia ( wzrost stężenia)
F3 – w większości wzrost
F4 – prawie wszystkie reakcje
biochemiczne są katalizowane
(katalizatory nie ulegają zmianom
chemicznych w reakcji – tzn. stan
chemiczny przed i po reakcji nie
ulega zmianie)

Dobór warunków prowadzący do
powstania produktów w maksymalnie
krótkim czasie
Lub w niektórych przypadkach do
uzyskania maksymalnego spowolnienia
reakcji
Np.. Wzrost grzybów i innych
mikroorganizmów powodujących
fermentację żywności

Największe korzyści uzyskujemy
poprzez uzyskanie dokładnych
informacji związanych z przebiegiem
reakcji.
Większość reakcji chemicznych składa
się z wielu etapów następujących
sekwencyjnie.
Ta sekwencja wydarzeń nosi nazwę
mechanizmu reakcji.

Badając szybkość reakcji
możemy wnioskować o jej
mechanizmie. W ten sposób
uzyskujemy odpowiedź na
pytanie dlaczego substancje
reagują w ten sposób.

Pozostałości po
elewatorze zbożowym
w Nowym Orleanie.
1977 rok – eksplozja
pociągnęła za sobą
śmierć 35 osób.
Zapalenie się pyłu
zbożowego –
wybuchowe spalanie
Grube polana
Rozpalenie
ogniska
Mała
powierzchnia
Małe kawałki –
szczapy
Rozpalenie
ogniska
Duża powierzchnia
ułatwia
rozpoczęcie
rozpalania się
ognia
Szybkość reakcji chemicznej =
zmiana stężenia/czas
Mol/litr//s
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
REAKCJE
REAKCJE
HOMOGENICZNE
HOMOGENICZNE
JEDNORODNE
JEDNORODNE
HETEROGENICZNE
HETEROGENICZNE
NIEJEDNORODNE
NIEJEDNORODNE
SZYBKOŚĆ REAKCJI
SZYBKOŚĆ REAKCJI
homogenicznej zachodzącej
homogenicznej zachodzącej
w stałej objętości
w stałej objętości
:
:
dt
dc
1
v
i
i
v
-
s
z
y
b
k
o
ś
ć
r
e
a
k
c
j
i
[
m
o
l
L
-
1
s
-
1
]
,
[
m
o
l
L
-
1
m
i
n
-
1
]
,
[
m
o
l
L
-
1
h
-
1
]
,
i
c
-
c
h
w
i
l
o
w
e
s
t
ę
ż
e
n
i
e
i
-
t
e
g
o
r
e
a
g
e
n
t
a
[
m
o
l
L
-
1
]
,
i
-
w
s
p
ó
ł
c
z
y
n
n
i
k
s
t
e
c
h
i
o
m
e
t
r
y
c
z
n
y
i
-
t
e
g
o
r
e
a
g
e
n
t
a
,
„
+
”
-
p
r
o
d
u
k
t
,
„
-
„
-
s
u
b
s
t
r
a
t
t
-
c
z
a
s
[
s
-
1
]
,
[
m
i
n
-
1
]
,
[
h
-
1
]
,
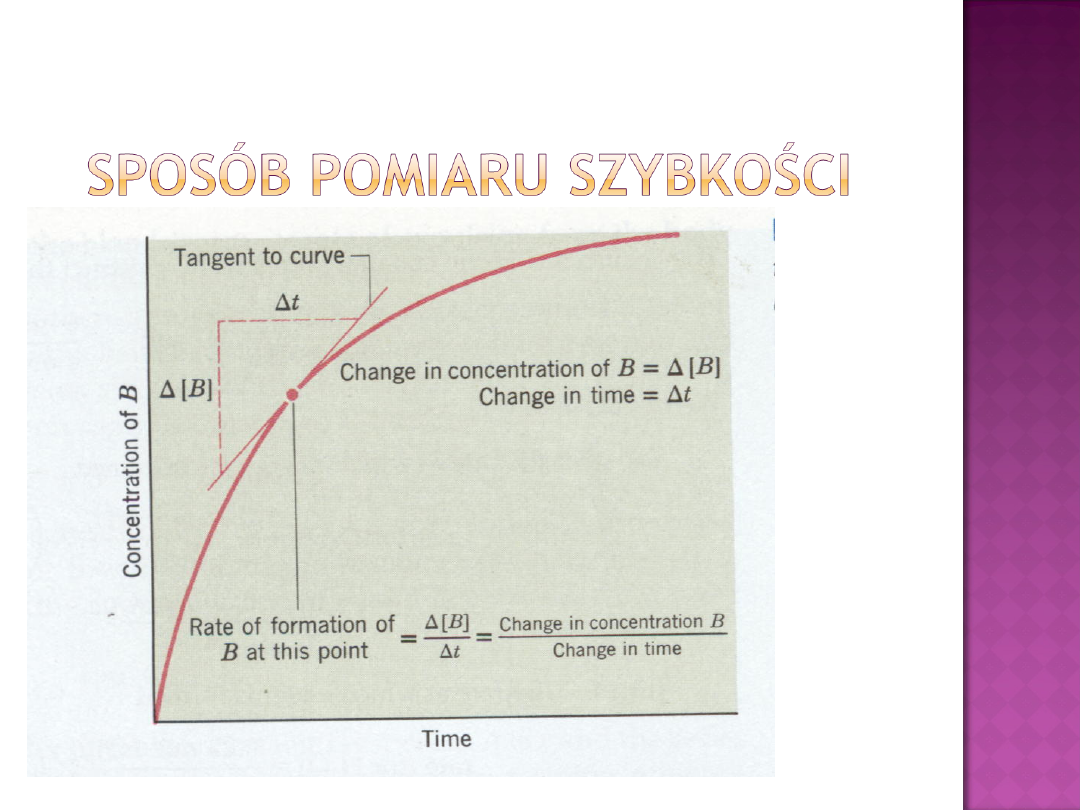
Szybkość –
nachylenie
stycznej w
punkcie
Szybkość =
D[B]/Dt
Szybkość =
-D[B]/Dt
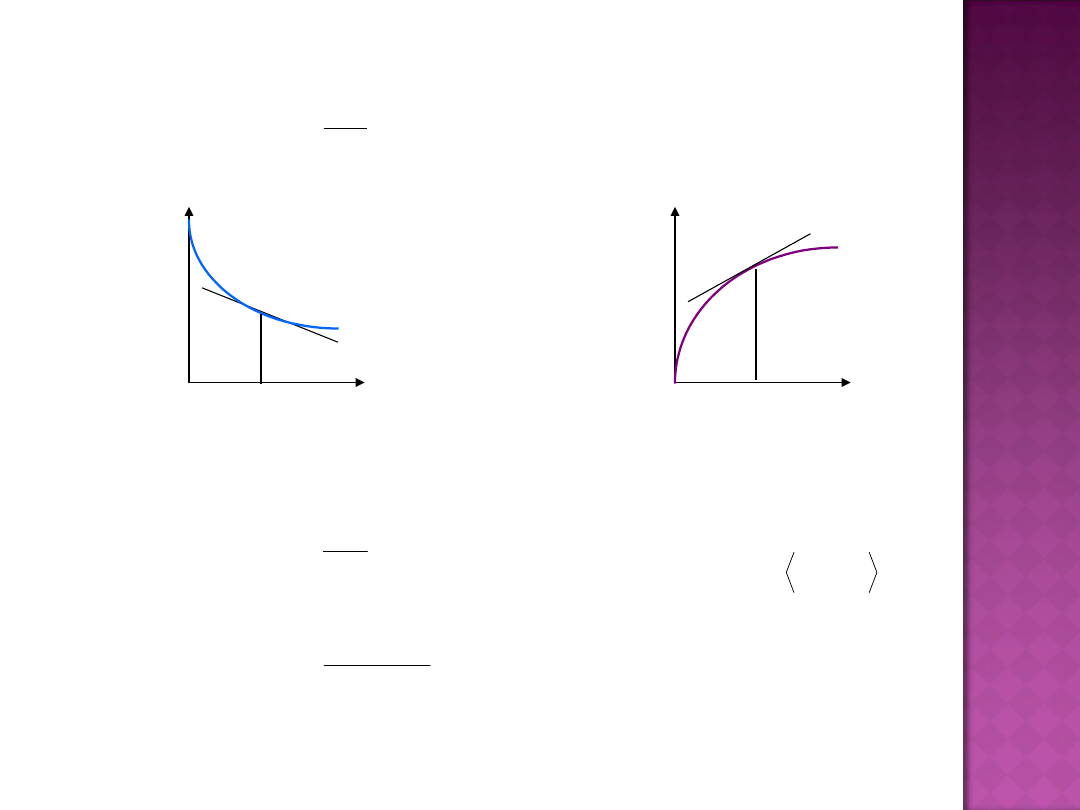
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
dt
dc
v
chwilowa szybkość
reakcji
stężenie
substrat
u
[mol L
-1
]
czas [h]
tg
v
t
stężenie
produktu
[mol L
-1
]
czas [h]
tg
v
t
t
c
v
średnia
szybkość
reakcji w przedziale
czasu
2
1
t
,
t
1
2
1
2
t
t
c
c
v

Nie wszystkie reakcje zachodzą z tą
samą szybkością.
Reakcje jonowe są uzależnione od
szybkości mieszania, natomiast
przemiana materii jest znacznie
wolniejszą reakcja.
Najważniejszym czynnikiem
kontrolującym szybkość jest stężenie.
Dla reakcji A B szybkość można
zapisać jako:
Szybkość ~[A]
x
Wykładnik x nosi nazwę rzędu reakcji
X = 0 do x = 3 lub x jest ułamkiem
X = 0 rozkład amoniaku na
powierzchni platynowej (nie zależy
od stężenia)
Inny przykład: wydalanie alkoholu ze
krwi niezależne od jego stężenia.
Wykładnik X można wyznaczyć tylko
doświadczalnie
Rozpatrzmy bardziej złożoną reakcję:
A + B produkty
Szybkość ~ [A]
x
[B]
y
Całkowity rząd reakcji to x+y

Wyrażenie na szybkość może być
zamienione na równość przez
wprowadzenie stałej.
Szybkość = k [A]
x
[B]
y
k – stała szybkości reakcji
Znając stałą można obliczyć szybkość
dla dowolnego stężenia.

Wyznaczanie rzędowości i
stałej szybkości
JON JODKOWY 0,1; 0,1; 0,2
JON NADSIARCZANOWY 0,05; 0,025,
0,05
SZYBKOŚĆ POCZĄTKOWA: 1,5 x 10^(-4);
7,5 x 10^(-5); 3,0 x 10^(-4)

Wykonujemy serię doświadczeń
A B
Szybkość = k [A]
X
Dla pierwszego rzędu x = 1, zatem
Szybkość = k [A]
Oznacza to proporcjonalność szybkości
do stężenia

Jeżeli podwoimy stężenie, to szybkość
wzrośnie dwukrotnie
Jeżeli szybkość opisuje równanie:
Szybkość = k [A]
2
Zatem dwukrotne zwiększenie stężenia
spowoduje czterokrotny wzrost
szybkości.
Jeżeli stężenie reagenta zmieni się p-
krotnie, to szybkość zmieni się z-krotnie
z = p
x
, gdzie z równa się krotności
zmiany stężenia podniesionego do
potęgi równej rzędowości względem
tego reagenta.

Prawo działania mas mówi o relacji
pomiędzy szybkością a stężeniem
reagentów. Szybkość chwilowa o której
wspominaliśmy, można zapisać jako
różniczkę:
dc/dt(-+)= k [A]

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
dt
dc
v
i
Jeżeli
Jeżeli
i
i
= 1:
= 1:
]
i
[
c
i
Przykład:
Przykład:
2 N
2 N
2
2
O
O
5
5
4 NO
4 NO
2
2
+ O
+ O
2
2
dt
]
O
[
d
dt
]
NO
[
d
4
1
dt
]
O
N
[
d
2
1
v
2
2
5
2
SZYBKOŚĆ REAKCJI
SZYBKOŚĆ REAKCJI
• rodzaj reakcji
•
stężenie
reagentów
• temperatura
• katalizatory

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
SZYBKOŚĆ REAKCJI
SZYBKOŚĆ REAKCJI
homogenicznej jeżeli objętość
homogenicznej jeżeli objętość
reagującego układu nie pozostaje stała:
reagującego układu nie pozostaje stała:
dt
dV
V
c
dt
dc
1
dt
)
V
c
(
d
V
1
v
i
i
i
i
i
SZYBKOŚĆ
KATALITYCZNYCH
REAKCJI
SZYBKOŚĆ
KATALITYCZNYCH
REAKCJI
HETEROGENICZNYCH
HETEROGENICZNYCH
- liczbę moli substancji reagującej w czasie dt odnosi się (zwykle)
- liczbę moli substancji reagującej w czasie dt odnosi się (zwykle)
do
do
jednostki powierzchni, na której przebiega reakcja.
jednostki powierzchni, na której przebiega reakcja.
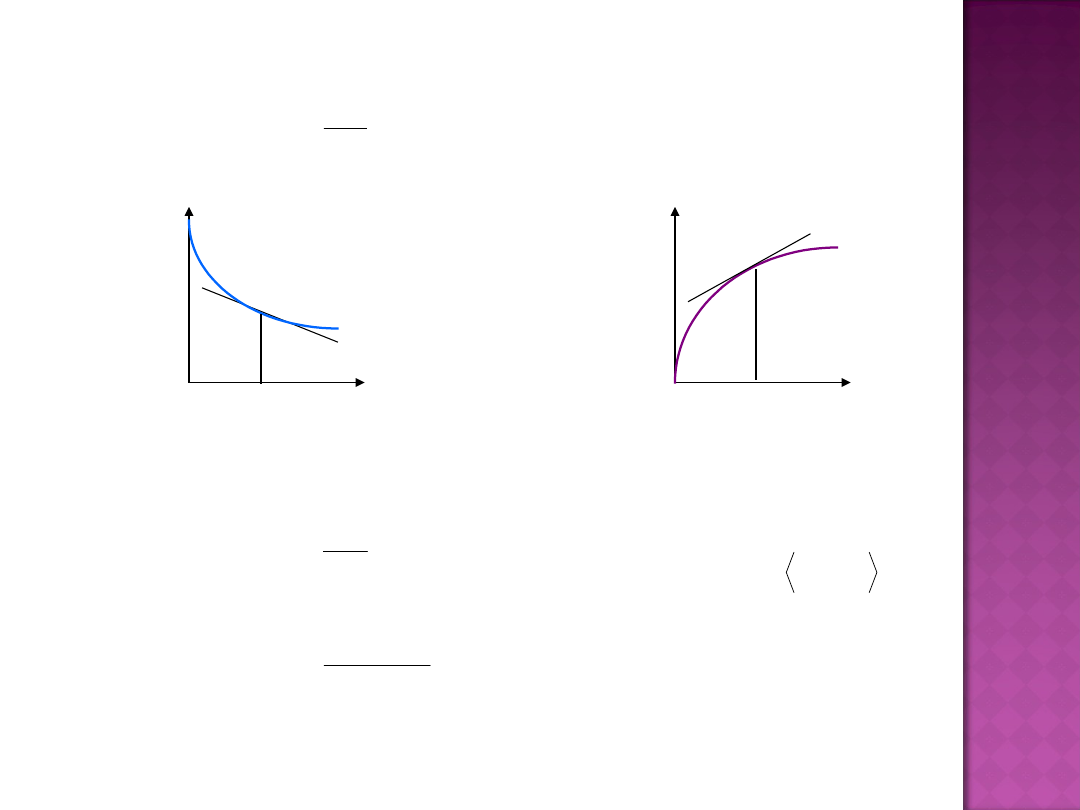
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
dt
dc
v
chwilowa szybkość
reakcji
stężenie
substrat
u
[mol L
-1
]
czas [h]
tg
v
t
stężenie
produktu
[mol L
-1
]
czas [h]
tg
v
t
t
c
v
średnia
szybkość
reakcji w przedziale
czasu
2
1
t
,
t
1
2
1
2
t
t
c
c
v

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
i
c
f
v
a A + b B
a A + b B
c C + d D
c C + d D
RÓWNANIE KINETYCZNE
RÓWNANIE KINETYCZNE
(postać ogólna):
(postać ogólna):
...
c
c
c
k
v
C
B
A
k – STAŁA SZYBKOŚCI REAKCJI –
k – STAŁA SZYBKOŚCI REAKCJI –
współczynnik proporcjonalności
współczynnik proporcjonalności
między szybkością reakcji a iloczynem stężeń reagentów (stężeniem
między szybkością reakcji a iloczynem stężeń reagentów (stężeniem
reagenta) w równaniu kinetycznym.
reagenta) w równaniu kinetycznym.
k = v
k = v
gdy c
gdy c
A
A
, c
, c
B
B
, ... = 1 mol L
, ... = 1 mol L
-1
-1
Wartość k zależy od temperatury.
Wartość k zależy od temperatury.
...
n
n – RZĄD REAKCJI –
n – RZĄD REAKCJI –
suma wykładników potęgowych w równaniu
suma wykładników potęgowych w równaniu
kinetycznym
kinetycznym
3
,
0
n

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
Przykłady:
Przykłady:
(1) 2 N
(1) 2 N
2
2
O
O
5
5
4 NO
4 NO
2
2
+ O
+ O
2
2
(w fazie gazowej lub w
(w fazie gazowej lub w
roztworze)
roztworze)
5
2
5
2
O
N
k
dt
O
N
d
2
1
v
n =
n =
1
1
(2) (C
(2) (C
2
2
H
H
5
5
)
)
3
3
N + C
N + C
2
2
H
H
5
5
I
I
(C
(C
2
2
H
H
5
5
)
)
4
4
NI
NI
(w roztworze)
(w roztworze)
I
H
C
N
H
C
k
dt
I
H
C
d
v
5
2
3
5
2
5
2
n =
n =
2
2
(3) CO + Cl
(3) CO + Cl
2
2
COCl
COCl
2
2
2
3
2
2
Cl
CO
k
dt
COCl
d
v
n =
n =
5
5
/
/
2
2

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
CZĄSTECZKOWOŚĆ (MOLEKULARNOŚĆ) REAKCJI
CZĄSTECZKOWOŚĆ (MOLEKULARNOŚĆ) REAKCJI
liczba cząsteczek (albo atomów, rodników, jonów) biorących udział w reakcji
elementarnej
REAKCJE
:
• jednocząsteczkowe (monomolekularne)
reakcje izomeryzacji, np. CH
2
H
2
C CH
2
reakcje rozkładu termicznego, np.
C
2
H
5
Br C
2
H
4
+ HBr
• dwucząsteczkowe (bimolekularne)
np.
CH
3
COOC
2
H
5
+ NaOH CH
3
COONa +
C
2
H
5
OH
• trójcząsteczkowe (trimolekularne)
procesy rekombinacji dwu atomów lub małych
rodników, np.
H + H + M H
2
+
M
CH
3
CH= CH
2

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
cząsteczkowość = rząd
reakcji
H
2
+ I
2
= 2HI
reakcja dwucząsteczkowa
n = 2
2
2
I
H
k
dt
HI
d
cząsteczkowość rząd
reakcji
CH
3
COCH
3
+ I
2
= CH
3
COCH
2
I +
HI
reakcja dwucząsteczkowa
n = 1
3
3
3
3
COCH
CH
k
dt
COCH
CH
d
REAKCJE
:
• pseudojednocząsteczkowe –
jedna z reagujących substancji
występuje
w tak dużym nadmiarze, że jej stężenie praktycznie nie ulega zmianie w
czasie reakcji
np. hydroliza octanu etylu w środowisku kwaśnym
CH
3
COOC
2
H
5
+ H
2
O CH
3
COOH + C
2
H
5
OH
H

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
RZĄD REAKCJI
–
–
wielkość empiryczna wyznaczana
na podstawie doświadczalnego równania kinetycznego.
CZĄSTECZKOWOŚĆ REAKCJI
–
–
odnosi się do reakcji
elementarnych postulowanych jako poszczególne etapy
mechanizmu reakcji.
PARAMETRY KINETYCZNE
PARAMETRY KINETYCZNE
STAŁA SZYBKOŚCI REAKCJI -
STAŁA SZYBKOŚCI REAKCJI -
k
k
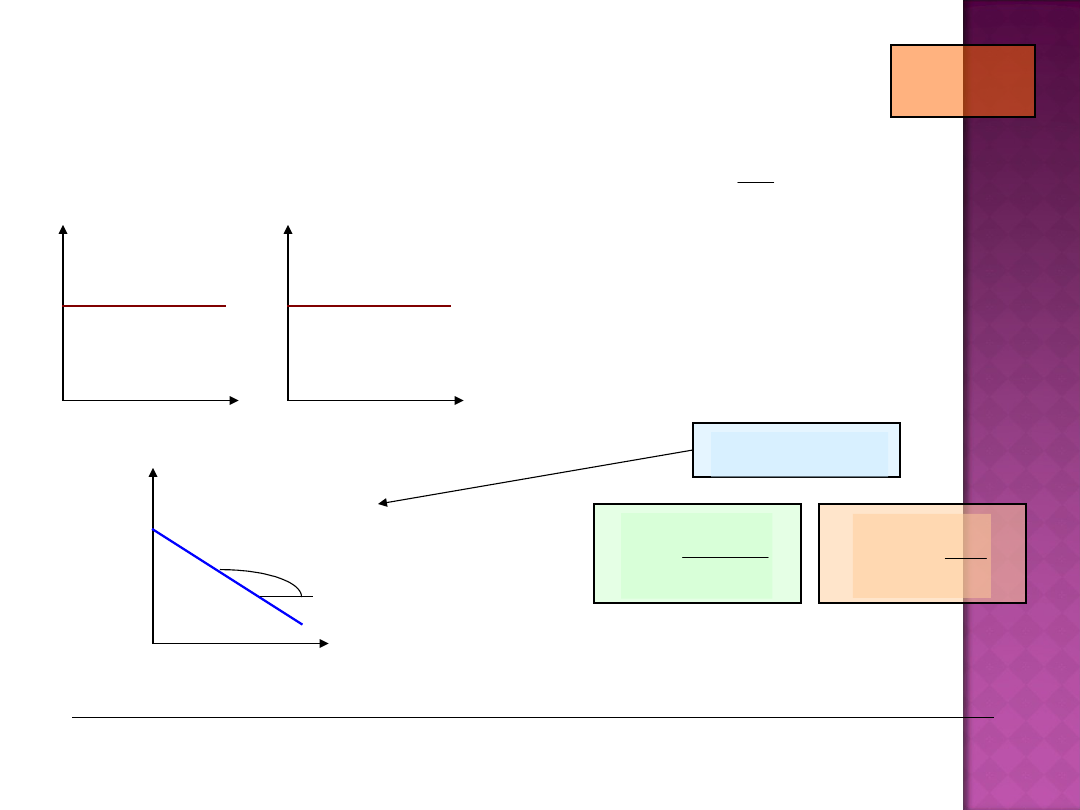
OKRES PÓŁTRWANIA (OKRES POŁOWICZNEJ PRZEMIANY) –
OKRES PÓŁTRWANIA (OKRES POŁOWICZNEJ PRZEMIANY) –
t
t
0.5
0.5
t
t
1/2
1/2
- czas po upływie którego przereagowuje połowa początkowej
ilości
substratu.
c
2
1
c
t
czasie
po
,
0.5
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
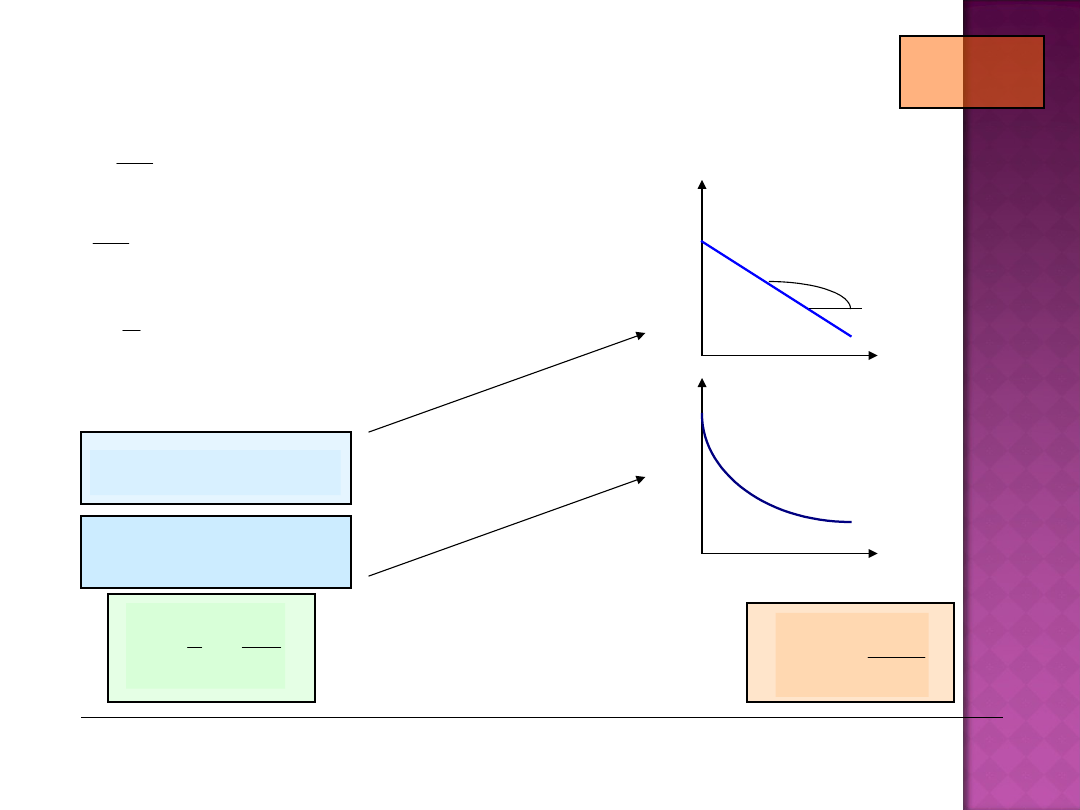
KINETYKA REAKCJI RZĘDU ZEROWEGO
KINETYKA REAKCJI RZĘDU ZEROWEGO
k
c
k
v
0
v
c
v
t
c
o
-
początkowe stężenie substratu , [molL
-1
], [mg L
-1
], [mg mL
-1
],
c
-
stężenie substratu po czasie t, [molL
-1
], [mg L
-1
], [mg mL
-1
],
t
k
c
-
c
dt
k
dc
dt
k
dc
k
dt
dc
c
c
t
0
t
t
k
c
c
c
c
o
t
k
-
a
tg
2k
c
t
5
.
0
n = 0
t
c
-
c
k
]
s
L
ol
m
[
],
min
L
ol
m
[
],
h
L
mol
[
k
1
-
1
-
1
-
1
-
1
-
1
-
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
KINETYKA REAKCJI RZĘDU PIERWSZEGO
KINETYKA REAKCJI RZĘDU PIERWSZEGO
c
k
v
k
2
ln
t
5
.
0
n = 1
t
k
e
c
c
ln
c
ln c
o
t
k
-
a
tg
t
c
c
o
c
c
ln
t
1
k
]
s
[
,
]
[min
],
h
[
k
1
1
-
1
-
t
k
c
ln
-
c
ln
dt
k
dc
c
1
dt
k
c
dc
c
k
dt
dc
c
c
t
0
t
t
k
c
ln
c
ln
c
o
-
początkowe stężenie substratu , [molL
-1
], [mg L
-1
], [mg mL
-1
],
c
-
stężenie substratu po czasie t, [molL
-1
], [mg L
-1
], [mg mL
-1
],
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
KINETYKA REAKCJI RZĘDU DRUGIEGO
KINETYKA REAKCJI RZĘDU DRUGIEGO
n = 2
B
A
c
c
k
v
2
c
k
v
c
t
k
1
c
c
c
k
1
t
0.5
c
c
c
c
t
1
k
]
s
mol
L
[
],
min
mol
L
[
],
h
mol
L
[
k
1
-
1
-
1
-
1
-
1
-
1
-
k
a
tg
t
c
1
c
1
t
k
c
1
c
1
t
k
c
1
c
1
dt
k
dc
c
1
dt
k
c
dc
c
k
dt
dc
c
c
t
0
t
2
2
2
2
c
k
v
c
o
-
początkowe stężenie substratu , [molL
-1
], [mg L
-1
], [mg mL
-1
],
c
-
stężenie substratu po czasie t, [molL
-1
], [mg L
-1
], [mg mL
-1
],

KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
METODY WYZNACZANIA RZĘDU REAKCJI
METODY WYZNACZANIA RZĘDU REAKCJI
•
różnicowa van’t Hoffa
•
podstawiania
wartości
stężeń
reagenta
oznaczonych w czasie trwania reakcji do
wzoru na stałą szybkości (danego rzędu)
•
graficzna
•
całkowa Ostwalda i Zawidzkiego
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
(1) Metoda
podstawiania wartości stężeń reagenta oznaczonych
w czasie
trwania reakcji do wzoru na stałą szybkości (danego rzędu)
t
o
t
1
t
2
t
3
t
4
...
c
o
c
1
c
2
c
3
c
4
...
n = 0
n = 1
n = 2
...
k
k
k
k
t
t
c
c
t
t
c
c
t
t
c
c
t
t
c
c
x
x
2
3
3
2
1
2
2
1
1
1
t
c
-
c
k
c
c
ln
t
1
k
...
ln
t
t
1
k
ln
t
t
1
k
ln
t
t
1
k
ln
t
t
1
k
x
c
c
x
3
c
2
c
2
3
2
c
1
c
1
2
1
c
c
1
...
t
t
1
k
t
t
1
k
t
t
1
k
t
t
1
k
x
c
c
x
c
c
x
3
c
2
c
3
c
2
c
2
3
2
c
1
c
2
c
1
c
1
2
1
c
c
1
c
c
1
stężenie
substratu
k =
const
k =
const
k =
const
c
c
c
c
t
1
k
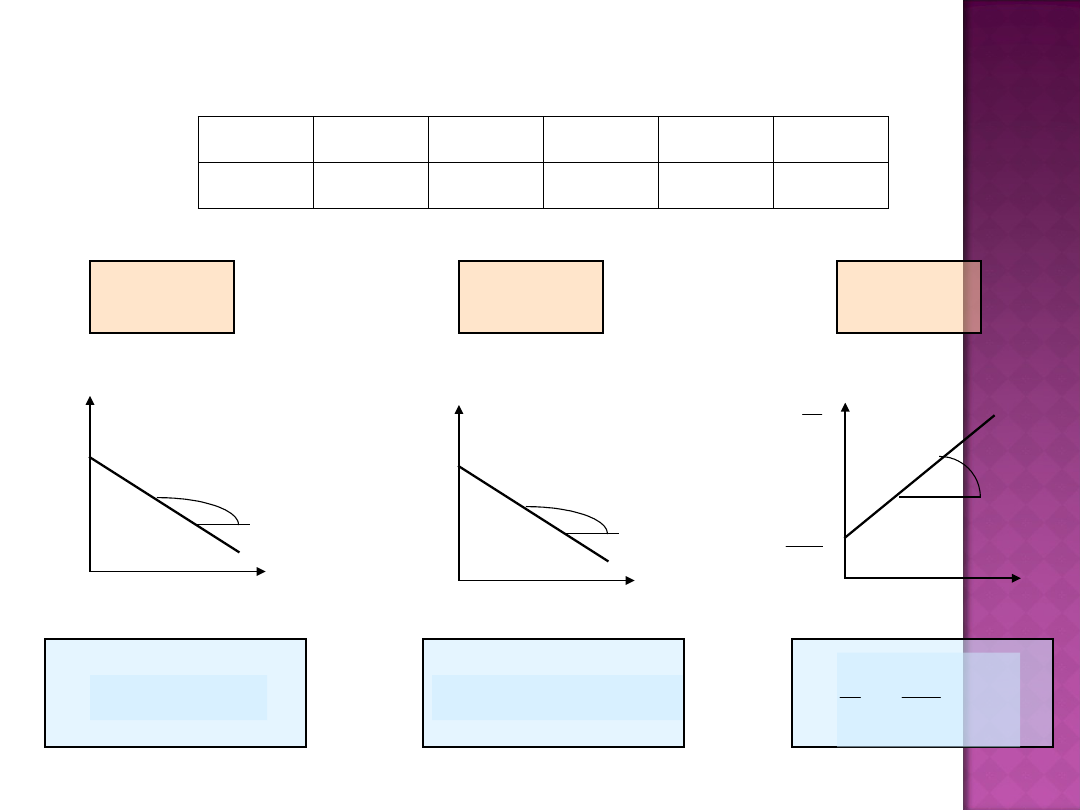
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
(2)
Metoda
graficzna
t
o
t
1
t
2
t
3
t
4
...
c
o
c
1
c
2
c
3
c
4
...
n = 0
n = 1
n = 2
c
1
t
c
1
k
a
tg
ln
c
ln c
o
t
k
-
a
tg
c
c
o
t
k
-
a
tg
t
k
c
c
t
k
c
ln
c
ln
t
k
c
1
c
1
stężenie
substratu
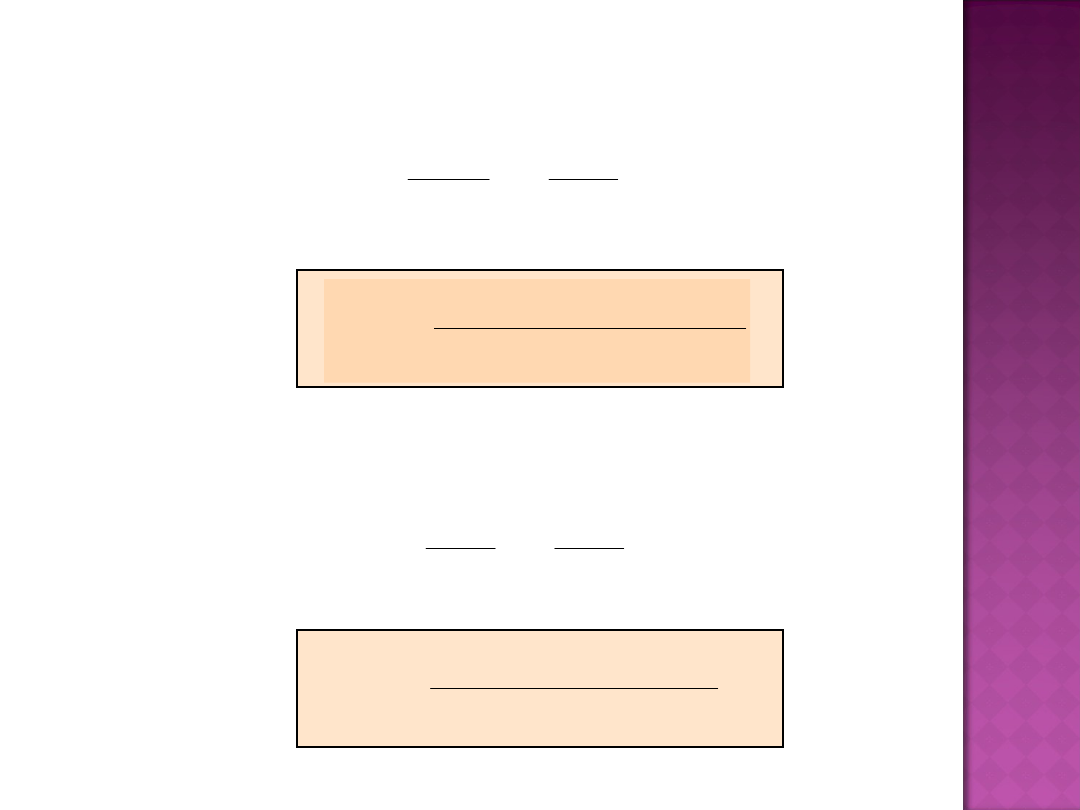
KINETYKA CHEMICZNA
KINETYKA CHEMICZNA
(3)
Metoda
całkowa Ostwalda i Zawidzkiego
1
n
)
1
(
)
2
(
)
2
(
5
.
0
)
1
(
5
.
0
c
c
t
t
)
1
(
)
2
(
)
2
(
5
.
0
)
1
(
5
.
0
c
log
c
log
t
log
t
log
1
n
(4)
Metoda
różnicowa van’t Hoffa
n
)
2
(
)
1
(
)
2
(
0
)
1
(
0
c
c
v
v
)
2
(
)
1
(
)
2
(
0
)
1
(
0
c
log
c
log
v
log
v
log
n
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
Wyszukiwarka
Podobne podstrony:
kinetyka chemiczna
4) Kinetyka chemiczna
10 Kinetyka chemicznaid 10897 ppt
Kinetyka chemiczna, CHEMIA, semestr 1, chemia ogólna, wykłady
10 wykad Statyka kinetyka chemiczna[F 2006]
chemia, kinetyka chemiczna, KINETYKA CHEMICZNA- 1
Kinetyka chemiczna
kinetyka chemiczna id 235068 Nieznany
10 Kinetyka chemiczna i kataliza
KINETYKA CHEMICZNA, Budownictwo PK, Chemia, Chemia nieorganiczna od Marysi
ELEMENTY KINETYKI CHEMICZNEJ, NAUKA, WIEDZA
3 1 Elementy kinetyka chemicznej reakcji prostych
Kinetyka chemiczna
Sprawozdanie - Kinetyka chemiczna. Wyznaczenie stałej szybkości, Studia, Chemia
3.kinetyka chemiczna, Politechnika Rzeszowska Budownictwo, IBD, Chemia
Kinetyka chemiczna, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
więcej podobnych podstron