
Materiały pochodzą z Platformy
Edukacyjnej Portalu
www.szkolnictwo.pl
Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www.szkolnictwo.pl mogą być wykorzystywane przez jego
Użytkowników
wyłącznie
w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian,
przesyłanie,
publiczne
odtwarzanie
i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby
własne
oraz
do
wykorzystania
w szkołach podczas zajęć dydaktycznych.
USTALANIE
WZORÓW
I
NAZW SOLI

Spis treści
Pojęcia podstawowe
Wzór ogólny soli
Znane kwasy, wartościowość reszt,
nazewnictwo pochodzących od nich soli
Wartościowość znanych metali
Ustalanie wzorów sumarycznych
Przykład I
Przykład II
Ustalanie nazw soli
Przykład I
Przykład II
Ustalanie wzorów strukturalnych
Przykład I
Przykład II
Określanie liczby atomów
poszczególnych pierwiastków w cząsteczce soli
Przykłady

Podstawowe pojęcia
Definicja soli
Jest to związek chemiczny, którego cząsteczka
zbudowana jest z kationu (kationów) metalu i anionu
(anionów) reszty kwasowej.
Wzór sumaryczny
Umowny
zapis, który określa tylko rodzaj i liczbę atomów
wchodzących w skład cząsteczki.
Wzór strukturalny (kreskowy)
Wzór uwzględniający rodzaj, liczbę atomów oraz
wiązania między nimi.

Indeks stechiometryczny
Liczba atomów danego pierwiastka w cząsteczce
Wartościowość
Określa liczbę wiązań chemicznych, jaką tworzy atom
danego pierwiastka (grupa funkcyjna) z atomami
innych pierwiastków (grupami funkcyjnymi) tworząc
cząsteczkę danego związku
Pojęcie wartościowości dotyczy atomów
związanych w cząsteczkach.
W stanie niezwiązanym wartościowość wynosi
„0”

A
B
n
n
m
m
M
– oznacza
symbol metalu
R
– oznacza
wzór reszty
kwasowej
n
– oznacza ilość
atomów metalu
w cząsteczce
m
– oznacza ilość reszt
w cząsteczce
A
– wartościowość metalu w tym związku
B
- wartościowość reszty kwasowej

W cząsteczce soli
Iloczyn wartościowości metalu ( A) i ilości
atomów tego metalu (n) równy jest
wartościowości reszty kwasowej (B) i jej ilości
(m)
A
A
x
n
n
=
B
B
x
m
m
UWAGA
Nie zapisuje się indeksów stechiometrycznych
( tzw małych współczynników), jeśli ich wartość
wynosi 1

Nazwa
kwasu
Wzór
Wartości
o-wość
niemetal
u
Wzór
reszty
kwasowej
Wartości
o-wość
reszty
Nazwa
soli
Kwas
chloro-
wodorow
y
HCl
I
Cl
I
I
chlorek
Kwas
bromo-
wodorow
y
HBr
I
Br
I
I
bromek
Kwas
siarko-
wodorow
y
H
2
S
II
S
II
II
siarcze
k
Kwas
azotowy
(III)
HNO
2
III
NO
2
I
I
azotan
(III)
Kwas
azotowy
( V)
HNO
3
V
NO
3
I
I
azotan
(V)
Nazwa
kwasu
Wzór
Wartości
o-wość
niemetal
u
Wzór
reszty
kwasowej
Wartości
o-wość
reszty
Nazwa
soli
Kwas
węglowy
H
2
CO
3
IV
CO
3
II
węglan
(IV)
Kwas
siarkowy
(IV)
H
2
SO
3
IV
SO
3
II
siarcza
n (IV)
Kwas
siarkowy
(VI)
H
2
SO
4
VI
SO
4
II
siarcza
n (VI)
Kwas
fosforow
y (V)
H
3
PO
4
V
PO
4
III
fosfora
n (V)
Reszta kwasowa ma wartościowość równą ilości
atomów wodoru w cząsteczce kwasu
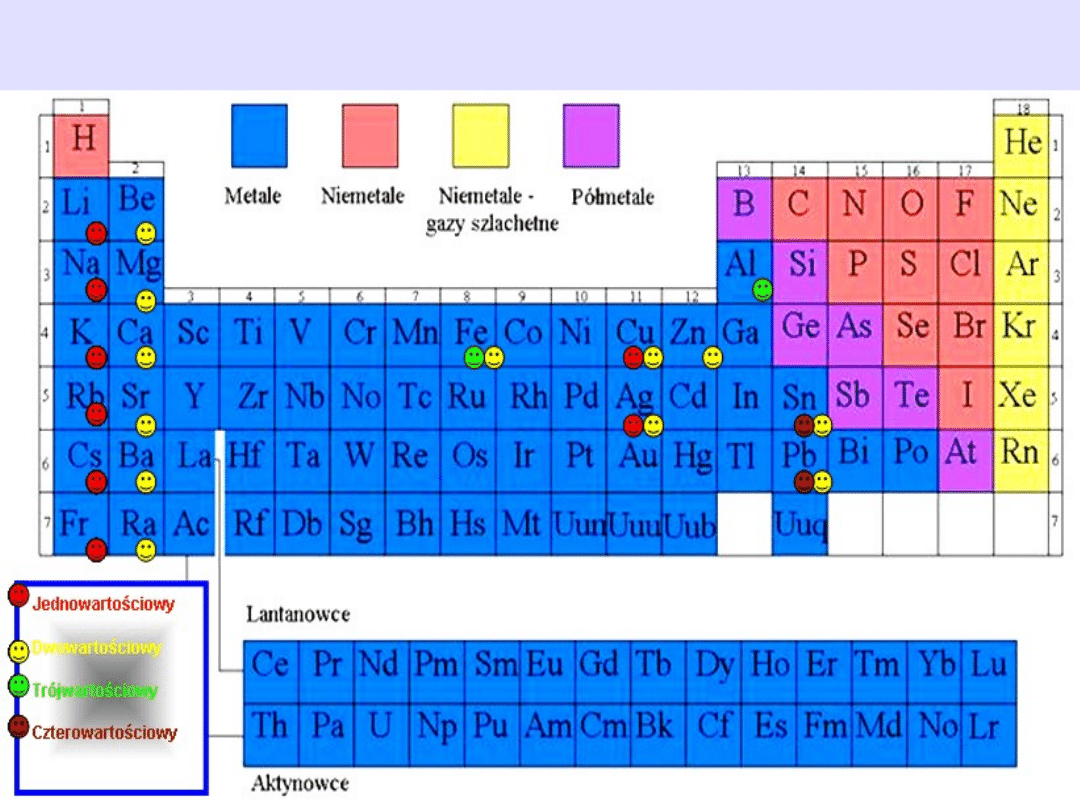
Wartościowość wybranych metali

Kroki, jakie należy podjąć, aby ustalić wzór
sumaryczny
1)
Ustalamy jakiego kwasu jest to sól –
R
2)
Ustalamy jakiego metalu jest to sól –
Me
3)
Wstępnie zapisujemy symbol metalu i wzór reszty
kwasowej
Me
R
4)
Ustalamy wartościowość metalu -
A
5)
Ustalamy
wartościowość reszty kwasowej –
B
6)
Dobieramy indeksy stechiometryczne -
n
,
m
7)
Sprawdzamy czy iloczyn wartościowości metalu i
indeksu przy nim jest równy wartościowości reszty i
indeksu przy niej
A
x
n
=
B
x
m
8)
Cieszymy się z poprawnie wykonanego zadania

Pamiętaj !
•
Przy ilości n, m = „1” nie wpisujemy indeksu
•
Resztę kwasową R traktujemy jako całość, więc
jej ilość w cząsteczce zapisujemy stosując
nawias okrągły (R)
•
Przy dobieraniu współczynników (indeksów
stechiometrycznych) stosujemy zasadę
najmniejszej wspólnej wielokrotności

Przykład I
•
Chlorek żelaza (III)
•
Jest to sól kwasu chlorowodorowego (solnego)
HCl
•
Żelaza trójwartościowego
Fe
•
FeCl
•
Wartościowość Fe w tym związku wynosi
III (A)
•
Wartościowość reszty kwasowej ( Cl ) wynosi
I
(B)
•
n
x A =
m
x B ; n x
3
= m x
1
FeCl
3
•
Sprawdzamy: 1
x
3
=
3
x
1

Przykład II
•
Siarczan (VI) miedzi (II)
•
Jest to sól kwasu siarkowego
(VI)
H
2
SO
4
•
Miedzi dwuwartościowej
Cu
•
CuSO4
•
Wartościowość reszty kwasowej (SO
4
)
wynosi
II
•
Wartościowość Cu w tym związku wynosi
II
•
n
x
2
=
m
x
2
; CuSO
4
•
1 x 2 = 1 x 2

Fe
2
(SO
4
)
3
Jest to sól kwasu siarkowego (VI) ( H2SO4),
czyli siarczan (VI)
Jest to sól żelaza trójwartościowego Fe (III)
Nazwa siarczan (VI) żelaza (III)
Al(NO
2
)
3
Jest to sól kwasu azotowego (III), czyli azotan
(III)
Jest to sól glinu
Nazwa azotan (III) glinu

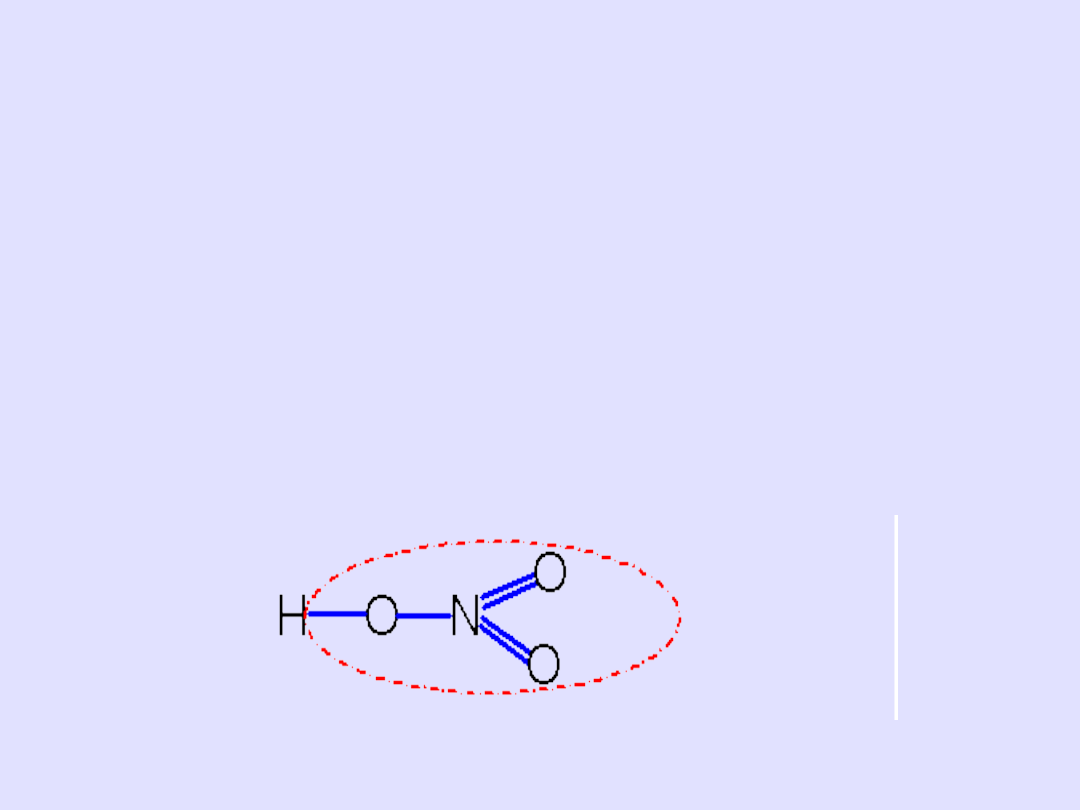
Wzory strukturalne (kreskowe)
soli
Uwagi wstępne
:
- Atom danego pierwiastka tworzy z innymi
ilość wiązań równą jego wartościowości, czyli
ilość wiązań ( kresek we wzorze)
odchodzących od symbolu atomu pierwiastka
musi być równa jego wartościowości
- Układ atomów reszty kwasowej jest taki jak
w kwasie

Proponowany algorytm postępowania
1.
Piszemy wzór sumaryczny
Me
n
R
m
2.
Piszemy wzór sumaryczny kwasu od którego pochodzi dana sól
H
B
R
3.
Piszemy wzór kreskowy kwasu i zaznaczmy resztę kwasową
4.
Z lewej strony w kolumnie piszemy symbole metalu w ilości n
(symbol oznacza 1 atom)
5.
Z prawej strony w kolumnie wzory reszt w ilości m
6.
Łączymy za pomocą kresek pamiętając o wartościowości
7.
Sprawdzamy: czy:
- od symbolu metalu odchodzi ilość kresek równa jego
wartościowości
- od każdej reszty kwasowej odchodzi ilość kresek równa
wartościowości reszty
- ilość symboli atomów i ilość wzorów reszt jest równa
indeksom stechiometrycznym we wzorze sumarycznym
Przykład I
Piszemy wzór sumaryczny Me
n
R
m
Ca(NO
3
)
2
Piszemy wzór sumaryczny kwasu od którego pochodzi
dana sól H
B
R
HNO
3
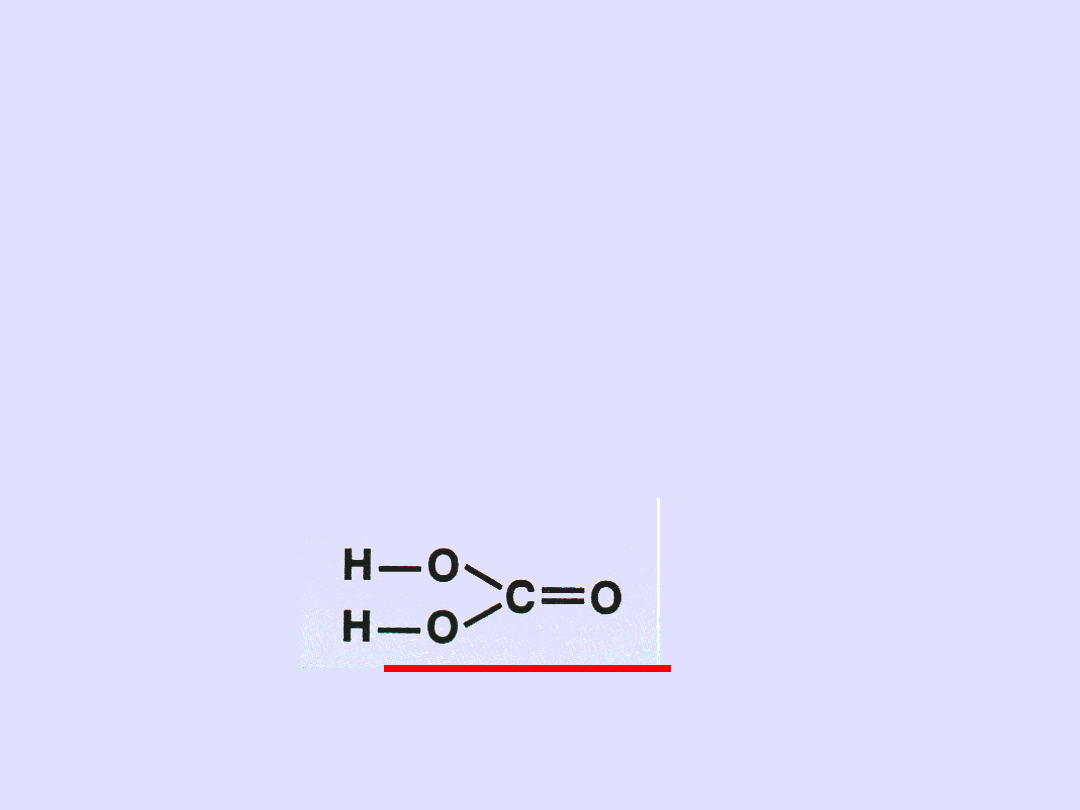
Piszemy wzór kreskowy kwasu i zaznaczmy resztę
kwasową
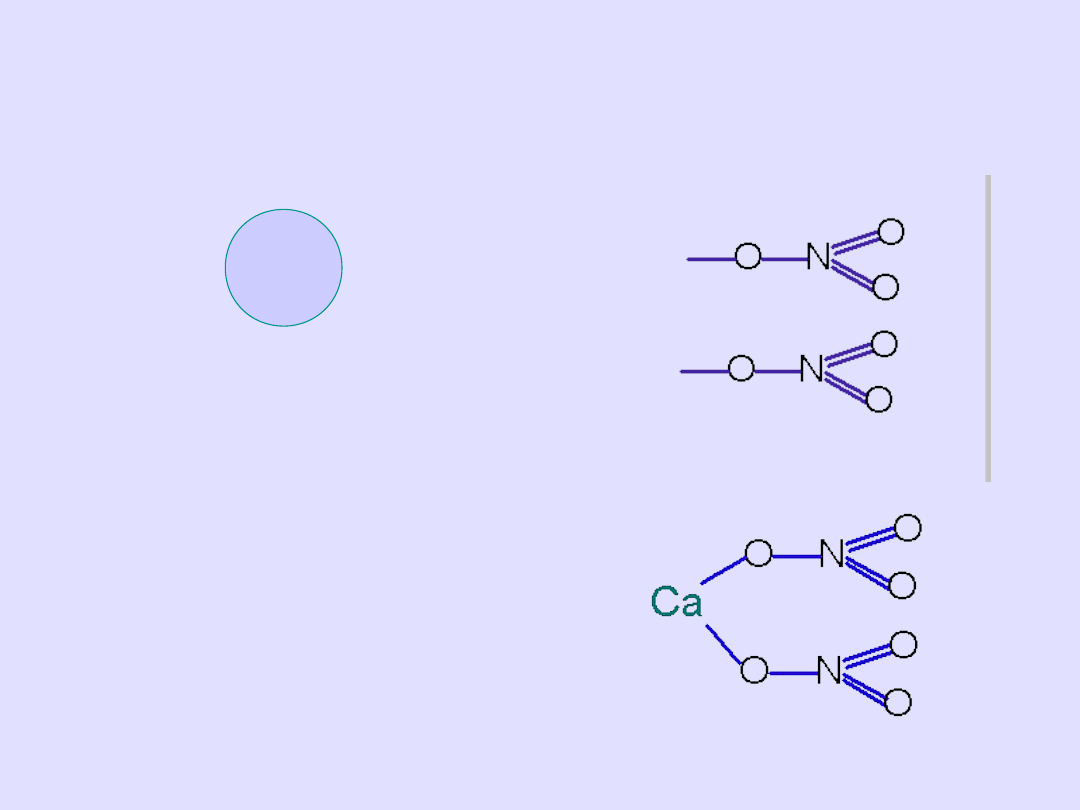
• symbole metalu w ilości n (symbol oznacza 1 atom) Ca
• Z prawej strony w kolumnie wzory reszt (w ilości m)
Ca
Ca
•
Łączymy za pomocą kresek
pamiętając o wartościowości
• Sprawdzamy
Przykład II
Piszemy wzór sumaryczny
Me
n
R
m
Węglan glinu Al
2
(CO3)
3
Piszemy wzór sumaryczny kwasu od którego pochodzi
dana sól H
B
R
H
2
CO
3
Piszemy wzór kreskowy kwasu i zaznaczmy resztę
kwasową
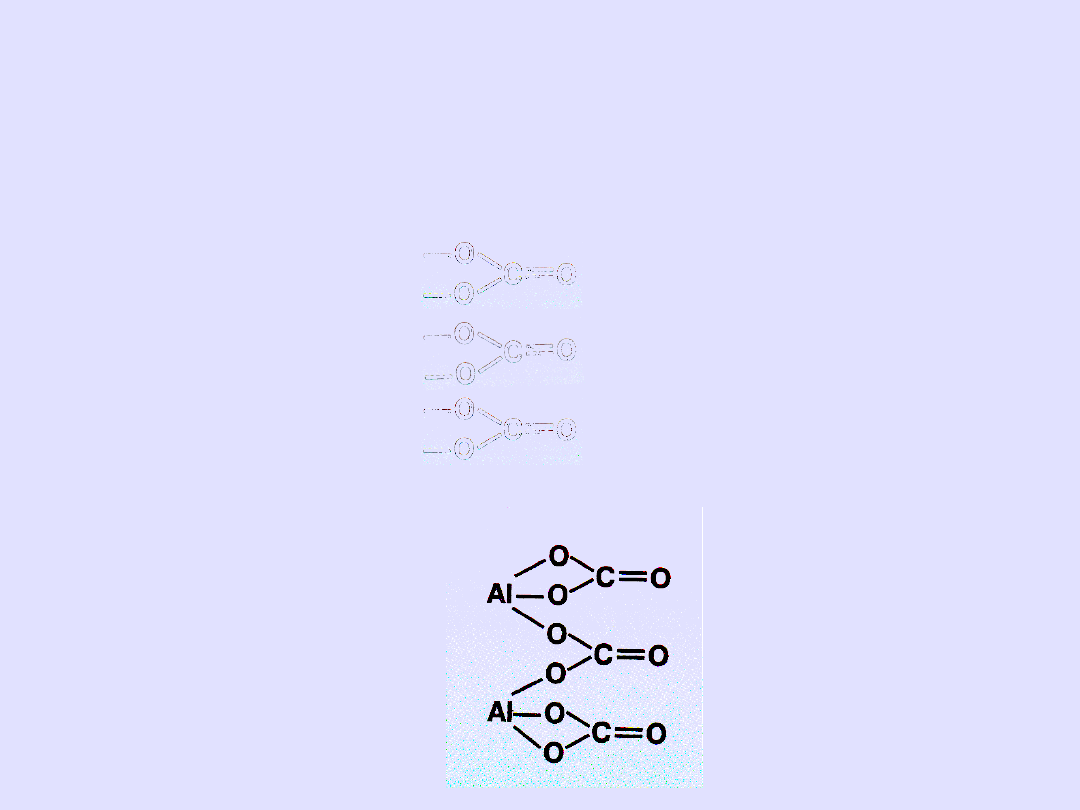
Z lewej strony w kolumnie piszemy symbole metalu w ilości n
(symbol oznacza 1 atom)
Z prawej strony w kolumnie wzory reszt w ilości m
Al
Al
Łączymy za pomocą kresek pamiętając o wartościowości
Sprawdzamy
Ustalanie ilości poszczególnych atomów
w cząsteczce soli
Me
n
(
R
)
m
Ilość atomów metalu wynosi n (równa jest indeksowi
stechiometrycznemu przy symbolu metalu
Ilość m to ilość reszt w cząsteczce
Liczbę atomów poszczególnych pierwiastków znajdujących
się w resztach kwasowych R obliczamy mnożąc indeks
stechiometryczny stojący przy symbolu danego niemetalu w
reszcie przez indeks wskazujący na ilość reszt w cząsteczce
soli

Me
n
(
N
x
O
y
)
m
N
– symbol niemetalu w reszcie
kwasowej
O
– symbol tlenu w reszcie kwasowej
x
– ilość atomów danego niemetalu w
reszcie kwasowej
y
– ilość atomów tlenu w reszcie
kwasowej
m
– ilość reszt kwasowych w
cząsteczce soli
Ilość atomów Me = n
Ilość atomów N = x × m
Ilość atomów O = y × m

Al
2
(
S
O
4
)
3
Ilość atomów glinu w jednej cząsteczce -
2
Ilość atomów siarki w jednej cząsteczce -
1
x 3 = 3
Ilość atomów tlenu w jednej cząsteczce -
4
x 3 = 12
Przykłady
Mg(NO
3
)
2
Ilość atomów magnezu w jednej cząsteczce – 1
Ilość atomów azotu w jednej cząsteczce – 1 x 2 =
2
Ilość atomów tlenu w jednej cząsteczce – 3 x 2 =
6
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
Wyszukiwarka
Podobne podstrony:
224 Ustalanie wzorow i nazw soli
224 Ustalanie wzorow i nazw soli
9 10 ustalanie wzorów wartościowosci
2 Ustalanie wzorow mineralow i Nieznany (2)
scen lekcji otwartej kl 1 ustalanie wzorów strukturalnych i modelowanie czasteczekx
Przekładzie nazw osobowych, nauka, ROSYJSKI, Rusycystyka (Język rosyjski)
scen lekcji otwartej kl 1 ustalanie wzorów strukturalnych i modelowanie cząsteczek załącznikx
USTALANIE WZORÓW TLENKÓW
ustalanie wzorów chemicznych
EK3E9C~1, Ekonometria - nauka zajmująca się ustalaniem ilościowych prawidłowości za pomocą metod mat
reguly ustalania nazw systematycznych dla alkanow oraz halogenoalkanow ppt
Złoża soli, GIG, semestr 5, Nauka o złożach
Przeksztalcanie wzorow
Epidemiologia jako nauka podstawowe założenia
Nauka chodu
socjologia jako nauka
NAUKA O ORGANIZACJI(1)
więcej podobnych podstron