USTALANIE
WZORÓW
I
NAZW SOLI

Spis treści
Pojęcia podstawowe
Wzór ogólny soli
Znane kwasy, wartościowość reszt,
nazewnictwo pochodzących od nich soli
Wartościowość znanych metali
Ustalanie wzorów sumarycznych
Przykład I
Przykład II
Ustalanie nazw soli
Przykład I
Przykład II
Ustalanie wzorów strukturalnych
Przykład I
Przykład II
Określanie liczby atomów
poszczególnych pierwiastków w cząsteczce soli
Przykłady

Podstawowe pojęcia
Definicja soli
Jest to związek chemiczny, którego cząsteczka
zbudowana jest z kationu (kationów) metalu i anionu
(anionów) reszty kwasowej.
Wzór sumaryczny
Umowny
zapis, który określa tylko rodzaj i liczbę atomów
wchodzących w skład cząsteczki.
Wzór strukturalny (kreskowy)
Wzór uwzględniający rodzaj, liczbę atomów oraz
wiązania między nimi.

Indeks stechiometryczny
Liczba atomów danego pierwiastka w cząsteczce
Wartościowość
Określa liczbę wiązań chemicznych, jaką tworzy atom
danego pierwiastka (grupa funkcyjna) z atomami
innych pierwiastków (grupami funkcyjnymi) tworząc
cząsteczkę danego związku
Pojęcie wartościowości dotyczy atomów
związanych w cząsteczkach.
W stanie niezwiązanym wartościowość wynosi
„0”

A
B
n
n
m
m
M
– oznacza
symbol metalu
R
– oznacza
wzór reszty
kwasowej
n
– oznacza ilość
atomów metalu
w cząsteczce
m
– oznacza ilość reszt
w cząsteczce
A
– wartościowość metalu w tym związku
B
- wartościowość reszty kwasowej

W cząsteczce soli
Iloczyn wartościowości metalu ( A) i ilości
atomów tego metalu (n) równy jest
wartościowości reszty kwasowej (B) i jej ilości
(m)
A
A
x
n
n
=
B
B
x
m
m
UWAGA
Nie zapisuje się indeksów stechiometrycznych
( tzw małych współczynników), jeśli ich wartość
wynosi 1

Nazwa
kwasu
Wzór
Wartości
o-wość
niemetal
u
Wzór
reszty
kwasowej
Wartości
o-wość
reszty
Nazwa
soli
Kwas
chloro-
wodorow
y
HCl
I
Cl
I
I
chlorek
Kwas
bromo-
wodorow
y
HBr
I
Br
I
I
bromek
Kwas
siarko-
wodorow
y
H
2
S
II
S
II
II
siarcze
k
Kwas
azotowy
(III)
HNO
2
III
NO
2
I
I
azotan
(III)
Kwas
azotowy
( V)
HNO
3
V
NO
3
I
I
azotan
(V)

Nazwa
kwasu
Wzór
Wartości
o-wość
niemetal
u
Wzór
reszty
kwasowej
Wartości
o-wość
reszty
Nazwa
soli
Kwas
węglowy
H
2
CO
3
IV
CO
3
II
węglan
(IV)
Kwas
siarkowy
(IV)
H
2
SO
3
IV
SO
3
II
siarcza
n (IV)
Kwas
siarkowy
(VI)
H
2
SO
4
VI
SO
4
II
siarcza
n (VI)
Kwas
fosforow
y (V)
H
3
PO
4
V
PO
4
III
fosfora
n (V)
Reszta kwasowa ma wartościowość równą ilości
atomów wodoru w cząsteczce kwasu
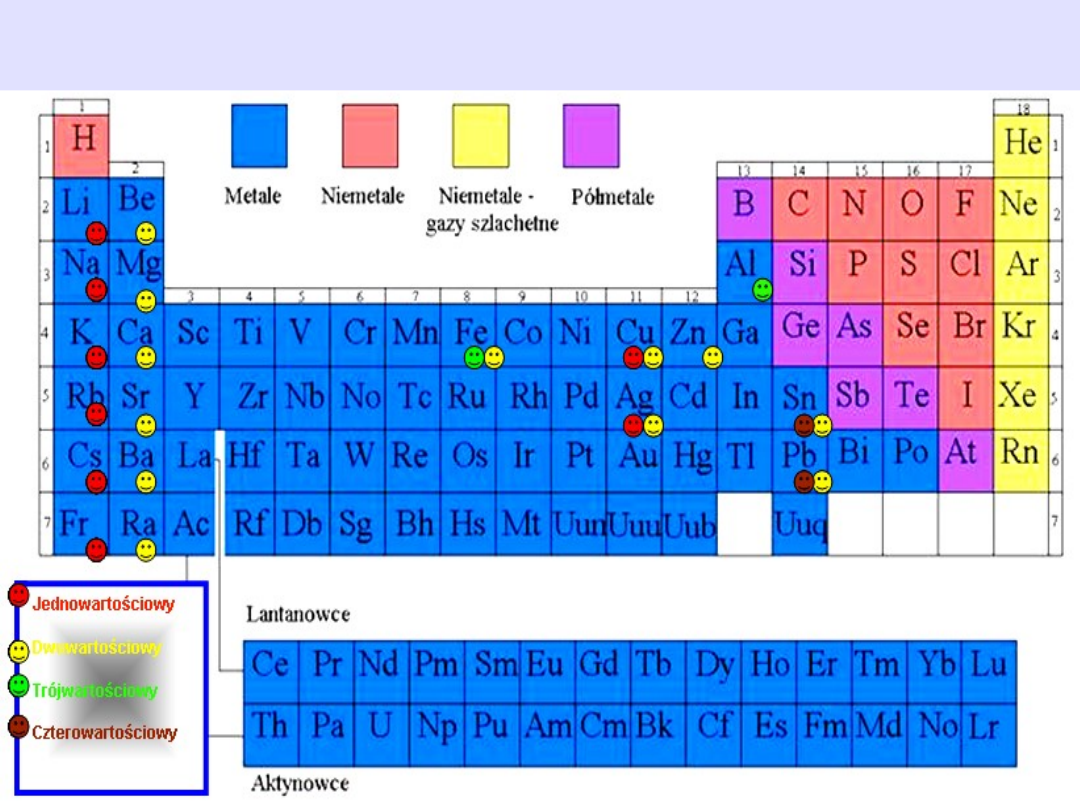
Wartościowość wybranych metali

Kroki, jakie należy podjąć, aby ustalić wzór
sumaryczny
1)
Ustalamy jakiego kwasu jest to sól –
R
2)
Ustalamy jakiego metalu jest to sól –
Me
3)
Wstępnie zapisujemy symbol metalu i wzór reszty
kwasowej
Me
R
4)
Ustalamy wartościowość metalu -
A
5)
Ustalamy
wartościowość reszty kwasowej –
B
6)
Dobieramy indeksy stechiometryczne -
n
,
m
7)
Sprawdzamy czy iloczyn wartościowości metalu i
indeksu przy nim jest równy wartościowości reszty i
indeksu przy niej
A
x
n
=
B
x
m
8)
Cieszymy się z poprawnie wykonanego zadania

Pamiętaj !
•
Przy ilości n, m = „1” nie wpisujemy indeksu
•
Resztę kwasową R traktujemy jako całość, więc
jej ilość w cząsteczce zapisujemy stosując
nawias okrągły (R)
•
Przy dobieraniu współczynników (indeksów
stechiometrycznych) stosujemy zasadę
najmniejszej wspólnej wielokrotności

Przykład I
•
Chlorek żelaza (III)
•
Jest to sól kwasu chlorowodorowego (solnego)
HCl
•
Żelaza trójwartościowego
Fe
•
FeCl
•
Wartościowość Fe w tym związku wynosi
III (A)
•
Wartościowość reszty kwasowej ( Cl ) wynosi
I
(B)
•
n
x A =
m
x B ; n x
3
= m x
1
FeCl
3
•
Sprawdzamy: 1
x
3
=
3
x
1

Przykład II
•
Siarczan (VI) miedzi (II)
•
Jest to sól kwasu siarkowego
(VI)
H
2
SO
4
•
Miedzi dwuwartościowej
Cu
•
CuSO4
•
Wartościowość reszty kwasowej (SO
4
)
wynosi
II
•
Wartościowość Cu w tym związku wynosi
II
•
n
x
2
=
m
x
2
; CuSO
4
•
1 x 2 = 1 x 2

Fe
2
(SO
4
)
3
Jest to sól kwasu siarkowego (VI) ( H2SO4),
czyli siarczan (VI)
Jest to sól żelaza trójwartościowego Fe (III)
Nazwa siarczan (VI) żelaza (III)
Al(NO
2
)
3
Jest to sól kwasu azotowego (III), czyli azotan
(III)
Jest to sól glinu
Nazwa azotan (III) glinu

Wzory strukturalne (kreskowe)
soli
Uwagi wstępne
:
- Atom danego pierwiastka tworzy z innymi
ilość wiązań równą jego wartościowości, czyli
ilość wiązań ( kresek we wzorze)
odchodzących od symbolu atomu pierwiastka
musi być równa jego wartościowości
- Układ atomów reszty kwasowej jest taki jak
w kwasie

Proponowany algorytm postępowania
1.
Piszemy wzór sumaryczny
Me
n
R
m
2.
Piszemy wzór sumaryczny kwasu od którego pochodzi dana sól
H
B
R
3.
Piszemy wzór kreskowy kwasu i zaznaczmy resztę kwasową
4.
Z lewej strony w kolumnie piszemy symbole metalu w ilości n
(symbol oznacza 1 atom)
5.
Z prawej strony w kolumnie wzory reszt w ilości m
6.
Łączymy za pomocą kresek pamiętając o wartościowości
7.
Sprawdzamy: czy:
- od symbolu metalu odchodzi ilość kresek równa jego
wartościowości
- od każdej reszty kwasowej odchodzi ilość kresek równa
wartościowości reszty
- ilość symboli atomów i ilość wzorów reszt jest równa
indeksom stechiometrycznym we wzorze sumarycznym
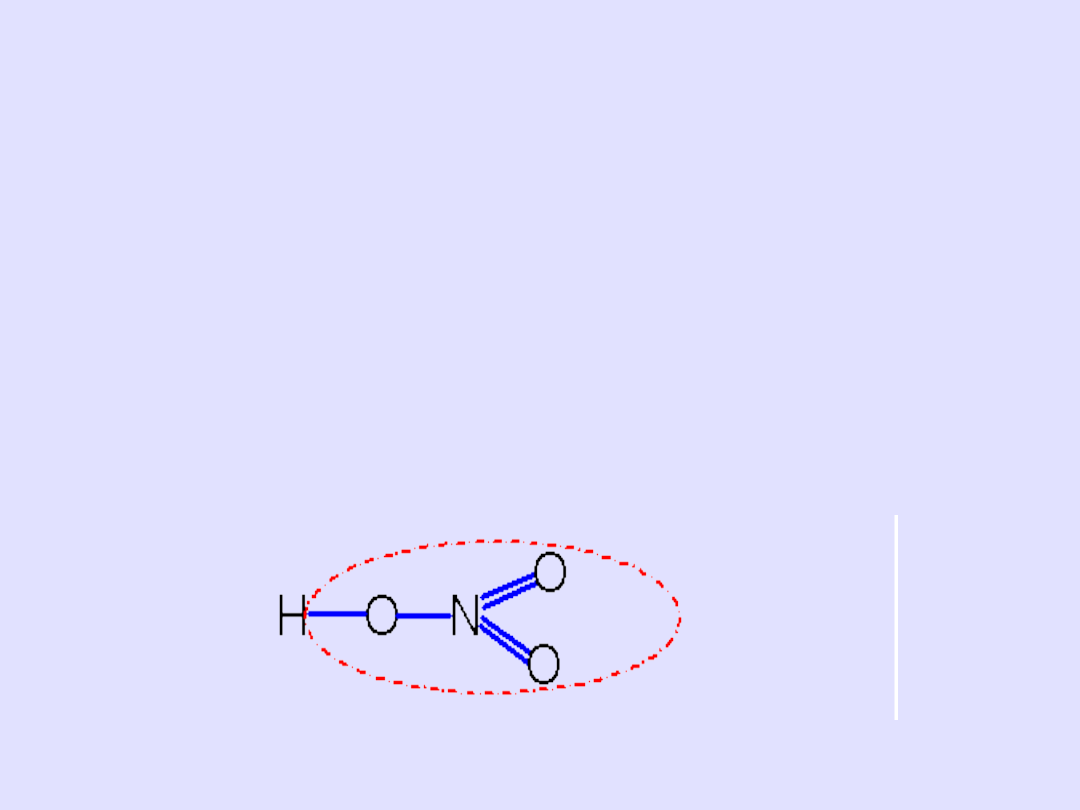
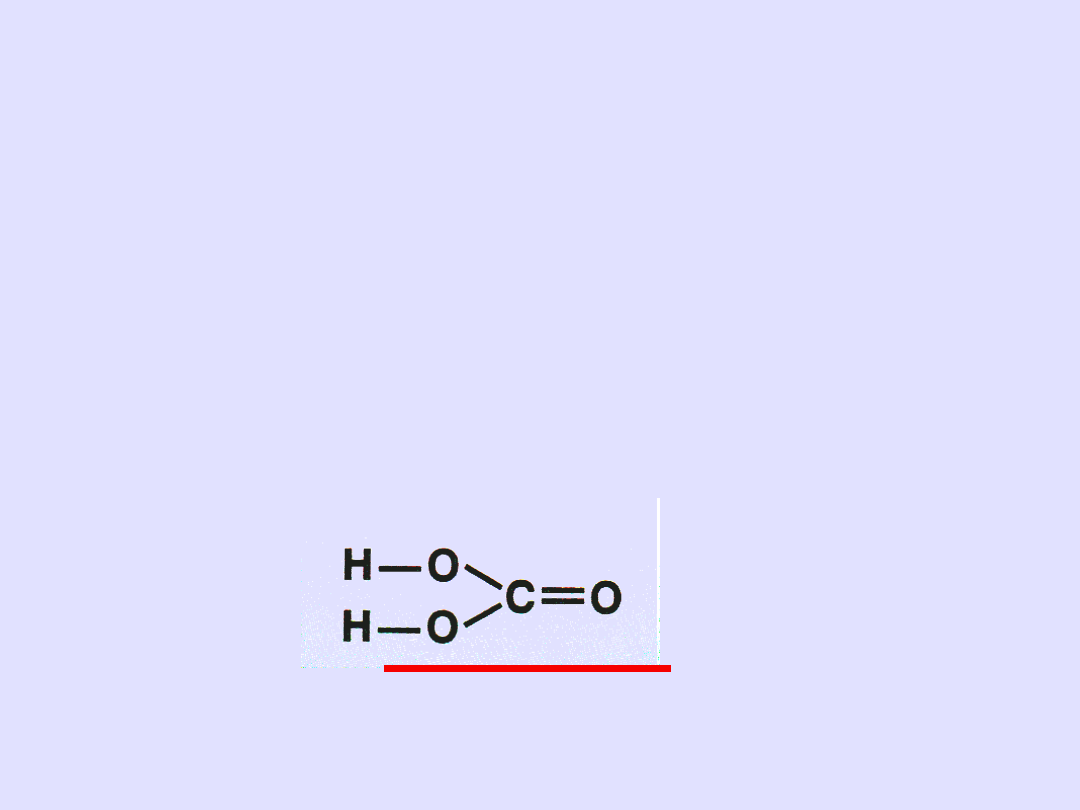
Przykład I
Piszemy wzór sumaryczny Me
n
R
m
Ca(NO
3
)
2
Piszemy wzór sumaryczny kwasu od którego pochodzi
dana sól H
B
R
HNO
3
Piszemy wzór kreskowy kwasu i zaznaczmy resztę
kwasową
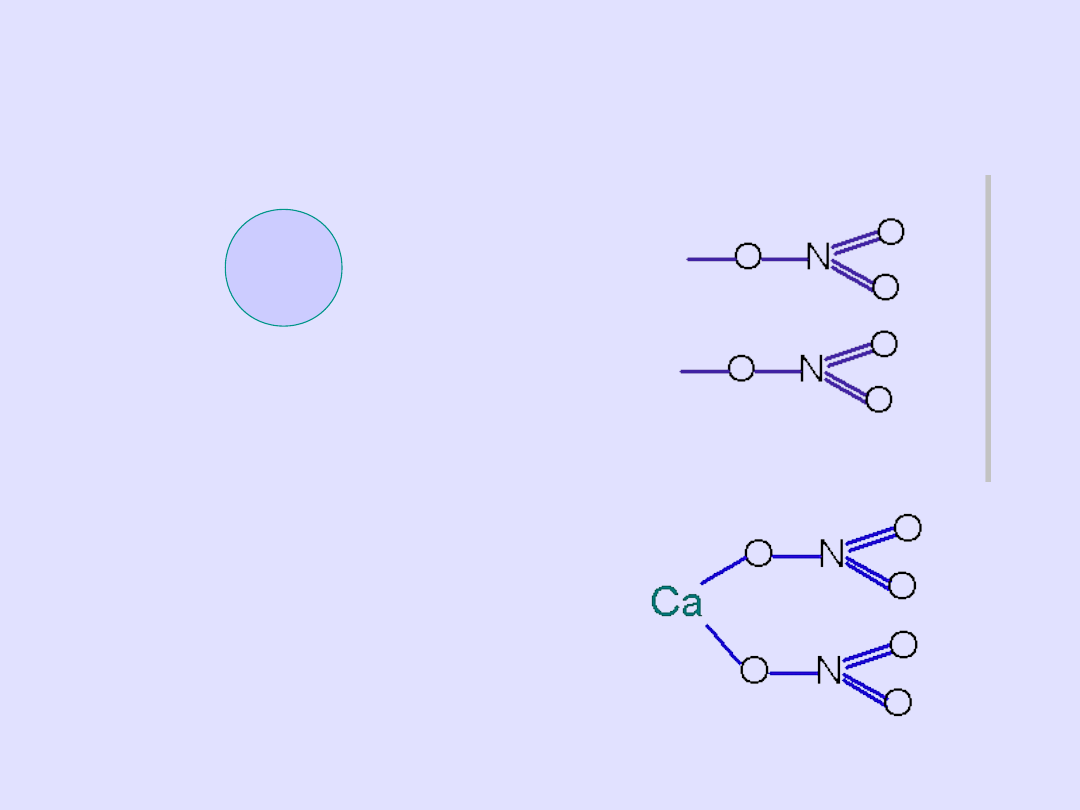
• symbole metalu w ilości n (symbol oznacza 1 atom) Ca
• Z prawej strony w kolumnie wzory reszt (w ilości m)
Ca
Ca
•
Łączymy za pomocą kresek
pamiętając o wartościowości
• Sprawdzamy
Przykład II
Piszemy wzór sumaryczny
Me
n
R
m
Węglan glinu Al
2
(CO3)
3
Piszemy wzór sumaryczny kwasu od którego pochodzi
dana sól H
B
R
H
2
CO
3
Piszemy wzór kreskowy kwasu i zaznaczmy resztę
kwasową
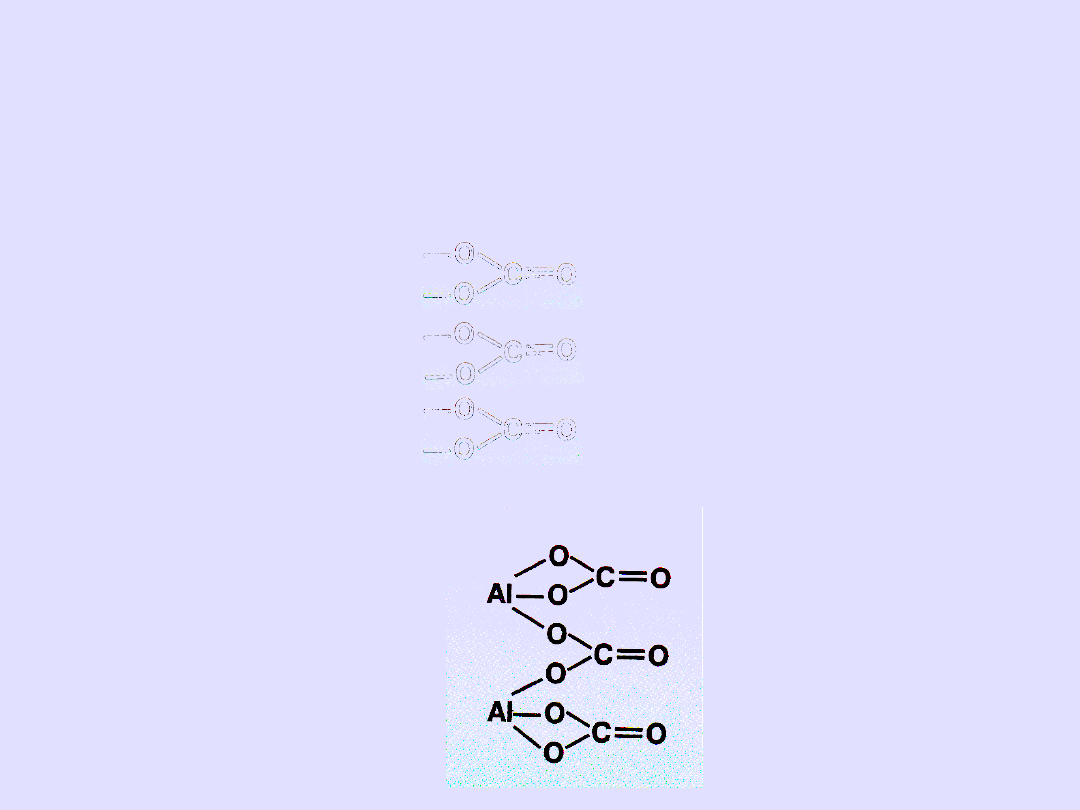
Z lewej strony w kolumnie piszemy symbole metalu w ilości n
(symbol oznacza 1 atom)
Z prawej strony w kolumnie wzory reszt w ilości m
Al
Al
Łączymy za pomocą kresek pamiętając o wartościowości
Sprawdzamy

Ustalanie ilości poszczególnych atomów
w cząsteczce soli
Me
n
(
R
)
m
Ilość atomów metalu wynosi n (równa jest indeksowi
stechiometrycznemu przy symbolu metalu
Ilość m to ilość reszt w cząsteczce
Liczbę atomów poszczególnych pierwiastków znajdujących
się w resztach kwasowych R obliczamy mnożąc indeks
stechiometryczny stojący przy symbolu danego niemetalu w
reszcie przez indeks wskazujący na ilość reszt w cząsteczce
soli

Me
n
(
N
x
O
y
)
m
N
– symbol niemetalu w reszcie
kwasowej
O
– symbol tlenu w reszcie kwasowej
x
– ilość atomów danego niemetalu w
reszcie kwasowej
y
– ilość atomów tlenu w reszcie
kwasowej
m
– ilość reszt kwasowych w
cząsteczce soli
Ilość atomów Me = n
Ilość atomów N = x × m
Ilość atomów O = y × m

Al
2
(
S
O
4
)
3
Ilość atomów glinu w jednej cząsteczce -
2
Ilość atomów siarki w jednej cząsteczce -
1
x 3 = 3
Ilość atomów tlenu w jednej cząsteczce -
4
x 3 = 12
Przykłady
Mg(NO
3
)
2
Ilość atomów magnezu w jednej cząsteczce – 1
Ilość atomów azotu w jednej cząsteczce – 1 x 2 =
2
Ilość atomów tlenu w jednej cząsteczce – 3 x 2 =
6
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
Ustalanie wzorow i nazw soli nauka
9 10 ustalanie wzorów wartościowosci
2 Ustalanie wzorow mineralow i Nieznany (2)
scen lekcji otwartej kl 1 ustalanie wzorów strukturalnych i modelowanie czasteczekx
scen lekcji otwartej kl 1 ustalanie wzorów strukturalnych i modelowanie cząsteczek załącznikx
USTALANIE WZORÓW TLENKÓW
ustalanie wzorów chemicznych
reguly ustalania nazw systematycznych dla alkanow oraz halogenoalkanow ppt
Przeksztalcanie wzorow
Ustalanie składu mieszanki betonowej1
16 Ustalanie wyniku finansowego Nieznany (2)
PALUSZKI RYBNE Z SOLI I KOPERKOWY MAJONEZ
USTALANIE ŁAŃCUCHA BIOKINEMATYCZNEGO, Fizjoterapia CM UMK, Biomechanika
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
USTALANIE PRIORYTET W, Inne
ustalanie oplaty inwestycyjnej
metody otrzymywania soli, ENERGETYKA AGH, sem 2, chemia
więcej podobnych podstron