
1
Równowagi kompleksowania w
roztworach
Są one zawsze sumą dwóch procesów:
redukcji i utlenienia; są więc
algebraiczną sumą reakcji
połówkowych red-ox, uzgodnionych
co do liczby przenoszonych
elektronów.

2
Równowagi kompleksowania w
roztworach
Rozważamy reakcje tworzenia związków kompleksowych
(koordynacyjnych) w roztworach.
Kompleksem (związkiem koordynacyjnym) nazywamy taki
związek, w którym występuje wiązanie koordynacyjne,
a więc związane z uwspólnieniem pary elektronowej
pochodzącej w całości od donora (liganda).
Akceptorami par elektronowych są metale i ich jony
(zwłaszcza metale grup przejściowych) zwane dalej
atomami (jonami) centralnymi; donorami (ligandami)
są jony lub cząsteczki, często organiczne, np. H
2
O,
NH
3
, aminy, kwasy karboksylowe.
Tak więc tworzenie się związku kompleksowego związane
jest z przeniesieniem (przyłączeniem) całych związków
chemicznych lub jonów wieloatomowych. Są to reakcje
równowagowe polegające na przeniesieniu cząsteczek
lub grup atomów.

3
Tworzenie związków
kompleksowych
Liczba par elektronowych jaką przyjmuje jon
(atom)
centralny
nazywa
się
liczbą
koordynacji
. Np. jony Cu
+2
z amoniakiem jako
ligandem mają liczby koordynacji 1, 2, 3 i 4.
Oznacza to, że w roztworze wodnym tworzenie
kolejnych kompleksów stanowi serię reakcji
następczych:
Cu
+2
+ NH
3
[Cu(NH
3
)]
+2
[Cu(NH
3
)]
+2
+ NH3
[Cu(NH
3
)
2
]
+2
[Cu(NH
3
)
2
]
+2
+ NH3 [Cu(NH
3
)
3
]
+2
[Cu(NH
3
)
3
]
+2
+ NH
3
[Cu(NH
3
)
4
]
+2
które opisywane są kolejnymi
stałymi tworzenia
:
4
Tworzenie związków
kompleksowych
K
Cu NH
Cu
NH
1
3
2
2
3
[ (
)]
[
][
]
K
Cu NH
Cu NH
NH
2
3 2
2
3
2
3
[ (
) ]
[ (
)] [
]
K
Cu NH
Cu NH
NH
3
3 3
2
3 2
2
3
[ (
) ]
[ (
) ] [
]
K
Cu NH
Cu NH
NH
4
3 4
2
3 3
2
3
[ (
) ]
[ (
) ] [
]

5
Tworzenie związków
kompleksowych
Niekiedy
wygodniej
jest
operować
sumaryczną
stałą
tworzenia
danego
kompleksu,
zwaną
stałą
trwałości
kompleksu:
1
1
3
2
2
3
K
Cu NH
Cu
NH
[ (
)]
[
][
]
2
1
2
3 2
2
2
3
2
K K
Cu NH
Cu
NH
[ (
) ]
[
][
]

6
Tworzenie związków
kompleksowych
3
1
2
3
3 3
2
2
3
3
K K K
Cu NH
Cu
NH
[ (
) ]
[
][
]
4
1
2
3
4
3 4
2
2
3
4
K K K K
Cu NH
Cu
NH
[ (
) ]
[
][
]

7
Tworzenie związków
kompleksowych
ogólnie:
Stałe trwałości są stablicowane, zwykle w
postaci
ich
logarytmów
dziesiętnych
(log
i
).
n
i
i
N
n
n
K
Me L
Me L
1
[
( ) ]
[
][ ]

8
Tworzenie związków
kompleksowych
Niektóre związki kompleksowe tworzą się
bezpośrednio (bez kompleksów pośrednich),
np.:
kompleks cyjankowy żelaza(II),
[Fe(CN)
6
]
-4
(log
6
=24)
kompleks cyjankowy żelaza(III),
[Fe(CN)
6
]
-3
(log
6
=36)
kompleks cyjankowy niklu(II),
[Ni(CN)
4
]
-2
(log
4
=31.3)
kompleks cyjankowy cynku(II),
[Zn(CN)
4
]
-2
(log
4
=16.7)

9
Tworzenie związków
kompleksowych
Szczególnie przydatne bywają wzory na
ułamki
molowe
form
metalu
(wyprowadzone wprost z wyrażeń na stałe
tworzenia).
Jeżeli metal w roztworze może istnieć w
postaciach z 0, 1, 2, ..., n przyłączonymi
ligandami, to ułamek
i
mówi, jaka jego
część (molowo) związana jest w kompleks z
i ligandami. Oczywiście
0
+
1
+... +
n
=1.

10
Tworzenie związków
kompleksowych
0
1
2
2
1
1
[ ]
[ ] ...
[ ]
L
L
L
n
n
1
1
1
2
2
1
[ ]
[ ]
[ ] ...
[ ]
L
L
L
L
n
n

11
Tworzenie związków
kompleksowych
.....................................
Wzory
te
są
przydatne
wtedy,
gdy
równowagowe znane jest stężenie liganda.
2
2
2
1
2
2
1
[ ]
[ ]
[ ] ...
[ ]
L
L
L
L
n
n
n
n
n
n
n
L
L
L
L
[ ]
[ ]
[ ] ...
[ ]
1
1
2
2

12
Wpływ pH na tworzenie się
związków kompleksowych
Wiele ligandów to słabe zasady: NH
3
, CN
-
, reszty
kwasów karboksylowych. Oznacza to, że w roztworze
wodnym ulegają one reakcji hydrolizy, która przesuwa
równowagę tworzenia kompleksów (bowiem z układu
ubywa formy będącej ligandem).
Jeżeli znamy równowagowe stężenie jonów H
+
w
układzie, można zastosować wzór
gdzie c
L
- całkowite stężenie ligandu, K
a
- stała dysocjacji
kwasowej kwasu sprzężonego z ligandem-zasadą.
Łatwo zauważyć, że w takich wypadkach obniżanie pH
powoduje osłabienie kompleksujących własności
ligandów.
[ ]
[
]
L
K
K
H
c
a
a
L
13
Diagramy tworzenia związków
kompleksowych
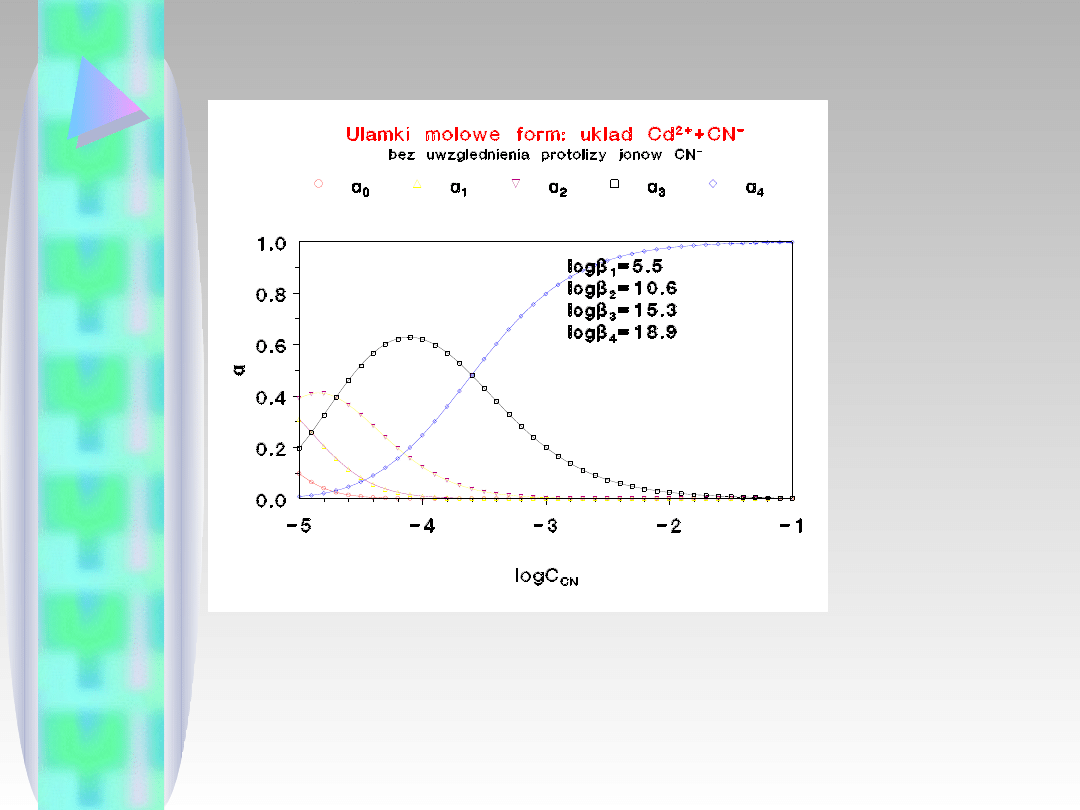
Typowy diagram, pozwalający określić niezbędny
nadmiar liganda, potrzebny do tego, żeby w roztworze
znajdował się przede wszystkim właściwy kompleks.
Jak widać nie dla każdego kompleksu jest to możliwe.
14
Diagramy tworzenia związków
kompleksowych
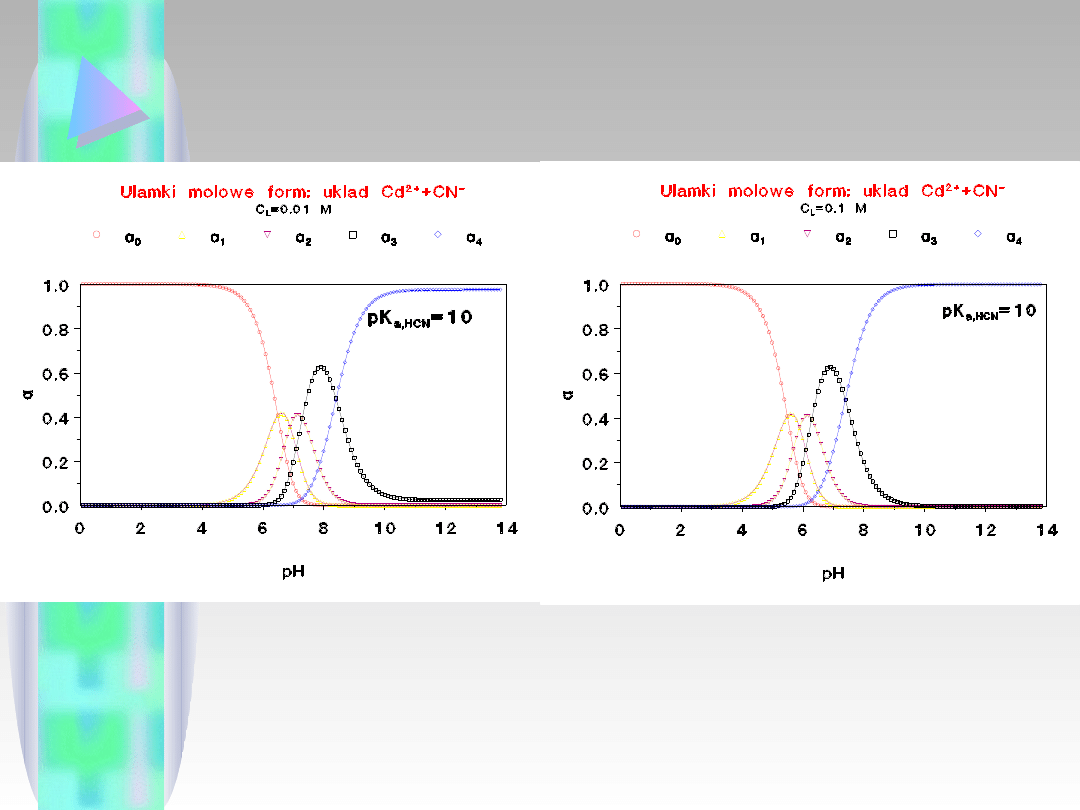
Jak widać, zmiana stężenia liganda niewiele wpływa
na rozkład form w funkcji pH.
15
Diagramy tworzenia związków
kompleksowych
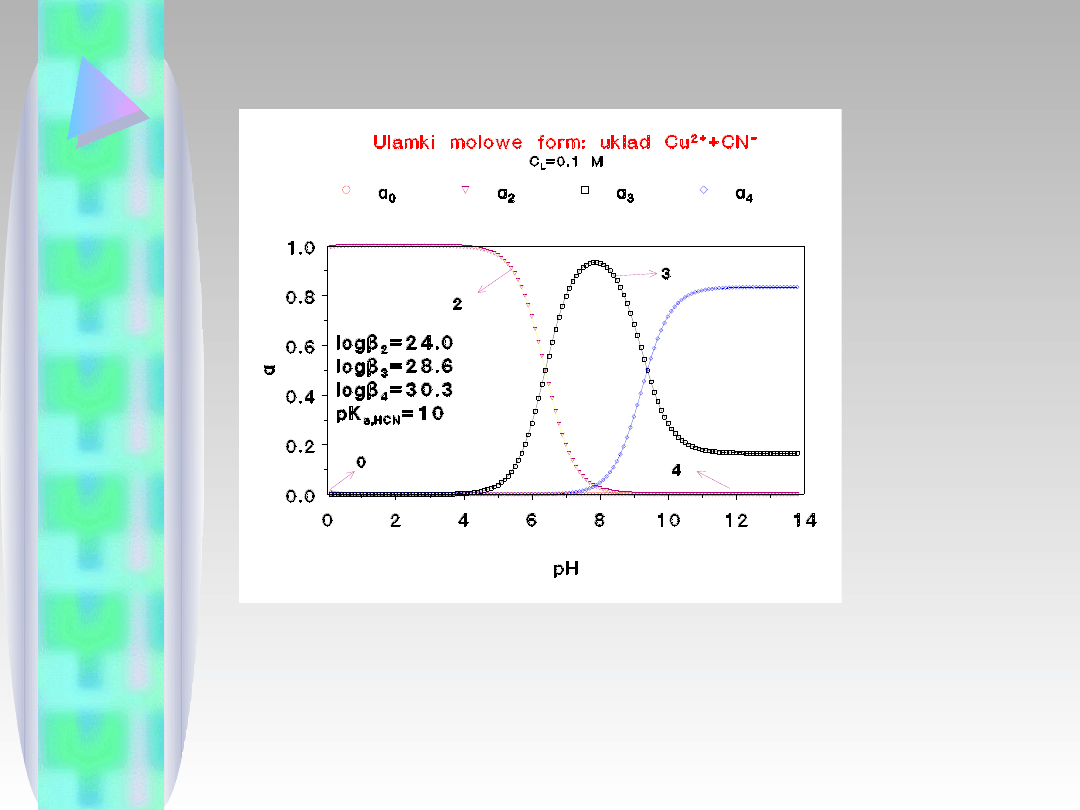
Proszę porównać te rozkłady z odpowiednim
wykresem dla kadmu. Są zupełnie różne. Na
kształt tych diagramów wpływ maja przede
wszystkim stałe trwałości.

16
Zastosowania metody iteracyjnej w
obliczeniach chemicznych
Metody
iteracyjne
pozwalają
obliczyć
pierwiastek równania lub rozwiązać układ
równań.
W przypadku jednego równania należy je
najpierw sprowadzić do postaci x=f(x).
17
Zastosowania metody iteracyjnej w
obliczeniach chemicznych
Zadanie:
rozwiąż równanie x-sinx=1 (x w
radianach).
Równanie nie jest rozwiązywalne analitycznie.
1.
Przekształcamy je do postaci x=sinx+1
2.
Wybieramy dowolną wartość x (np. 10). Jest
to nasze przybliżenie „zerowe”, x
0
.
3.
x
0
podstawiamy do prawej strony. Wynik
jest przybliżeniem nr 1, x
1
.
4.
x
1
podstawiamy do prawej strony. Wynik
jest przybliżeniem nr 2, x
2
.
5.
Procedurę powtarzamy aż x
n
różni się od x
n-1
o mniej niż zadana dokładność.

18
Zastosowania metody iteracyjnej w
obliczeniach chemicznych
i (nr
iter.)
x
i
0
1
2
3
4
5
6
7
8
9
10
11
12
13
10.0000000000
0.4559788891
1.4403414011
1.9915028172
1.9128006336
1.9420843619
1.9318607990
1.9355213074
1.9342218938
1.9346845959
1.9345200154
1.9345785787
1.9345577428
1.9345651562
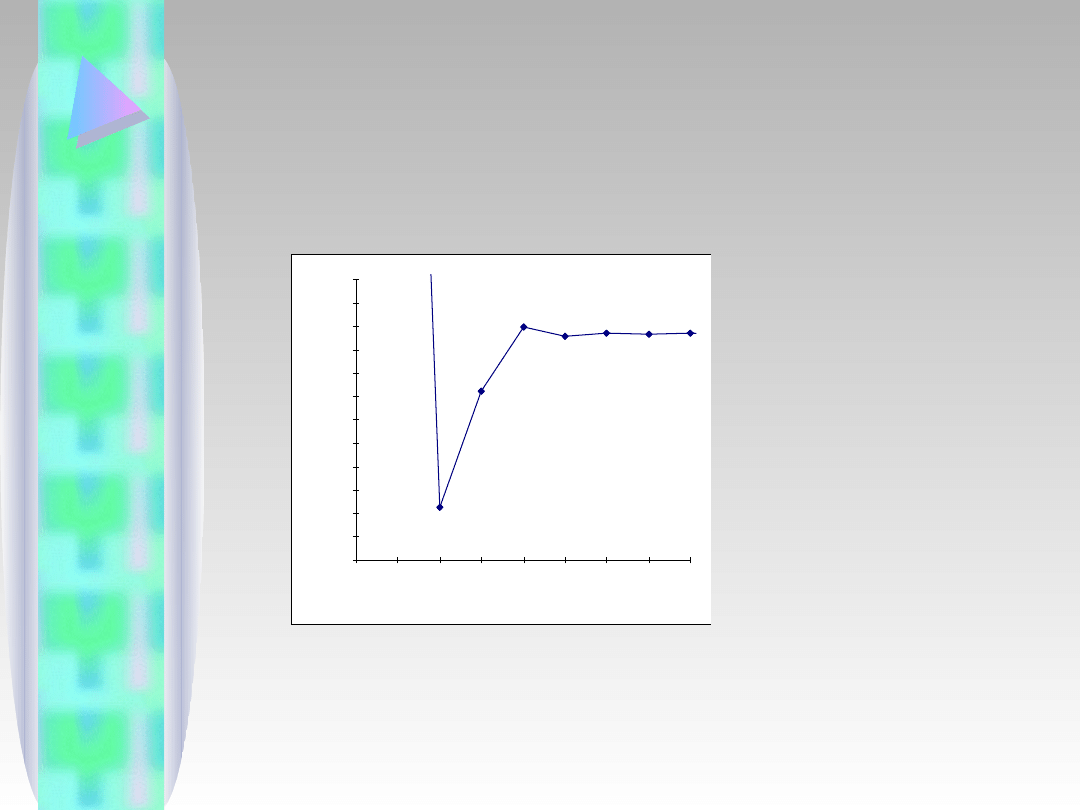
19
Zastosowania metody iteracyjnej w
obliczeniach chemicznych
Już po 28 iteracjach wynik jest dokładny na 10.
miejscu po przecinku (x=1.9345632108).
Zwróćmy uwagę na oscylacje rozwiązań wokół
wartości dokładnej. Nie zawsze tak jest (iteracje
mogą być zbieżne jednostronnie lub nie być w
ogóle zbieżnymi). Zbieżność trzeba sprawdzić!
0.0
0.2
0.4
0.6
0.8
1.0
1.2
1.4
1.6
1.8
2.0
2.2
2.4
0
1
2
3
4
5
6
7
8
nr iteracji
w
a
rt
o
œ
æ
x

20
Zastosowania metody iteracyjnej w
obliczeniach chemicznych
W
obliczeniach
analitycznych
metody
iteracyjne szczególnie nadają się do
rachunków związanych z równowagami
kompleksowania.
Zadanie:
Do 1 dm
3
0.01 M roztworu
Sn(NO
3
)
2
dodano 0.05 moli KCl. Oblicz
rozkład kompleksów chlorkowych cyny.
log
1
=1.5,
log
2
=2.2,
log
3
=2.0,
log
4
=1.5.
1
=31.62,
2
=158.5,
3
=100.0,
4
=31.62)
Reakcje uboczne pomiń.

21
Zastosowania metody iteracyjnej w
obliczeniach chemicznych
Rozwiązanie analityczne, mocno przybliżone:
Załóżmy, że tworzą się głównie kompleksy SnCl
+
(będzie to zaraz widoczne). Gdyby to była prawda,
to stężenie wolnych jonów chlorkowych powinno
wynosić [L]=0.05-0.01=
0.04
. Podstawiamy tę
wartość do wyrażeń na ułamki molowe form:
0
=1/(1 + 1.2648 + 0.2536 + 0.0064 + 0.000081) =
0.396
1
=0.501,
2
=0.100,
3
=0.00253,
4
=0.0000321
Widać,
że
wprawdzie
rzeczywiście
przeważa
kompleks SnCl
+
, ale wolnej formy Sn
2+
jest
niewiele mniej. Stawia to pod niejakim znakiem
zapytania nasze założenie i użytą wartość [L]=0.04
M.

22
Zastosowania metody iteracyjnej w
obliczeniach chemicznych
Rozwiązanie iteracyjne:
Niech założenie że tworzą się wyłącznie kompleksy
SnCl
+
([L]=0.05-0.01=0.04)
będzie
naszym
„zerowym x-em”. Obliczenia z poprzedniego
rozwiązania, dające
0
=0.396,
1
=0.501,
2
=0.100,
3
=0.00253,
4
=0.0000321, pozwalają udokładnić
[L]:
[L]=0.05-
(0.501+2*0.100+3*0.00253+4*0.0000321)*0.01
[L]=
0.0429
Widać, że wprawdzie rzeczywiście przeważa kompleks
SnCl
+
, ale wolnej formy Sn
2+
jest niewiele mniej.
Stawia to pod niejakim znakiem zapytania nasze
założenie i użytą pierwotnie wartość [L]=0.04 M.

23
Zastosowania metody iteracyjnej w
obliczeniach chemicznych
Do następnego etapu bierzemy więc [L]=0.0429,
otrzymując:
0
=0.376,
1
=0.511,
2
=0.110,
3
=0.00297,
4
=0.0000404
Różnica nie jest wielka (w tym wypadku). Powtórzmy
obliczenia jeszcze raz, na wszelki wypadek:
[L]=0.05-(0.511+2*0.110+3*0.00297+4*0.0000404)*0.01
[L]=0.0426
co daje
0
=0.378,
1
=0.510,
2
=0.109,
3
=0.00293,
4
=0.0000397 oraz [L]=
0.0426
.
Na żądanym poziomie dokładności (tutaj trzy cyfry
znaczące) obliczenia można zakończyć.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
KOMPLEKSY POLAKOW wykl 29 03 2012
pytania nowe komplet
zwiazki kompleksowe 2
8 kompleksy
W19 kompleksonometria, wska«niki i krzywe miareczkowania kompleks i
Bliskowschodni kompleks bezpieczeństwa Przyczyny destabilizacji w regionie
Kompleksowa ocena geriatryczna
Komplementarnosc
Kompleksowa rozgrzewka z pilkam Nieznany
Kompleksowa rozgrzewka z pilkam Nieznany (2)
ModulIII cz3 kompleksy i osady Nieznany
Metody kompleksowego zarządzania jakością karty kontrolne
dok po wypadku komplet, polec pow
transport zywnosci, Transport Polsl Katowice, 5 semestr, TPD, Komplet
Procedury check in i check out oraz kompleksowa obsługa, powtórki do egzaminów
Laborki 5 zadania kompleksy
więcej podobnych podstron