
Chemia organiczna
Wykład 15
Biocząsteczki: aminokwasy i
peptydy,
lipidy i cukry
Aminokwasy
Związki dwufunkcyjne zawierające:
grupę kwasową (grupa karboksylowa -COOH
i
grupę zasadową ( aminową -NH
2
)
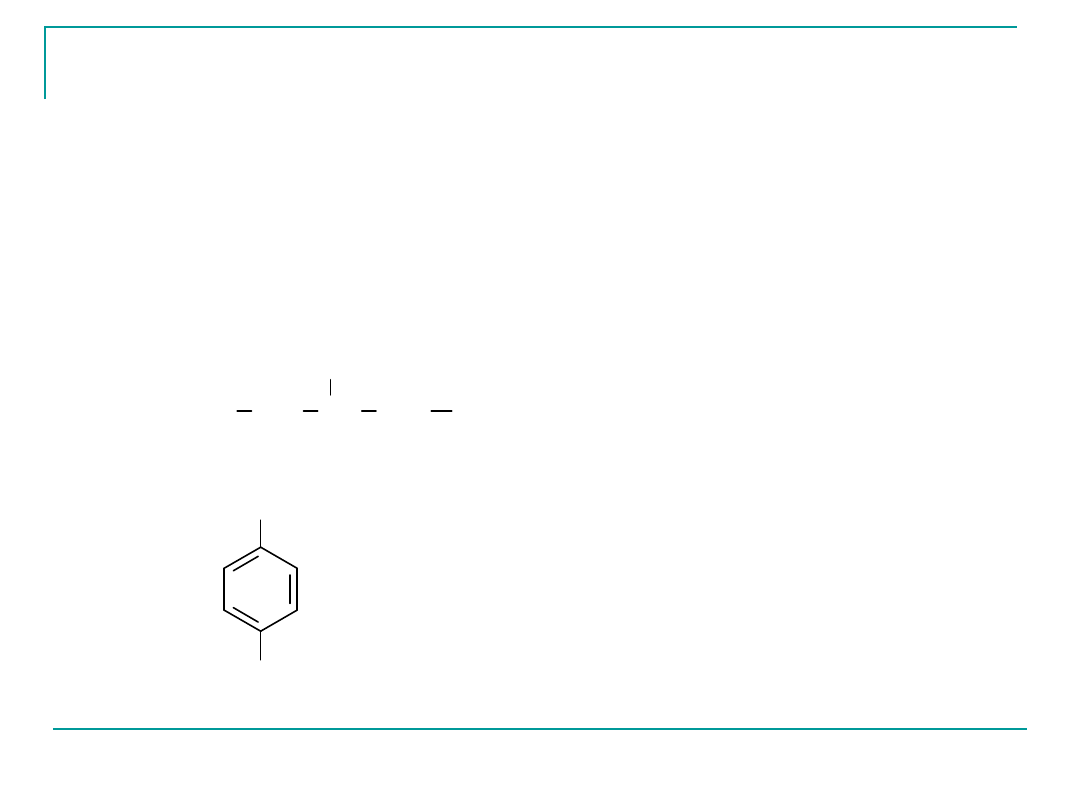
1
2
3
4
5
CH
3
CH
2
CH CH
2
COOH
NH
2
kwas 3-aminopentanowy
(kwas -aminopentanowy)
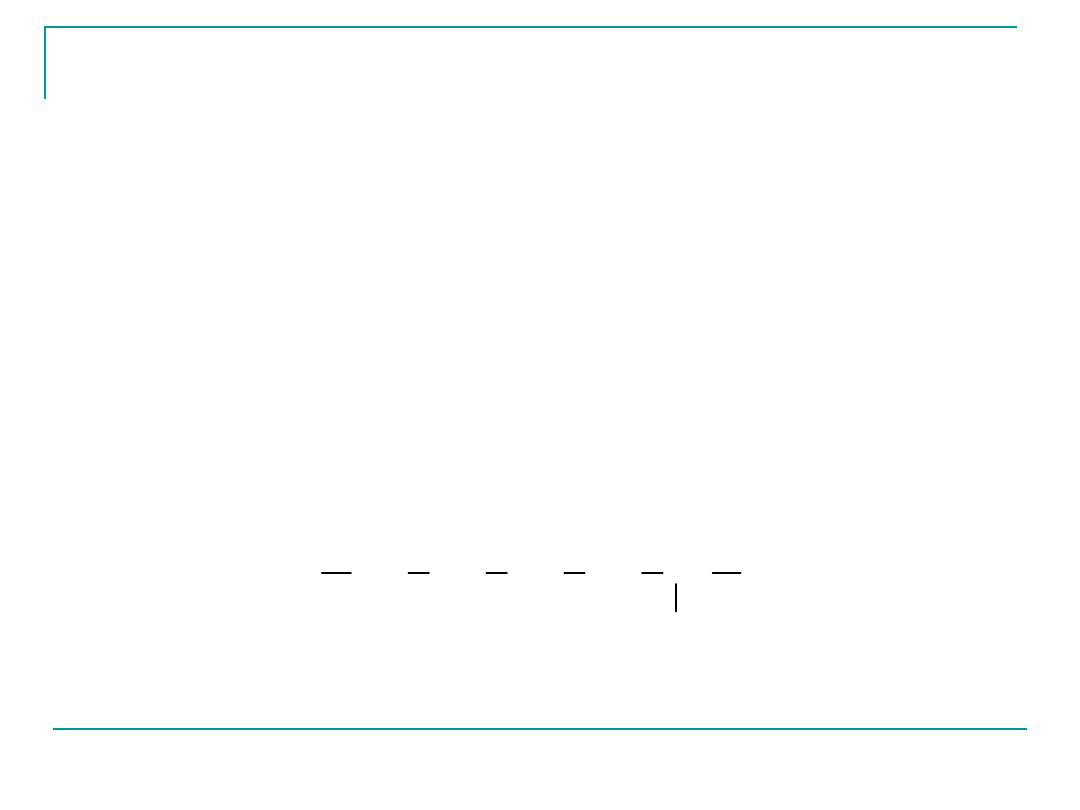
COOH
NH
2
kwas para-aminobenzoesowy
Aminokwasy w znaczeniu potocznym- kwasy karboksylowe
posiadające grupę aminową w położeniu α (czyli przy
sąsiednim węglu) w stosunku do grupy karboksylowej.
Aminokwasy (α-aminokwasy) występują w przyrodzie w
postaci wolnej lub w postaci związków o budowie
polimerycznej (peptydy, białka).
Dotychczas poznano około 200 aminokwasów, jednak
zaledwie 20 z nich zaliczane jest do tzw. aminokwasów
białkowych.
Αminokwasy występujące w przyrodzie to głównie α-
aminokwasy.
R CH
2
CH
2
CH
2
CH
2
CH COOH
NH
2
1
2
3
4
5
6
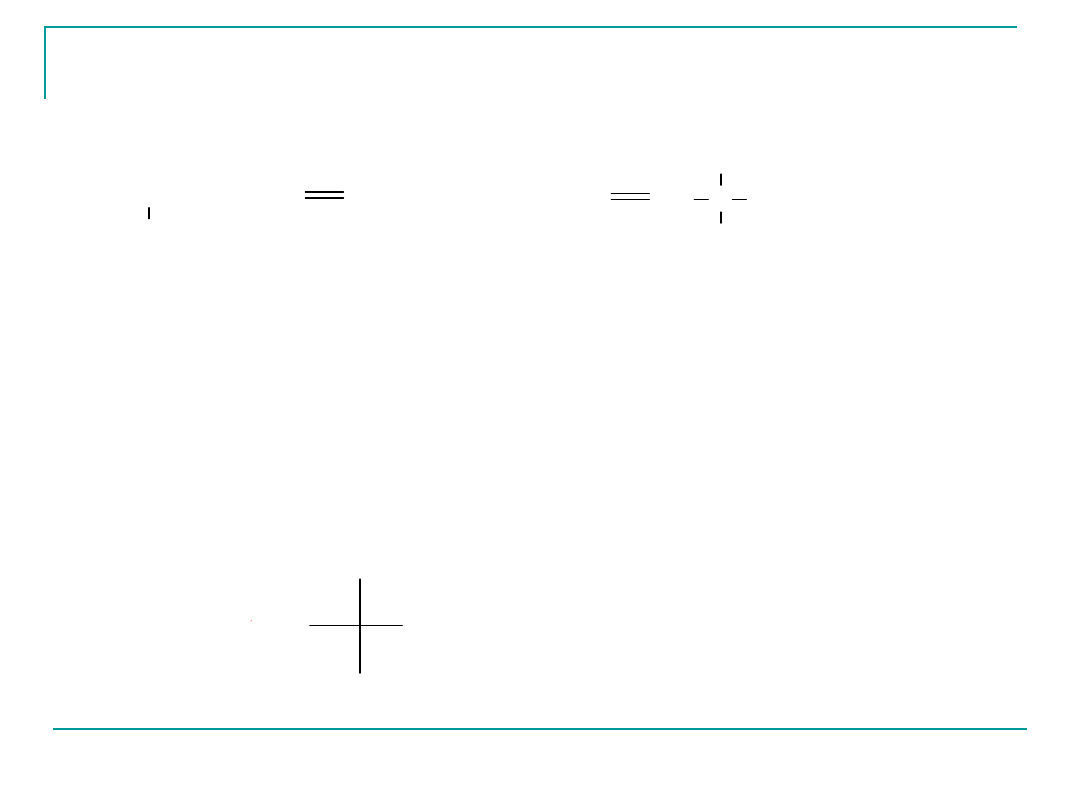
Najprostszym aminokwasem występującym w organizmach
żywych jest glicyna, czyli kwas aminooctowy (aminoetanowy)
Węgiel C α jest pozostałych białkowych aminokwasach
centrum chiralności, czyli jest to atom C posiadający cztery
różne podstawniki (za wyjątkiem glicyny wszystkie
pozostałe aminokwasy są optycznie czynne).
W przyrodzie większość aminokwasów to L-aminokwasy:
COOH
R
H
2
N
H
CH
2
COOH
NH
2
H
2
N
-
CH
2
COOH
C
NH
2
COOH
H
H
kwas aminoetanowy = kwas aminooctowy = glicyna (Gly)
L-aminokwas
grupa NH
2
we wzorze Fischera
przy węglu sąsiednim do
grupy kwasowej -COOH
po lewej stronie
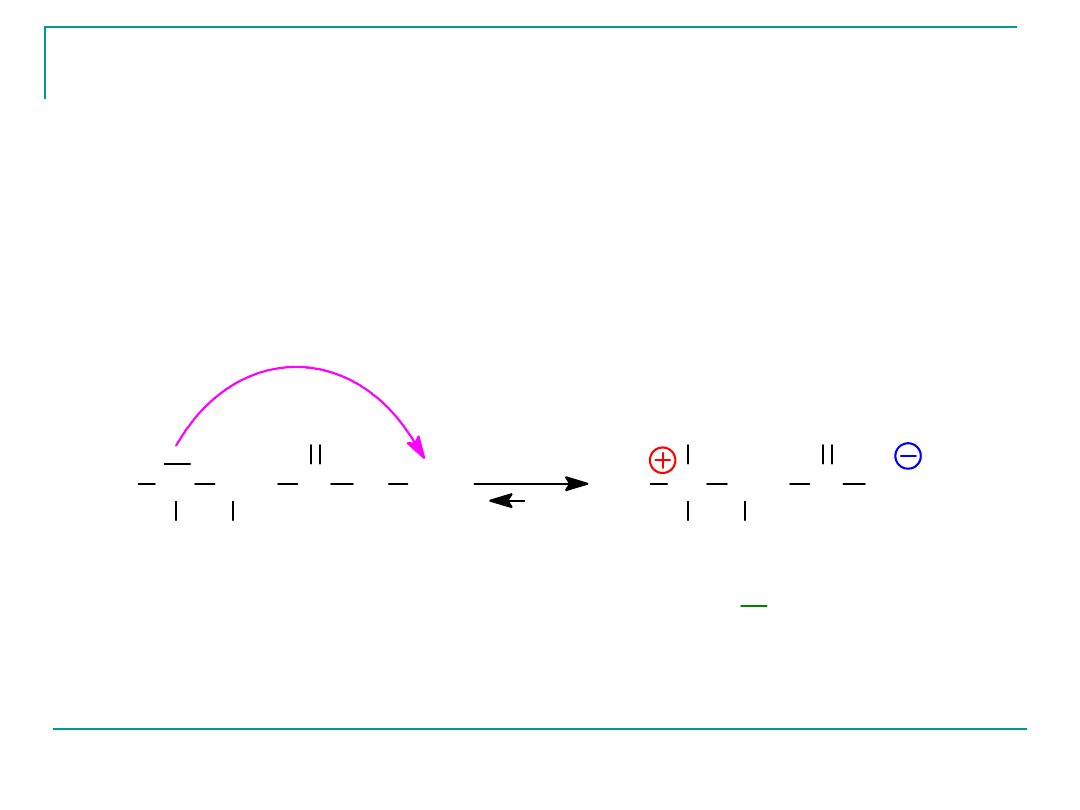
Ponieważ aminokwasy zawierają zarówno grupę kwasową,
jaki i zasadową, ulegają one wewnątrzcząsteczkowej reakcji
kwas-zasada i występują głównie w formie jonu dipolowego
albo obojnaczego (lub Zwitterjonu)- czyli inaczej mówiąc
soli wewnętrznej
N
H
H
CH
R
C
O
O
H
N
H
H
H
CH
R
C
O
O
jon obojnaczy
"Zwitterjon"
Grupa NH
2
jest akceptorem protonu , grupa COOH donorem protonu

Jony obojnacze aminokwasów są rodzajem wewnętrznych
soli
i dlatego charakteryzują się wieloma właściwościami
fizycznymi
typowymi dla soli.
Mają duże momenty dipolowe, są rozpuszczalne w wodzie,
ale nierozpuszczalne w węglowodorach,
są substancjami krystalicznymi o wysokich temperaturach
topnienia.
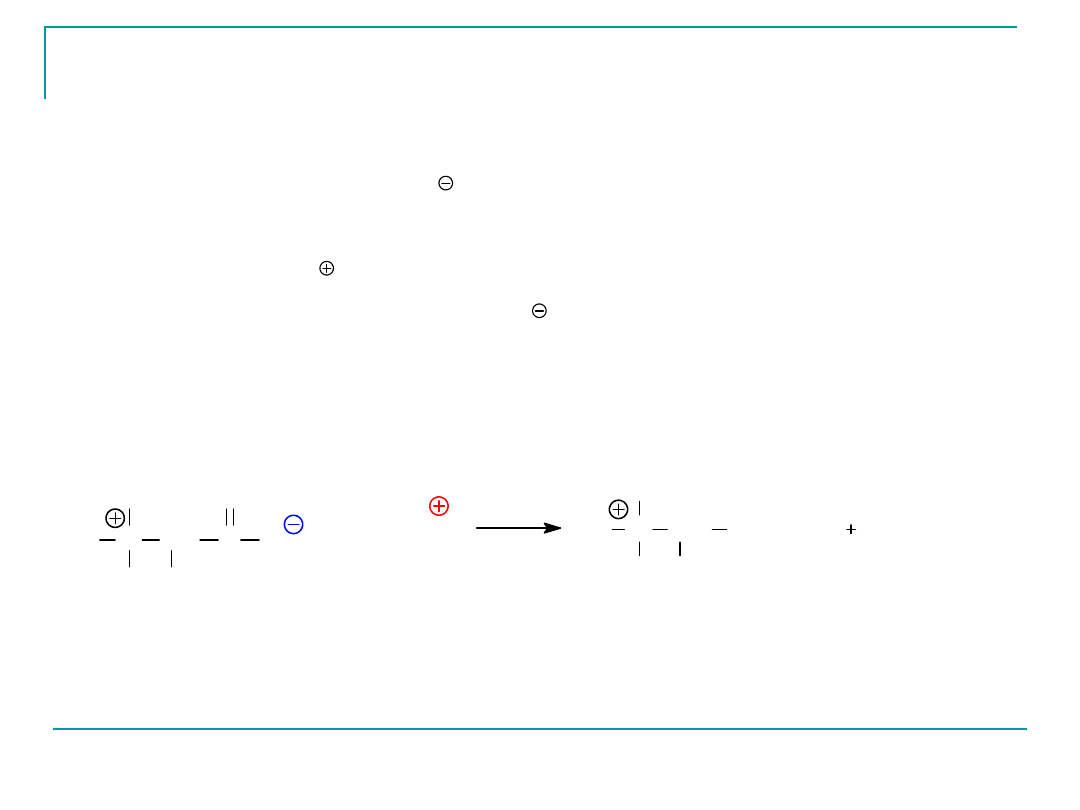
W pH osocza krwi ( pH 7,4) czy przestrzeni śródkomórkowej
(pH 7,1)
grupy karboksylowe istnieją prawie całkowicie jako
jony karboksylowe -COO
a większość grup aminowych (przy Cα) występuje w formie
protonowanej –NH
3
.
To anion karboksylanowy, -COO , a nie grupa
aminowa działa
jako centrum zasadowe i przyłącza proton w
roztworze
kwaśnym:
N CH
H
H
R
C
O
O
H
jon obojnaczy
+
H
3
O
œrodowisko kwaœne
H N
H
H
CH
R
COO
H
H
2
O
kation
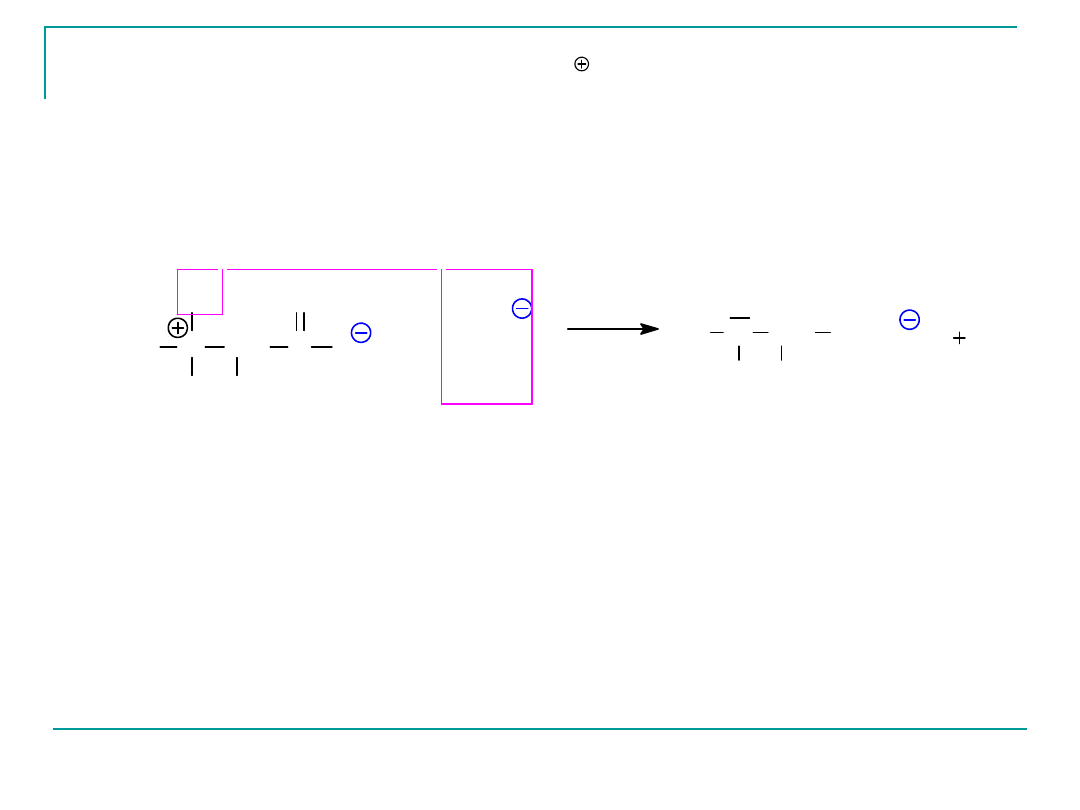
Podobnie, to kation amoniowy, -NH
3
, nie zaś grupa
karboksylowa działa jako centrum kwasowe i oddaje
proton w roztworze zasadowym:
N CH
H
H
R
C
O
O
H
+
OH
H
2
O
jon obojnaczy
H N
H
CH
R
COO
anion
środowisko zasadowe
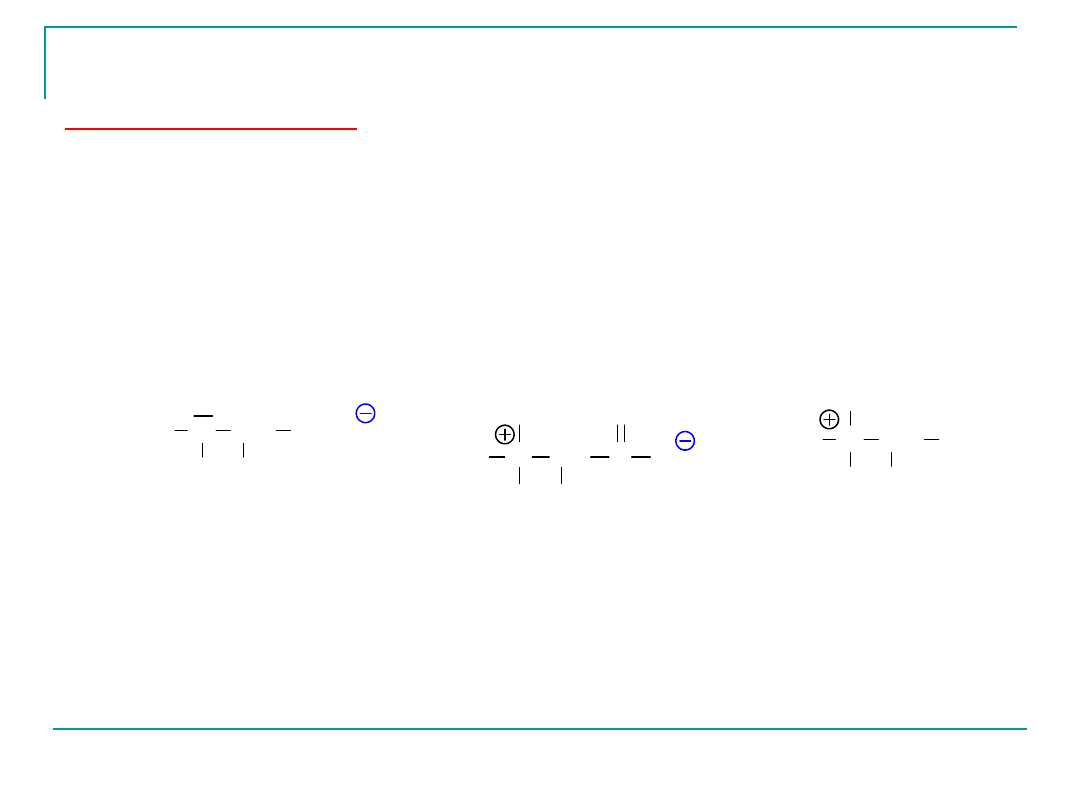
Punkt izoelektryczy pI
to jest takie pH środowiska, w którym
aminokwas, jako cała cząsteczka nie jest obdarzona żadnym
ładunkiem.
kation
H
H N
H
H
CH
R
COO
środowisko kwaśne
jon obojnaczy
N CH
H
H
R
C
O
O
H
środowisko zasadowe
anion
H N
H
CH
R
COO
pH = pI
(np.pH = 10)
(np. pH =2)
Dla aminokwasu obojêtnego

Aminokwasy białkowe :
Aminokwasy obojętne
Glicyna
Gly
G
pI 5,97
NH
2
1
2
CH COOH
2
kwas 2-aminoetanowy
Alanina
Ala
A
pI 6,02
NH
2
1
2
CH COOH
CH
3
3
kwas 2-aminopropanowy

Walina
Val
V
pI 5,97
Egzogenny
NH
2
1
2
CH COOH
CH
CH
3
CH
3
3
4
kwas 2-amino-3-metylobutanowy
Leucyna LeuL
pI 5,98
Egzogenny
NH
2
1
2
CH COOH
CHCH
2
CH
3
CH
3
3
4
5
kwas 2-amino-4-metylopentanowy
Izoleucyna
Ile I
pI 6,02
Egzogenny
NH
2
1
2
CH COOH
CH
CH
2
CH
3
3
4
5
CH
3
kwas 2-amino-3-metylopentanowy
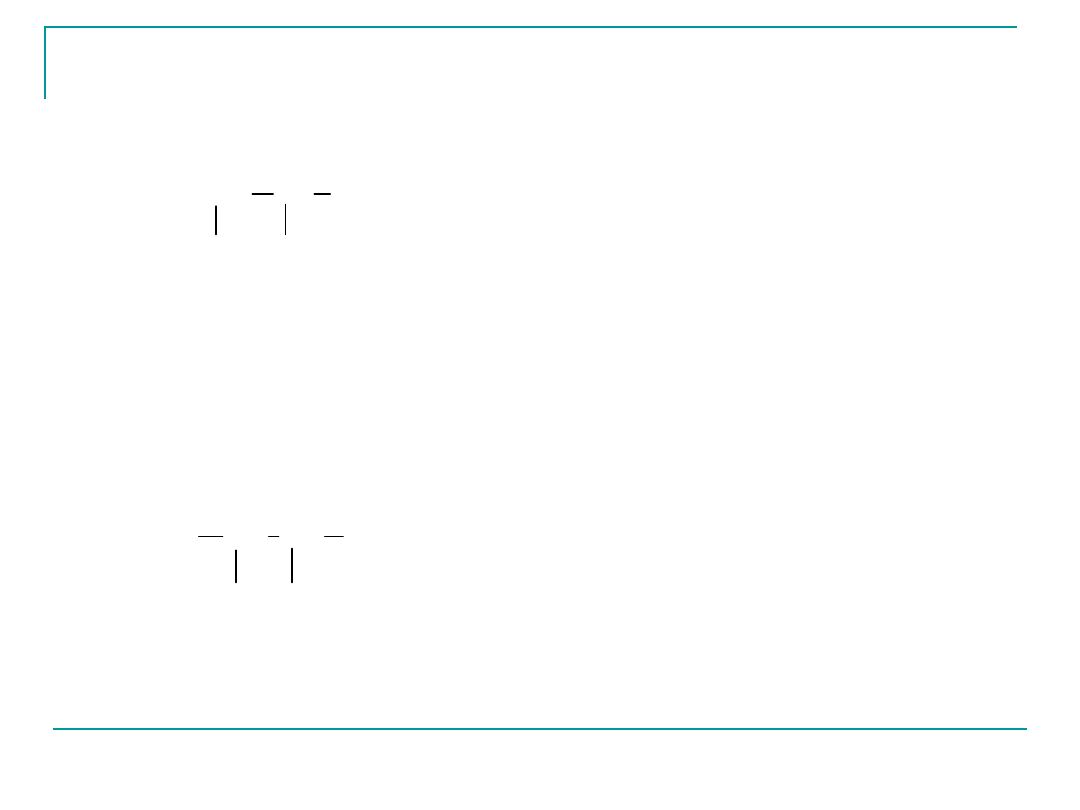
Aminokwasy obojętne zawierające grupę
hydroksylową
Seryna Ser
S
pI 5,68
NH
2
1
2
CH COOH
CH
2
3
OH
kwas 2-amino-3-hydroksypropanowy
pK
3
= ~13
Treonina
Thr
T
pI 5,60
Egzogenny
NH
2
1
2
CH COOH
CH
CH
3
3
OH
4
kwas 2-amino-3-hydroksybutanowy
pK
3
= ~13

Aminokwasy obojętne zawierające siarkę:
Cysteina Cys
C
pI 5,07
NH
2
1
2
CH COOH
CH
3
2
SH
kwas 2-amino-3-merkaptopropanowy
Metionina
Met M
pI 5,75
Egzogenny
NH
2
1
2
CH COOH
CH
CH
2
S
CH
3
3
2
4
kwas 2-amino-4-metylotiobutanowy
Aminokwasy obojętne zawierające drugorzędowy
(dwupodstawiony) atom azotu:
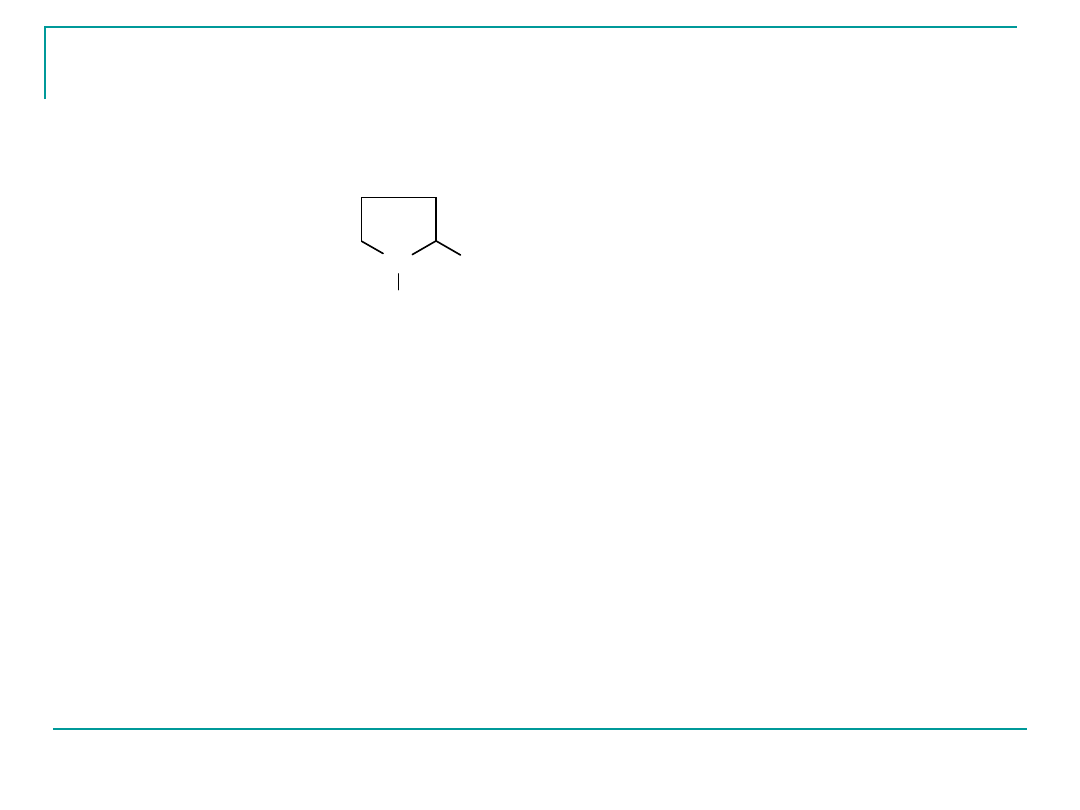
Prolina
Pro
P
pI 6,30
N
H
COOH
1
2
nie daje pozytywnego wyniku reakcji z ninhydryną
Aminokwasy obojętne zawierające układ
aromatyczny lub heteroaromatyczny:
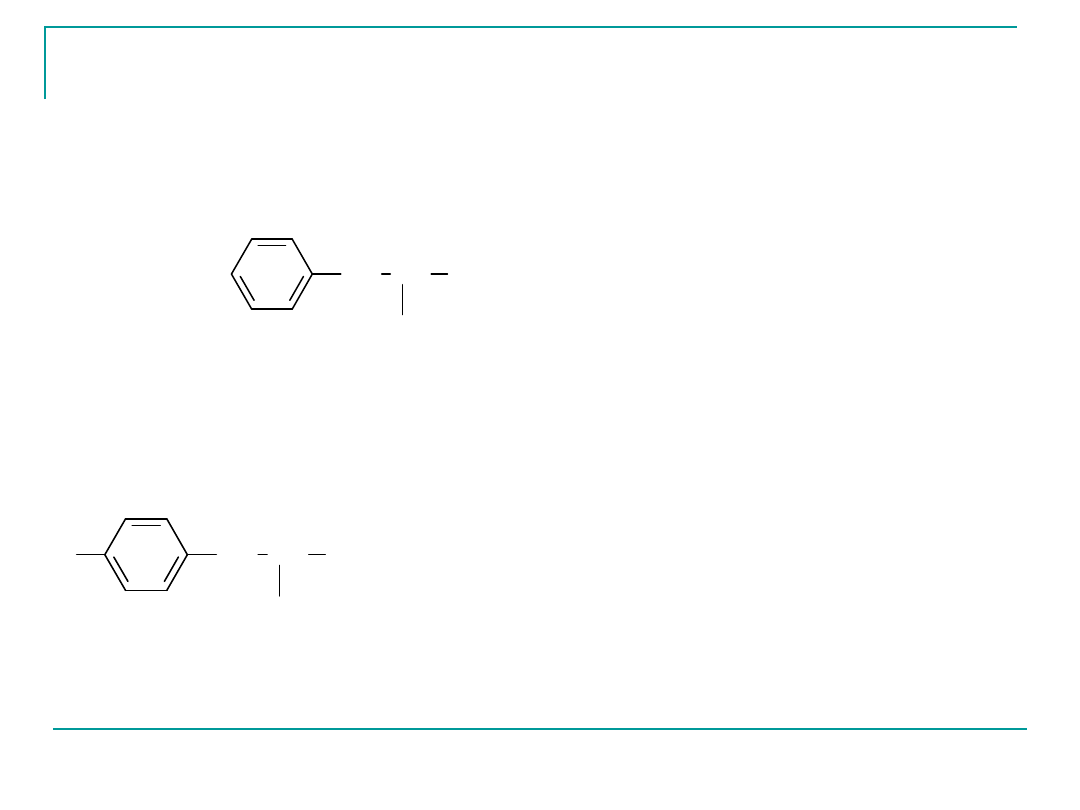
Fenyloalanina Phe F
pI 5,48
Egzogenny
NH
2
1
2
CH COOH
CH
3
2
kwas 2-amino-3-fenylopropanowy
Tyrozyna Tyr
Y
pK
3
= 10,1 pI 5,65
NH
2
1
2
CH COOH
CH
HO
3
2
kwas 2-amino-3-(4'-hydroksyfenylo)propanowy
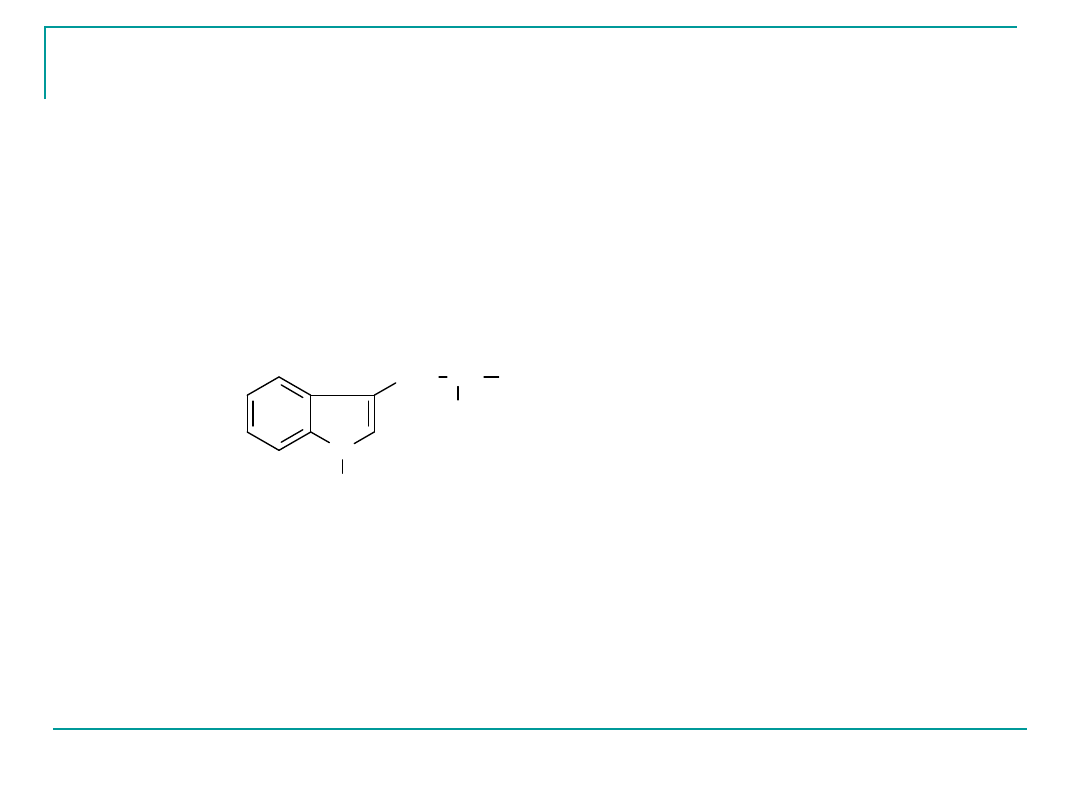
Tryptofan
Trp
W
pI 5,88
Egzogenny
N
H
CH
2
CH
NH
2
COOH

Aminokwasy kwasowe:
Kwas asparaginowy Asp D
pI 2,87
HOOC CH
2
CH
NH
2
COOH
1
2
3
4
kwas 2-aminobutanodiowy
Kwas glutaminowy Glu E pI 3,22
HOOC CH
2
CH
2
CH
NH
2
COOH
1
2
3
4
5
kwas 2-aminopentanodiowy

Aminokwasy zasadowe:
Lizyna Lys
K
pI 9,74
H
2
N CH
2
CH
2
CH
2
CH
2
CH COOH
NH
2
1
2
3
4
5
6
H
2
N (CH
2
)
4
CH
NH
2
COOH
inaczej:
kwas 2,6-diaminoheksanowy
Arginina
Arg R
pI 10,76
Aminokwas niezbędny dla młodych rozwijających się
organizmów
H
2
N C NH
NH
(CH
2
)
3
CH
NH
2
COOH
Histydyna
HisH
pI 7,64
Aminokwas niezbędny dla
młodych
rozwijających się
organizmów
N
N
H
CH
2
CH
NH
2
COOH

Aminokwasy egzogenne
, to takie , które nie są syntezowane
przez organizm ludzki i muszą być dostarczone (w formie gotowej)
z pożywieniem.
W budowie białek biorą także udział dodatkowe aminokwasy
hydroksyprolina i hydroksylizyna powstające w wyniku hydroksylacji
proliny i lizyny.
Cysteina natomiast tworzy z drugą cząsteczką tego samego
aminokwasu połączenie (mostek disiarczkowy(–S─S−), tworząc w ten
sposób cząsteczkę cystyny.
Poza aminokwasami białkowymi w organizmach żywych spotykamy
inne aminokwasy pełniące funkcje metaboliczne (np. tyroksyna-
prekursor hormonów tarczycy, lub 3,4-dihydroksyfenyloalanina-
tzw.DOPA prekursor dopaminy) a także β-alanina (kwas 3-
aminopropanowy), składnik koenzymu A.

N
H
COOH
HO
1
2
hydroksyprolina
H
2
N CH
2
CH CH
2
CH
2
CH COOH
NH
2
OH
1
2
3
4
5
6
hydroksylizyna
S
S
CH
2
CHCOOH
NH
2
CH
2
CHCOOH
NH
2
cystyna
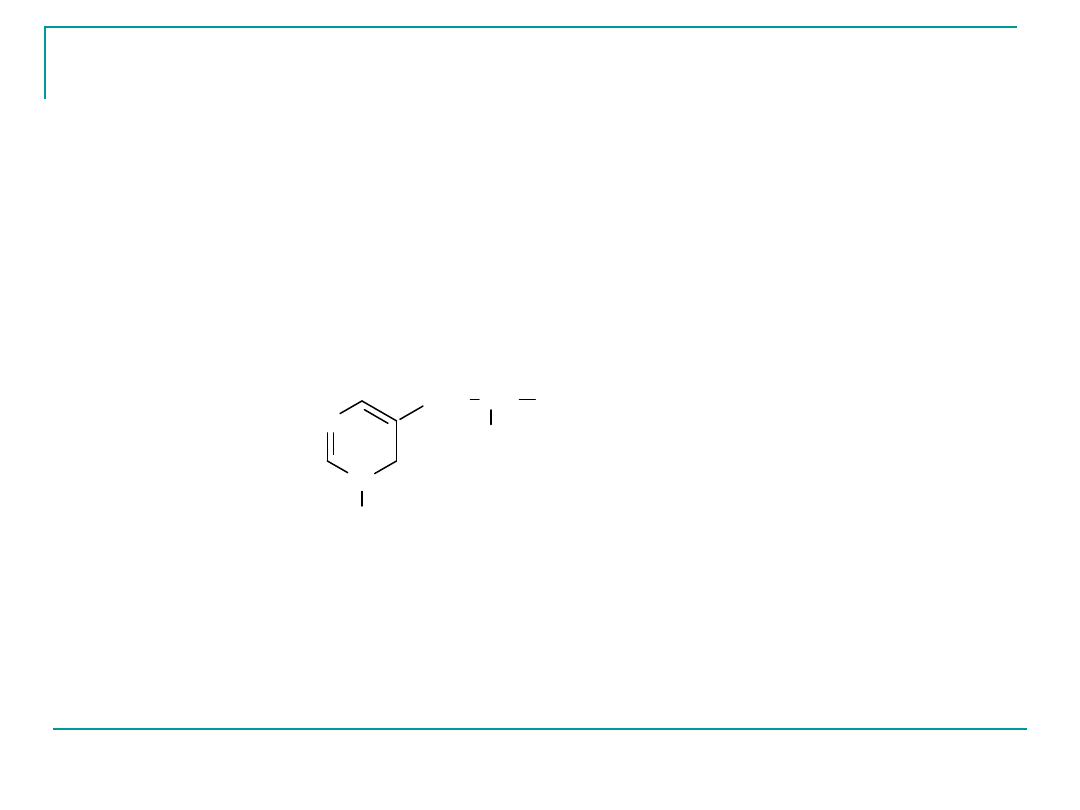
O
CH
2
CHCOOH
NH
2
HO
I
I
I
I
tyroksyna
OH
OH
CH
2
CHCOOH
NH
2
DOPA (3,4-dihydroksyfenyloalanina)
CH
2
CH
2
COOH
NH
2
kwas 3-aminopropanowy (-alanina)

Budowa i nomenklatura peptydów
Najważniejszą reakcją chemiczną aminokwasów jako
związków
dwufunkcyjnych przebiegającą z jednoczesnym
wykorzystaniem obu
grup funkcyjnych (pochodzących od dwóch aminokwasów)
jest reakcja
tworzenia wiązania amidowego
−CO─NH−
zwanego
wiązaniem
peptydowym.
W wyniku tej reakcji powstają związki polimeryczne - zwane
peptydami. Jeżeli połączone zostają dwa aminokwasy powstaje
dipeptyd, z trzech aminokwasów tripeptyd itd.
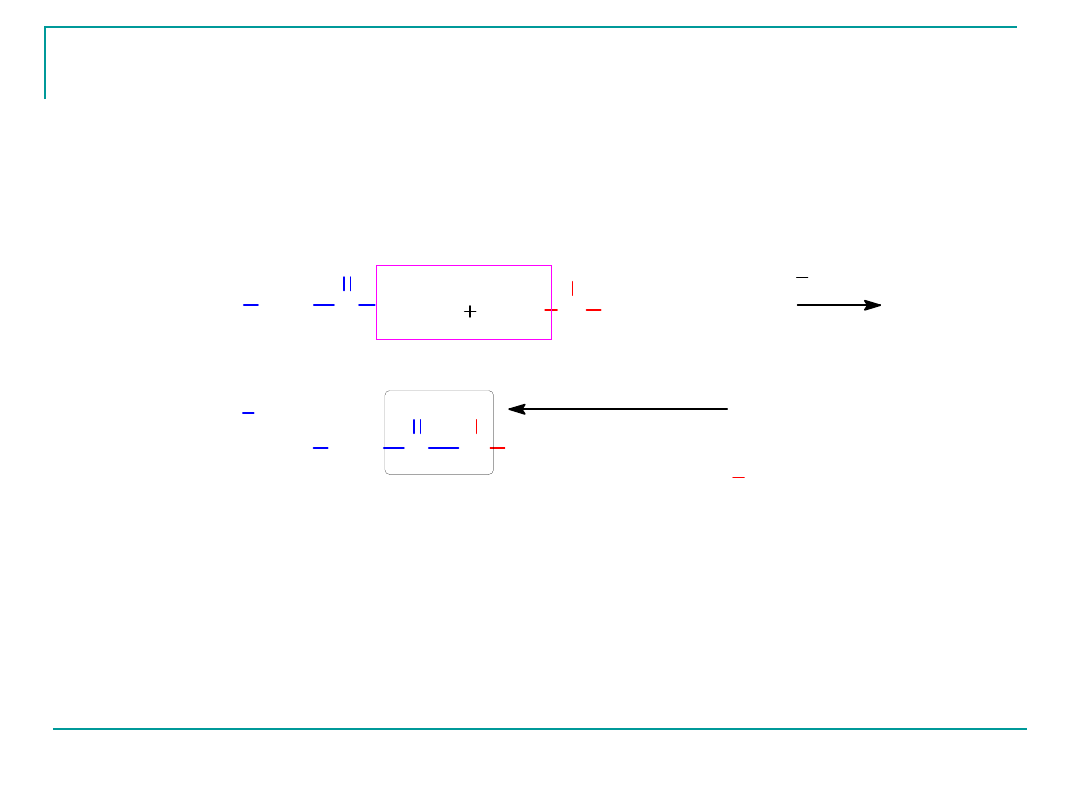
Tworzenie wiązania peptydowego – reakcja
grupy karboksylowej jednego aminokwasu i
grupy aminowej
drugiego aminokwasu
H
2
N CH
2
C
O
OH
N
H
H
CH
2
COOH
Gly
Gly
H
2
O
H
2
N CH
2
C
O
N
H
CH
2
COOH
(glicyloglicyna)
wi¹ zanie peptydowe
(amidowe)
aminokwas N koñcowy
aminokwas C koñcowy
dipeptyd Gly-Gly
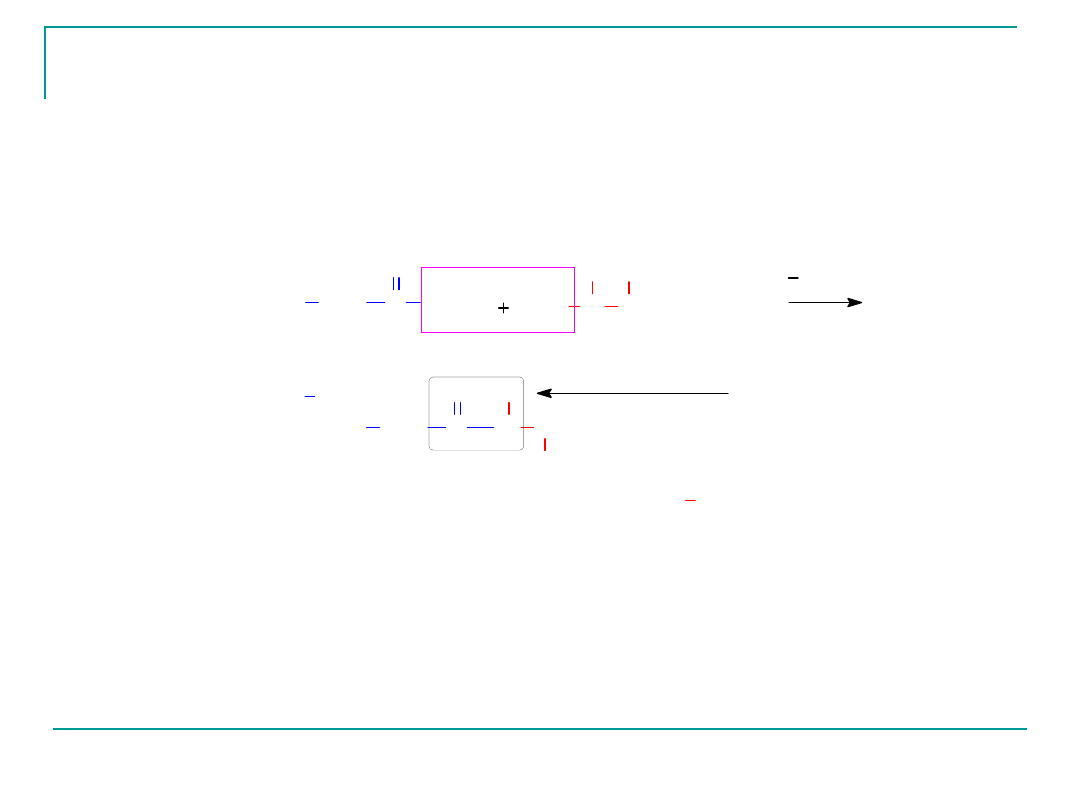
W przypadku obecności w mieszaninie reakcyjnej
dwóch aminokwasów np.:
L-alaniny (Ala) i glicyny (Gly) możliwe jest
powstanie czterech dipeptydów:
H
2
N CH
2
C
O
OH
N
H
H
CHCOOH
CH
3
Gly
H
2
O
H
2
N CH
2
C
O
N
H
CHCOOH
CH
3
wiązanie peptydowe
(amidowe)
aminokwas N końcowy
aminokwas C końcowy
Ala
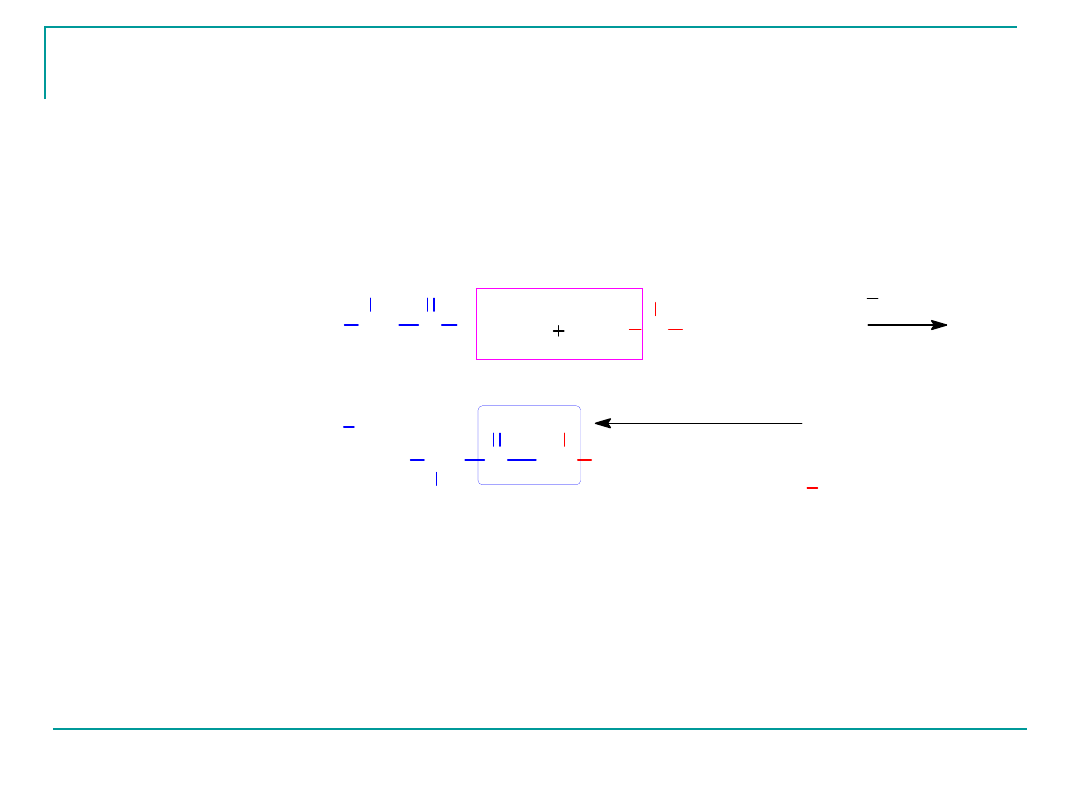
Dipeptyd Gly-Ala
Ten dipeptyd zbudowany jest z obu aminokwasów –
aminokwas N- końcowy –glicyna
Aminokwas C-końcowy- alaniana
H
2
N CH C
O
OH
CH
3
N
H
H
CH
2
COOH
Gly
H
2
O
H
2
N CH C
O
CH
3
N
H
CH
2
COOH
wiązanie peptydowe
(amidowe)
aminokwas N końcowy
aminokwas C końcowy
Ala
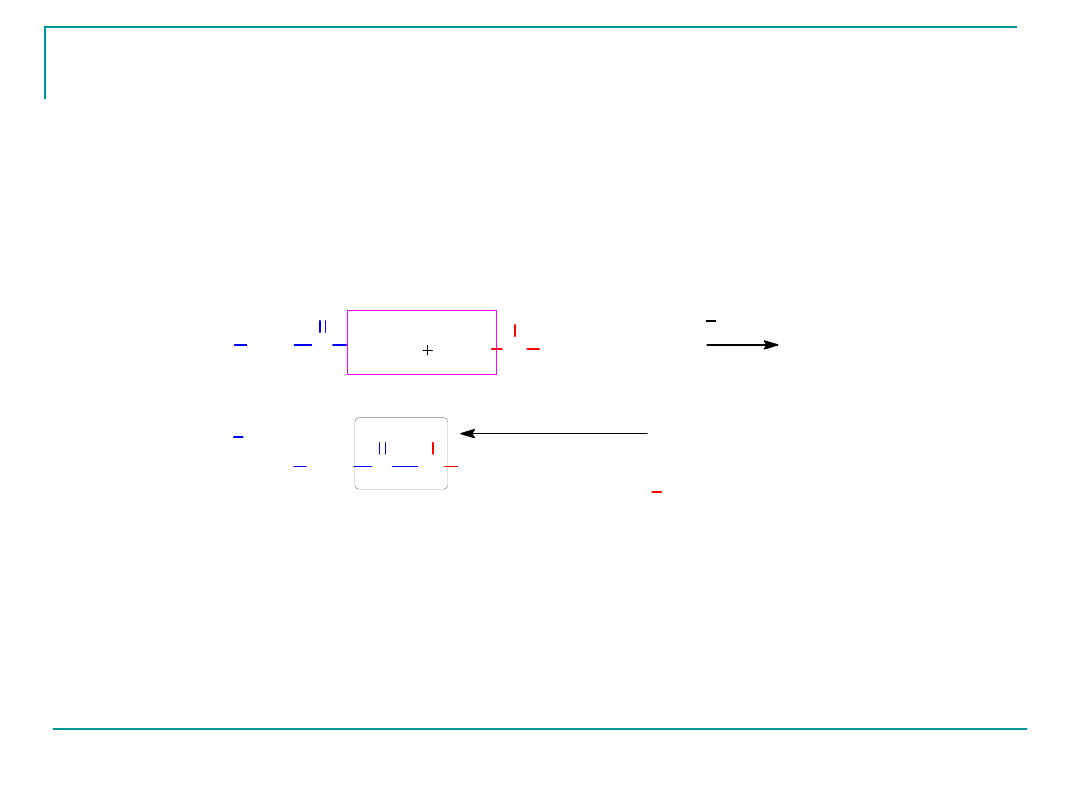
Dipeptyd Ala-Gly
Ten dipeptyd zbudowany jest z obu aminokwasów –
aminokwas N- końcowy –alanina
Aminokwas C-końcowy- glicyna
H
2
N CH
2
C
O
OH
N
H
H
CH
2
COOH
Gly
Gly
H
2
O
H
2
N CH
2
C
O
N
H
CH
2
COOH
(glicyloglicyna)
wi¹ zanie peptydowe
(amidowe)
aminokwas N koñcowy
aminokwas C koñcowy
dipeptyd Gly-Gly
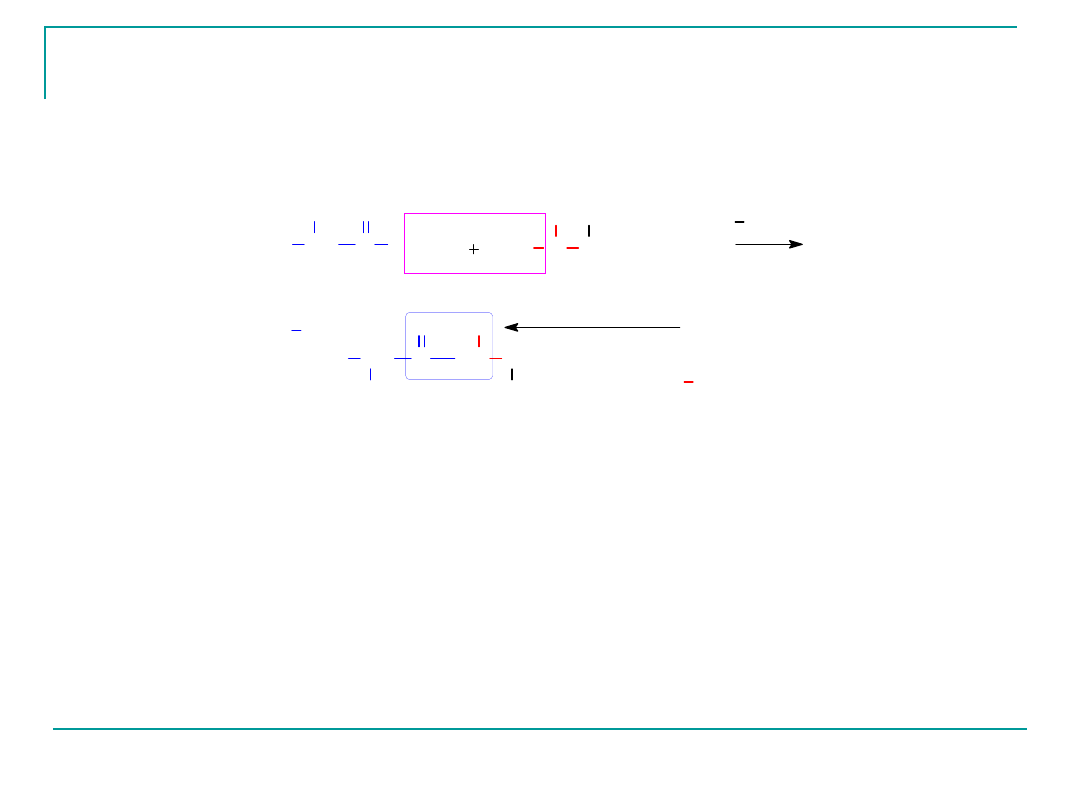
Dipeptyd Gly-Gly
Ten dipeptyd składa się tylko z dwóch cząsteczek glicyny,
która jest aminokwasem N – końcowym i C-końcowym
H
2
N CH C
O
OH
CH
3
N
H
H
CHCOOH
CH
3
H
2
O
H
2
N CH C
O
CH
3
N
H
CHCOOH
CH
3
wiązanie peptydowe
(amidowe)
aminokwas N końcowy
aminokwas C końcowy
Ala
Ala
Ala-Ala
Ten dipeptyd składa się tylko z dwóch cząsteczek alaniny,
która jest aminokwasem N – końcowym i C-końcowym

Kolejność połączenia aminokwasów nosi nazwę
sekwencji
aminokwasów.
AlaGly to nie to samo co GlyAla

Tripeptydy
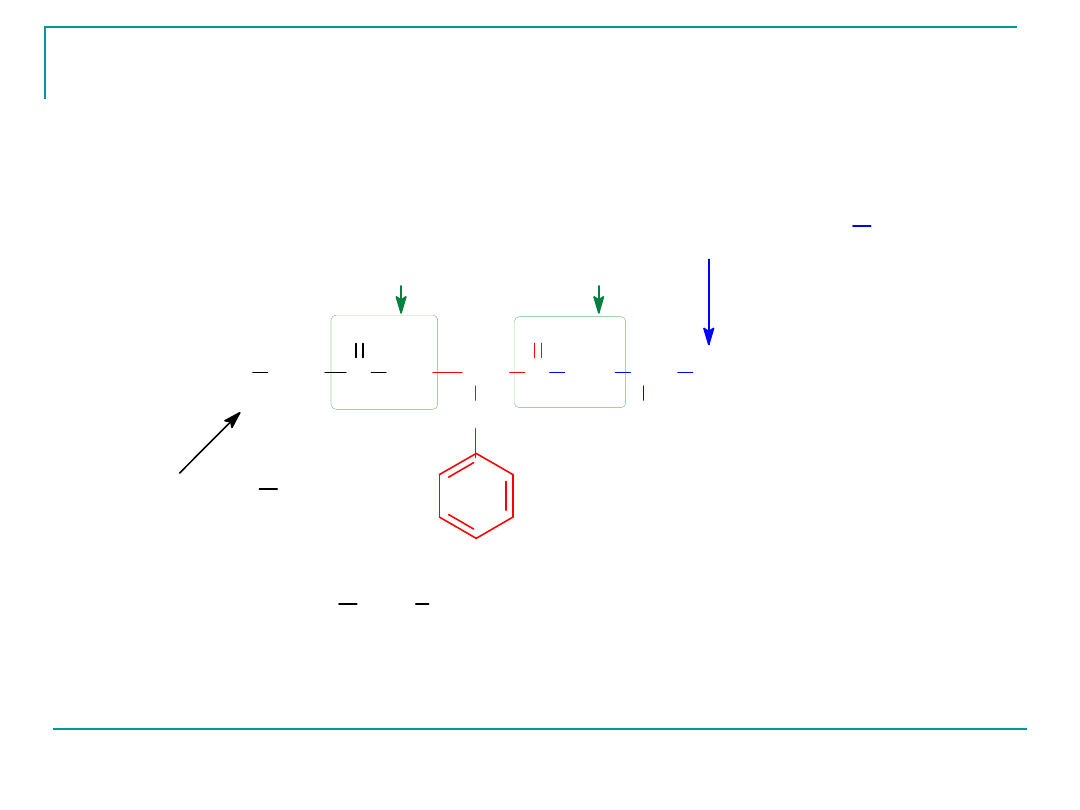
Tripeptyd zbudowany z trzech L-aminokwasów Gly-Phe-Cys
może mieć również kilka sekwencji aminokwasów,
poniżej podano tripeptyd, którego
aminokwasem N-końcowym (aminokwas ten umieszcza
sie po lewej stronie zapisu wzoru) jest glicyna
a C-końcowym- cysteina (aminokwas ten znajduje się po
prawej stronie zapisu wzoru).
Na wzorze w ramkach ujęto wiązania peptydowe:
H
2
N CH
2
C
O
NH CH
CH
2
C
O
NH CH
CH
2
SH
COOH
aminokwas N koñcowy
aminokwas C koñcowy
Tripeptyd Gly Phe Cys (Glicylofenyloalanylocysteina)
wiazania peptydowe

W celu ustalenia budowy peptydu konieczna jest znajomość
nie tylko
końcowych aminokwasów, lecz również kolejność ich
połączenia, czyli
sekwencja aminokwasów.

Podział peptydów i ustalanie ich budowy
Peptydy dzielą się na:
oligopeptydy (do 10 aminokwasów)
polipeptydy (od 11-100 aminokwsów)
białka (masa molowa powyżej 10
000g/mol)

Białka
Klasyfikacja białek
Białka proste – te które w wyniku hydrolizy dają jedynie
aminokwasy
Białka złożone – dają po hydrolizie także inne związki
(np.:węglowodany, tłuszcze, kwasy nukleinowe)
Zależnie od ich trójwymiarowej postaci
Białka fibrylarne (włókienkowe) – składają się z łańcuchów
polipeptydowych ułożonych obok siebie w długie włókna
( kolagen, keratyna).
Ponieważ te białka są odporne i nierozpuszczalne w wodzie, są
one w naturze wykorzystane do budowy tkanek konstrukcyjnych
(ścięgna, kopyta, rogi, mięśnie)
Białka globularne (kłębuszkowe) – zwykle są zwinięte w
zwarty, w przybliżeniu kulisty kształt.
Białka te są zasadniczo rozpuszczalne w wodzie i swobodnie
przemieszczają się w obrębie komórki.
Większość ( z ~2000) znanych enzymów jest globularna.

Struktura białek
Struktura pierwszorzędowa –
sekwencja aminokwasów
Oprócz kolejności aminokwasów w łańcuchu
peptydowym istotną cechą charakterystyczną
białek i polipeptydów jest budowa ich
przestrzenna wpływająca na funkcje biologiczne
białek i polipeptydów.

Lipidy
Związki naturalne, zróżnicowana budowa, podobieństwo cech
fizycznych nierozpuszczalne w H
2
O, rozpuszczalne w
niepolarnych
i słabo polarnych rozpuszczalnikach organicznych (np. eter
dietylowy,
chloroform, benzen).
Podział lipidów
lipidy
steroidy
izoprenoidy
t³uszcze
woski
fosofolipidy
odmienna budowa
w prównaniu
z t³uszczami
fosfolipidami
i woskami
(gr. lipos = t³uszcz)
prostaglandyny
prostacykliny
i

Podział lipidów
Lipidy dzieli się na proste i złożone
Lipidy proste: estry kwasów tłuszczowych z różnymi
alkoholami
a) tłuszcze właściwe
– estry kwasów tłuszczowych i jednego
alkoholu – 1,2,3-propanotriolu czyli glicerolu (gliceryna)
stąd ta grupa związków nosi również nazwę glicerydów
(acyloglicerole
)
CH
2
OH
CHOH
CH
2
OH
R'COOH
R"COOH
R'''COOH
CH
2
OCOR'
CHOCOR"
CH
2
OCOR'''
gliceryna
kwasy t³uszczowe
t³uszcz

Tłuszcze właściwe są najbardziej rozpowszechnionymi w
przyrodzie
lipidami.
Stanowią źródło energii i rezerwę pokarmową organizmów
roślinnych
i zwierzęcych (rośliny- nasiona, owoce: zwierzęta- tkanka
podskórna).
Otrzymywanie: wtłaczanie, wytapianie, ekstrakcja.
Kwasy karboksylowe wchodzące w skład tłuszczów – tzw.
kwasy
tłuszczowe,
zawierają prosty łańcuch węglowy (nasycony lub
nienasycony) o parzystej liczbie atomów węgla.
Tłuszcze występujące w stanie płynnym nazywa się olejami
(są to
głównie tłuszcze roślinne, wyjątek np „masło kakaowe”).
Tłuszcze roślinne zawierają zawsze w znaczącym udziale
nienasycone
kwasy tłuszczowe.
Tłuszcze zwierzęce są na ogół stałe (wyjątek np. tłuszcz
wielorybi –
tran) i dominujący udział w ich budowie stanowią mają kwasy
nasycone.
Nazewnictwo kwasów tłuszczowych tworzących
tłuszcze:
nasycone –owy (jak w kwasach karboksylowych) i nazwy
zwyczajowe:
nienasycone -enowy, -polienowy

Przykłady kwasów nasyconych występujących
w tłuszczach
CH
3
(CH
2
)
10
COOH
kwas dodekan
owy
(laurynowy)
CH
3
(CH
2
)
14
COOH = C
15
H
31
COOH kwas heksadekan
owy
(palmitynowy)
CH
3
(CH
2
)
16
COOH = C
17
H
35
COOH kwas oktadekan
owy
(stearynowy)
Kwasy nasycone

Przykłady kwasów nienasyconych
występujących w tłuszczach
CH
3
(CH
2
)
7
CH CH(CH
2
)
7
COOH
kwas oktadec - 9-
enowy
kwas 9 - oktadecenowy (oleinowy)
= C
17
H
33
COOH
Kwasy nienasycone
CH
3
(CH
2
)
4
CH CHCH
2
CH=CH(CH
2
)
7
COOH kwas oktadeka - 9,12 -
dienowy
kwas - 9,12 - oktadekadienowy (linolowy)
= C
17
H
31
COOH
CH
3
CH
2
CH CHCH
2
CH CHCH
2
CH CH(CH
2
)
7
COOH
= C
17
H
29
COOH
kwas oktadeka - 9,12,15 -
trienowy
kwas - 9,12,15 - oktadekatrienowy (linolenowy)
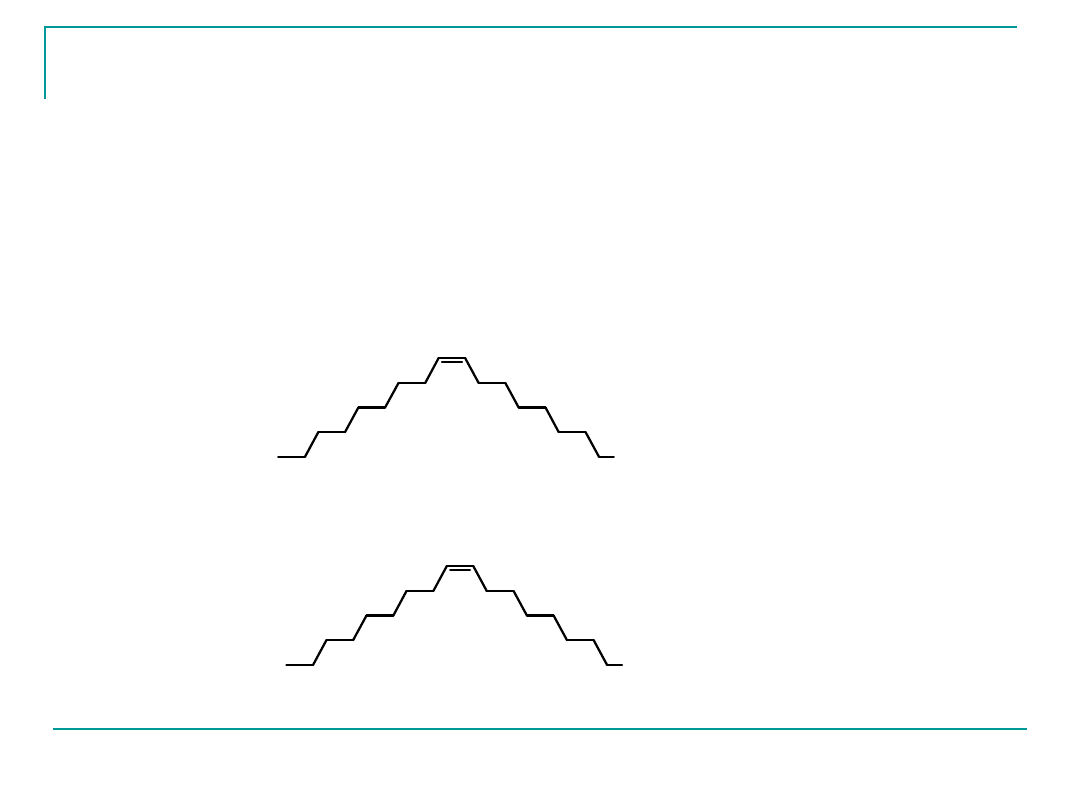
Nienasycone kwasy tłuszczowe wchodzące w skład
tłuszczów mają konfigurację Z (cis) przy wiązaniu
podwójnym,
numeracja atomów węgla –zgodna z regułami UPAC
(grupa karboksylowa lokant 1)
lub
stosowana w chemii żywności, od węgla najdalszego od
grupy karboksylowej
COOH
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
COOH
1 2
3
4
5
6
7
8
9
kwas oleinowy

6
5
4
3
2
1
COOH
1
2
3
4
5
6
7
8
9
COOH
10
11
12
13
14
15
16
17
18
COOH
kwas linolowy

Wiązania podwójne mają konfigurację Z (Zusammmen, w
chemii żywności stosuje się ciągle jeszcze często określenie
cis).
Ta ostatnia właściwość decyduje o stanie skupienia
tłuszczów
roślinnych (bogatych w reszty kwasów nienasyconych).
Łańcuch węglowy tych kwasów jest zgięty, co uniemożliwia
ścisłe
upakowanie cząsteczek – i obniża temperaturę topnienia
tłuszczów
zawierających te kwasy.

Niezbędne Nienasycone Kwasy Tłuszczowowe
(NNKT)
Kwasy nienasycone zawierające więcej niż jedno
wiązanie podwójne są bardzo ważne z punktu widzenia
zdrowotnego –
Kwasy te nazywane są Niezbędnymi Nienasyconymi
Kwasami Tłuszczowymi (NNKT)
Przykłady tłuszczów zwierzęcych
Przykłady tłuszczów
C
H
H
O C
O
C
17
H
35
C
H
O C
O
C
17
H
35
C
H
H
O C
O
C
17
H
35
tristearynian glicerolu
(tristearyna)
-
stały
tłuszcz charakterystyczny
organizmów zwierzęcych
C
H
H
O C
O
C
15
H
31
C
H
O C
O
C
17
H
35
C
H
H
O C
O
C
11
H
23
trigliceryd mieszany -stały
tłuszcz charakterystyczny
dla organizmów zwierzęcych
C
H
H
O C
O
C
15
H
31
C
H
O C
O
C
17
H
35
C
H
H
O C
O
C
15
H
31
tluszcz zwierzęcy
(optycznie nieczynny)
C
H
H
O C
O
C
15
H
31
C
H
O C
O
C
17
H
35
C
H
H
O C
O
C
17
H
31
tluszcz zwierzęcy
(optycznie czynny)
dla
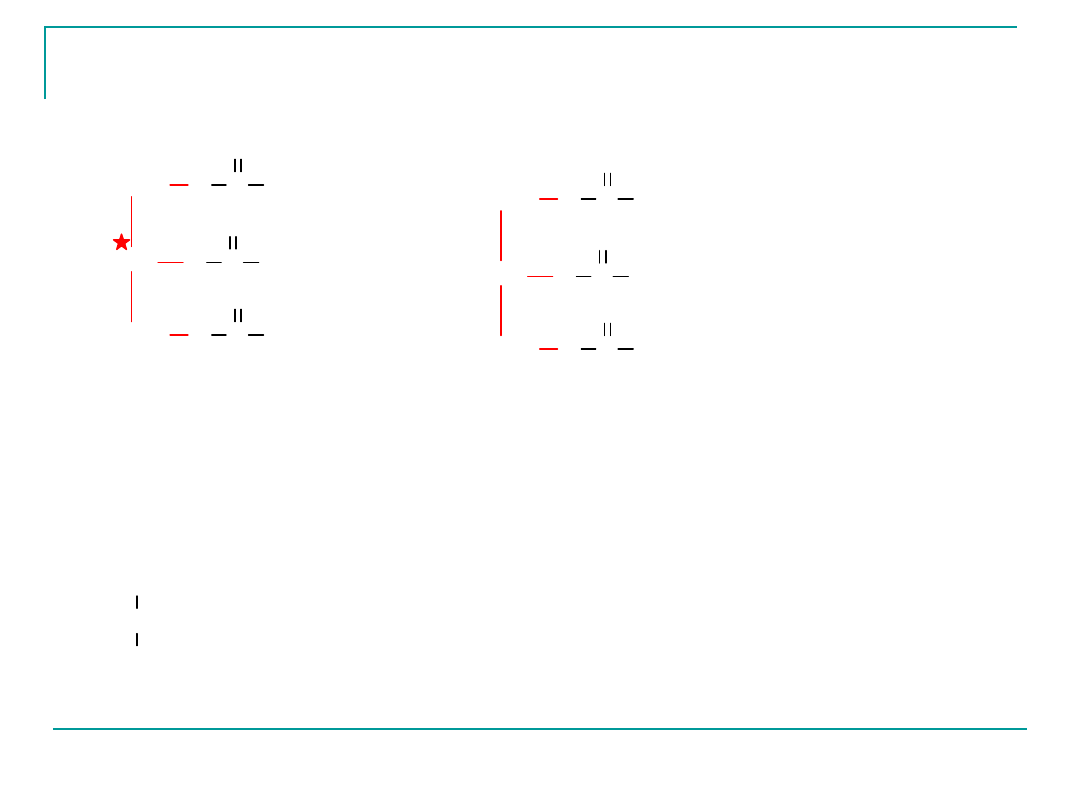
Przykłady tłuszczów roślinnych
CH
2
CH
CH
2
O
O
C
C
O
O
C
17
H
33
C
17
H
31
O
C
O
C
17
H
31
trigliceryd mieszany
charakterystyczny dla
tłuszczów roślinnych
CH
2
CH
CH
2
O
O
C
C
O
O
C
17
H
33
C
17
H
33
O
C
O
C
17
H
31
trigliceryd -trioleinian glicerolu
charakterystyczny dla
t³uszczów roœlinnych
ester gliceryny
i kwasów:
oleinowego i linolowego
ciek³y
optycznie nieczynny
CH
2
O
COC
18
H
29
CHO
COC
18
H
29
CH
2
O
COC
18
H
29
trigliceryd (trilinoleinian glicerolu)
charakterystyczny dla tluszczów roœlinnych

Zawartość wybranych kwasów tłuszczowych w
tłuszczach roślinnych i zwierzęcych
tłuszcz
Kwasy
nasycone
*(suma
kwasów C16
+C18)
kwasy
palmitynowy i
stearynowy
Kwas
oleinowy
C18 jedno
wiązanie =
Kwas
linolowyC18
dwa wiązania
=
Masło
46% - 56%
39% - 42%
2%
Smalec
40% - 48%
40% - 50%
3% - 8%
Olej sojowy
9% - 16%
23% -34%
50% -60%
Oliwa
(olej z oliwek
8% - 23%
53% - 86%
4% - 22%
Olej
słonecznikowy
8% - 10%
73% -84%
10% - 12%

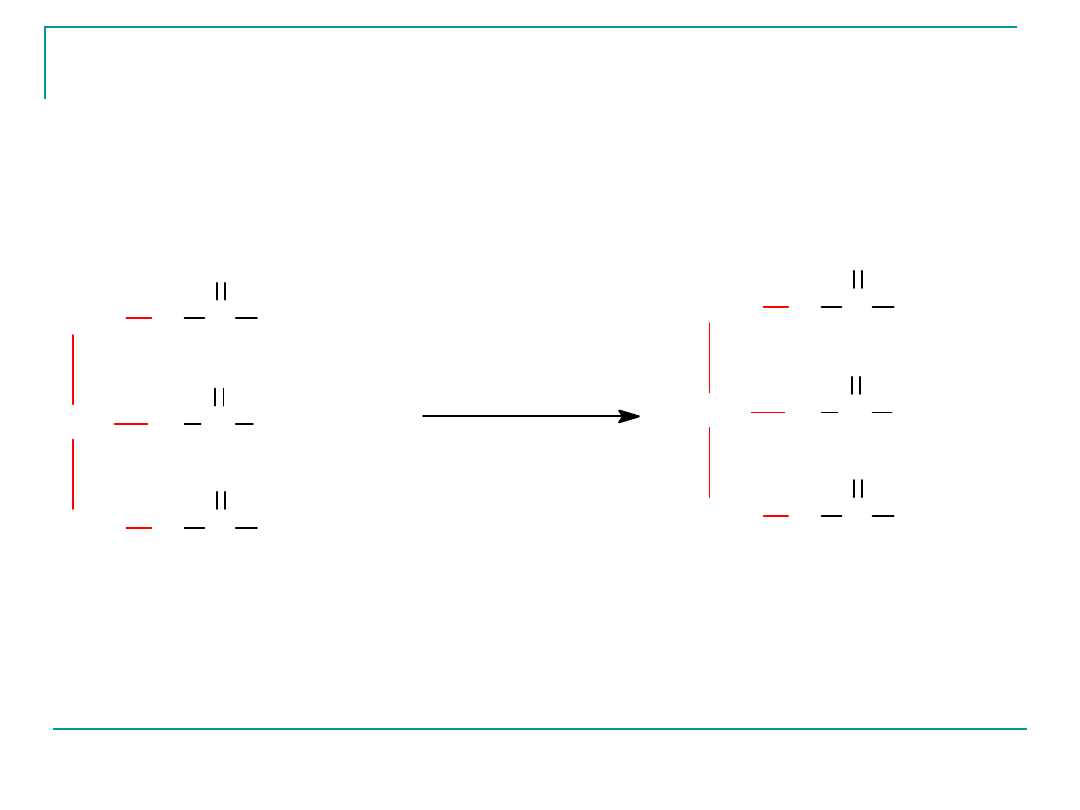
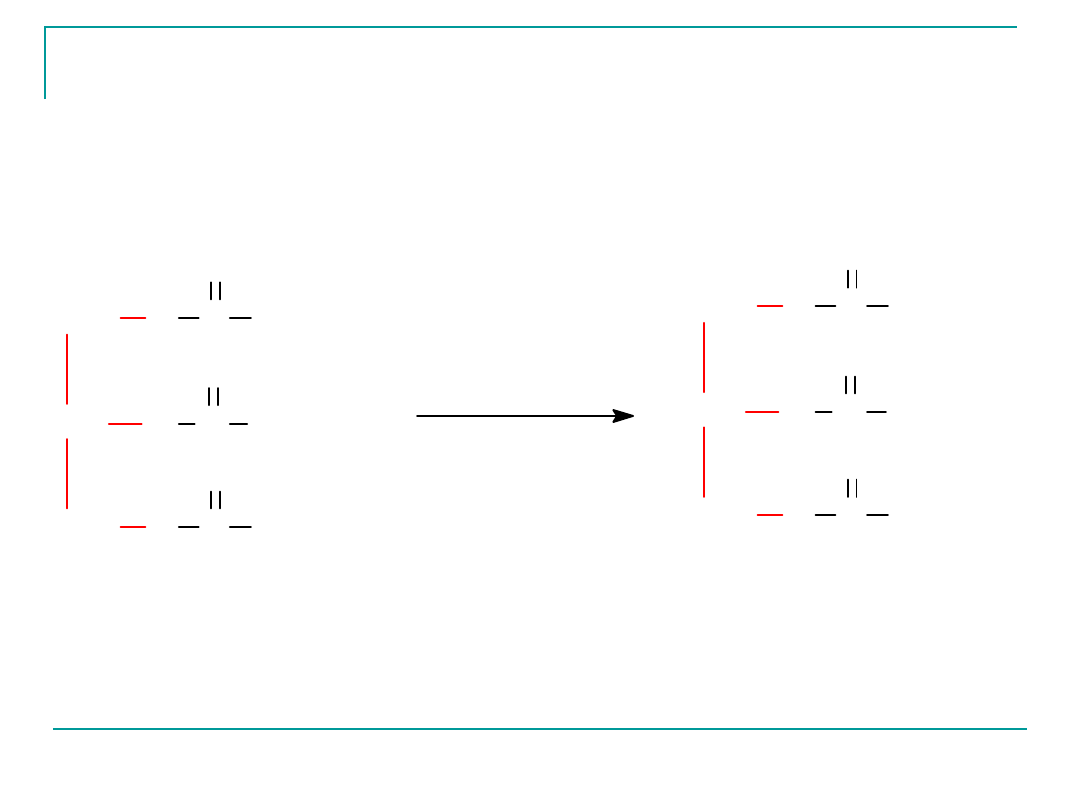
Tłuszcze ciekłe mogą być przeprowadzone w tłuszcze stałe
w wyniku reakcji uwodornienia (przyłączenie wodoru do
wiązań podwójnych prowadzone w obecności katalizatora
np. Pt, Pd, Ni).
Reakcja uwodornienia tłuszczów nosi nazwę reakcji
utwardzania tłuszczów.
Reakcja utwardzania tłuszczów wykorzystywana jest w
produkcji utwardzonych tłuszczów roślinnych –margaryn.
Katalizatorem stosowanym w przemyśle jest nikiel.
CH
2
CH
CH
2
O
O
C
C
O
O
C
17
H
33
C
17
H
33
O
C
O
C
17
H
33
3H
2
Ni
Reakcja utwardzania t³uszczu
CH
2
CH
CH
2
O
O
C
C
O
O
C
17
H
35
C
17
H
35
O
C
O
C
17
H
35
trioleinian glicerolu
tristearynian glicerolu
CH
2
CH
CH
2
O
O
C
C
O
O
C
17
H
31
C
17
H
29
O
C
O
C
17
H
33
Ni
Reakcja utwardzania t³uszczu
CH
2
CH
CH
2
O
O
C
C
O
O
C
17
H
35
C
17
H
35
O
C
O
C
17
H
35
tristearynian glicerolu
triglicerian mieszany
6 H
2

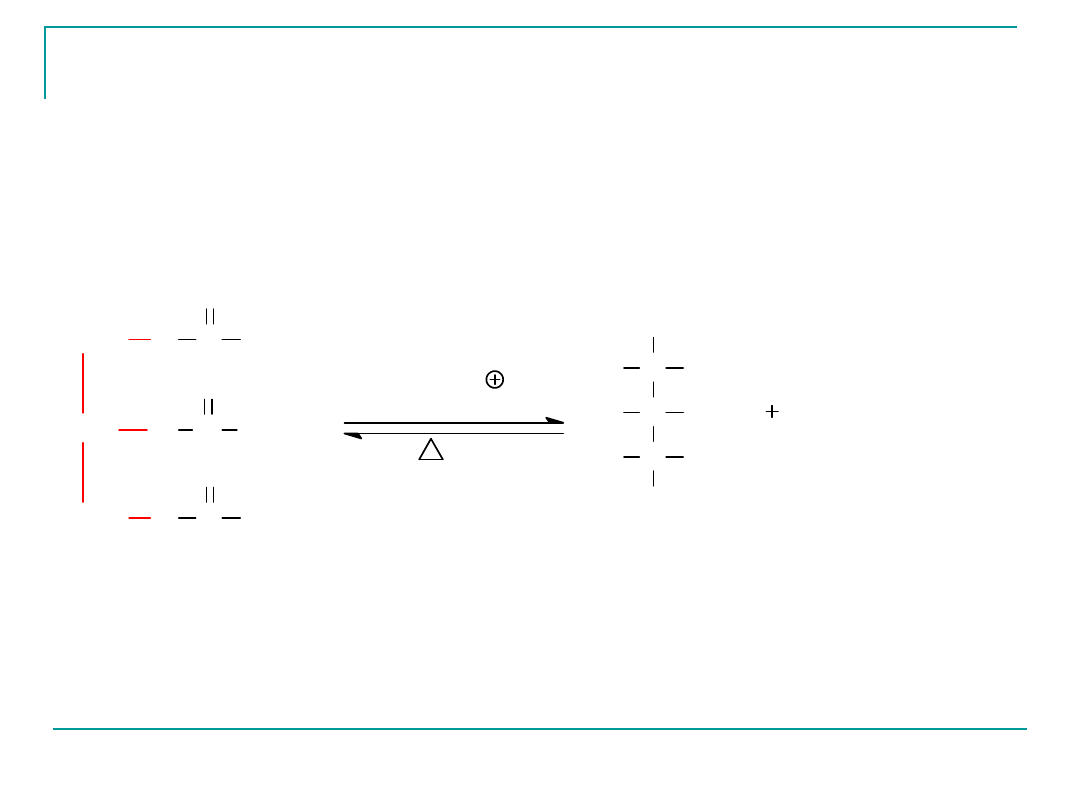
Hydroliza tłuszczów
Tłuszcze jak wszystkie estry mogą być hydrolizowane (w
obecności kwasu lub zasady). Reakcja ta polega na
wytworzeniu z estrów jakimi są tłuszcze -kwasów
tłuszczowych (jeżeli reakcja biegnie w środowisku
kwaśnym) i gliceryny.
Jeżeli reakcja biegnie w środowisku zasadowym powstają
sole kwasów tłuszczowych (mydła) i gliceryna.
CH
2
CH
CH
2
O
O
C
C
O
O
C
17
H
31
C
17
H
29
O
C
O
C
17
H
33
triglicerian mieszany
H
2
O, H
t
C
C
C
H
H
H
H
H
OH
OH
OH
Hydroliza kwasowa
gliceryna
C
17
H
31
COOH
kwas linolowy
C
17
H
33
COOH
kwas oleinowy
C
17
H
29
COOH
kwas linolenowy
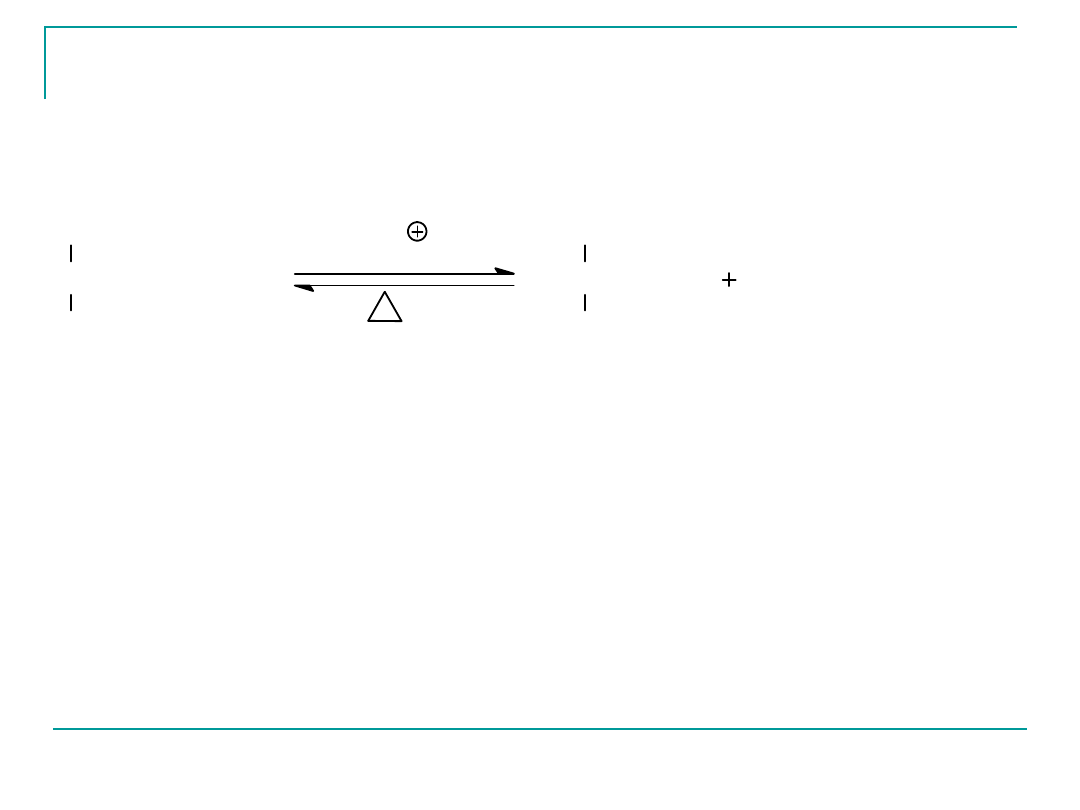
CH
2
O
COC
17
H
35
CHO
COC
17
H
35
CH
2
O
COC
17
H
35
H
3
O
CH
2
OH
CHOH
CH
2
OH
tristearynian glicerolu
3C
17
H
35
COOH
kwas stearynowy
gliceryna

Hydroliza zasadowa tłuszczów – zmydlanie
tłuszczów
Hydroliza zasadowa przebiega w środowisku zasadowym
(zastosowanie NaOH, KOH)
prowadzi do otrzymania soli kwasów tłuszczowych i
gliceryny.
Sole sodowe i potasowe kwasów tłuszczowych noszą nazwę
mydeł.
Reakcję hydrolizy zasadowej tłuszczów nazywamy
reakcją zmydlania.
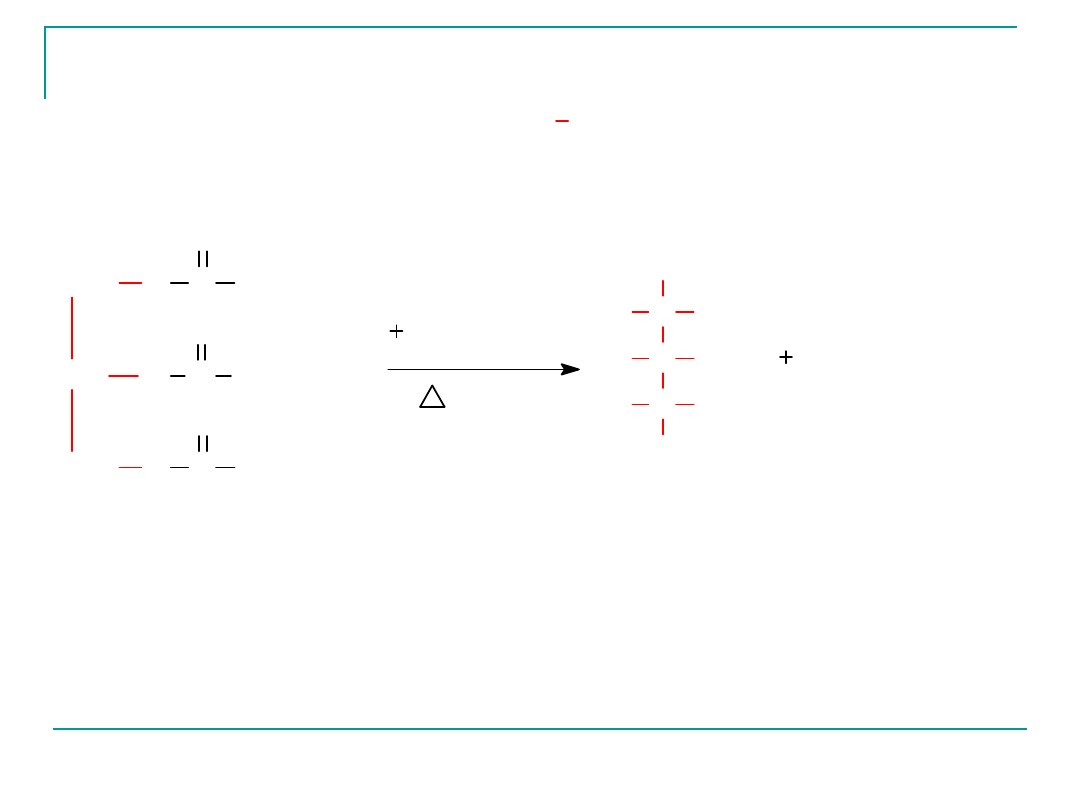
Hydroliza zasadowa tluszczów zmydlanie
CH
2
CH
CH
2
O
O
C
C
O
O
C
17
H
31
C
17
H
29
O
C
O
C
17
H
33
triglicerian mieszany
t
C
C
C
H
H
H
H
H
OH
OH
OH
gliceryna
C
17
H
31
COOK
linolowego
C
17
H
33
COOK
oleinowego
C
17
H
29
COOK
sole potasowe
kwasów
linolenowego
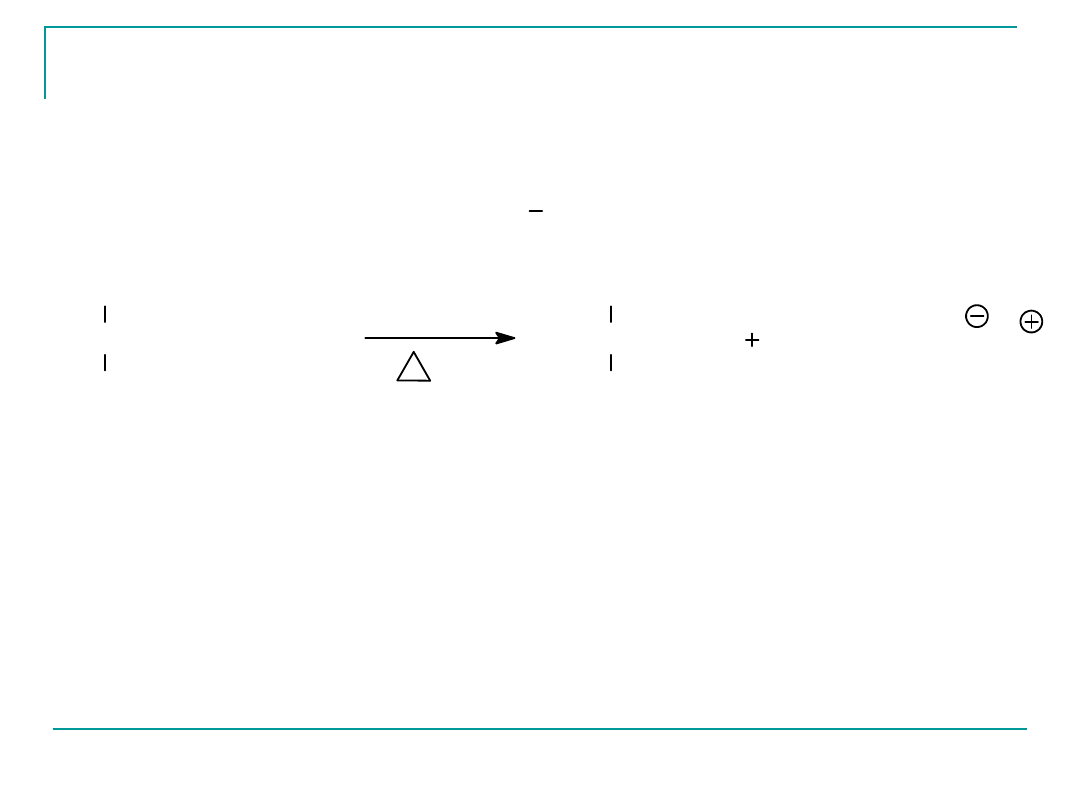
Mydła - czyli
KOH
3
CH
2
O
COC
17
H
35
CHO
COC
17
H
35
CH
2
O
COC
17
H
35
CH
2
OH
CHOH
CH
2
OH
tristearynian glicerolu
3C
17
H
35
COONa
gliceryna
NaOH
Hydroliza zasadowa tluszczów zmydlanie
sól sodowa kwasu
stearynowego

Mydła – sole sodowe i potasowe wyższych
kwasów tłuszczowych
Reakcji zmydlania ulegają zarówno tłuszcze roślinne jak
i zwierzęce.
Mydła dzięki swojej budowie amfifilowej (składają się z
części
hydrofilowej i lipofilowej) mają właściwości detergencyjne
(myjące).
Mydła otrzymywano już 600p.e.-Fenicjanie).
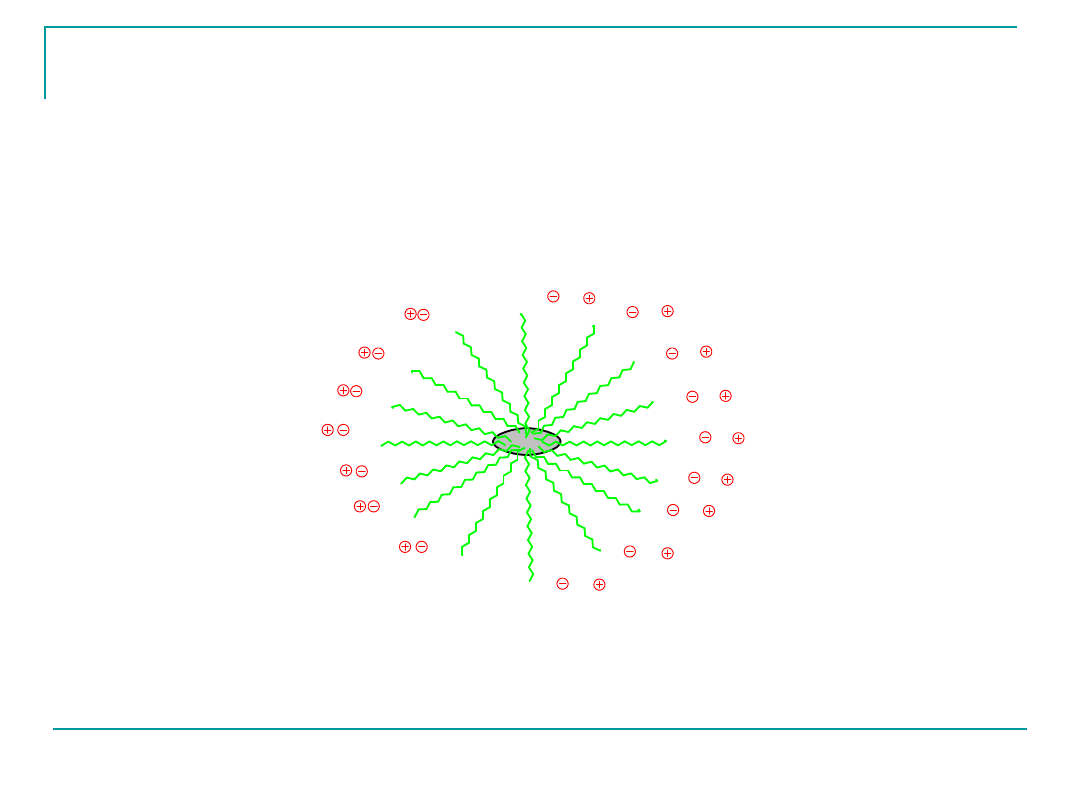
Właściwości detergencyjne mydeł
Micela mydła rozpuszczająca cząstkę brudu w wodzie
CO
2
Na
Na O
2
C
CO
2
Na
CO
2
Na
Na O
2
C
Na O
2
C
CO
2
Na
CO
2
Na
Na O
2
C
CO
2
Na
CO
2
Na
CO
2
Na
Na O
2
C
Na O
2
C
Na O
2
C
CO
2
Na
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O
H
2
O

Sacharydy (węglowodany,
cukry)
Sacharydy -jedna z najważniejszych grup związków
organicznych
występujących w przyrodzie (materiał zapasowy, źródło energii,
materiał strukturalny, ważne składniki związków istotnych ze
względów przebiegających w organizmach procesów
biochemicznych- np. składniki koenzymów czy kwasów
nukleinowych).
Budowa cukrów – polihydroksyaldehydy lub polihydroksyketony
lub ich polimery.
Wiele z nich ma ogólny (CH
2
O)
n
≡ Cn (H
2
O)
n
stąd nadana im
w XIX w. błędna z punktu widzenia istoty ich budowy nazwa
węglowodany, czyli wodziany węgla [glukoza C
6
(H
2
O)
6
].

Podział sacharydów sacharydów oparciu o
wielkość cząsteczek:
monosacharydy,
związki, które w wyniku hydrolizy nie mogą
wytworzyć cząsteczek prostszych cukrów.
Zawierają od 3-do 8 atomów węgla w cząsteczce, najbardziej
rozpowszechnione są monosacharydy zawierające 5 lub 6 atomów
węgla w cząsteczce, czyli pentozy i heksozy (przyrostek -
oza
jest
cechą charakterystyczna w nazwach cukrów);
disacharydy
- cukry składające się z dwóch cząsteczek
monosacharydów, połączonych wiązaniem acetalowym
(eterowym)
(w odniesieniu do cukrów ten rodzaj nazywany jest wiązaniem
glikozydowym);
oligosacharydy
- związki składające się z kilku (od trzech do
kilkunastu)
cząsteczek monosacharydów połączonych wiązaniem glikozydowym;
polisacharydy
– związki o charakterze polimerycznym zbudowane z
setek
lub tysięcy cząsteczek cukrów prostych połączonych wiązaniem
acetalowym (glikozydowym).
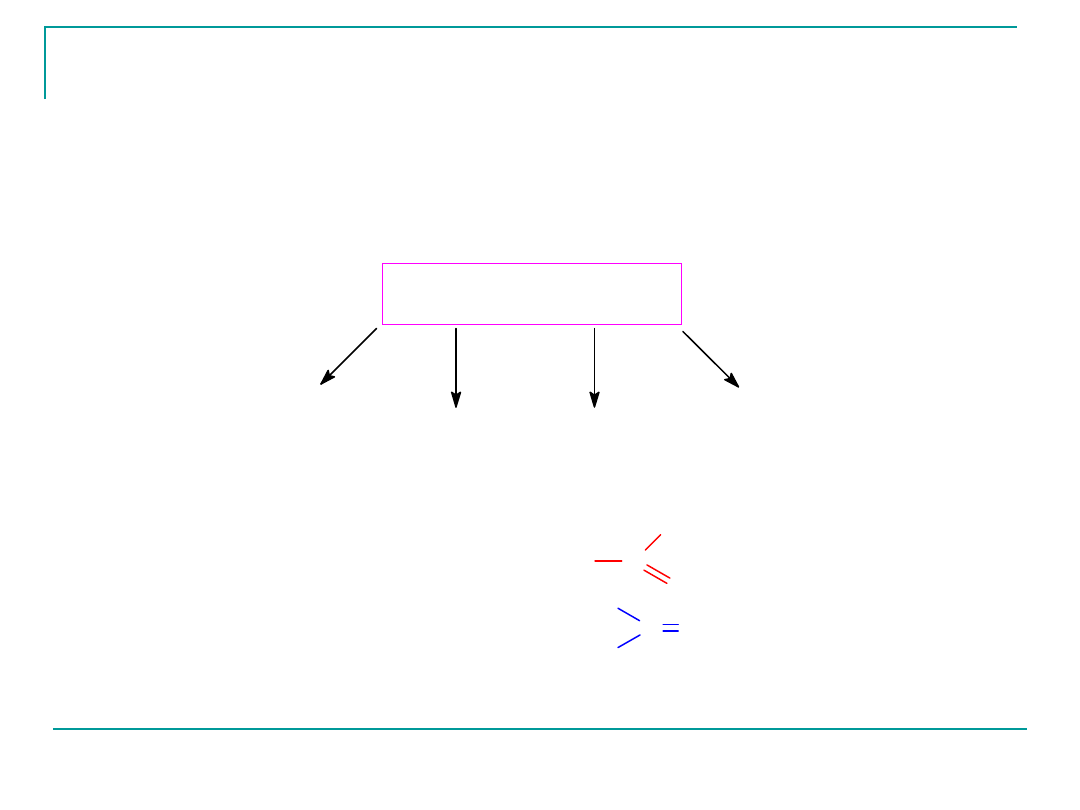
Podział monosacharydów
cukier nazywamy ketozą
C O
J eżli w cząsteczce cukru znajduje się grupa
cukier nazywamy aldozą
O
C
H
J eżli w cząsteczce cukru znajduje się grupa
heksozy
6C
pentozy
5C
tetrozy
4C
triozy
3C
MONOSACHARYDY
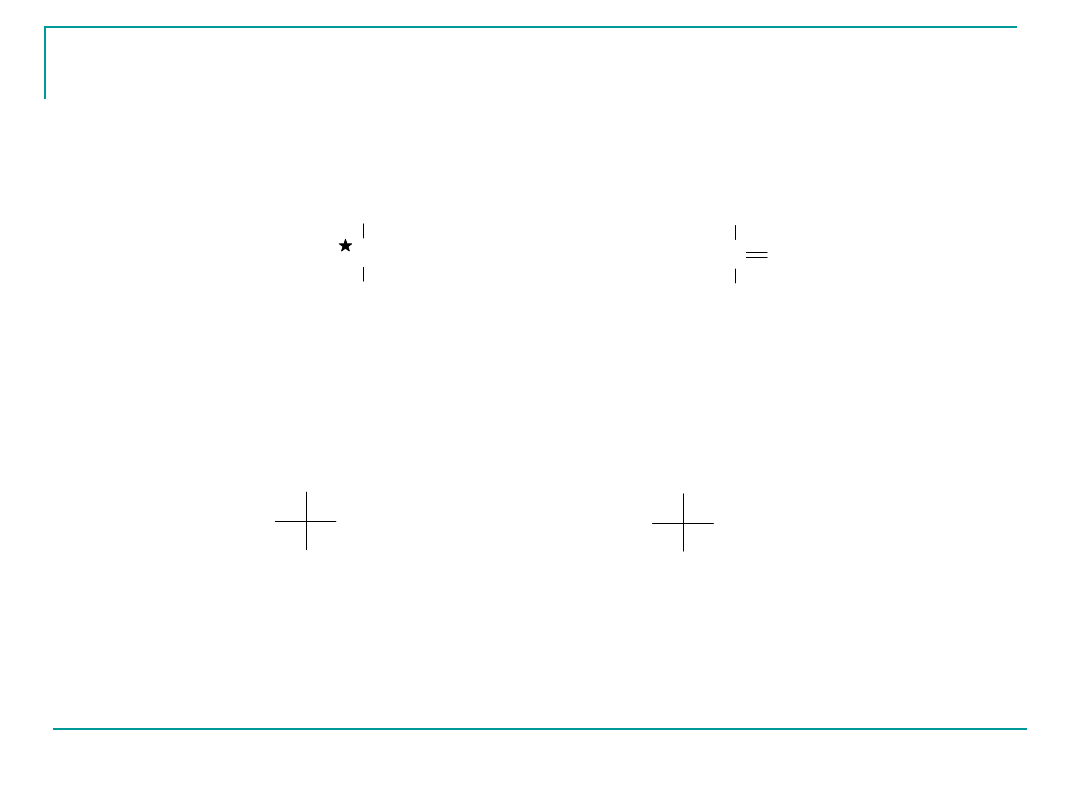
Najprostsze monosacharydy
Enancjomery
aldehyd L-glicerynowy
aldehyd D-glicerynowy
x
(R)-(+)-2,3-dihydroksypropanal
CHO
CH2OH
H
HO
CHO
CH2OH
OH
H
aldehyd glicerynowy dihydroksyaceton
aldotrioza ketotrioza
CH2OH
C
CH2OH
O
CHO
CHOH
CH2OH
Najprostsze cukry to triozy:

Monosacharydy występujące w przyrodzie
Cukry występujące w przyrodzie to przede wszystkim
cukry należące do szeregu D.
Triozy i tetrozy nie występują nigdzie w większych
ilościach, ale
każda komórka zawiera aldehyd glicerynowy,
dihydoroksyaceton
i erytrozę (tetroza) będące produktami pośrednimi
syntezy
i degradacji cukrów w organizmie.
Pentozy ( z wyjątkiem liksozy) są rozpowszechnione w
przyrodzie –
do najważniejszych pentoz należą D-ryboza i D-
deoksyryboza (dezoksyryboza).
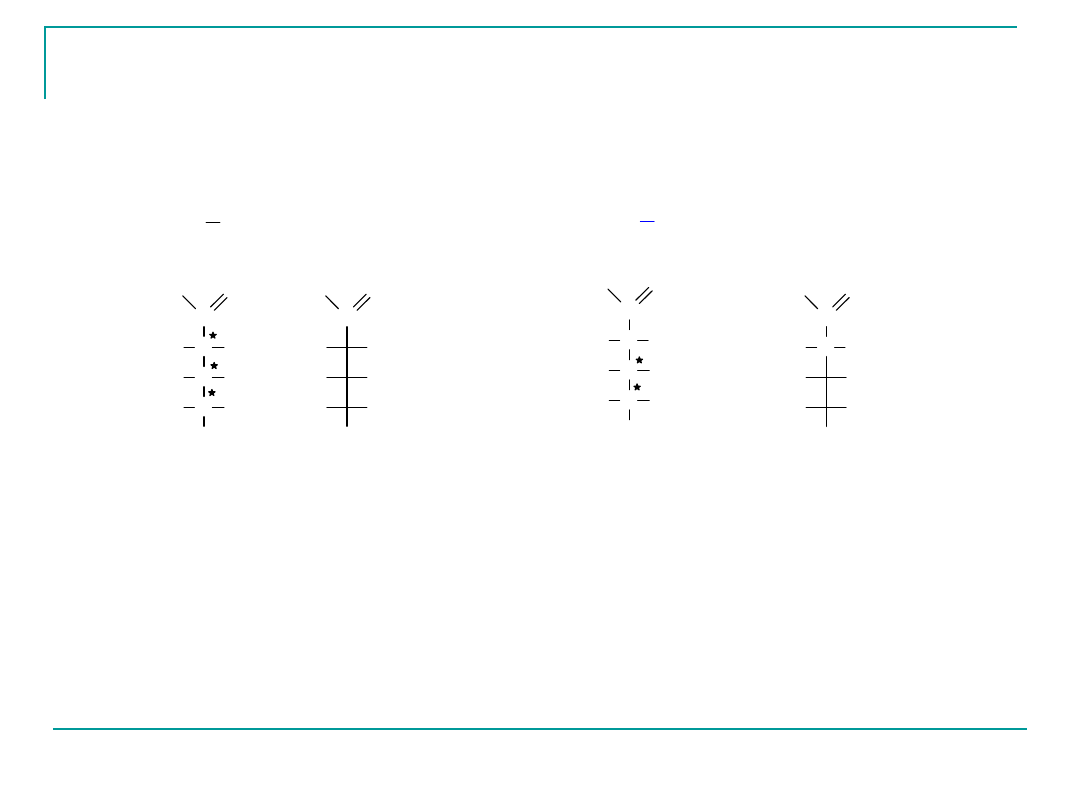
D-Ryboza i D-2-Deoksyryboza –składniki kwasów
nukleinowych
wzór
strukturalny
D
C
CH
2
OH
H
OH
OH
H
H
OH
O
H
C
C
C
C
CH
2
OH
H
OH
OH
OH
H
H
O
H
RYBOZA
C
C
CH
2
OH
H
H
OH
H
H
OH
O
H
C
C
C
C
CH
2
OH
H
H
OH
OH
H
H
O
H
D
2-DEOKSYRYBOZA
wzór
strukturalny

D-ksyloza i D-arabinoza są składnikami polisacharydów
roślinnych.
Wyjątek stanowi L-arabinoza, która występuje częściej od
D-arabinozy.

Monosacharydy występujące w przyrodzie
Ketopentozy występują w komórkach (D-rybuloza i D-
ksyluloza)
w małych ilościach. D-fruktoza jest pospolitą ketoheksozą.
Wzór fruktozy
Do najbardziej rozpowszechnionych w przyrodzie
cukrów należy glukoza.
Rośliny wytwarzają w toku fotosyntezy rocznie ok. 100 miliardów
ton tego związku.
Jest to podstawowy składnik cukrów złożonych występuje w
di-, oligo- i polisacharydach (celuloza- składnik budulcowy szeregu
roślin).
CH
2
OH
C O
H
HO
OH
H
OH
H
CH
2
OH

Glukoza występująca powszechnie w przyrodzie
należy do
szeregu D jest cukrem prawoskrętnym (+).
Określenie D-odnosi się do konfiguracji względnej
na ostatnim asymetrycznym (piątym atomie
węgla w cząsteczce glukozy).
Glukoza jest aldoheksozą (czyli posiada grupę
aldehydową oznaczaną w numeracji atomów
glukozy lokantem 1 i sześć atomów
węgla w cząsteczce).
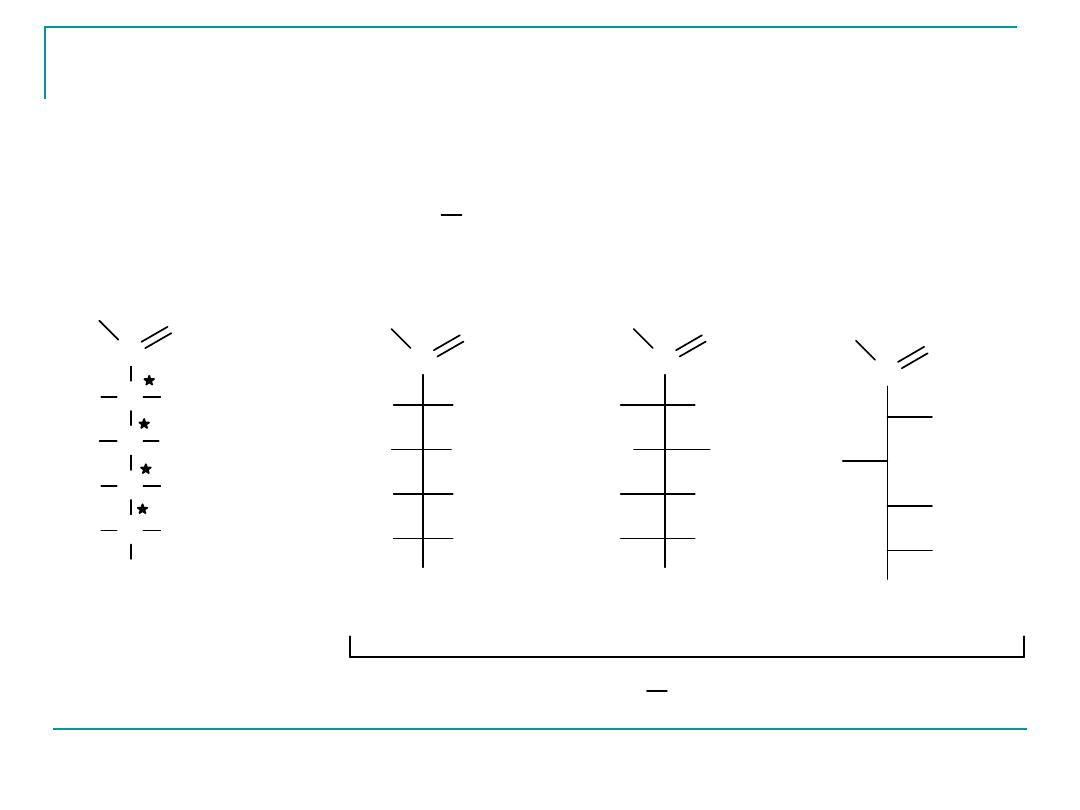
Wzory Fischera
D
-glukozy
C
C
C
C
C
CH
2
OH
OH
HO
H
H
OH
OH
H
H
H
O
wzór
strukturalny
GLUKOZA
C
CH
2
OH
OH
HO
H
H
OH
H
H
OH
H
O
C
CH
2
OH
OH
HO
OH
OH
H
O
C
CH
2
OH
H
O
D
GLUKOZY
D
Wzory Fischera

Aldozy szeregu D
Wszystkie aldozy mogą być otrzymane odpowiednio z
aldehydu D-Lub L-glicerynowego.
Wszystkie aldozy szeregu D posiadają identyczną
konfigurację na przedostatnim atomie węgla (ostatni
asymetryczny atom węgla).
We wzorze Fischera grupa OH będzie znajdowała się w
cukrach szeregu D po prawej stronie.
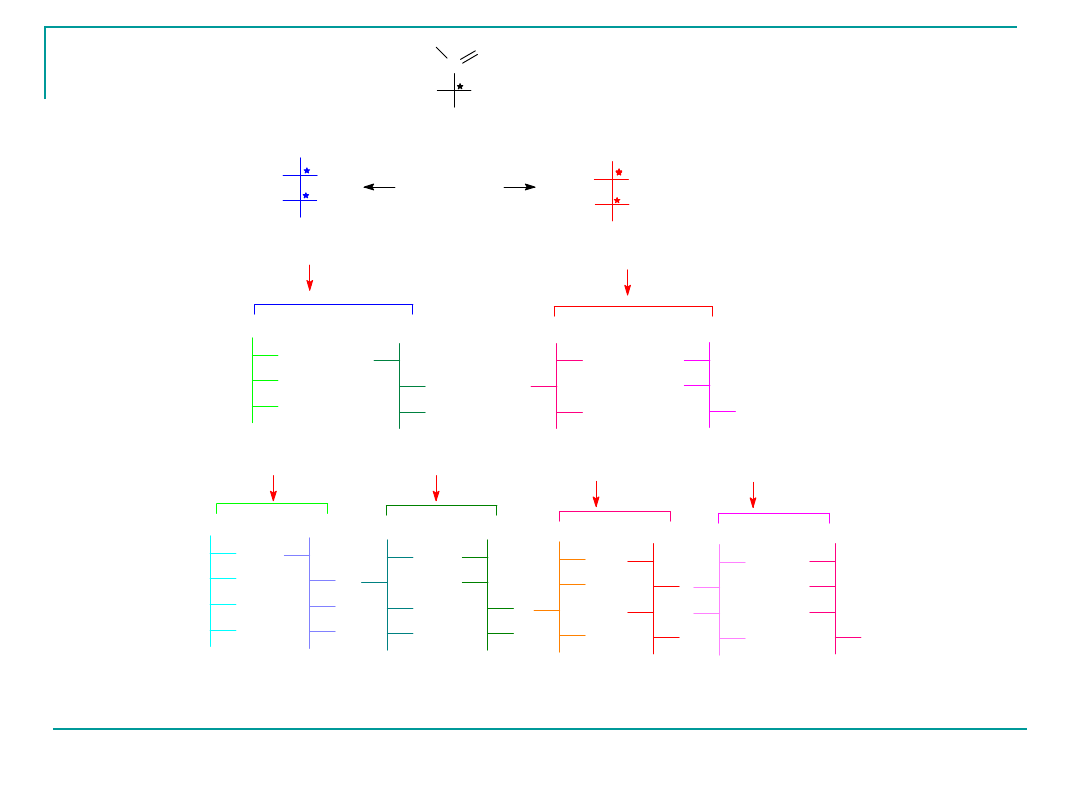
C
CH
2
OH
OH
H
H
O
aldehyd
D
-glicerynowy
CHO
OH
OH
CH
2
OH
H
H
D
-(-)-erytroza
CHO
H
OH
CH
2
OH
HO
H
D
- (+)- treoza
CHO
CH
2
OH
CHO
CH
2
OH
CHO
CH
2
OH
CHO
CH
2
OH
D-ryboza
D-arabinoza
D-ksyloza
D-liksoza
CHO
CH
2
OH
CHO
CH
2
OH
CHO
CH
2
OH
CHO
CH
2
OH
CHO
CH
2
OH
CHO
CH
2
OH
CHO
CH
2
OH
CHO
CH
2
OH
D- alloza
D- altroza D- glukoza D- mannoza D- guloza D- idoza D- galaktoza D- taloza
Epimery C-2

W celu zapamiętania nazw poszczególnych
aldoz (pentoz i heksoz) stosowane są
wierszyki:
Pentozy
Ryby Arabski Książe Liczy (Ryboza, Arabinoza, Ksyloza,
Liksoza)
Heksozy
Albinos Altruista Glinowo Magenzowy Guzik Idealnie
Gałgankiem Talkuje (Alloza, Altroza, Glukoza, Mannoza,
Guloza, Idoza, Galaktoza, Taloza)
lub
Aluzyjny Altruista – Głuchy Mandaryn Gulgocząc Idzie
Galerią Talentów

Szereg L-aldoz. Liczba możliwych izomerów.
Wychodząc z aldehydu L-glicerynowego można
otrzymać szereg L-aldoz.
Liczba możliwych izomerów = 2
n
(gdzie n jest
liczbą asymetrycznych atomów C cząsteczce
monosacharydu).
Dla glukozy n=4 liczba możliwych izomerów =
2
4
= 16
(czyli 8 aldoheksoz szeregu D i 8
enancjomerycznych cukrów szeregu L)
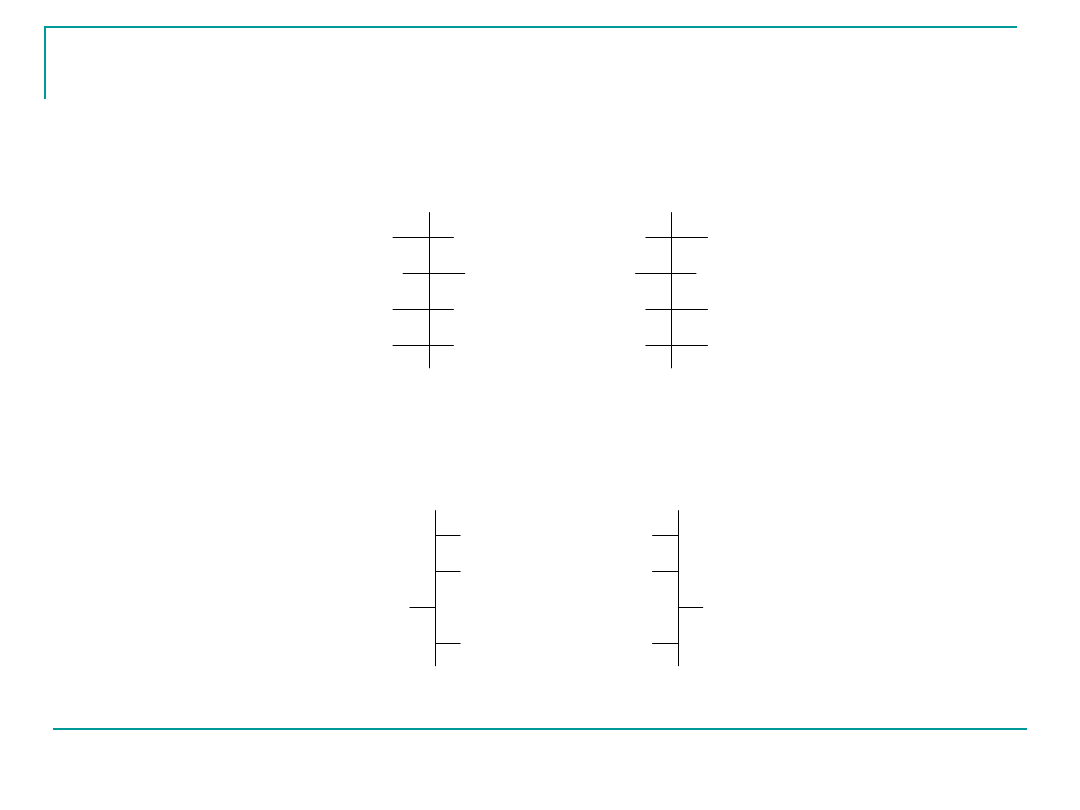
Aldozy szeregu D posiadają enancjomeryczne
odpowiedniki w szeregu L.
Enancjomerem D-glukozy jest L-glukoza
CHO
OH
HO
OH
OH
CH
2
OH
CHO
HO
OH
HO
HO
CH
2
OH
D-glukoza L-glukoza
CHO
OH
OH
HO
OH
CH
2
OH
CHO
HO
HO
OH
HO
CH
2
OH
D-guloza L-guloza

Ketodzy
Ketozy są cukrami posiadającymi grupę ketonową zamiast
grupy aldehydowej.
Podobnie jak aldozy można otrzymać szereg ketoz w wyniku
reakcji prowadzących do przedłużania łańcucha węglowego.
Związkiem wyjściowym do otrzymywania ketoz jest
dihydroksyaceton (1,3-dihydroksy aceton = 1,3-
dihydroksypropanon)
1,3-dihydroksypropanon
CH
2
OH
C O
CH
2
OH
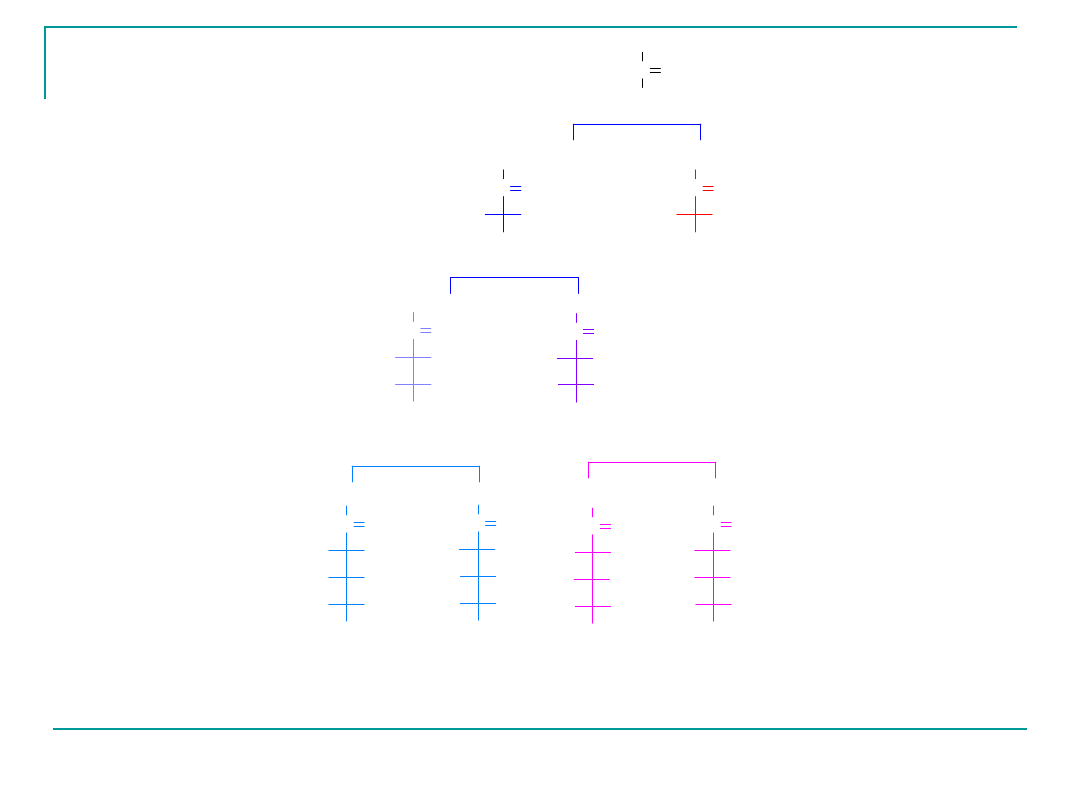
Syntezę szeregu D-ketoz z D-erytrulozy przedstawiono poniżej,
Analogicznie można otrzymać szereg L-ketoz z L-erytrulozy
1,3-dihydroksypropanon
CH
2
OH
C O
CH
2
OH
D-erytruloza
L-erytruloza
CH
2
OH
C O
CH
2
OH
OH
H
CH
2
OH
C O
CH
2
OH
H
HO
CH
2
OH
C O
OH
H
OH
H
CH
2
OH
D-rybuloza
CH
2
OH
C O
H
HO
OH
H
CH
2
OH
D-ksyluloza
CH
2
OH
C O
OH
H
OH
H
OH
H
CH
2
OH
CH
2
OH
C O
H
HO
OH
H
OH
H
CH
2
OH
CH
2
OH
C O
OH
H
H
HO
OH
H
CH
2
OH
CH
2
OH
C O
H
HO
H
HO
OH
H
CH
2
OH
D-alluloza
D-fruktoza
D-sorboza
D-tagatoza
zwana te¿
D-psikozą

Furanozy i piranozy
Wzory Fischera, którymi posługiwaliśmy się do tej pory nie oddają
w
pełni prawdziwej budowy cukrów.
W związku z obecnością w cząsteczkach monosacharydów grup
hydroksylowych (OH) i grupy karbonylowej C=O (aldehydowej lub
ketonowej) związki te ulegają wewnątrz cząsteczkowej reakcji z
utworzeniem form cyklicznych zawierających w pierścieniu atoma
tlenu.
Jeżeli w wyniku tej reakcji tworzy się pierścień pięcioczłonowy-
nazywamy tę formę występowania monosacharydu -
furanozą
,
natomiast jeżeli w wyniku reakcji wewnątrz cząsteczkowej
powstaje
pierścień sześcioczłonowy- mówimy o powstawaniu
piranoz.
Pierścienie pięcio- i sześcioczłonowe jako wyjątkowo trwałe
tworzą się szczególnie łatwo.
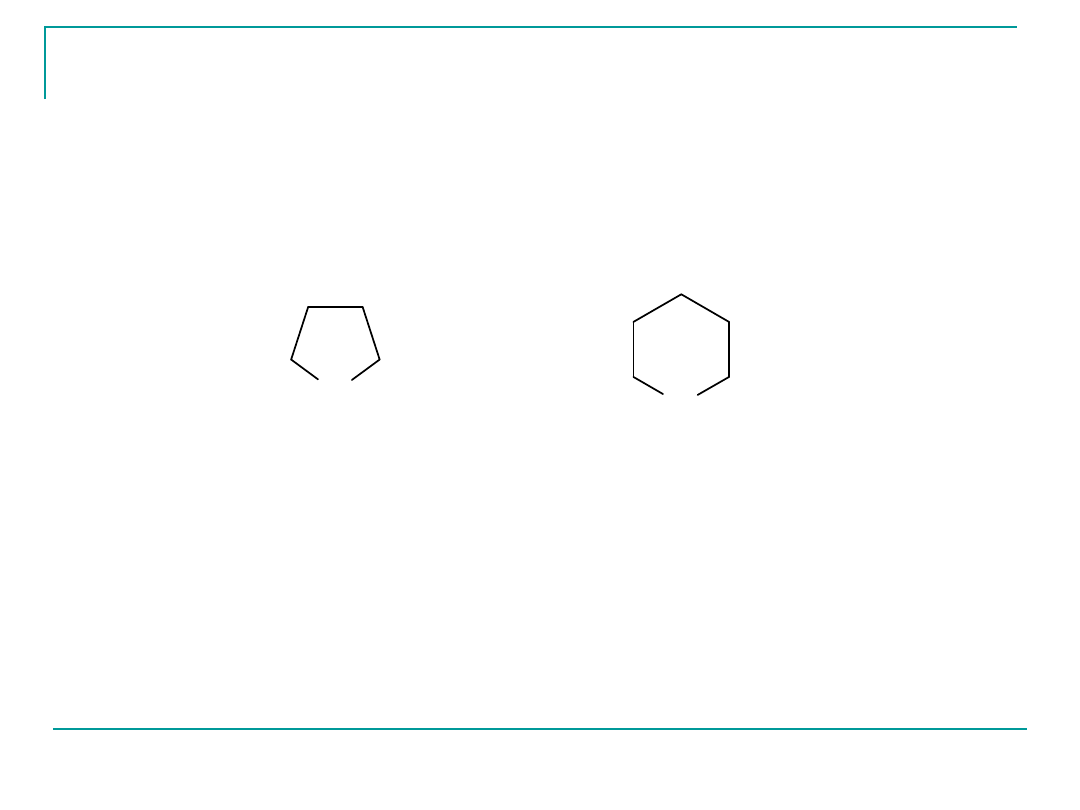
O
O
pierœcieñ furanozowy
pierścień piranozowy

Oligosacharydy
Cyklodekstryny.
Są cyklicznymi oligomerami (polimerami) glukozy
zawierającymi
6
-cyklodekstryna
7
-cyklodekstryna
8
γ-cyklodekstryna
cząsteczek tego cukru w pierścieniu.
Związki te mogą być otrzymane w wyniku enzymatycznej
hydrolizy skrobi.
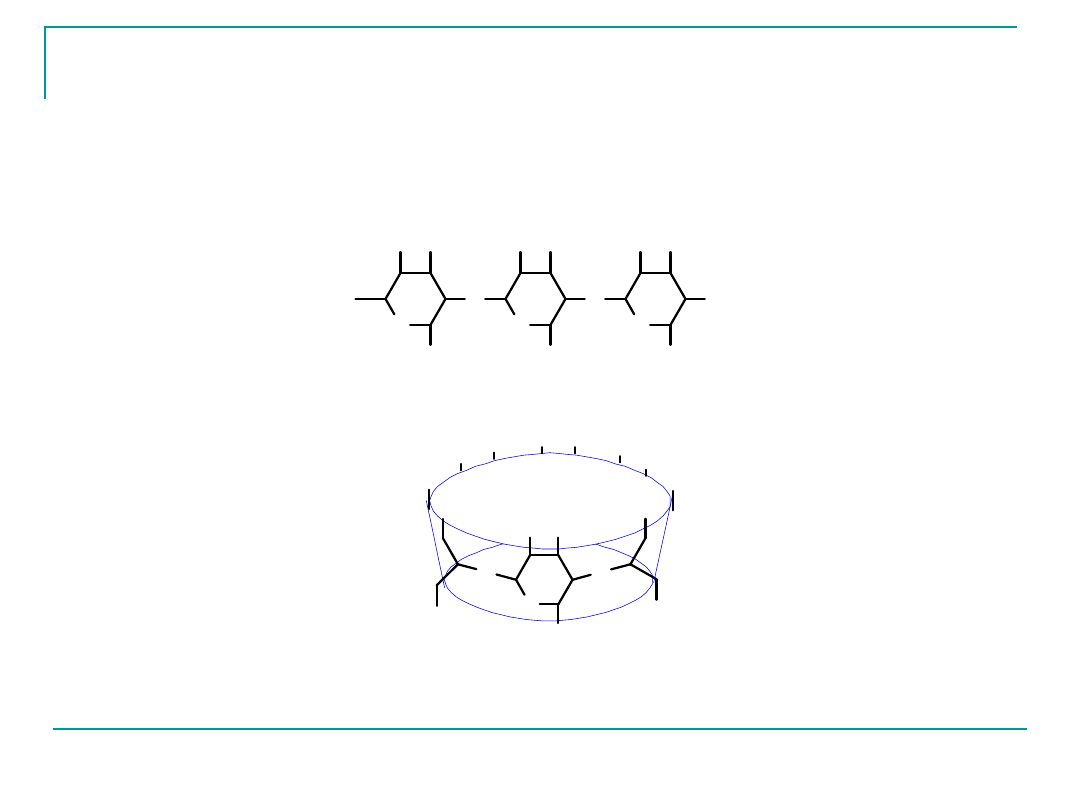
Budowa cząsteczki -cyklodekstryny
O
O
OH
OH
CH
2
OH
O
OHOH
CH
2
OH
O
O
O
OHOH
CH
2
OH
O
OHOH
CH
2
OH
O
O
OH
OH
CH
2
OH
CH
2
OH
OH
OH
OH
OH
OH
OH
OH
OH
cząsteczka cyklodekstryny

Polisacharydy
Skrobia
Skrobia – składa się z dwóch frakcji:
rozpuszczalnej w wodzie amylozy
i
nierozpuszczalnej amylopektyny (występującej w przewadze).
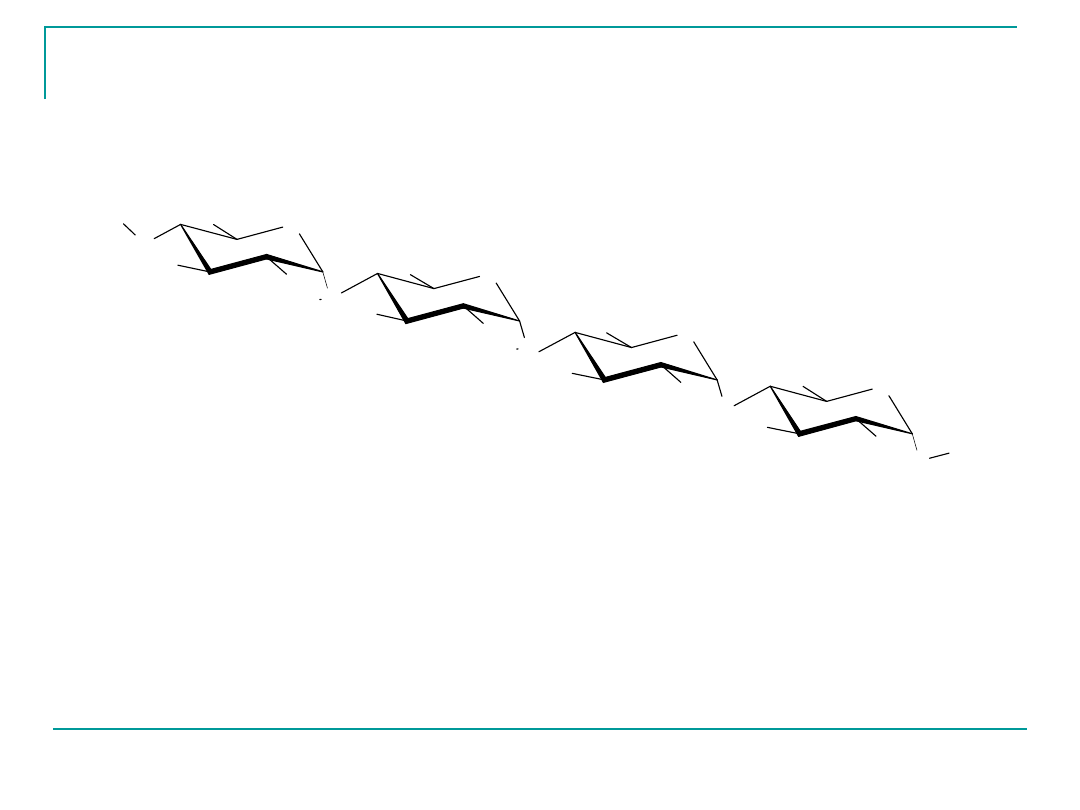
Budowa amylozy
O
OH
HOH
2
C
HO
O
O
OH
O
HOH
2
C
HO
O
O
OH
HOH
2
C
HO
O
O
OH
HOH
2
C
HO
O
amyloza
100 – 500 cząsteczek D-glukozy, wiązania -glikozydowe 1,4
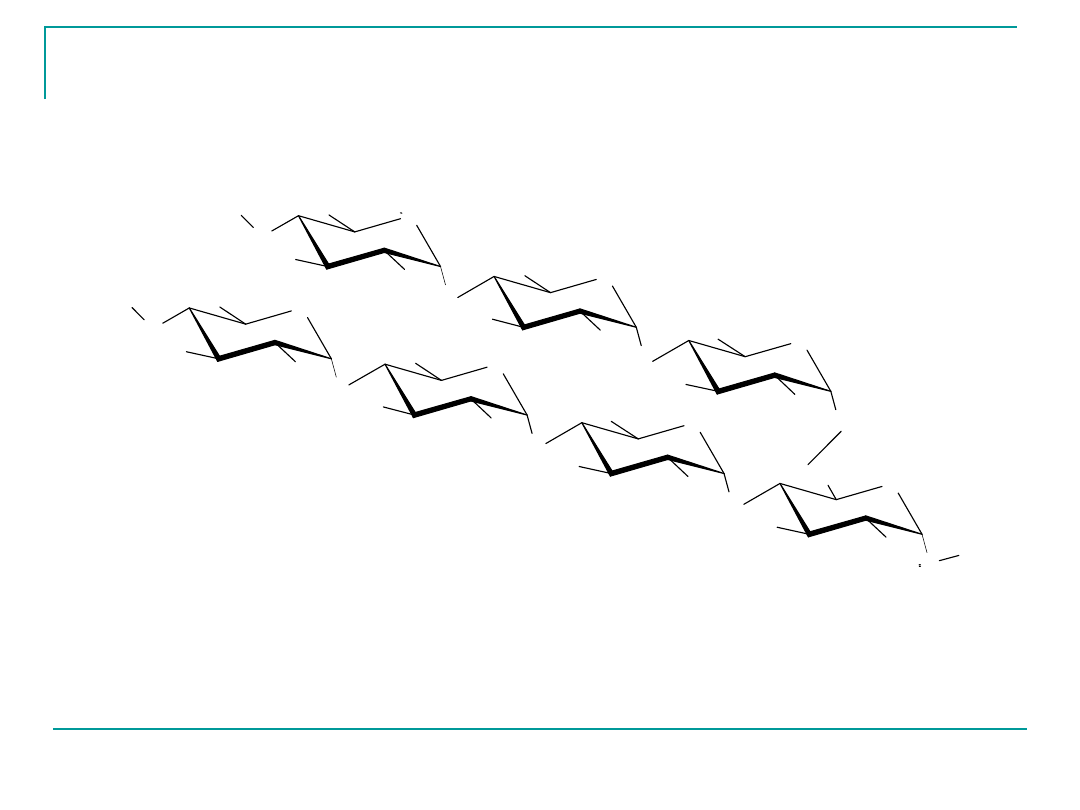
Budowa amylopektyny
O
OH
HOH
2
C
HO
O
O
OH
HOH
2
C
HO
O
O
OH
O
HOH
2
C
HO
O
O
OH
O
HOH
2
C
HO
O
O
OH
HOH
2
C
HO
O
O
OH
HOH
2
C
HO
O
O
OH
HO
O
CH
2
1
4
1
6
Amylopektyna
10 – 30 cząsteczek D-glukozy, ale rozgałęzione łańcuchy
(rozgałęzienie na C 6)

Gilkogen
Do polisacharydów zaliczany jest także glikogen (materiał
zapasowy
odkładany w wątrobie zwierząt , występuje również w
mięśniach).
Glikogen – ma budowę zbliżoną do amylopektyny, jego
cząsteczki są
jednak większe i jeszcze bardziej rozgałęzione
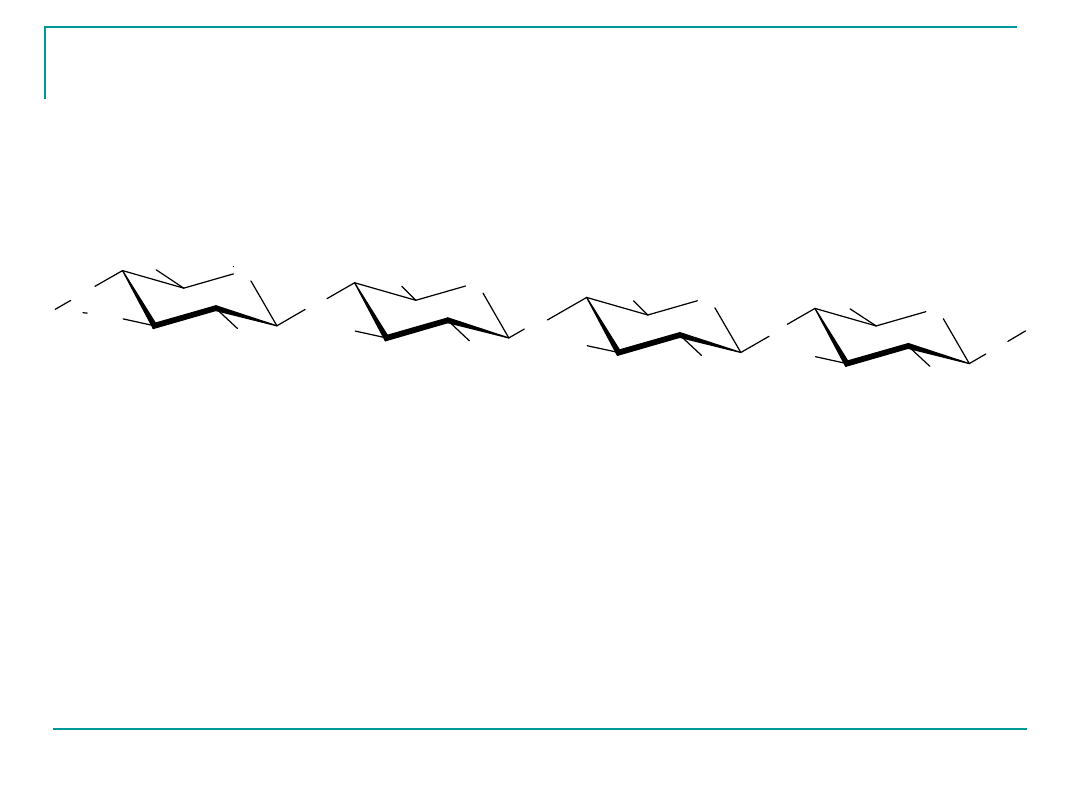
Celuloza
O
OH
O
HOH
2
C
HO
O
OH
O
HOH
2
C
HO
O
O
OH
O
HO
O
HOH
2
C
O
OH
HO
HOH
2
C
1
wiązanie -glikozydowe 1,4
(organizmy ludzi i zwierząt mięsożernych nie hydrolizują wiązania
β glikozydowego).
Celuloza i jej pochodne znajdują zastosowanie w przemyśle włókienniczym
i przy wytwarzaniu folii.

Budowa łańcuchów cukrowych w
polisacharydach
W polisacharydach łańcuchy cukrowe mogą być rozgałęzione
(glikogen, amylopektyna) lub o budowie liniowej (amyloza, celuloza).
łańcuch prosty (amyloza C1C4- udział w skrobii 20%)
(celuloza C1C4)
Łańcuch prosty
Łańcuch rozgałęziony
łańcuchy rozgałęzione
glikogen C1 C4 rozgałęzienie C6
amylopektyna (łańcuchy
10-30 cząsteczek glukozy)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
Wyszukiwarka
Podobne podstrony:
Wyk-ad 15 relacje
folder, 15 wyk-ad, Uczeń
folder, 15 wyk-ad, Uczeń
SPECJACJA Fe 15 10 2010 Podyp Wyk ad do, wicze
notatek pl KPA wyk ad 10
notatek pl KPA wyk ad 12
notatek pl KPA wyk ad 3
notatek pl KPA wyk ad 7
notatek pl KPA wyk ad 6
wyk ad 3 14.03.11 5 28.03.11 www.przeklej.pl, FiR, Notatki, Bankowość
Wyk ad IV Aneks Budzet MON 2007 pl
wyk ad psychologia przest pczo ci www.przeklej.pl, RESOCJALIZACJA, Przestępczość
notatek pl KPA wyk ad 8
notatek pl KPA wyk ad 1
mikroekonomia wyk ad iii ma y www.przeklej.pl, ZIiP, Semestr 1, MIKROEKONOMIA, WYKŁADY
notatek pl KPA wyk ad 5
więcej podobnych podstron