
Równowaga
kwasowo -
zasadowa
mgr Izabela Sałacińska

Definicja kwasów i
zasad – teoria
Bronsteda
- kwas – związek, który w danych
warunkach uwalnia jon wodorowy
(donor protonów)
- zasada – związek, który w danych
warunkach przyłącza jon wodorowy
(akceptor protonów)
Ze względu na to, że uwalnianie lub
przyłączanie jonów wodorowych
zależy od pH środowiska oraz stałej
dysocjacji kwasu, jeden i ten sam
związek może być w danym
środowisku kwasem lub zasadą.

Definicja kwasów i zasad
TEORIA BRONSTEDA
KWAS WĘGLOWY (H
2
CO
3
)
w warunkach fizjologicznych
H
2
CO
3
jest kwasem:
H
2
CO
3
H
+
+ HCO
3-
jon HCO
3-
jest zasadą
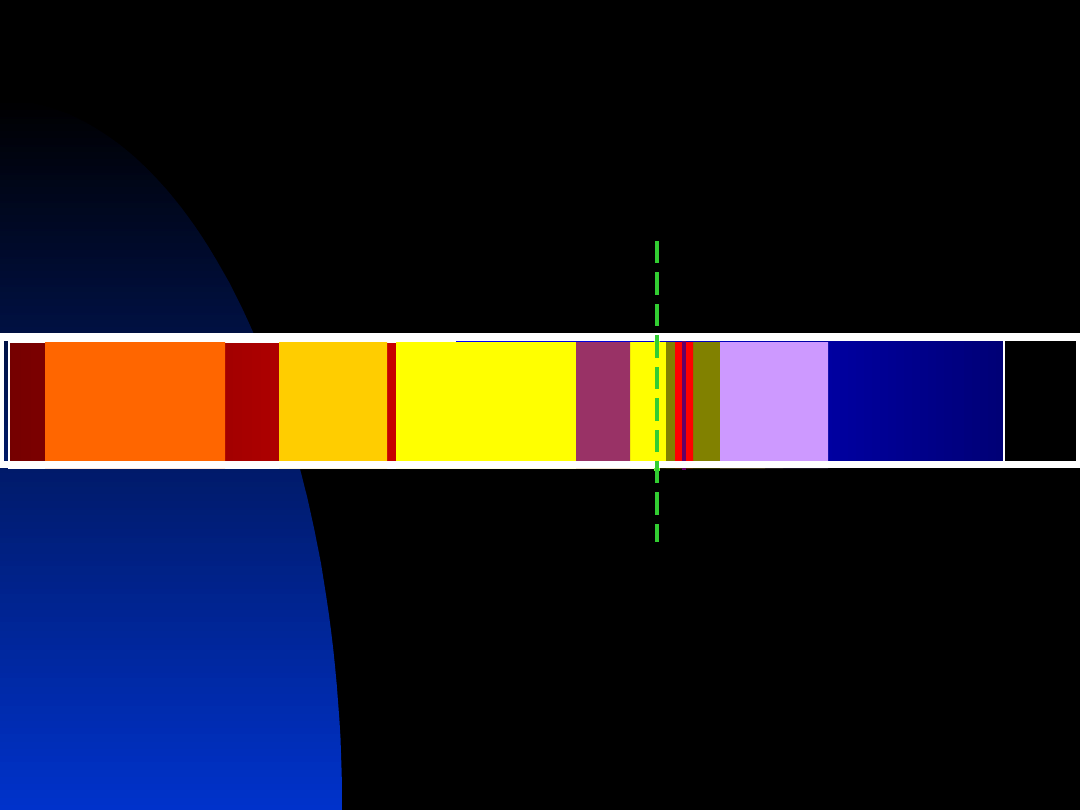
Stężenie jonów
wodorowych
pH płynów ciała
1
2
3
4
5
6
8
9
10
11
so
k ż
oł
ąd
ko
w
y
ślu
z p
oc
hw
y
m
oc
z
ślin
a
pły
n m
óz
go
w
o-r
dz
en
io
w
y
kr
ew
so
k t
rz
us
tk
ow
y
żó
łć
kwaśne
zasadowe
7

Stężenie jonów
wodorowych
Źródła jonów wodorowych
Stężenie jonów H
+
w płynach
ustrojowych zależy pośrednio od
nasilenia procesów katabolicznych
zachodzących w organizmie, natomiast
bezpośrednio od dysocjacji kwasu
węglowego i nielotnych kwasów.
Źródłem kwasu węglowego jest CO
2
powstający w procesie
dekarboksylacji.

Równowaga kwasowo-
zasadowa
Mechanizmy obronne
1. Układy buforowe – pierwsza i
natychmiastowa „linia obrony”
organizmu
2. Czynność układu oddechowego
3. Przemieszczanie jonów wodorowych
pomiędzy przestrzeniami wodnymi
organizmu
4. Czynność nerek

Zaburzenia równowagi kwasowo
– zasadowej przejawiają się
jako spadek lub wzrost
stężenia jonów H+, względnie
wartości pH we krwi. Kwasica
(przewaga kwasów) i
zasadowica (przewaga zasad)
to dwa podstawowe
zaburzenia równowagi
kwasowo – zasadowej.

Podstawowe zaburzenia:
1. Kwasica – nadmiar kwasów
albo niedostateczna ilość
zasad, pierwotna –
rozpoznawana jako wzrost
paCO2 > 45 mmHg lub spadek
stężenia wodorowęglanów
(HCO3¯) < 22 mmHg we krwi
tętniczej; wartość pH może
pozostać niezmieniona.

2. Zasadowica – nadmiar zasad
albo niedostateczna ilość
kwasów; pierwotna –
rozpoznawana jako wzrost
we krwi tętniczej stężenia
HCO3¯ > 26 mmol/l lub
spadek paCO2 < 36 mmHg;
wartość pH może pozostać
w zakresie normy.

3. Acydemia – wzrost stężenia
jonów H+ we krwi tętniczej
> 44 mmol/l; względnie
spadek pH < 7,35 we krwi.
4. Alkalemia – spadek stężenia
jonów H+ we krwi < 36
mmol/l, względnie pH >
7,45

W zależności od przyczyny zaburzenia
równowagi kwasowo – zasadowej
dzieli się na oddechowe,
metaboliczne i oddechowo –
metaboliczne; w zależności od
przebiegu na ostre i przewlekłe.
Ważne:
- uwarunkowane oddechowo
zaburzenia równowagi kwasowo –
zasadowej objawiają się początkowo
zmianami paCO2 i prowadzą do
zasadowicy lub kwasicy oddechowej
- metabolicznie uwarunkowane
zaburzenia równowagi kwasowo –
zasadowej objawiają się początkowo
zmianami stężenia HCO3¯ i wywołują
kwasicę lub zasadowicę
metaboliczną.
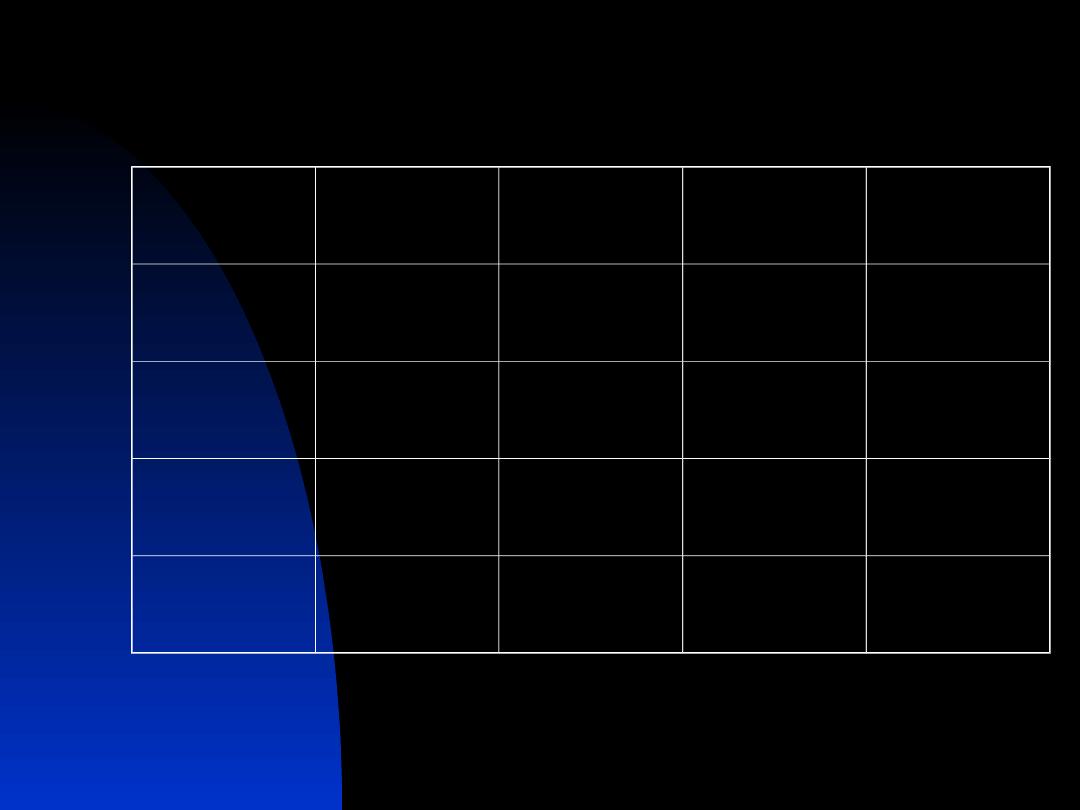
pH
pCO2
HCO3¯
BE
Kwasica
oddechowa
↓
↑
prawidłowe
prawidłowe
Zasadowica
oddechowa
↑
↓
prawidłowe
prawidłowe
Kwasica
metaboliczna
↓
prawidłowe
↓
↓
Zasadowica
metaboliczna
↑
prawidłowe
↑
↑
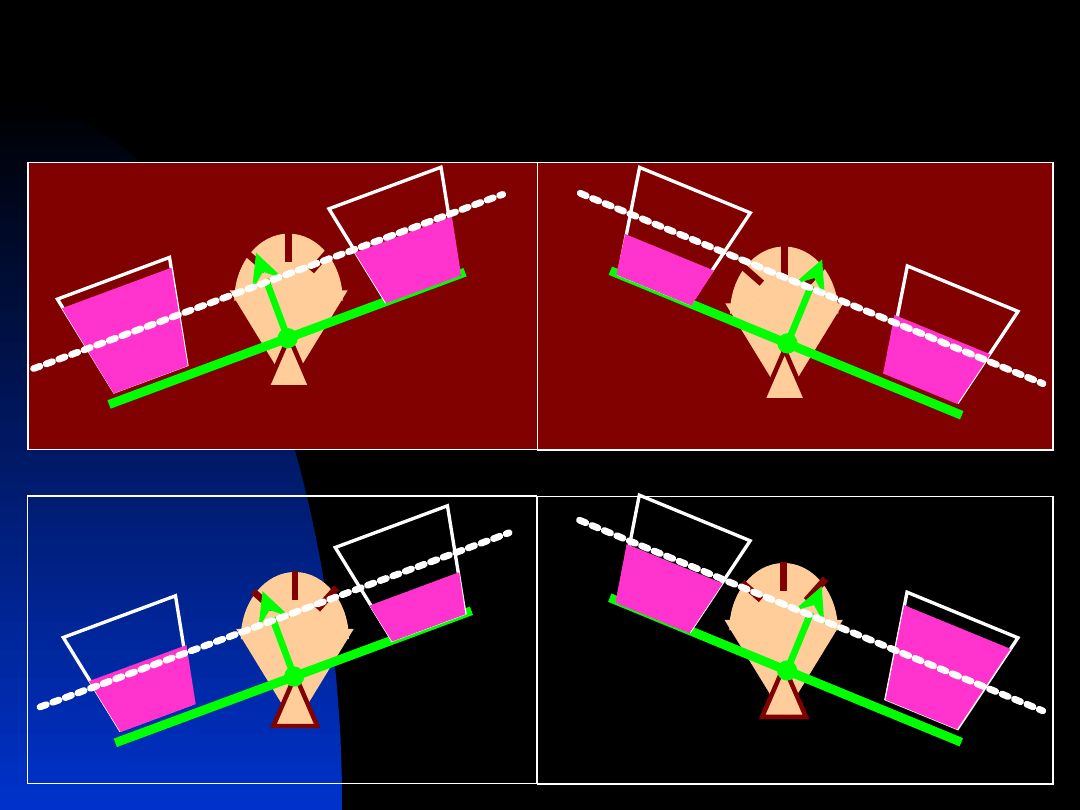
Zaburzenia RKZ
Główne rodzaje
L
ow
pH
Zasadowica metaboliczna
P
CO
2
HCO
3
-
norm
al
H
ig
h
L
ow
pH
Zasadowica oddechowa
P
CO
2
HCO
3
-
norm
al
H
ig
h
H
ig
h
pH
P
CO
2
HC
O
3
-
Kwasica oddechowa
nor
mal
L
ow
H
ig
h
pH
P
CO
2
HC
O
3
-
Kwasica metaboliczna
nor
mal
L
ow
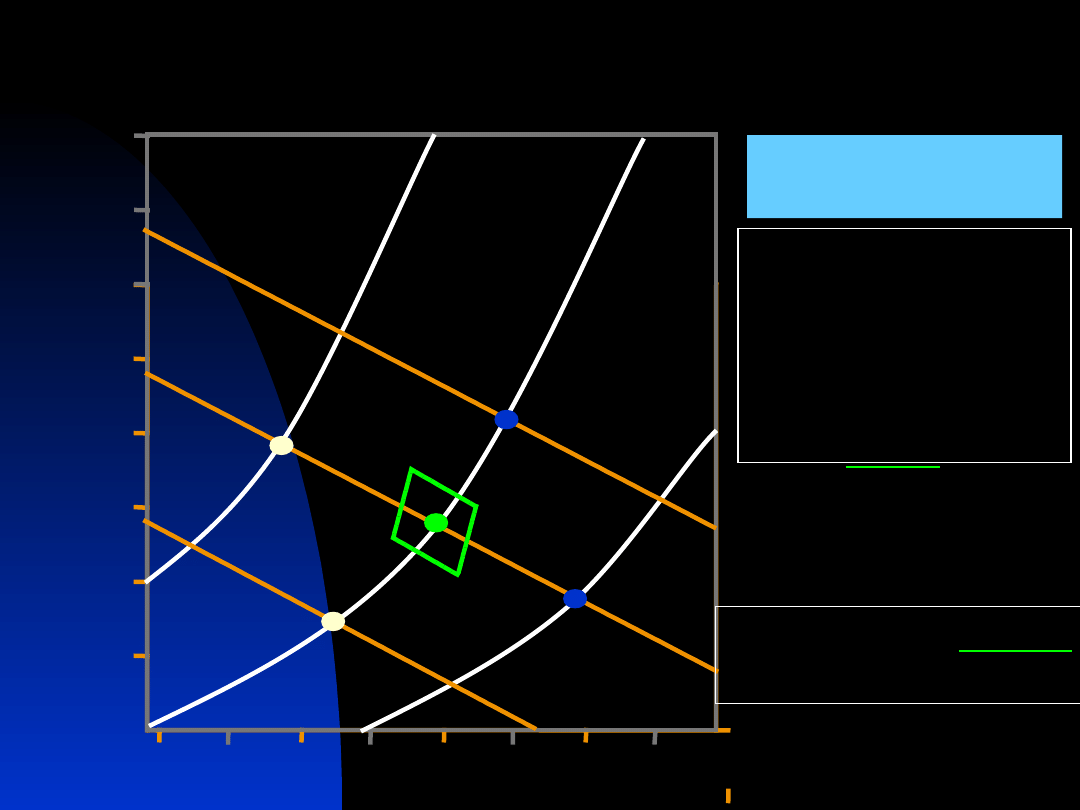
Zaburzenia RKZ
[H
C
O
3
-
]
P
CO
2
= 80
40
20
pH
7.0
7.2
7.4
7.6
7.8
10
20
30
40
50
Henderson-
Hasselbalch:
pH =
pK + log
[HCO
3
-
]
s
P
CO
2
Kwasica
oddechowa
Zasadowica
metaboliczna
Zasadowica
oddechowa
Kwasica
metaboliczna
pH = 6.1 +
Nerki
Płuca
or,
Diagram
Davenporta

Zaburzenia
oddechowe

Zaburzenia
oddechowe
1. Kwasica oddechowa – prosta lub
pierwotna kwasica oddechowa
polega na niewystarczającym
usuwaniu CO2 przez płuca. Ostry
wzrost paCO2 prowadzi do
zwiększenia się kwasu
węglowego w osoczu, z
odpowiednim wzrostem stężenia
jonów H+ i spadkiem pH. Po kilku
godzinach włączają się nerkowe
mechanizmy kompensacyjne,
które przy utrzymującej się
hiperkapni, osiągają maksimum
działania po około 3 – 5 dniach.

Przyczyny:
- płucne: zaburzenia lub choroby
dolnych dróg oddechowych,
miąższu płucnego lub naczyń
płucnych
- zewnątrzpłucne: zaburzenia lub
choroby centralnego lub
obwodowego układu nerwowego,
mięśni oddechowych, ściany klatki
piersiowej, opłucnej, górnych dróg
oddechowych lub błędne ustawienie
parametrów wentylacji w
respiratorze.

Objawy:
- zwiększa się dopływ krwi do
mózgu, zwiększa się ciśnienie
płynu mózgowo – rdzeniowego,
zmniejsza się pojemność minutowa
serca, pojawia się nadciśnienie
płucne
Rozpoznanie:
- gazometria
- pH krwi
- stężenie elektrolitów jest w normie

Leczenie kwasicy oddechowej
- Ostra kwasica oddechowa –
powinna zostać usunięta przyczyna
ją wywołująca, należy zadecydować
czy konieczna jest intubacja
dotchawicza i mechaniczne
wspomaganie oddychania
- Przewlekła kwasica oddechowa –
terapia powinna być
długoterminowa, decyzja odnośnie
intubacji dotchawiczej i wentylacji
mechanicznej zależy przede
wszystkim od rozwijania się
kwasicy.

2.
Zasadowica oddechowa – jest to uwarunkowany
hiperwentylacją pęcherzykową spadek PaCO2
< 36 mmHg, ze spadkiem stężenia jonów H+
i wzrostem pH.
W przypadku zasadowicy oddechowej płucna
eliminacja CO2 jest większa niż jego
produkcja w procesach tlenowej przemiany
materii. W ostrym nieskompensowanym
okresie, wartość pH jest zwiększona a
stężenie wodorowęglanów niezmienione.
W ciągu kilku minut po rozpoczęciu
hiperwentylacji następuje aktywacja układów
buforowych we krwi i dochodzi do spadku
stężenia HCO3¯, oprócz tego wzrasta
przejściowo stężenie obecnych kwasów
(np.mleczanów) we krwi.

W przypadku zasadowicy przewlekłej w ciągu
pierwszych 24 godzin uaktywniają się
mechanizmy kompensacyjne, które osiągają
maksimum działania po 2 – 3 dniach.
Przyczyny:
- reakcja na hipoksemię
- choroby płuc
- błędne ustawienie paramentów wentylacji w
respiratorze
- kontrolowana hiperwentylacja
- sepsa
- reakcja na kwasicę metaboliczną
- ciąża
- zaburzenia w obrębie centralnego układu
nerwowego
- ciężka niedokrwistość
- marskość wątroby, nadczynność tarczycy

Leczenie zasadowicy oddechowej
- uważa się, że leczenie
zasadowicy oddechowej jest
konieczne przy wartości
pH > 7,55
- postępowanie w pierwszej
kolejności ukierunkowane jest
na przyczynę, która ją wywołuje
- w przypadku błędnego
ustawienia parametrów
wentylacji należy skorygować
ustawienia respiratora

Zaburzenia
metaboliczne

Wszystkie nieoddechowe odchylenia
równowagi kwasowo – zasadowej
poza zakres fizjologiczny są nazywane
zaburzeniami metabolicznymi. W tym
przypadku można również wyróżnić
dwie pierwotne postacie:
- kwasica metaboliczna
- zasadowica metaboliczna
Zaburzenia metaboliczne mogą
występować łącznie z zaburzeniami
oddechowymi. W celu dokładnego
zróżnicowania tych zaburzeń
niezbędne jest wykonanie gazometrii
krwi tętniczej.

W celu zróżnicowania zaburzeń
metabolicznych i oddechowych
należy określić takie parametry
krwi tętniczej jak:
o
pH, względnie stężenie wolnych
jonów H+
o
PaCO2 – jako parametr
oddechowy
o
Nieoddechowe lub metaboliczne
zmienne: HCO3¯, zasady
buforujące, standardowe stężenie
wodorowęglanów, zasób zasad

Aktualne stężenie wodorowęglanów –
jest to stężenie HCO3¯ obecnie
występujące w osoczu. Jest ono
uzależnione od oddziaływań
oddechowych a także
nieoddechowych, z tego względu
jego wartość diagnostyczna jest
dość względna.
Standardowe stężenie
wodorowęglanów – jest to stężenie
HCO3¯ w osoczu próbki krwi w
pełni utlenowanej, przy
prawidłowym pCO2 o wartości 40
mmHg. Prawidłowe wartości: 22 –
26 mmol/l.

Zasady buforujące – jest to
suma buforujących anionów
krwi, składająca się z HCO3¯,
znajdującego się w
erytrocytach i osoczu, oraz
anionów hemoglobiny i białek
osocza. Zasady buforujące są
niezależne od PaCO2, na ich
stężenie wpływają tylko
zaburzenia nieoddechowe;
ulegają zmniejszeniu w
kwasicy metabolicznej, a
wzrastają w zasadowicy
metabolicznej. Prawidłowa
wartość – 48 mmol/l

Zasób zasad (nadmiar lub niedobór zasad –
BE) – zasób zasad określa ile kwasu
lub zasady jest potrzebne do
osiągnięcia przez krew prawidłowej
wartości pH 7,4. Jest to więc różnica
pomiędzy aktualnym stężeniem zasad
buforujących we krwi a ich stężeniem
po dodaniu do niej silnego kwasu lub
zasady aż do osiągnięcia pH 7,4 przy
PaCO2 40 mmHg w temp. 37°C.
Wartości prawidłowe: - 3 do + 3
mmol/l.

Nadmiar zasad jest określany jako
dodatnia rezerwa zasad i
oznaczany symbolem „+”, jest
charakterystyczny dla zasadowicy
metabolicznej.
Natomiast niedobór zasad określa
się pojęciem ujemnej rezerwy
zasad lub deficytu zasad i oznacza
się symbolem „-”, jest
charakterystyczny dla kwasicy
metabolicznej.

Zaburzenia
metaboliczne
1.
Kwasica metaboliczna – pierwotne stężenie
jonów H+ we krwi jest zwiększone. Wartości
pH, aktualne stężenie HCO3¯, zasady
buforujące, zasób zasad i standardowe
stężenie wodorowęglanów jest zmniejszone.
Luka anionowa
Stężenie anionów w osoczu musi odpowiadać
stężeniu kationów. W rzeczywistości
występuje jednak tzw. luka anionowa – czyli
różnica między sumą anionów (Cl¯, HCO3¯)
a sumą kationów (Na+, K+)

Kwasice metaboliczne ze względu
na przyczynę dzieli się na:
a)
Kwasica metaboliczna
przebiegająca z
poszerzeniem luki anionowej
b)
Kwasica mleczanowa
c)
Kwasica metaboliczna
przebiegająca z prawidłową
luką anionową

a)
Kwasica metaboliczna
przebiegająca z poszerzeniem luki
anionowej
Do najczęstszych przyczyn, które wywołują
tej rodzaj kwasicy są:
- kwasica mleczanowa
- przewlekła niewydolność nerek
- kwasica ketonowa: cukrzyca,
alkohol, głodowanie
- zatrucia: salicylanami, metanolem,
glikoetylenem, toluenem

b) Kwasica mleczanowa
Prawidłowe stężenie mleczanów w
surowicy wynosi 1 mmol/l;
podczas maksymalnego wysiłku
fizycznego może przejściowo
wzrosnąć do 20 mmol/l. kwasica
mleczanowa jest najczęstszą
kwasicą metaboliczną u
pacjentów na oddziałach
intensywnej terapii.
Śmiertelność wzrasta wraz ze
wzrostem stężenia mleczanów w
osoczu. Przy stężeniu w osoczu
> 5 mmol/l – ok.75%; przy > 10
mmol/l – powyżej 95%.

Kliniczne objawy kwasicy mleczanowej (rozwijają
się w ciągu kilku godzin, są niespecyficzne):
Wymioty i nietypowe bóle brzucha
Splatanie
Letarg
Śpiączka
Oddech Kussmaula
Odwodnienie
Hipotensja, tachykardia, skurcz naczyń
krwionośnych
Hipotermia
Rozpoznanie ustala się na podstawie
znacznego wzrostu stężenia mleczanów w
osoczu.

c) Kwasica metaboliczna przebiegająca
z prawidłową luką anionową
W tym rodzaju kwasicy stężenie
chlorków w osoczu jest
zwiększone. Cl¯ zastępuje w
osoczu utracony jon HCO3¯.
Najważniejszą przyczyną jest
utrata wodorowęglanów przez
przewód pokarmowy lub nerki (w
wyniku biegunki lub cewkowej
kwasicy nerkowej)

Diagnostyka kwasicy metabolicznej:
- rozpoznanie ustala się na
podstawie badania
gazometrycznego krwi; poprzez
pomiar stężenia elektrolitów w
surowicy można oprócz tego
określić lukę anionową i
dokładniej sklasyfikować daną
kwasicę
- prosta kwasica metaboliczna
charakteryzuje się niskimi
wartościami pH i zmniejszonym
stężeniem HCO3¯, przy
kompensacji oddechowej
zmniejsza się również pCO2 we
krwi tętniczej.

2. Zasadowica metaboliczna –
charakteryzuje się
zwiększonym stężeniem
HCO3¯ w osoczu,
zwiększonym w osoczu
dodatnim zasobem zasad i
wzrostem pH.

Przyczyny zasadowicy
metabolicznej:
Utrata kwaśnego soku
żołądkowego, wymioty,
drenaż przez sondę
żołądkową
Terapia diuretykami
Biegunka z utratą chlorków
Nadmierna podaż
wodorowęglanów i roztworów
je zawierających
Hiperaldosteronizm
Ciężki niedobór potasu
Niewydolność wątroby

Następstwa kliniczne:
Typowymi objawami zasadowicy
(oddechowej) są:
- nadwrażliwość nerwowo – mięśniowa
z parestezjami
- skurcze mięśniowe w obrębie
nadgarstka i stopy
- zawroty głowy
W przypadku zasadowicy metabolicznej
nie występują żadne objawy
kliniczne. Jeżeli objawy wystąpią to
związane są przede wszystkim z
odwodnieniem (uczucie osłabienia,
skurcze mięśniowe, oszołomienie)

Diagnostyka
- rozpoznanie ustala się na
podstawie analizy
gazometrii krwi
- przyczyną wywołującą
zasadowicę metaboliczną
często określa się na
podstawie wywiadu i
badania przedmiotowego
- zmierzenie ciśnienia
tętniczego, oznaczenie
stężenia elektrolitów w
osoczu, stężenie chlorków w
moczu

Pierwotna zasadowica
metaboliczna:
- pH > 7,44
- HCO3¯ > 26 mmol/l
- standardowe stężenie
wodorowęglanów > 25
mmol/l
- zasób zasad > +2 mmol/l

Leczenie:
- leczenie choroby
podstawowej
- podaż chlorków (NaCl lub
KCl)
- acetazolamid (hamuje
działanie anhydrazy
węglanowej, zwiększając
przez to wydalanie
wodorowęglanów z
moczem)
- podaż kwasu solnego

Prawidłowe
wartości krwi
tętniczej
pH krwi – 7,35 – 7,45
pCO2 – 32 – 45 mmHg
pO2 – 65 – 100 mmHg (80 –
100 mmHg)
Zawartość HCO3¯ - 21 – 25
mmol/l
Saturacja – 94 – 98 %
Zasób zasad BE +/- 2,5 mmol/l
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
Wyszukiwarka
Podobne podstrony:
Zaburzenia gospodarki kwasowo zasadowej
ZABURZENIA GOSPODARKI KWASOWO ZASADOWEJ ppt
Zaburzenia Gospodarki Kwasowo-Zasadowej, MEDYCYNA, Biochemia
Gospodarka kwasowo-zasadowa, Studia - materiały, Fizjologia
6 Zaburzenia gospodarki kwasowo zasadowej
Gospodarka kwasowo zasadowa 2005
Gospodarka kwasowo zasadowa 2007 ppt
Patologia gospodarka kwasowo zasadowa organizmu
Zaburzenia gospodarki kwasowo zasadowej 1(1)
Podstawowe mechanizmy w regulacji gospodarki kwasowo zasadowej
(4871) gospodarka kwasowo zasadowa
10 GOSPODARKA WODNO ELEKTROLITOWA I RÓWNOWAGA KWASOWO ZASADOWAid 10549 ppt
więcej podobnych podstron