
Rola metali
Jony metali odgrywają rolę
katalityczną i
strukturalną.
Enzymy możemy podzielić na:
1. Metaloenzymy - ponad 25% enzymów zawiera silnie
związany jon
metalu niezbędny do ich pełnej aktywności.
2. Enzymy aktywowane przez metal - wiążą metal
słabiej.

Aktywatorami są przeważnie jony metali
dwuwartościowych, np.
enzymy przekształcające ATP wymagają z reguły
obecności jonów Mg
2+
(fosforylazy, fosfohydrolazy),
jony wapnia Ca
2+
aktywują lipazy i trypsynę,
jony manganu Mn
2+
aktywują arginazę,
jony Zn
2+
i Co
2+
aktywują karboksylazy.

Enzymy działające poza komórką wymagają przeważnie
dla swojej
aktywności jonów wapnia np. enzymy krzepnięcia krwi.
Przez usuwanie jonów Ca
2+
z krwi (przez dodanie
cytrynianu,
szczawianu, wersenianu lub fluorku) można zahamować
proces
krzepnięcia krwi, co znalazło szerokie zastosowanie.

Z metali jednowartościowych do najważniejszych należą
K
+
i Na
+
np.:
K
+
- aktywuje acetylotransferazę cholinową.
Aktywatorami mogą być również aniony np.:
amylaza wymaga obecności Cl
,
SO
4
2
- aktywują sporadycznie peptydazy,
inne to Br
-
i NO
3
-
.

Metale - ułatwiają połączenie enzymu z substratem.
Mechanizm i rola metalu w działaniu enzymu:
ułatwia wytwarzanie związku pośredniego
przyłączając się
z jednej strony do apoenzymu a z drugiej do
substratu,
może sam uczestniczyć w reakcji np. w
przenoszeniu elektronów zachodzącym w
procesach oksydo-redukcyjnych
(układcytochromowy w łańcuchu oddechowym),
może stabilizować strukturę II, III i IV rzędową
białka enzymatycznego, np. α-amylaza zawierająca
wapń,
ułatwia wiązanie apoenzymu z koenzymem.

Dla kompleksów trójskładnikowych utworzonych między
miejscem aktywnym enzymu E, jonem metalu M i
substratem S możliwe są cztery schematy:
(1) Me—E—S - kompleks przez mostek enzymowy (liaza
cytrynianowa, syntetaza glutaminianowa, hydroksylaza
dopaminy).
(2,3) E—Me—S - prosty kompleks z mostkiem
metalowym lub cykliczny kompleks z mostkiem
utworzonym przez metal (kinaza pirogronianowa,
karboksylaza pirogronianowa, aldolaza, polimeraza DNA
i enolaza).
(4) E—S—Me - kompleks przez mostek substratowy
(kinaza kreatynowa, kinaza adenylanowa, kinaza
argininowa, kinaza 3-fosfoglicerynianowa).

HAMOWANIE ALLOSTERYCZNE.
ENZYMY ALLOSTERYCZNE
Posiadają dwa centra:
katalityczne i allosteryczne usytuowane
niezależnie.
Najczęściej mają budowę tetrameryczną.
Noszą nazwę enzymów regulatorowych często bowiem
od ich
aktywności zależy szybkość tworzenia się końcowego
produktu ciągu
przemian.
Katalizują zazwyczaj jedną z pierwszych reakcji danego
ciągu
reakcji.

Efektory allosteryczne mogą być dodatnie lub ujemne w
zależności od
ich działania aktywującego lub hamującego.
Efektorem enzymów może być substrat lub związek nie
będący substratem.
W zależności od rodzaju efektora enzymy allosteryczne
dzielimy na:
1. Homotropowe - cząsteczka substratu jest
jednocześnie efektorem.
Substrat łączy się z centrum katalitycznym i
allosterycznym enzymu.
2. Heterotropowe - efektorem jest cząsteczka różna od
substratu.
1. Homo-heterotropowe - efektorem jest substrat, a także
substancja
różna od substratu.
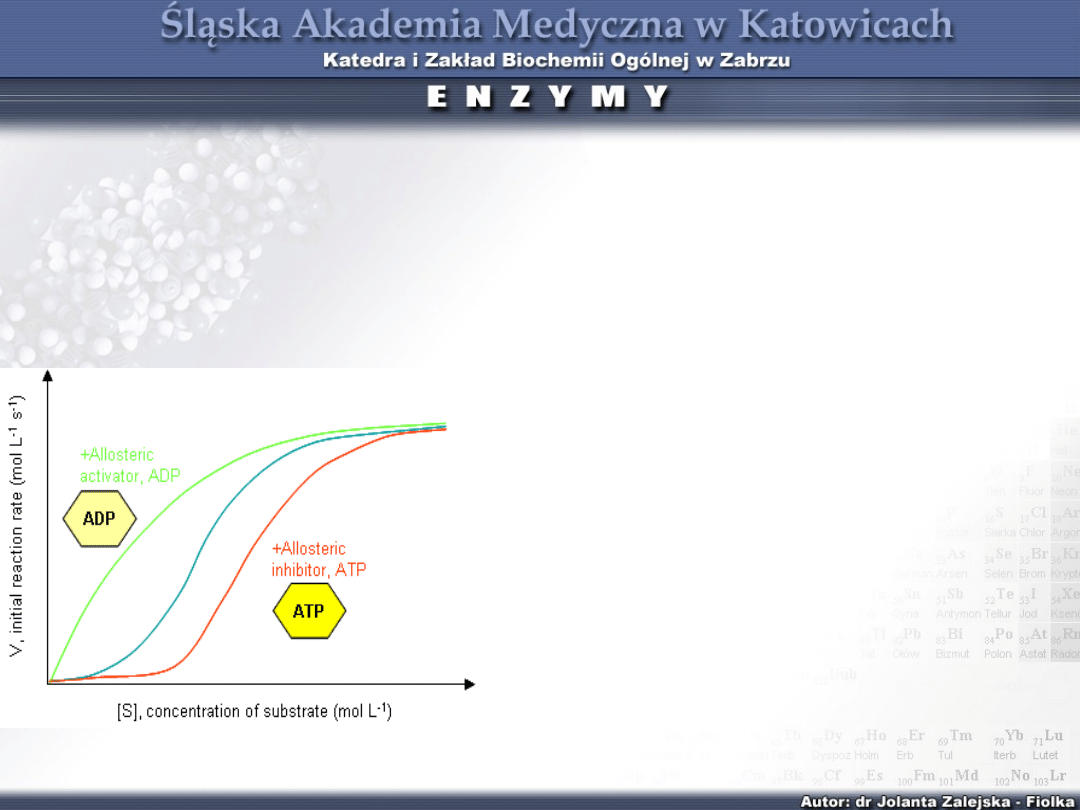
Pod wpływem efektorów dodatnich (+) przyłączonych
do centrum allosterycznego, centrum katalityczne
otwiera się i powinowactwo enzymu do substratu
wzrasta, zmniejsza się sigmoidalność i wartość S
0,5
np. cAMP jest efektorem dla kinazy białkowej.
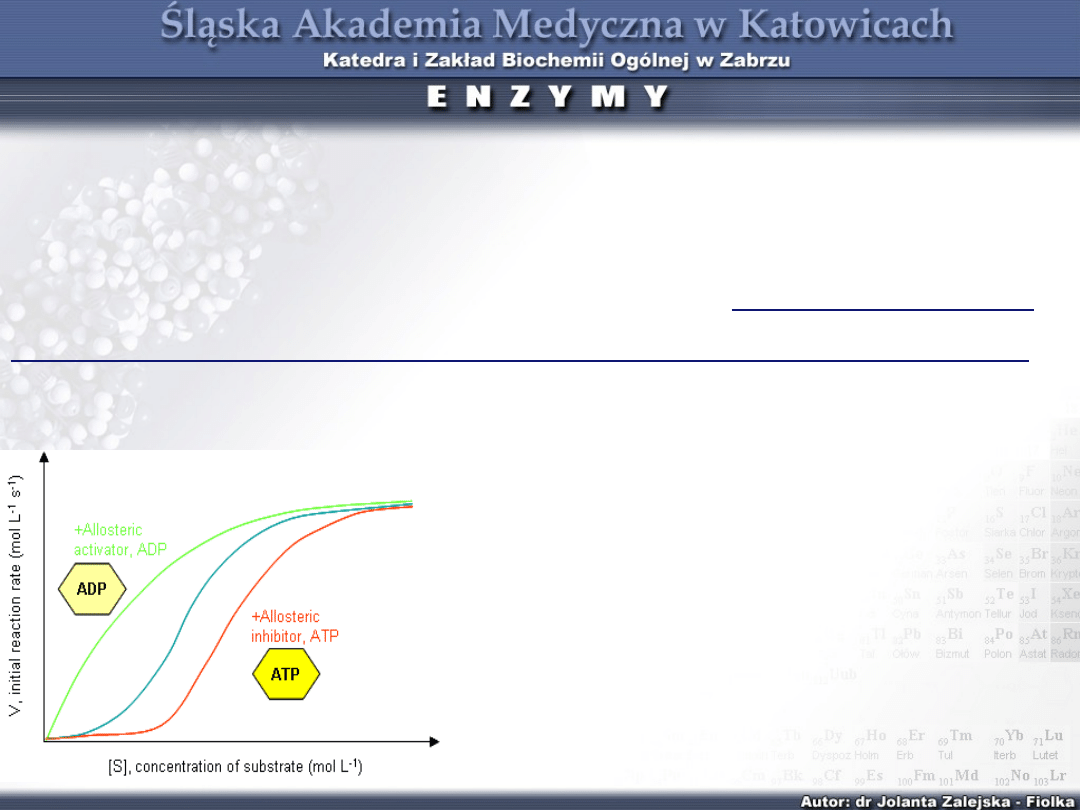
Pod wpływem efektorów ujemnych (-) przyłączonych
do centrum allosterycznego, centrum katalityczne
zamyka się i powinowactwo enzymu do substratu maleje,
rośnie sigmoidalność i wartość S
0,5
. Efektory ujemne
wykazują podobieństwa do inhibitorów kompetycyjnych
tj. obniżają powinowactwo enzymu do substratu,
zwiększając wartość S
0,5
(K
m
), a nie wpływają na V
m
, nie
wykazują jednak żadnego podobieństwa do substratu.

Często efektorami allosterycznymi mogą być
substraty
lub
produkty
danego
szlaku
enzymatycznego.
Efektorami allosterycznymi mogą być różne
związki:
- cAMP - w przypadku kinaz białkowych typu
A. cAMP przyłącza się do podjednostek
regulatorowych w wyniku czego następuje
uwolnienie jednostek, które stają się aktywne
katalitycznie.

Regulacja allosteryczna za pomocą
przyłączania tego typu związków jest
reakcją na sytuację energetyczną w
komórce.
Enzymy aktywowane przez ATP to
zazwyczaj
enzymy
związane
ze
szlakami biosyntezy, a aktywowane
przez przyłączenie AMP, ADP czy PPi to
enzymy
zwykle
uczestniczące
w
procesach katabolicznych.
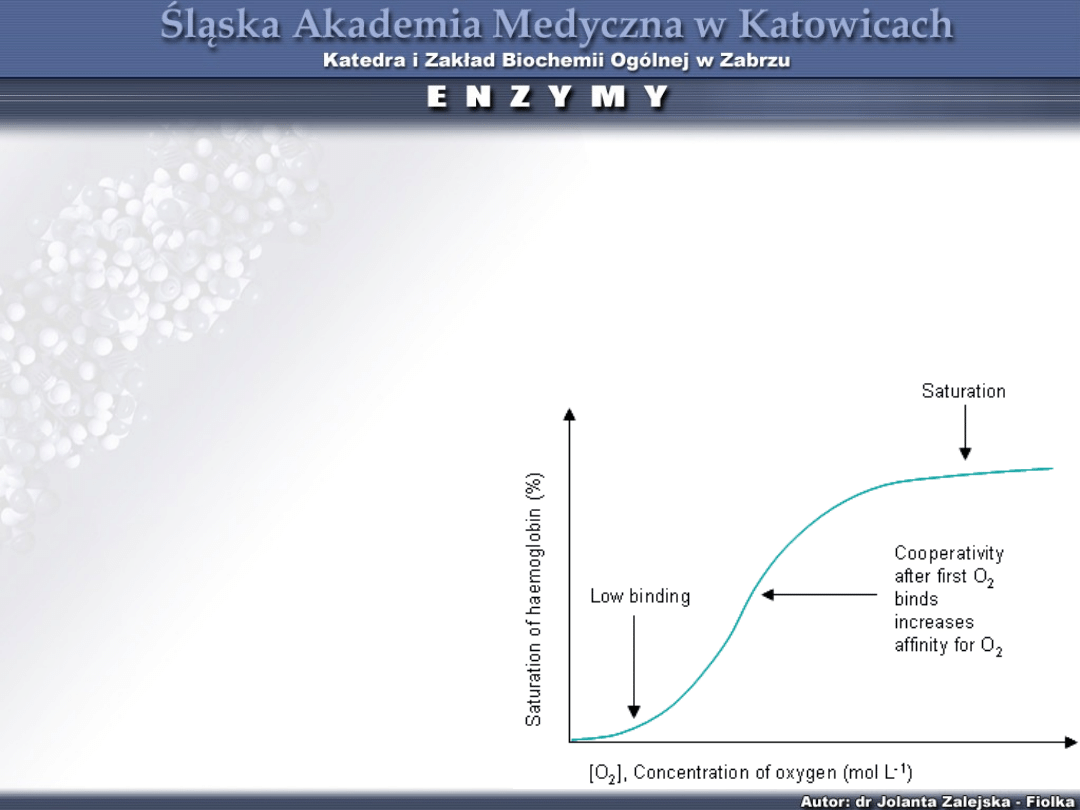
Kinetyka allosteryczna wskazuje na tzw.
„kooperatywność pozytywną” przyłączenie pierwszej
cząsteczki substratu do jednej z podjednostek zmienia
tak konformację sąsiednich podjednostek enzymu, że
następne cząsteczki substratu wiążą się z nimi z
większym powinowactwem.
Przykładem kooperatywności pozytywnej
jest proces łączenia się
hemoglobiny z tlenem.

Jeżeli natomiast przyłączenie jednej jednostki substratu
utrudnia związanie następnych mówimy o
„kooperatywności negatywnej”.
Przykładem może być dehydrogenaza aldehydu-3-
fosfoglicerynowego.
Pierwsza cząsteczka NADH
2
łączy się bardzo silnie z
podjednostką enzymu.
Znaczenie fizjologiczne: słabo związane cząsteczki
NADH
2
ulegają oddysocjowaniu i wymianie z NAD
+
.
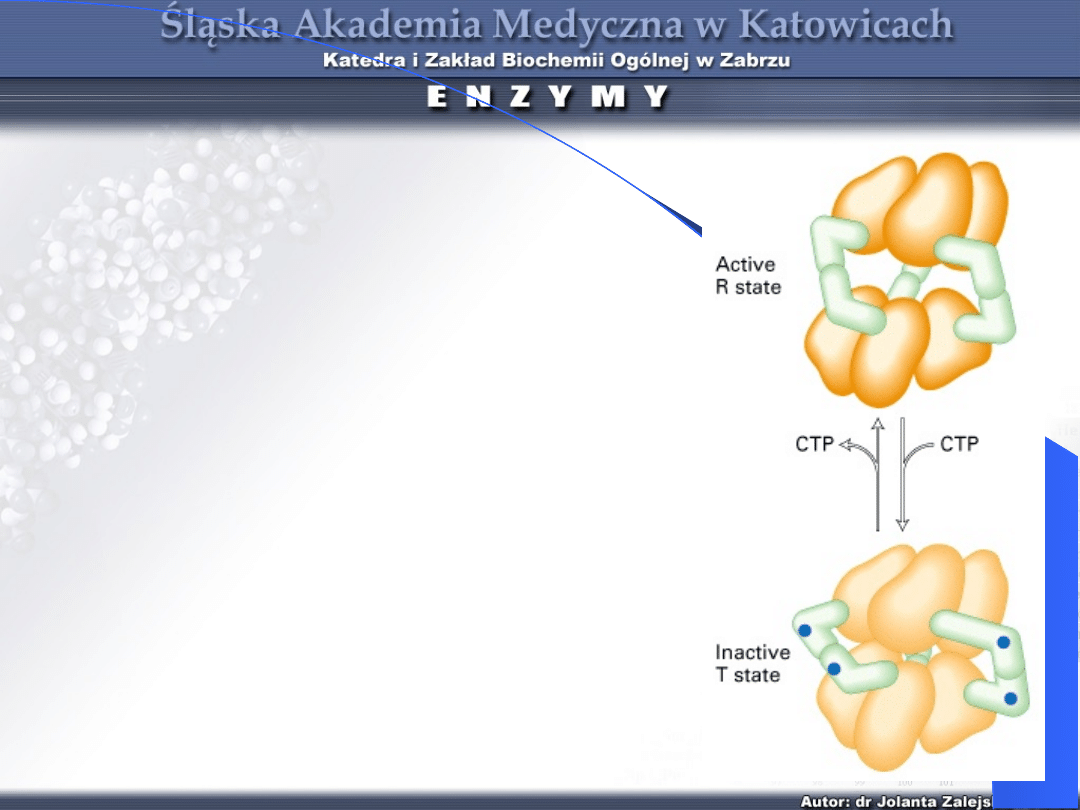
Karbamoilotransferaza asparaginianowa
Karbamoilotransfer
aza
asparaginianowa
Katalizuje
pierwszą
reakcję w biosyntezie
pirymidyn
–
zasad
będących składnikami
kwasów
nukleinowych.
Ostatecznie powstaje
CTP.

IZOENZYMY
Katalizują tą samą reakcję, ale występują w różnych
formach molekularnych.
Różnią się między sobą właściwościami:
- fizycznymi (temperaturą, migrowaniem w polu
elektrycznym),
- chemicznymi (powinowactwo do substratów,
koenzymów),
- immunologicznymi.

Aspekty kliniczne
Dehydrogenaza mleczanowa LDH
LDH
1-5
- duże znaczenie w diagnozowaniu choroby
nowotworowej, jej
zaawansowaniu i przerzutach np. u chorych z
nowotworami OUN
wzrasta aktywność LDH w płynie mózgowo-rdzeniowym,
przy
nowotworze żołądka wzrasta aktywność LDH w soku
żołądkowym.

Aldolaza
Jej brak wywołuje nietolerancję na fruktozę -
fruktozemia.
Jest to enzym rozwojowy, wyróżniamy:
- aldolazę A – występuje w tkankach, e. glikolizy,
rozkłada fruktozo-1,6-bisfosforan do aldehydu
3-fosfoglicerynowego i fosfodihydroksyacetonu,
najwcześniej pojawia się w rozwoju ontogenetycznym,
- aldolazę B – występuje w wątrobie i nieznacznie w
jelitach,
- aldolaza C – występuje w tkance nerkowej, soczewce
oka i w mózgu,
pojawia się w rozwoju ontogenetycznym najpóźniej.

Fosfataza zasadowa AP (i. wątrobowo-kostny, jelitowy,
łożyskowy).
Aktywność wzrasta:
- kostny w nadczynności przytarczyc, krzywicy, chorobie
Pageta, nowotworach kości (osteoblastoma), chronicznym
uszkodzeniu nerek
- wątrobowy w żółtaczce zaporowej, marskości i inn.
chorobach wątroby
- jelitowy nie wzrasta w chorobach jelita, ale u osób z
łojotokiem i marskością wątroby
- nerkowy – pojawia się u chorych z odrzutami po
przeszczepie nerek
- łożysko - podobny u chorych z nowotworami: izoenzym
Regana - nowotwór płuc, jajników, izoenzym Nagao -
rakowatość opłucnej, rak ogona trzustki i przewodów
żółciowych.

Amylaza
- śliniankowy – świnka, kamica przewodów żółciowych,
- trzustkowy – kamica żółciowa, zapalenie trzustki.
-Kinaza fosfokreatynowa CPK
CPK-MB > 5% całkowitej aktywności CPK zawał
mięśnia sercowego,
CPK-MB < 5% całkowitej aktywności CPK
uszkodzenie mięśni.

Przykłady enzymów jako leków:
Tkankowy aktywator plazminogenu i urokinaza –
leczenie choroby
zakrzepowej.
Lipaza – leczenie zaburzeń wydzielniczych trzustki.
Asparaginaza – leczenie białaczek.

Oznaczanie różnych enzymów w tkankach i płynach
fizjologicznych
odgrywa rolę w diagnostyce lekarskiej. Brak lub
niedobór pewnych
enzymów lub zmiana ich aktywności w wyniku zmiany
ich budowy jest
powodem wielu schorzeń, np.
1. Bielactwo wrodzone, albinizm, wrodzone zaburzenie
metabolizmu
tyrozyny (brak tyrozynazy), powodujące
zmniejszenie lub brak produkcji melanin
w komórkach barwnikowych
człowieka i zwierząt.
2. Fenyloketonuria, genetycznie uwarunkowany
niedobór enzymu (hydroksylazy fenyloalaniny)
uniemożliwiający przemianę fenyloalaniny w tyrozynę
(aminokwasy).

3. Galaktozemia, choroba wywołana mutacją punktową
blokującą aktywność enzymu rozkładającego
galaktozę (pochodzącą najczęściej z rozpadu laktozy)
do glukozy i w następstwie nadmierne jej gromadzenie
się w organizmie, co powoduje niedorozwój fizyczny i
umysłowy oraz utratę wzroku.
4. Methemoglobinemia, genetycznie uwarunkowany
niedobór układu
zależnej od NADH reduktazy methemoglobiny.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
Wyszukiwarka
Podobne podstrony:
K2 2009 10 zad 2 id 229691
psyikoty, Rok szkolny 2009-10, Ściągnięte z sieci
2009 10 13
Patofizjologi zagadnienia 2009 10
ż Pytania do wykladu Transport sI 2009 10, matematyka
K1 2009 10 zad 3
Zagadnienia egzaminacyjne 2009-10, Epi, Egzamin, pyt epi
Egzam.WILFIZYKA 2009 10, Budownictwo PK, Fizyka
2009 10 27
egz kon ETI EiT 2009 10
2009 10 27 19 40 Puszcze i bory z legenda 2xA4
2009 10 05 praid 26669 Nieznany
Technologie Informacyjne - tematy prezentacji dzienne 2009-10, Wiertnik, Technologie informacyjne, I
MAJ-PLAN, rok szkolny 2009-10 -dzieci4,5 letnie
KWIECIEŃ-PLAN, rok szkolny 2009-10 -dzieci4,5 letnie
2009 10 09 OZPN Praca Pisemna (2)
K2 2009 10 zad 3
Egzamin 2009 10
więcej podobnych podstron