
Ćwiczenie 9-12
cz.1
Obserwacja wzrostu
drobnoustrojów
na podłożach

POŻYWKI I PODŁOŻA
Pożywkami lub podłożami nazywa się mieszaniny
różnych związków chemicznych, które stwarzają
optymalne warunki dla rozwoju drobnoustrojów in vitro.
Pożywka powinna odpowiadać następującym
wymogom:
Odpowiednia wartość odżywcza
Odpowiednia izotoniczność podłoża
Odpowiedni odczyn pH
Klarowność
Sterylność

Odpowiednia wartość odżywcza
Podłoża powinny zawierać wszystkie konieczne składniki
zapewniające wzrost: źródło energii, węgla i azotu, jony, a także
pierwiastki śladowe.
pierwiastki biogenne – węgiel, tlen, wodór, azot, fosfor, siarka
(C, O, H, N, P, S),
mikroelementy,
źródło węgla - cukry (glukoza, maltoza, laktoza, celuloza,
skrobia),
źródło azotu
związki nieorganiczne (NaNO
3
, NH
4
, NO
3
)
związki organiczne (enzymatyczny hydrolizat kazeiny,
pepton - produkt trawienia białka pepsyną, aminokwasy)
Zawartość cukru i substancji białkowych w pożywce wynosi 0,5 - 2
%.

Odpowiednia izotoniczność podłoża
Ciśnienie osmotyczne musi być takie samo jak w
komórkach drobnoustrojów.
Uzyskuje się je przez dodanie do podłożą NaCl do uzyskania
stężenia 0,5 %.
Podłoże hipotoniczne (o niższym ciśnieniu osmotycznym niż
komórkowe), powoduje pęcznienie, a nawet pękanie komórek.
Podłoże hipertoniczne ( o wyższym ciśnieniu osmotycznym niż
komórkowe) następuje kurczenie się plazmy i oddzielenie od
ściany komórkowej.

Odpowiedni odczyn pH
Musi odpowiadać danej grupie drobnoustrojów, dla której
przygotowane jest podłoże.
Dla bakterii optymalny jest odczyn słabo alkaliczny pH = 7
(7,2 - 7,4), dla grzybów pH = 5,5 - 6,5.

Klarowność
Konieczna do wizualnego stwierdzenia wzrostu kultury (określenie
stopnia zmętnienia).
Nie dotyczy to podłóż zawierających składniki nierozpuszczalne np.
CaCO
3
.

Sterylność
Warunkuje prawidłową pracę w laboratorium, umożliwia poprawne
określenie cech morfologicznych, fizjologicznych i biochemicznych.

PODZIAŁ PODŁOŻY MIKROBIOLOGICZNYCH
I.
Wg właściwości fizycznych
(konsystencja):
1.
Płynne
2.
Półpłynne
3.
Stałe
II. Ze względu na charakter
składników:
1.
Naturalne
2.
Półsyntetyczne
3.
Syntetyczne
III. Ze względu na wartość
użytkową:
1.
Proste
2.
Wzbogacone
3.
Wybiórczo-
namnażające
4.
Różnicujące
5.
Kombinowane
6.
Specjalne

I. Podział pożywek ze względu na właściwości
fizyczne (konsystencję):
1. Płynne:
bulion,
mleko,
brzeczka (półprodukt stosowany przy produkcji piwa
przygotowywany ze słodu jęczmiennego, chmielu i innych
dodatków).
2. Półpłynne:
bulion z dodatkiem 0,15 - 0,5% agaru
3. Stałe:
podłoża żelatynowe (bulion + 10 - 15% żelatyny)
agarowe (bulion + 1,5 - 2% agaru)
ścięta surowica
ścięte podłoże jajowe
Rodzaj użytego podłoża zależy od naturalnego środowiska
drobnoustroju oraz celu w jakim jest hodowany.

Agar
wielocukier pęczniejący w wodzie,
składa się w 70% z agarozy i agaropektyny,
otrzymywany z glonów morskich (krasnorostów),
nie zawiera składników odżywczych,
nie jest na ogół przyswajany przez drobnoustroje,
rozpuszcza się w temp. ok. 96
o
C, schłodzony krzepnie w
temp. ok. 46
o
C,
produkowany w postaci włókien lub proszku.

Żelatyna
produkt degradacji kolagenu,
rozpuszcza się i krzepnie w temp. 20-25
o
C,
może być przyswajany przez drobnoustroje wytwarzające
enzymy proteolityczne,
używana do pożywek dla bakterii psychrofilnych; do
wykazania enzymu żelatynazy bakterii chorobotwórczych.
Żel krzemionkowy
stosowany do zestalania podłoży nie zawierających
składników organicznych.

II. Podział pożywek ze względu na charakter
składników
1. Naturalne
(wyłącznie składniki naturalne)
mleko, serwatka, bulion, brzeczka, wyciągi z gleby, ziemniaków,
drożdży, jaja, krew.
2. Półsyntetyczne
(syntetyczne związki chemiczne + składniki naturalne)
mleko z lakmusem,
agar ziemniaczany z tiaminą.
3. Syntetyczne
- każdy składnik znany jest jakościowo i ilościowo;
Zazwyczaj stosowane w postaci płynnej, konsystencję stałą nadaje się
poprzez zestalenie żelem krzemionkowym lub bardzo dokładnie
oczyszczonym agarem
pożywka Kozera,
pożywka Sołtysa
III. Podział pożywek ze względu na wartość
użytkową
1. Podłoża proste
pozwalają na rozwój większości bakterii
najszersze zastosowanie
podstawa do przygotowania innych typów pożywek
zaliczamy:
bulion odżywczy,
agar odżywczy,
żelatynę odżywczą
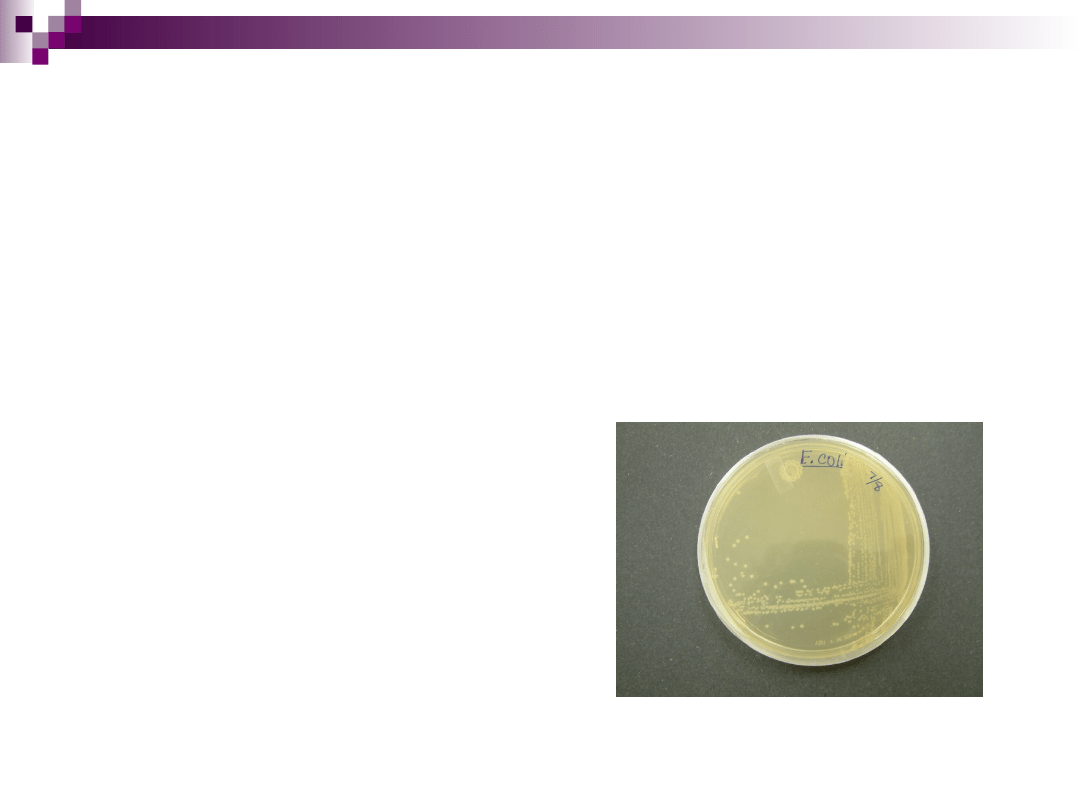
Hodowla E. coli

Do podłoży prostych
Przygotowanie wody mięsnej
Mięso oczyszczone z błon i tłuszczu, zmielone, zalewa się zimną wodą
wodociągową wzgl. destylowaną (1:2) i ekstrahuje w temp. 4 – 8
o
C
(10 – 12h) lub w 12 – 18
o
C (2 – 4h). Następnie gotuje się przez 45 – 60
min i sączy przez płótno, bibułę lub watę szklaną. Otrzymany
przesącz dopełniamy do pierwotnej objętości i wyjaławiamy w
autoklawie stanowi wodę mięsną, którą można przechowywać w
chłodni, wzgl. używać bezpośrednio do przygotowania bulionu czy
agaru odżywczego.
Bulion odżywczy
Zawiera wodę mięsną z dodatkiem 0,5% NaCl i 1-2% peptonu.
Chlorek sodu stwarza w podlożu odpowiednie ciśnienie osmotyczne, a
pepton (produkt trawienia białka pepsyną), zawierający polipeptydy i
wolne aminokwasy, wzbogaca pożywkę i umożliwia pobieranie azotu
bakteriom nie posiadającym enzymów rozkładających cząsteczki
białka.
2. Podłoża wzbogacone
służą do hodowli drobnoustrojów o znacznych
wymaganiach odżywczych
substancje wzbogacające:
krew 5-10%,
surowica,
wyciąg drożdżowy,
glukoza,
żółtko jaja.
Agar z krwią

3. Podłoża wybiórczo - namnażające
używane do wyosobniania tylko określonego gatunku
drobnoustroju z materiału silnie zakażonego inną florą,
podłoże podstawowe + czynnik wzmagający wzrost
danych bakterii + odczynnik hamujący wzrost
niepożądanych drobnoustrojów
Np. pożywka Müller-Kauffmanna:
żółć wzmaga namnażanie pałeczek rodzaju
Salmonella
zieleń malachitowa lub brylantowa hamuje wzrost
E.coli
pożywka SF wg Leifsona: dla Salmonella i Shigella -
inhibitorem wzrostu dla innych bakterii jest kwaśny
selenin sodowy.

4. Podłoża różnicujące
zawierają substancję, która musi być rozłożona
enzymatycznie przez określone szczepy bakterii, a przez
inne nie naruszona; takimi substancjami mogą być np.
cukry, alkohole, glikozydy,
stosowane do odróżniania poszczególnych gatunków
bakterii na podstawie ich odmiennych właściwości
biochemicznych,
do stałych pożywek różnicujących zaliczamy:
podłoże Krumwieda (Salmonella, Shigella, Escherichia,
Klebsiella),
podłoże Kliglera;
do płynnych: barwny szereg pożywek

5. Podłoża kombinowane (wybiórczo – różnicujące)
stosowane w odróżnianiu poszczególnych gatunków bakterii
na podstawie odmiennych właściwości biochemicznych,
ogólny skład:
podłoże odżywcze
substancja diagnostyczna
wskaźnik (indykator)
inhibitor (barwniki, antybiotyki, sole kwasów
organicznych)

Przykłady pożywek wybiórczo - różnicujących
Podłoże Chapmana
stosowane do izolacji gronkowców (Staphylococcus aureus i St.
epidermitis)
skład:
podłoże odżywcze - bulion + pepton + agar
substancja diagnostyczna - mannitol (rozkładany przez St. aureus)
wskaźnik - czerwień fenolowa (kolor różowy lub żółty, w zależności
od pH)
inhibitor - 7,5% NaCl
St. aureus rozkłada mannitol, co powoduje
zakwaszenie pożywki. Pod wpływem obniżonego
pH następuje zmiana barwy wskaźnika (czerwieni
fenolowej) z różowej na żółtą. Szczepy St. aureus
wyrastają w postaci dużych kolonii, średnicy 1-3
mm, otoczonych wyraźną żółtą strefą. Szczepy St.
epidermitis rosną w postaci kolonii białych. NaCl
spełnia tu rolę hamującą wzrost innych
drobnoustrojów.
Podłoże Chapmana
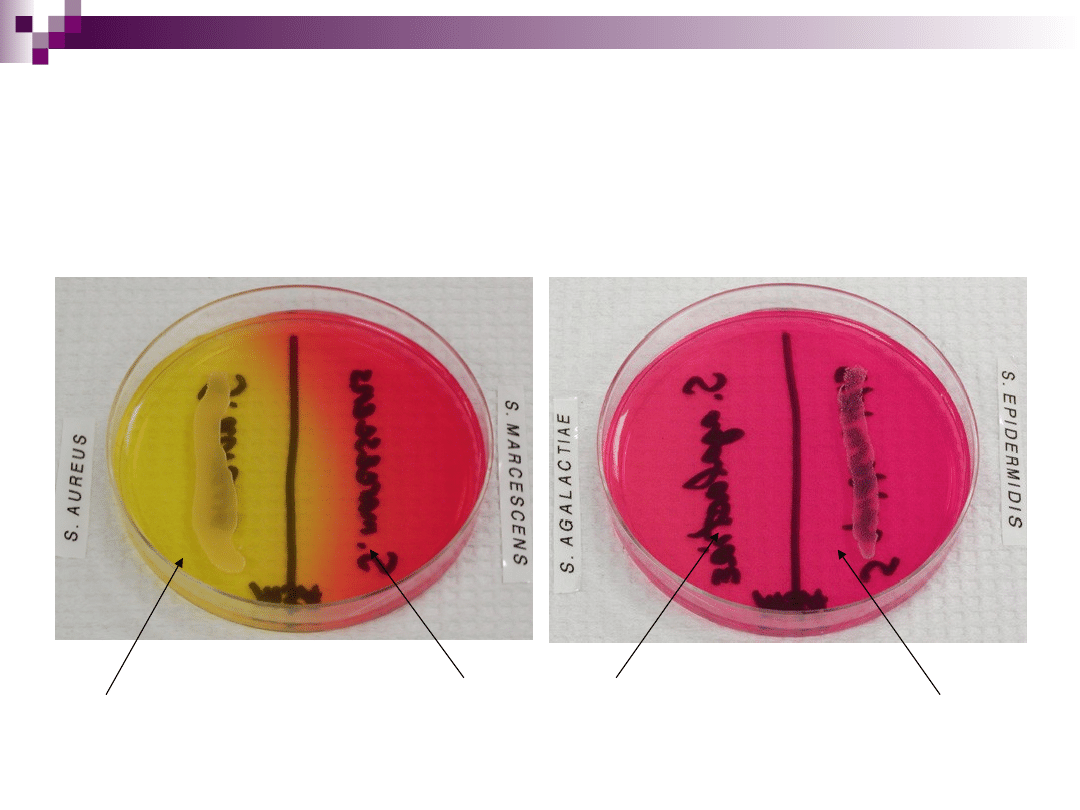
Wzrost gronkowców na podłożu Chapmana
Rozkład mannitolu
i wzrost na podłożu
(żółte kolonie)
Brak wzrostu i
rozkładu
mannitolu
Brak rozkładu
mannitolu i wzrost
na podłożu (kolonie
białe)
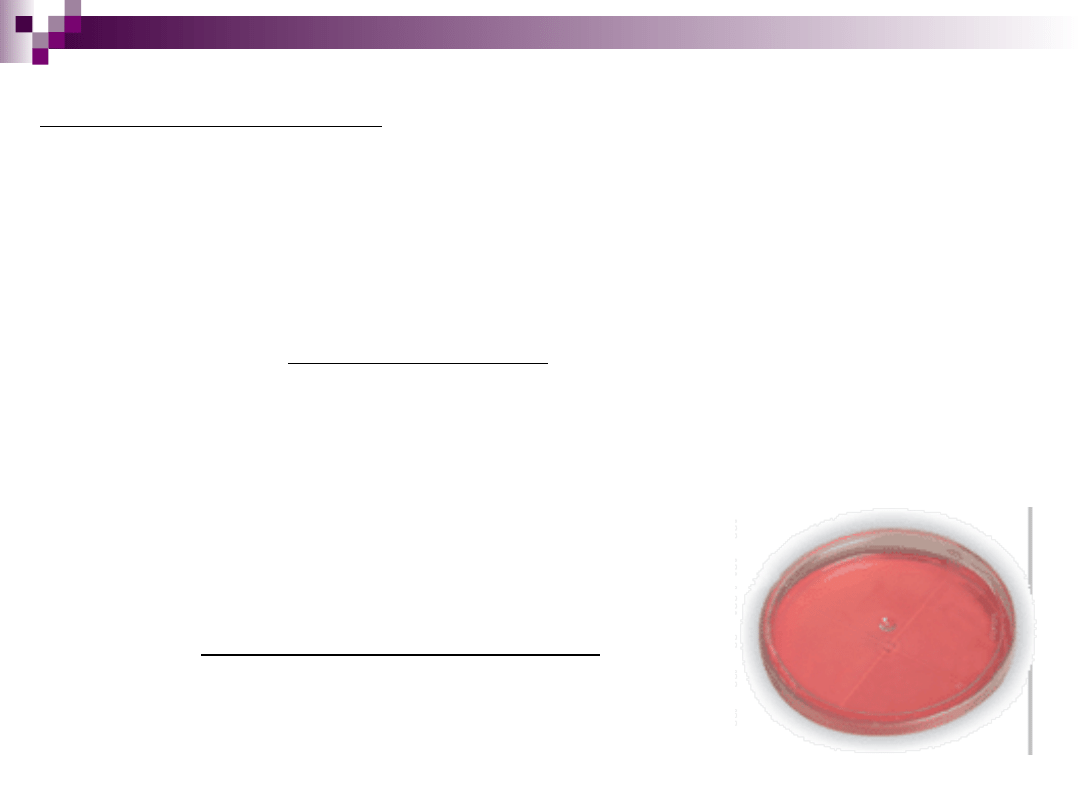
Podłoże MacConkey’a
stosowane do izolacji Shigella, Salmonella
skład:
podłoże odżywcze - bulion + pepton + agar
substancja diagnostyczna - laktoza (rozkładana przez bakterie
laktozo – dodatnie)
wskaźnik - czerwień obojętna (kolor czerwony lub buraczkowy)
inhibitor - sole kwasów żółciowych - dezoksyholan sodu
Wszystkie pałeczki Enterobacteriaceae rosną
obficie. Drobnoustroje, rozkładające laktozę,
powodują zakwaszenie pożywki, wskutek czego
następuje zmiana barwy wskaźnika czerwieni
obojętnej na czerwoną lub buraczkową.
Dodatkowo wokół wyrosłych kolonii wytrąca się
kwas dezoksyholowy. Kolonie drobnoustrojów
laktozo-ujemnych są bezbarwne, przejrzyste.
Rozwój drobnoustrojów Gram-dodatnich zostaje
zahamowany przez dezoksyholan sodu.
Podłoże MacConkey’a
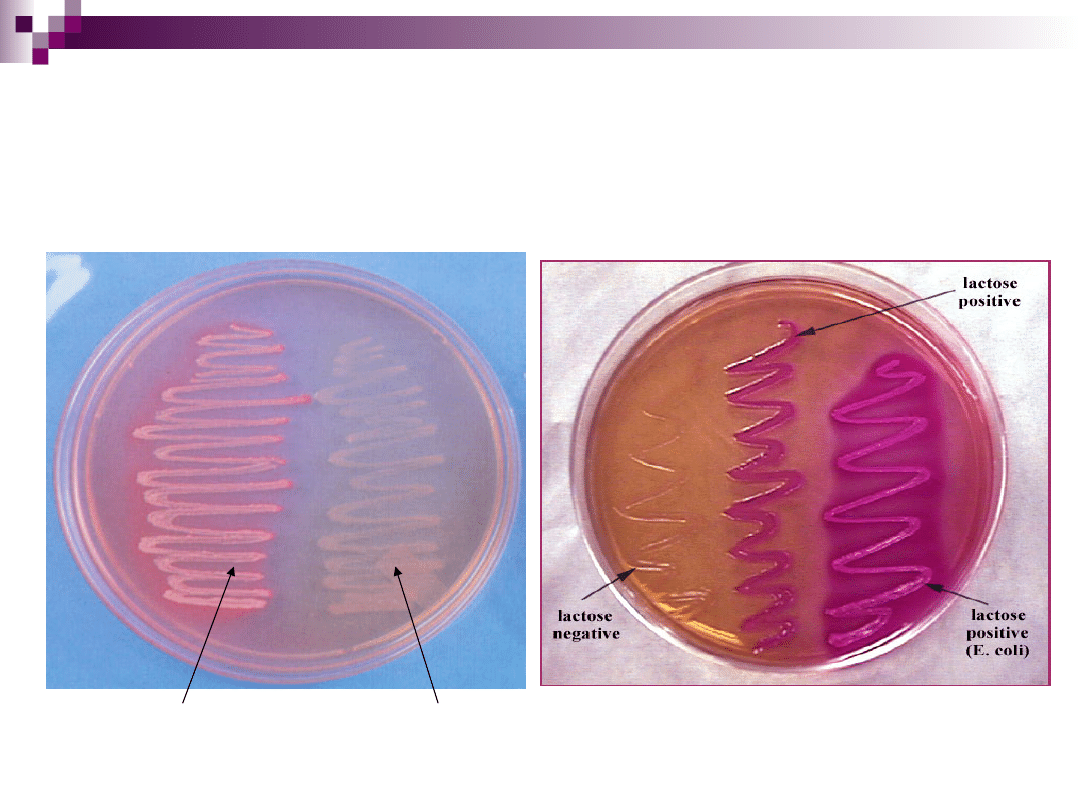
Wzrost bakterii na podłożu MacConkey’a
E. Coli
(laktozo - dodatnia)
Proteus
(laktozo - ujemny)

Pożywka Levine’a
stosowana dla pałeczek Enterobacteriaceae
skład:
podłoże odżywcze - bulion + pepton + agar
substancja diagnostyczna - laktoza i sacharoza
wskaźnik - eozyna
inhibitor - błękit metylenowy
Bakterie nie fermentujące laktozy lub
fermentujące ją z opóźnieniem tworzą kolonie
przejrzyste lub opalizujące. Drobnoustroje
fermentujące laktozę i sacharozę tworzą kolonie
intensywnie zabarwione na kolor
czerwonofioletowy z metalicznym, zielonkawym
połyskiem. Niektóre pałeczki, rozkładające
laktozę, tworzą kolonie przejrzyste z zabarwionym
środkiem. Do tej grupy należą również: pożywka
Wilsona-Blaira, Endo, Sołtysa, SS i inne.
Pożywka Levine’a
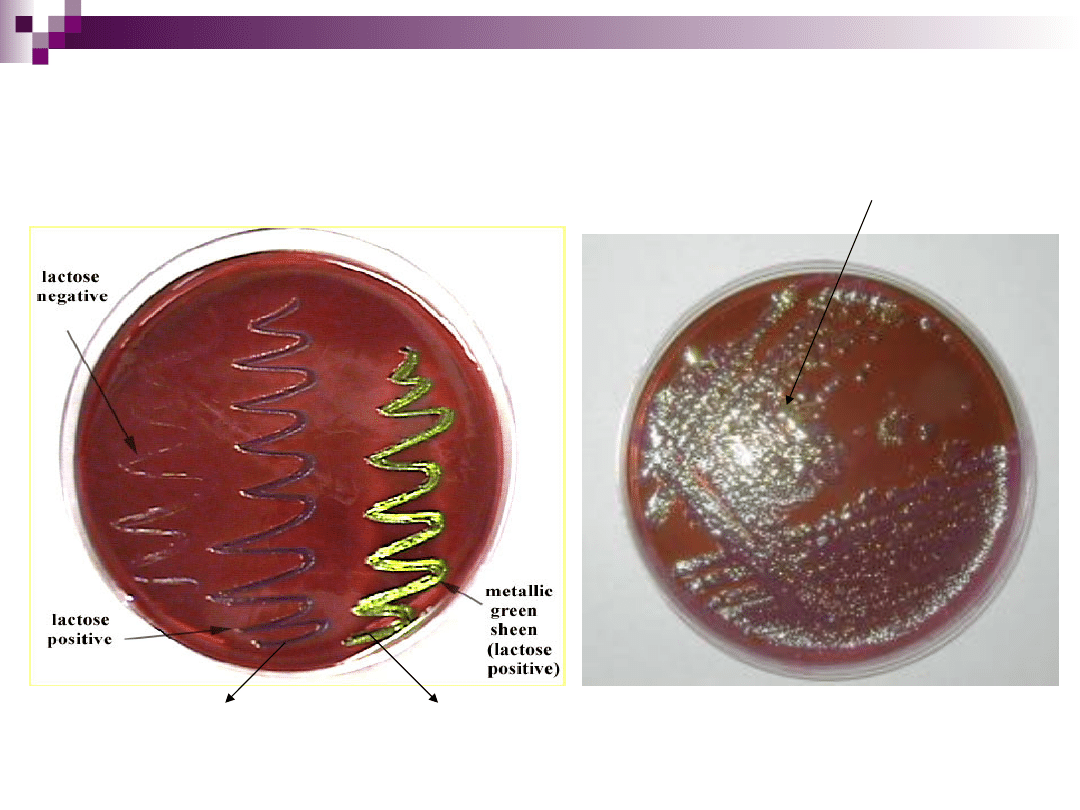
Wzrost bakterii na podłożu Levine’a
Podłoże EMB (Eosin methylene blue agar)
Podłoże
Levine’a
E. coli
E. coli silnie
rozkładająca
laktozę
Kolonie słabiej
rozkładające laktozę

6. Podłoża specjalne
przeznaczone do hodowli drobnoustrojów o szczególnych
wymaganiach odżywczych
do tej grupy zalicza się:
pożywkę Löfflera (maczugowce błonicy) - zawiera
surowicę cielęcą lub baranią
pożywka Löewensteina-Jensena (prątki gruźlicy) -
zawiera białka i żółtka jaj
pożywka Tarozziego-Wrzoska (hodowla beztlenowców)
- zawiera zmieloną wątrobę, pokryta jest warstwą
płynnej parafiny
agar czekoladowy (hodowla małych pałeczek)

Ważne terminy:
Kolonia – charakterystyczne dla rodzaju lub gatunku skupienia dużej
ilości komórek wyrosłych na pożywce zestalonej przy założeniu, że
rozmnożyły się one z jednej komórki bakteryjnej. Kolonie są najczęściej
widoczne gołym okiem.
Podstawowym wymaganiem w badaniach fizjologii i morfologii
drobnoustrojów jest praca z czystymi kulturami. Pod pojęciem tym
rozumie się hodowlę wyprowadzoną z jednej komórki bakteryjnej. Do
wyosabniania czystych kultur wykorzystuje się pożywki proste lub
wzbogacone. Uzyskana którymś z tych sposobów pojedyncza kolonia
bakteryjna stanowi jeden klon.
Kulturą mieszaną nazywamy hodowlę z różnymi gatunkami
drobnoustrojów.
Różne klony, należące do tego samego gatunku, izolowane niezależnie od
siebie nazywamy w mikrobiologii szczepami. Szczepy zachowują zwykle
literowe i numeryczne oznaczenia zaproponowane przez badacza, który
je izolował i zidentyfikował

Metody stosowane do wyosabniania czystych
kultur
Metody bezpośrednie
1. za pomocą mikromanipulatorów
Izolowanie pojedynczej komórki z wykorzystaniem mikromanipulatorów.
Badany materiał rozcieńcza się i pobierając z niego jedną kroplę
umieszcza się ją w specjalnej komorze aparatu, a następnie za pomocą
specjalnej pipetki wychwytuje się jedną komórkę, którą przenosi się do
kropli pożywki. Cała manipulacja musi przebiegać w warunkach
sterylnych.
2. kropelkowa – Lindnera
Badany płyn rozcieńcza się w takim stopniu, by w pobieranych kropelkach
znajdowały się komórki w ilości od 1 do kilku. Kropelki przenosi się za
pomocą mikropipetki pasterowskiej na szkiełko przykrywkowe i ogląda się
w komorze wilgotnej pod mikroskopem. Następnie wyszukuje się takie
kropelki, w których obecna jest tylko jedna komórka.

Metody pośrednie
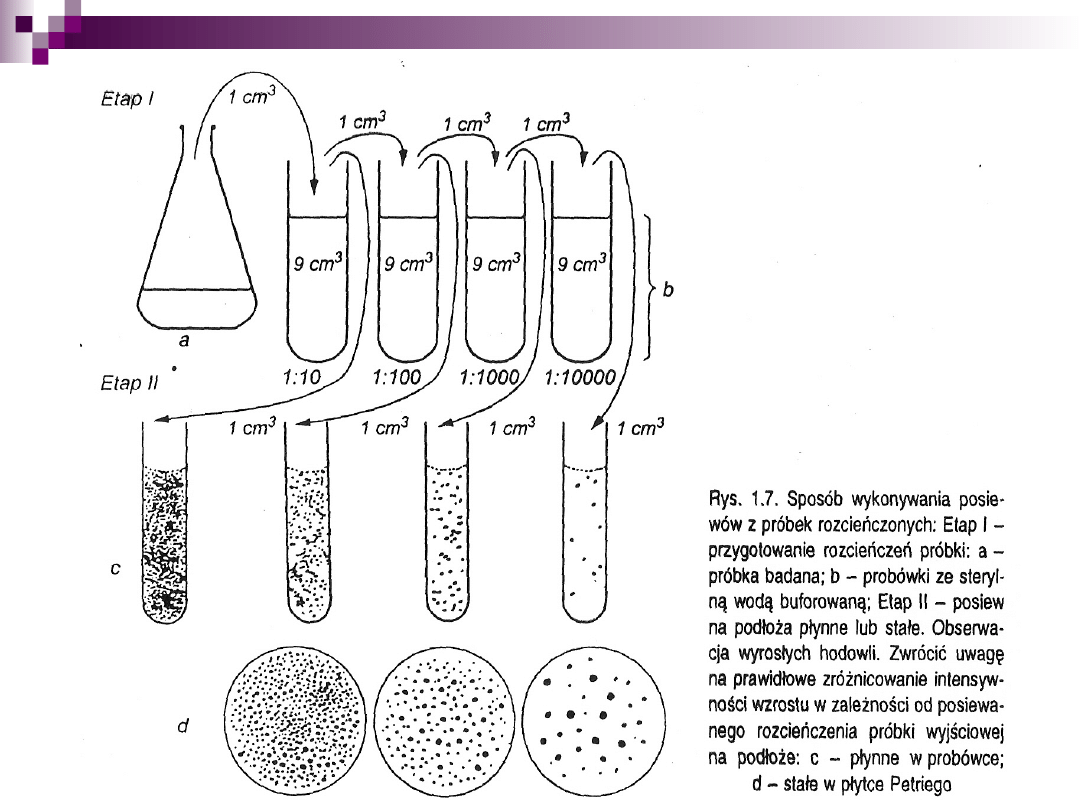
1. Metoda seryjnych rozcieńczeń Listera
Zasada tej metody polega na wielokrotnym sporządzaniu
rozcieńczeń do chwili uzyskania jednej komórki w kolejnym
rozcieńczeniu.
2. Metoda płytkowa Kocha
metoda rozsiewu na pożywkę stałą
metoda posiewu wgłębnego (płytek lanych)
metoda wysiewu powierzchniowego
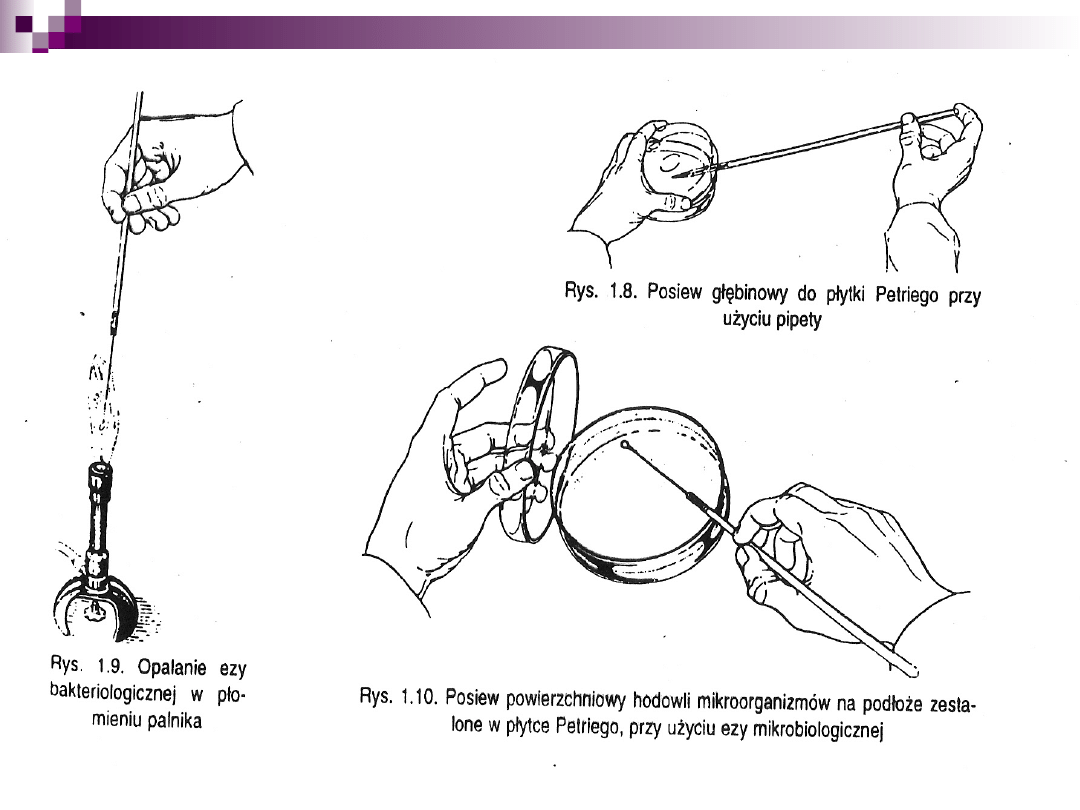
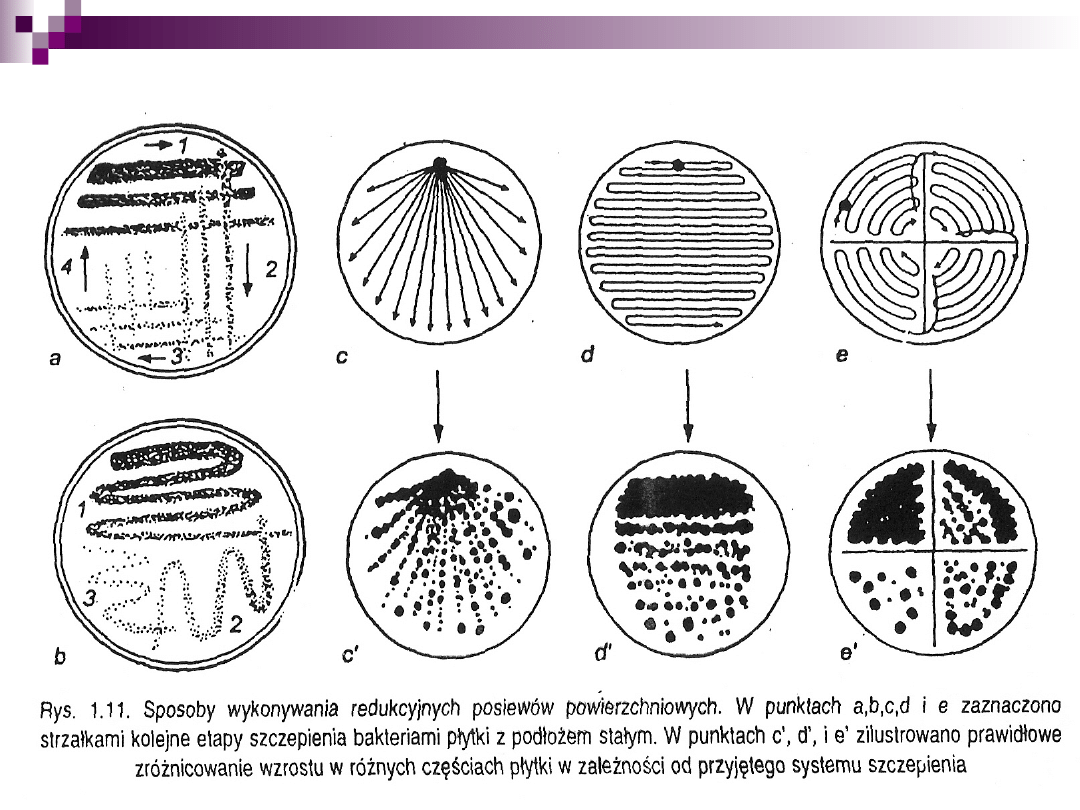
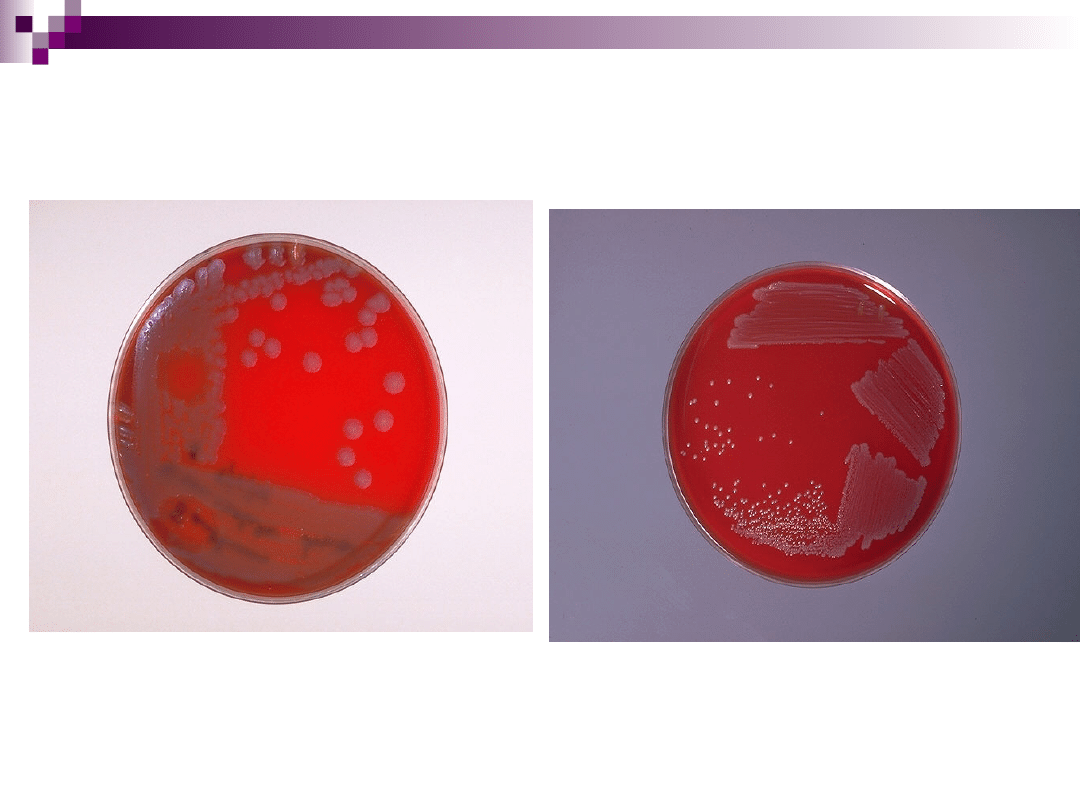
Posiew redukcyjny
Kolonie maczugowca błonicy
(Corynebacterium diptheriae)
na podłożu z krwią
Kolonie laseczek wąglika
(Bacillus anthracis)

Część praktyczna
1.
Wykonaj posiew z podłoża stałego kolonii wzorcowej na podłoże
stałe na płytce metodą posiewu redukcyjnego.
2.
Wykonaj posiew z podłoża stałego kolonii wzorcowej na:
podłoże w postaci słupka (słupek agarowy),
podłoże w postaci płynnej (pożywka bulionowa),
podłoże w postaci skosu (skos agarowy).
3.
Wykonaj posiew 0,5 ml płynnej hodowli bakteryjnej na podłoże
stałe metodą posiewu powierzchniowego.
4.
Nastaw płytkę na posiew z powietrza.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
Wyszukiwarka
Podobne podstrony:
plik (71) ppt
plik (80) ppt
plik (86) ppt
plik (22) ppt
plik (26) ppt
plik (48) ppt
plik (29) ppt
plik (40) ppt
plik (74) ppt
plik (78) ppt
plik (36) ppt
plik (67) ppt
plik (75) ppt
plik (55) ppt
więcej podobnych podstron