
1
Znaczenie
enzymów
w diagnostyce
Stempniewska Paulina
Kierunek lekarski
Gr. 6

2
Pojęcia
Enzymy- wyspecjalizowana grupa białek mających
zdolność katalizowania reakcji chemicznych.
Izoenzymy (izozymy)- homologiczne enzymy w obrębie danego
organizmu, które katalizują tę samą reakcję, ale różnią się
nieznacznie strukturą, oraz właściwościami regulacyjnymi i
kinetycznymi. Wykazują często pewnego stopnia swoistość
tkankową. Izozymia może dotyczyć enzymów zbudowanych z
więcej niż 1 podjednostek, np. dehydrogenaza mleczanowa,
kinaza kreatynowa.
Izoformy- różne formy tego samego enzymu w surowicy- różnice
wynikają z enzymatycznej modyfikacji przez surowicze
peptydazy, po uwolnieniu enzymu z tkanki (np. CK-MM1,
CK-MM2, CK-MM3).

3
Podział enzymów ze względu na rodzaj
przeprowadzanej reakcji
HYDROLAZY-
rozkładające substrat hydrolitycznie, z
jednoczesnym przyłączeniem cząsteczki wody
TRANSFERAZY
- przenoszące określoną grupę chemiczną (np.
aminową, acetylową) z jednego związku do drugiego,
OKSYDOREDUKTAZY
- przenoszące elektrony i protony do
odpowiedniego akceptora; dochodzi do zmiany stopnia utlenienia
IZOMERAZY-
przebudowujące strukturę cząsteczki bez zmiany
jej składu atomowego
LIAZY
- odszczepiające pewne grupy od substratu bez udziału
wody
LIGAZY
- katalizujące tworzenie nowych wiązań, czyli łączenie się
dwóch cząsteczek

4
Podział enzymów
Enzymy komórkowe
Miejscem ich działania są komórki
Związane są z różnymi organellami komórkowymi:
Cytoplazma,
Błona komórkowa,
Mitochondria,
Lizosomy,
Siateczka endoplazmatyczna.
Wszystkie enzymy komórkowe są enzymami
wskaźnikowymi
, nie wszystkie mają zastosowanie w
diagnostyce.

5
Podział enzymów
Enzymy pozakomórkowe
Są to enzymy produkowane przez komórki i
wydzielane do środowiska pozakomórkowego gdzie
pełnią swoje funkcje:
Enzymy sekrecyjne (wydzielnicze) np. osoczowe
Enzymy ekskrecyjne (wydalnicze) np. trawienne.

6
Enzymy wskaźnikowe
pojawiają się w dużych ilościach po
uszkodzeniu narządów
Należą do nich:
aminotransferaza asparaginianowa (AspAT),
aminotransferaza alaninowa (AlAT),
dehydrogenaza mleczanowa (LDH)
fosfataza zasadowa (ALP)

7
Enzymy sekrecyjne
Należą do nich:
czynniki krzepnięcia krwi oraz fibrynolizy,
esteraza cholinowa,
ceruloplazmina,
lipaza, amylaza
Po uszkodzeniach komórek wątroby zachodzi
spadek ich aktywności, ponieważ ich ilość zależy
od syntezy w rybosomach wątroby;

8
Enzymy ekskrecyjne
przeszkoda w normalnym odpływie różnych
wydzielin ustrojowych, takich jak: żółć, sok
trzustkowy, ciecz sterczowa czy ślina, powoduje
zastój wydzieliny i przedostanie się enzymów do
krwiobiegu
Do tej grupy należą enzymy:
soku trzustkowego,
żółci,
fosfataza kwasowa cieczy sterczowej.

9
Diagnostyka enzymologiczna
Wzrost aktywności enzymów może
być skutkiem:
Urazów zewnętrznych (zmiażdżenie),
Urazów wewnętrznych (krwotok),
Stanów zapalnych, procesów zwyrodnieniowych i
martwiczych (wirusy, bakterie, czynniki
chemiczne lub fizyczne),
Procesów nowotworowych

10
Przyczyny zmian aktywności
enzymów we krwi:
Zmiana przepuszczalności
błon komórkowych
Zwiększona proliferacja
komórek i indukcja enzymów
Rozpad komórek z wyniku
procesów patologicznych
Utrudniony odpływ
wydzieliny gruczołu,
zawierającej enzymy
ekskrecyjne
Upośledzenie syntezy
enzymu

11
Aminotransferaza
asparaginianowa (AspAT)
katalizuje reakcję:
L-asparaginian + α-ketoglutaran L-glutaminian +
szczawiooctan
enzym cytoplazmatyczny i mitochondrialny
występuje głównie w mięśniu sercowym, wątrobie,
mięśniach szkieletowych, nerkach
dawniej używany jako marker zawału serca
obecnie razem z AlAT jest markerem
uszkodzenia wątroby.

12
Aminotransferaza alaninowa
(AlAT)
katalizuje reakcję:
L-alanina + α-ketoglutaran L-glutaminian +
pirogronian
enzym cytoplazmatyczny
największa aktywność w wątrobie ale też w sercu,
mięśniach, nerkach
marker uszkodzenia wątroby
koenzymem obu aminotransferaz jest wit. B6
(fosforan pirydoksalu)

13
Dehydrogenaza mleczanowa
(LDH)
aktywna w tkankach, w których dominuje
glikoliza beztlenowa np. mięśnie, erytrocyty,
nerki, wątroba
tetramer, z 4 podjednostek (5 izoenzymów), w
surowicy najwyższy poziom LDH2, LDH1 i LDH3
katalizuje reakcję:
L-mleczan + NAD+ pirogronian + NADH +
H+

14
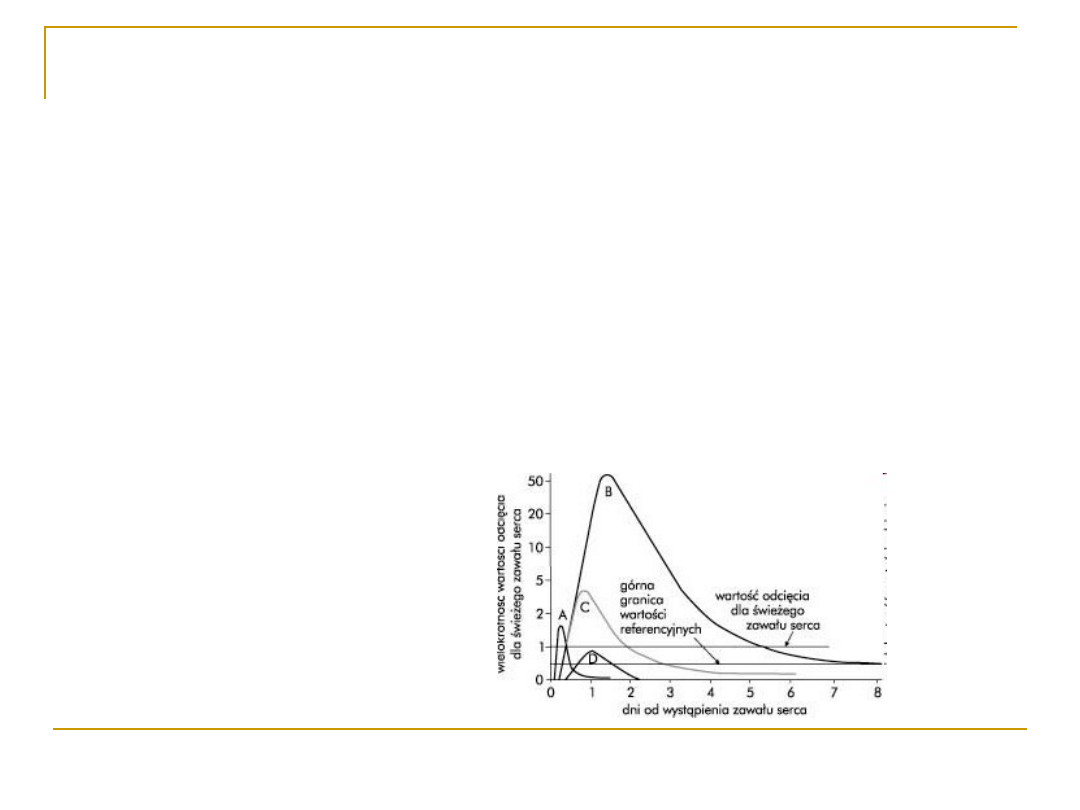
Dehydrogenaza mleczanowa-
wykorzystanie diagnostyczne
dawniej wykorzystywana do diagnostyki zawału
serca
obecnie jest tylko ogólnym wskaźnikiem
uszkodzenia tkanek, oznaczana coraz rzadziej, np.
w nowotworach
w specjalistycznych laboratoriach mają znaczenie
pomiary aktywności całkowitej jak i jej
poszczególnych izoenzymów

15
Dehydrogenaza mleczanowa –
metodyka oznaczania
Materiałem do badania jest świeża surowica,
próbka szybko odwirowana, bez śladu hemolizy.
Najczęściej stosowana metoda:
L-mleczan + NAD+ pirogronian + NADH + H+
Pomiar szybkości wzrostu absorbancji przy 340
nm jest wprostproporcjonalny do aktywności LDH.

16
Fosfataza zasadowa (ALP)
katalizuje reakcję hydrolizy monoestrów
fosforanowych w pH alkalicznym (optimum ok.
10):
R-O-PO3H2 + H2O R-OH +H3PO4
wydalana jest z żółcią, jest markerem
cholesterazy i ch. kości
we krwi występują izoenzymy pochodzące z
wątroby, kości (b-ALP), jelita, łożyska

17
Fosfataza zasadowa-
patologie
i odchylenia
patologiczny izoenzym tzw.
Regana – rakowołożyskowy –
marker nowotworowy, wydzielany
przez komórki nowotworowe
(jajnik, płuco, pierś, trzustka)
duże różnice aktywności w
zależności od wieku:
kobiety ciężarne (łożyskowy).
niemowlęta i dzieci w okresie
wzrostu (kostny).

18
Fosfataza zasadowa – metodyka
oznaczania
Najczęściej stosowanym substratem jest
p-nitrofenylofosforan, produktem reakcji jest
intensywnie żółty p-nitrofenol.
Miarą aktywności enzymu jest wzrost
intensywności zabarwienia w czasie (metoda
Bowersa i Mc Comba, manualna i automatyczna,
kinetyczna).

19
Esteraza cholinowa
(acetylocholinesteraza)
Rola w przekształcaniu ksenobiotyków, w tym
leków, jak sukcynylocholina (zwiotcza mięśnie) i
kokaina
Jej aktywność maleje w przebiegu wirusowego
zapalenia wątroby lub jej marskości, a także w
przypadkach zatruć środkami owadobójczymi
wrodzony brak powoduje nadwrażliwość na
działanie sukcynylocholiny, co może doprowadzić
do porażenia mięśni oddechowych
20
Ceruloplazmina (CER)
Syntetyzowana w wątrobie, zawiera 8 atomów
miedzi
Nie ma wpływu na obraz elektroforetyczny
Funkcje:
Katalizator oksydacji Fe2+ do Fe 3+
Utleniacz wielofenoli i diamin
Przeciwutleniacz osocza

21
Ceruloplazmina- odchylenia od
normy
Przyczyny podwyższonego stężenia:
Ciąża, stany zapalne
choroby zakaźne, nowotwory
zawał mięśnia sercowego, reumatoidalne
zapalenie stawów
Przyczyny obniżonego stężenia
genetycznie uwarunkowana choroba Wilsona,
polegająca na niedoborze ceruloplazminy, co
prowadzi m.in. do uszkodzenia wątroby
zespół nerczycowy, choroby wątroby
niedobór miedzi

22
Lipaza
tzw. lipaza trzustkowa – należy do esteraz
katalizuje rozkład estrów glicerolu i kwasów
tłuszczowych, najszybciej rozkłada triglicerydy
optimum pH wynosi 9, najefektywniej pracuje w
37°C w obecności soli kwasów żółciowych
badanie wykorzystywane w diagnostyce i
monitorowaniu ostrego zapalenia trzustki

23
Amylaza (diastaza)
najczęściej stosowany marker w diagnostyce
chorób trzustki
amylaza α i β to enzymy hydrolizujące wiązania
α-1,4-glikozydowe
α-amylaza hydrolizuje glikany zbudowane z co
najmniej 3 reszt glukozy
największą aktywność wykazuje w:
soku trzustkowym
ślinie
surowicy
moczu.

24
Fosfataza kwasowa (ACP)
Występuje w:
gruczole krokowym
erytrocytach
trombocytach
wątrobie
kościach
Stosowany w diagnostyce raka prostaty (ułatwia
ocenę stopnia zaawansowania choroby i efektów
jej leczenia)
Skuteczna terapia obniża poziom ACP
Postęp choroby podwyższa poziom ACP

25
Kinaza kreatynowa (CK)
jest enzymem cytoplazmatycznym i mitochondrialnym
dimer, 2 jednostki B i M – 3 izoenzymy:
CK-BB (1) – mózg,
CK-MM (3)– mięśnie szkieletowe,
CK-MB (2)– mięsień sercowy.
dodatkowo występuje CK-Mt izoenzym mitochondrialny
katalizuje reakcję:
fosfokreatyna + ADP kreatyna + ATP
26
Kinaza kreatynowa
aktywność CK zależna jest od wieku, płci, rasy,
pory roku, rośnie po dużym wysiłku
jest sygnałem uszkodzenia mięśnia sercowego,
mięśni szkieletowych, zatoru tętnicy płucnej
obecnie największą wartość diagnostyczną ma
oznaczanie izoenzymu CK-MB w diagnostyce
zawału mięśnia sercowego

27
Bibliografia:
E. Bańkowski, Biochemia. Podręcznik dla
studentów uczelni medycznych
R. K. Murray, D. K. Granner, V.W. Rodwell,
Biochemia Harpera ilustrowana
internet
28
Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
Znaczenie enzymów cytochromu P450
religijne znaczenie wyjścia z niewoli egipskiej
Budowa, wystepowanie i znaczenie biologiczne disacharydow
Znaczenie liści dla roślin
Enzymologia 4
Znaczenie rodziny w opiece
1 wykład1 gosodarcze znaczenie gorzelnid 10093 ppt
Modul 1 ZNACZENIE JAKOSCI
znaczenie postawy nauczyciela w zapobieganiu agresji i przem
AKTYWNOŚĆ ENZYMÓW PRZECIWUTLENIAJĄCYCH!
strategiczne znaczenie nowych technologii
07 Modyfikacje struktury enzymówid 7062 ppt
Znaczenie wiechliny łąkowej (Poa pratensis L ) w zadarnieniu
Enzymologia materiały do ćwiczeń
enzymologia
MP 5 Doskonalenie cech produkcyjnych mikroorganizmów o znaczeniu przemysłowym cz 1
b Obraz 2 znaczenie podstawowych poj
więcej podobnych podstron