
Fosfolipidy inozytolowe
w przekazywaniu informacji w komórkach
Paulina Jasińska
Dominika Kierus

Fosfolipidy inozytolowe
Biorą udział w przekazywniu informacji jako wtórne
przekaźniki.
Stanowią mniej niż 10% błon komórkowych ssaków.
Znajdują się po wewnętrznej stronie błony
plazmatycznej.
Występują w trzech różnie ufosforylowanych
formach: fosfatydyloinozytolu (PI),
fosfatydyloinozytolo-4-fosforanu (PIP) i
fosfatydyloinozytolo-4,5-bisfosforanu (PIP
2
). Stopień
fosforylacji tych związków jest ciągle zmieniany w
obecności ATP przez dwa rodzaje enzymów: PI i PIP-
kinazy i odpowiadające im PIP
2
i PIP-
fosfomonoesterazy
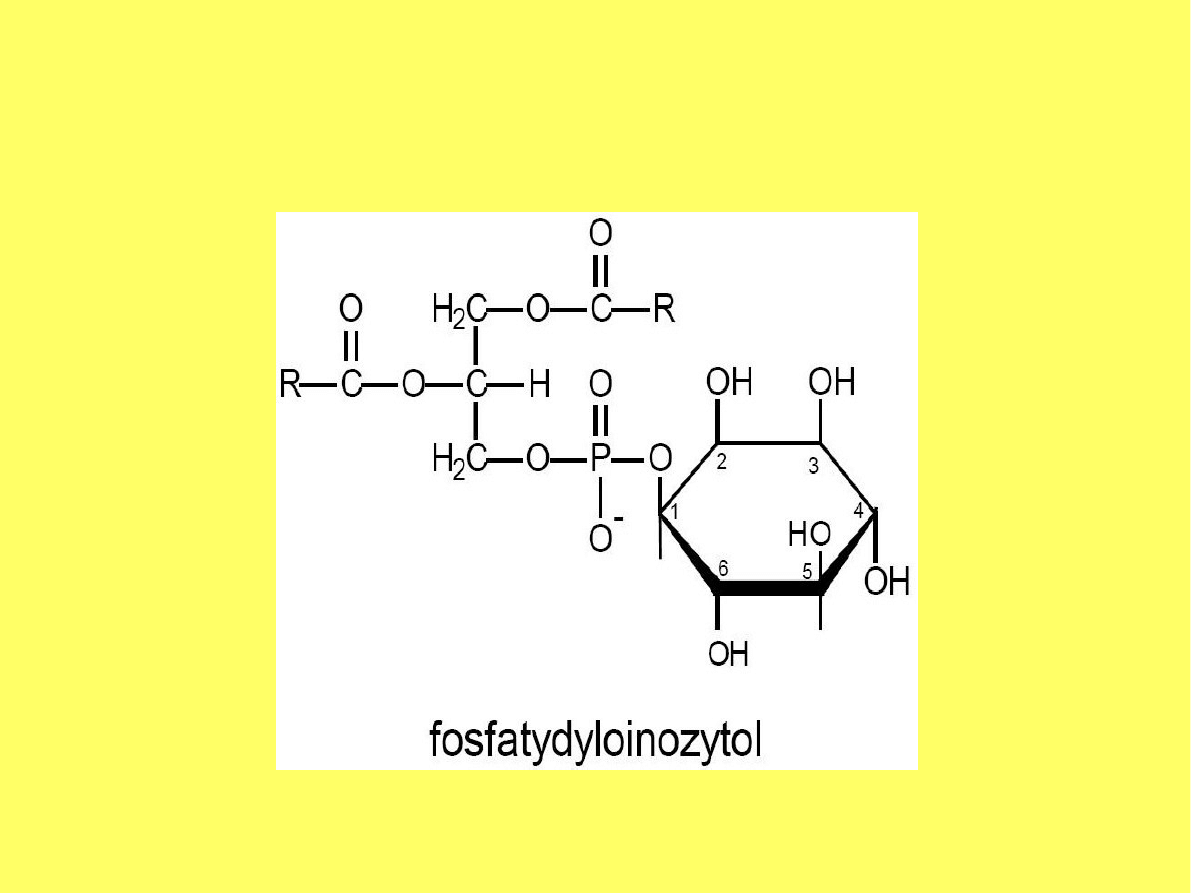
Budowa cząsteczki
fosfatydyloinozytolu

Przekazywanie sygnału przez PIP
2
rozpoczyna się hydrolizą(katalizowaną
przez fosfolipazę C) na dwa wtórne
przekaźniki: inozytolo-1,4,5-
trisfosforan (IP
3
), który jest cząsteczką
rozpuszczalną dyfundującą do
cytoplazmy, oraz diacyloglicerol (DAG),
który pozostaje w błonie komórkowej.
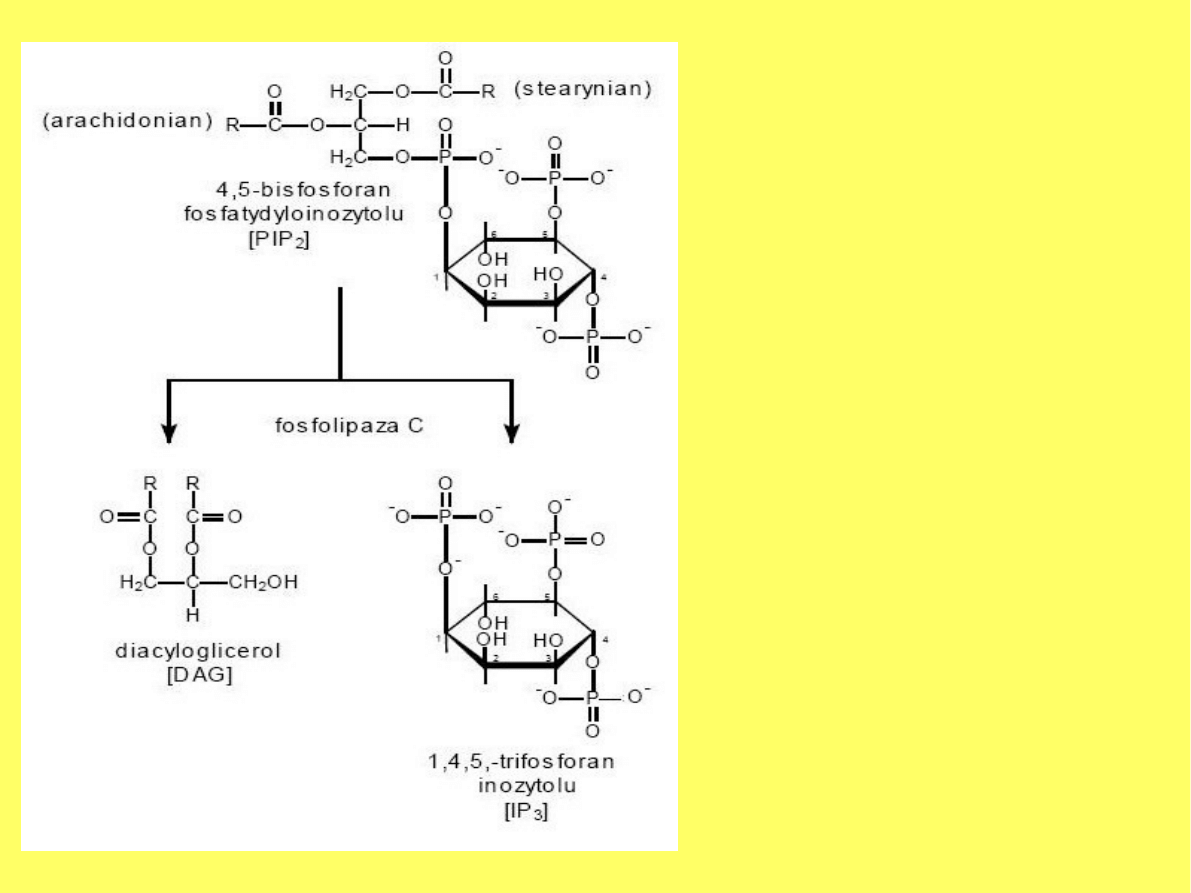
Rozkład fosfolipidów
inozytolowych jest
zjawiskiem
rozpowszechnionym.
Obserwujemy go
m.in. w wątrobie,
mózgu, śliniankach,
mięśniach,
komórkach krwi,
fibroblastach,
gruczołach
dokrewnych i
nowotworach.

Inozytolo-1,4,5-trisfosforan (IP
3
)
Powoduje gwałtowne uwolnienie Ca
2+
z
wewnątrzkomórkowych magazynów
(retikulum endoplazmatycznego, bądź
retikulum sarkoplazmatycznego w
przypadku mięśni gładkich) poprzez
receptor IP
3
, będący kanałem jonowym.
Ma krótki czas trwania. Ulega szybkiemu
przekształceniu w pochodne, które nie
otwierają kanału (głównie inozytol).
Podwyższony poziom Ca
2+
w cytozolu
powoduje skurcz mięśni gładkich, rozpad
glikogenu i egzocytozę.

Diacyloglicerol (DAG)
W obecności jonów wapnia i
fosfatydyloseryny aktywuje kinazę
białkową C.
Działa przejściowo. Jest fosforylowany do
kwasu fosfatydowego i hydrolizowany do
formy monoacyloglicerolu, który jest potem
hydrolizowany do kwasu arachidowego(AA).
AA może być dalej wykorzystywany do
eikozanoidów: prostanoidów, tromboksanów
i leukotrienów.

Kinaza białkowa C (PK-C) występuje w
komórkach w stanie spoczynku w formie
rozpuszczonej i nieaktywnej.
Aktywacja PK-C po stymulacji receptora
powoduje przeniesienie kinazy z cytoplazmy
do błony komórkowej w obecności jonów
wapnia.
W błonach komórki jej hydrofobowa
regulatorowa podjednostka, tworzy kompleks
z DAG, Ca
2+
i fosfatydyloseryną.
Aktywowana PK-C fosforyluje reszty seryny i
treoniny w wielu białkach docelowych.

Zmniejszenie stężenia PIP
2
w komórce jest
samo w sobie ważnym sygnałem
wewnątrzkomórkowym.
Związek ten jest aktywatorem fosfolipazy
D (PLD) i fosfolipazy A2 (PLA2).
PIP2 uczestniczy także w reorganizacji
cytoszkieletu.
Podczas polimeryzacji aktyny oddziałuje z
wiążącymi się z aktyną białkami.
Bierze udział w regulacji procesów endo- i
egzocytozy oraz w regulacji
funkcji kanałów jonowych.
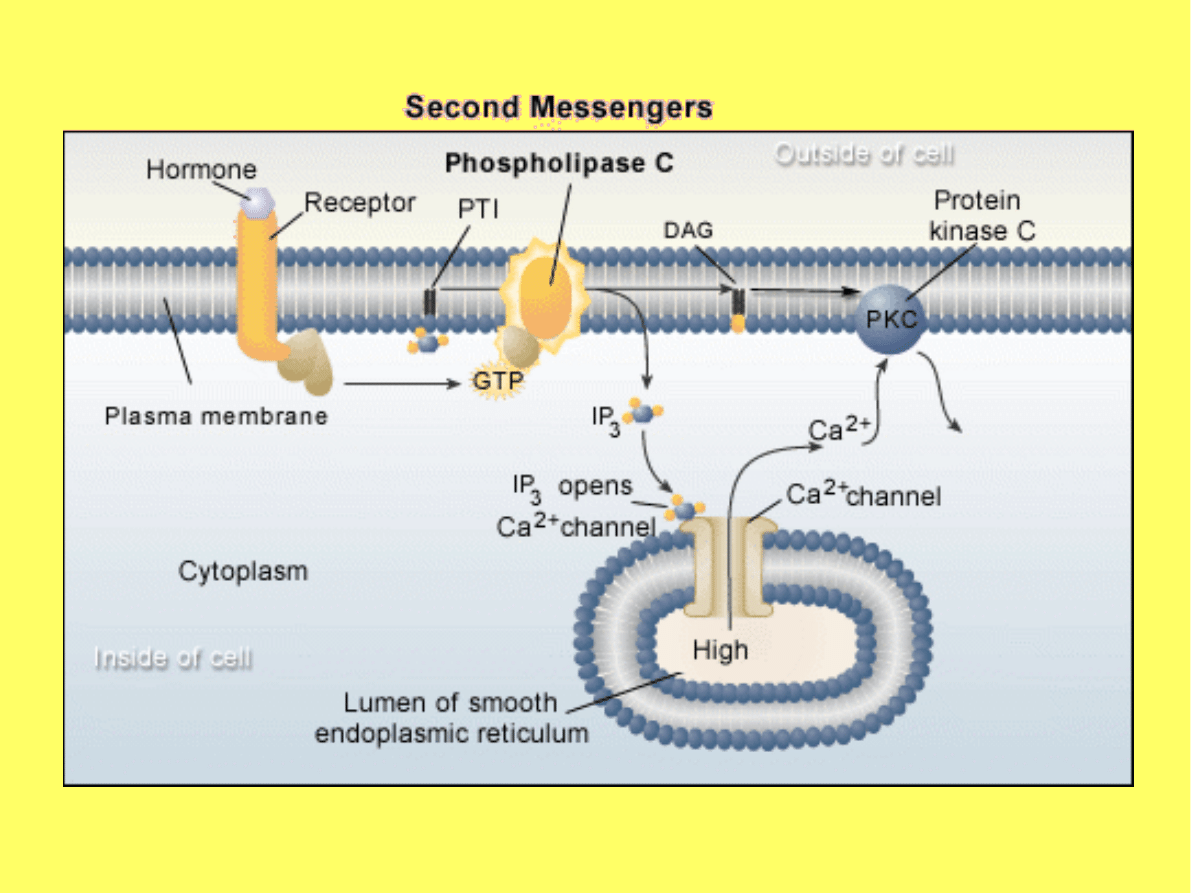

Działanie IP3 i DAG jest powiązane.
IP3 zwiększa stężenie Ca
2+
, które
ułatwia aktywację kinazy białkowej C
i zwiększa aktywność fosfolipazy C.
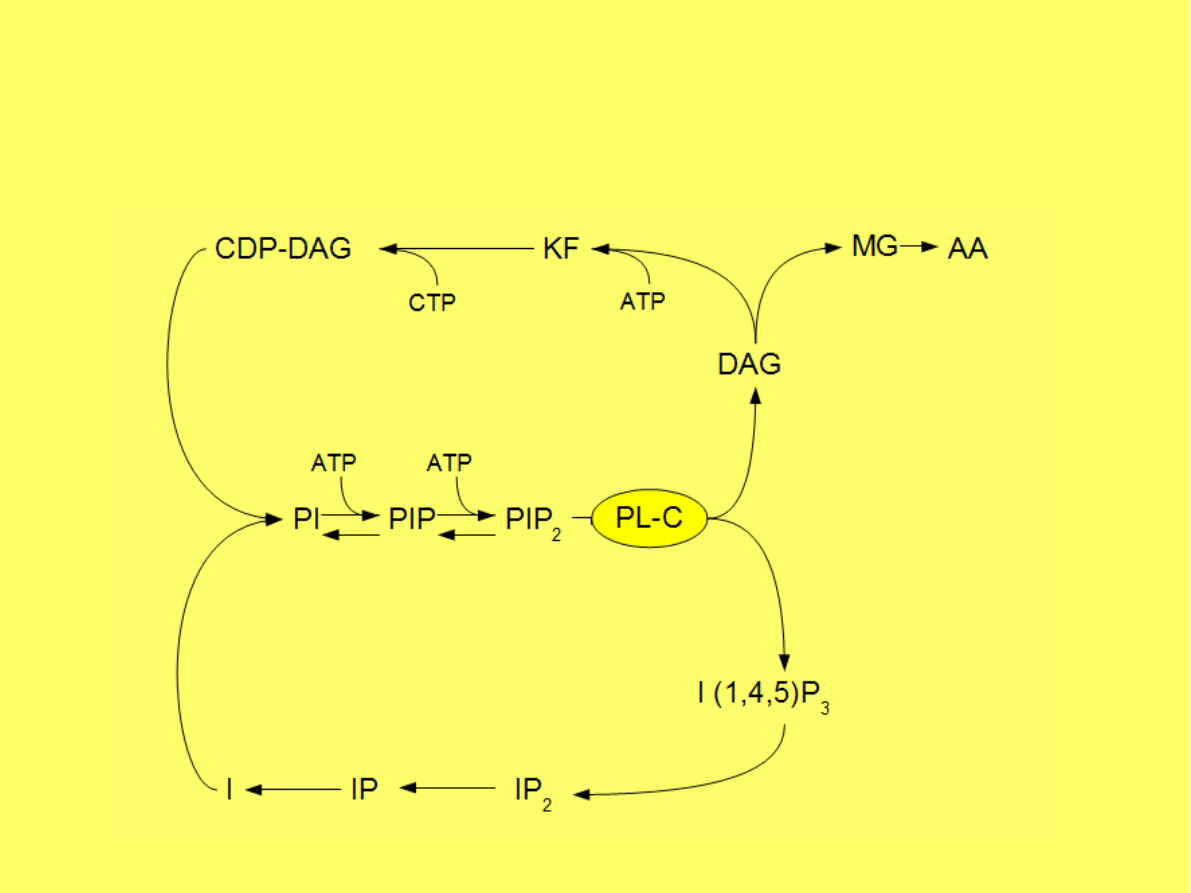
Cykl fosfolipidów inozytolu
Document Outline
Wyszukiwarka
Podobne podstrony:
fosfolipidy inozytolowe
fosfolipidy inozytolowe
20 Fosfolipidy inozytolowe
Fosfolipidy inozytolowe
Fosfolipid
Witamina B8 (Inozytol), Witaminy
Dwuwarstwa fosfolipidowa
Mezo Inozyt
Mezo Inozyt (2)
6 tłuszcze, nienasycone kwasy tłuszczowe, prostanoidy, woski, fosfolipidy Kopia
fosfolipidy iznozytolowe (2)
Cholina inozytol
4 Oznaczanie składu reszt kwasów tłuszczowych w glicerydach i fosfolipidach
fosfolipaza A2 id 179963 Nieznany
fosfolipidy, Kosmetologia
Fosfolipidy
FOSFOLIPIDY 2
Inozytole
fosfolipidy
więcej podobnych podstron