
Własności
Własności
roztworów
roztworów
rozcieńczonych -
rozcieńczonych -
wielkości
wielkości
koligatywne
koligatywne

Własności (wielkości)
koligatywne
Są
to
własności
roztworów
rozcieńczonych, których wartość zależy
tylko od ilości (liczby moli, liczby
cząsteczek) substancji rozpuszczonej
przypadającej
na
określoną
ilość
rozpuszczalnika lub roztworu.

Własności (wielkości)
koligatywne
•
Obniżenie prężności pary
rozpuszczalnika nad roztworem
substancji nielotnej
•
Podwyższenie temperatury wrzenia
roztworu substancji nielotnej w
stosunku do czystego rozpuszczalnika
•
Obniżenie temperatury krzepnięcia
roztworu, w którym rozpuszczalnik i
substancja rozpuszczona tworzą układ
eutektyczny, w stosunku do czystego
rozpuszczalnika
•
Ciśnienie osmotyczne

Sposoby wyrażania stężeń
•
Ułamek molowy
•
Ułamek wagowy (zwykle wyrażany w
procentach)
•
Stężenie wagowe (masowe)
•
Stężenie molowe
•
Stężenie molarne
2
1
2
2
n
n
n
x
%
100
m
m
m
w
%
2
1
2
2
3
roztworu
2
2
w
dm
V
m
c
3
roztworu
2
2
dm
V
n
c
kg
m
n
c
1
2
2
m

Obniżenie prężności pary
rozpuszczalnika nad
roztworem substancji
nielotnej
(
)
2
1
2
1
1 1
1
2
1
2
1
1
2 1
2 1
1
1
1
p
0
p p
p p
x p
x
1 x
p
1 x p
p
x p
x p
p
p
p
*
*
*
*
*
*
*
=
=
+
=
= -
= -
=
-
=
-
=D
Rozpatrujemy układ w stałej temperaturze
T =
const

1
1
2
1
2
1
p
p x
p
x
p
*
*
D =
�
D
=
Względne
obniżenie
prężności
pary
rozpuszczalnika nad roztworem substancji
nielotnej jest równe ułamkowi molowemu
substancji rozpuszczonej w roztworze.
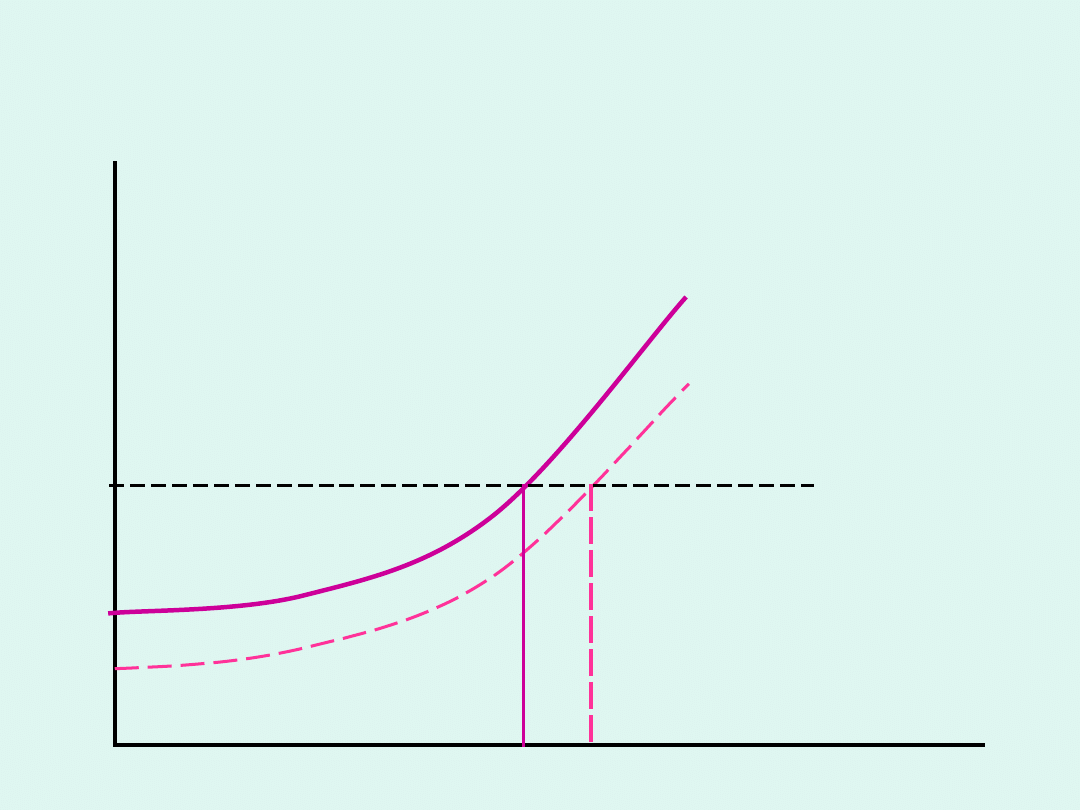
Podwyższenie temperatury
wrzenia roztworu substancji
nielotnej
1
1 1
1
1
1
p
x p
x
1
p
p
*
*
=
<
�
<
Rozpatrujemy układ pod
stałym ciśnieniem
p =
const
1
p
*
p
1
T
p
w
w roztworu
T
T
*
,
<
ciśnienie
atmosferyczne
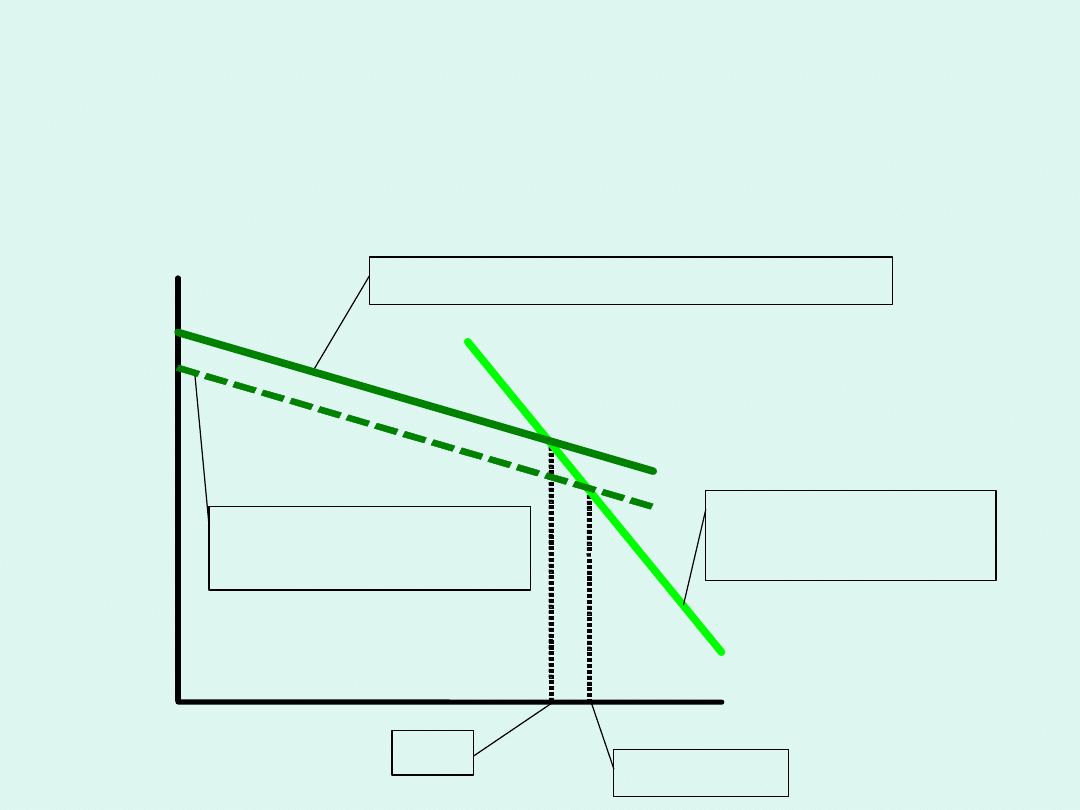
T
czysty ciekły rozpuszczalnik
rozpuszczalnik w
roztworze
pary
rozpuszczalnika
T
w (roztwór)
T
w
*
p = const
c
1
c
1
1
1
c
1
c
1
1
x
x
RT
*
*
ln

W stanie równowagi potencjał chemiczny
rozpuszczalnika w roztworze i w parze nad
roztworem są sobie równe.
( )
( )
( )
( )
g
c
1
1
g
c
1
1
1
RT
x
*
*
ln
m =m
m
=m
+

2
m
E
w
c
K
T
Wzór ebuliometryczny
*
,
,
1
w
roztw
w
w
T
T
T
*
,
*
,
1
m
par
1
2
1
w
E
H
M
T
R
K
K
E
– stała ebulioskopowa (jednostka - kg·K/mol)
c
m2
– stężenie molarne substancji rozpuszczonej (w
mol/kg)
M
1
– masa cząsteczkowa rozpuszczalnika
par
H
*
m,1
– molowa entalpia parowania
rozpuszczalnika

Podwyższenie
temperatury
wrzenia
roztworu substancji nielotnej w stosunku do
czystego
rozpuszczalnika
jest
wprost
proporcjonalne do stężenia molarnego
substancji rozpuszczonej, a współczynnik
proporcjonalności (stała ebulioskopowa)
zależy tylko od własności rozpuszczalnika.
Do pomiaru temperatury wrzenia roztworu i
czystego rozpuszczalnika służy
ebuliometr
np. Świętosławskiego.
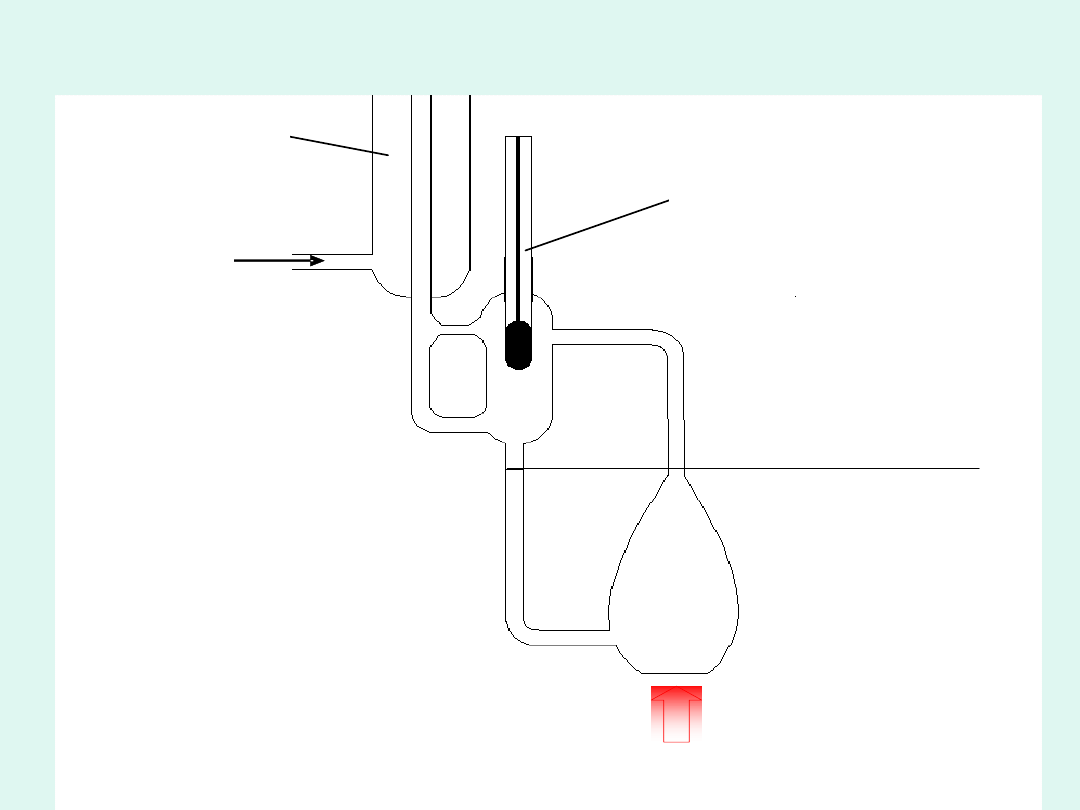
poziom roztworu
termometr Beckmana
wlot wody
chłodzącej
chłodnica
mikropalnik
Ebuliometr Świętosławskiego

Obniżenie temperatury
krzepnięcia roztworu substancji,
która z rozpuszczalnikiem
tworzy układ eutektyczny
Ponieważ rozpuszczalnik i substancja rozpuszczona w
stanie stałym nie mieszają się (tworzą układ
eutektyczny), to w momencie, gdy roztwór zaczyna
krzepnąć, krystalizuje z niego tylko czysty
rozpuszczalnik.
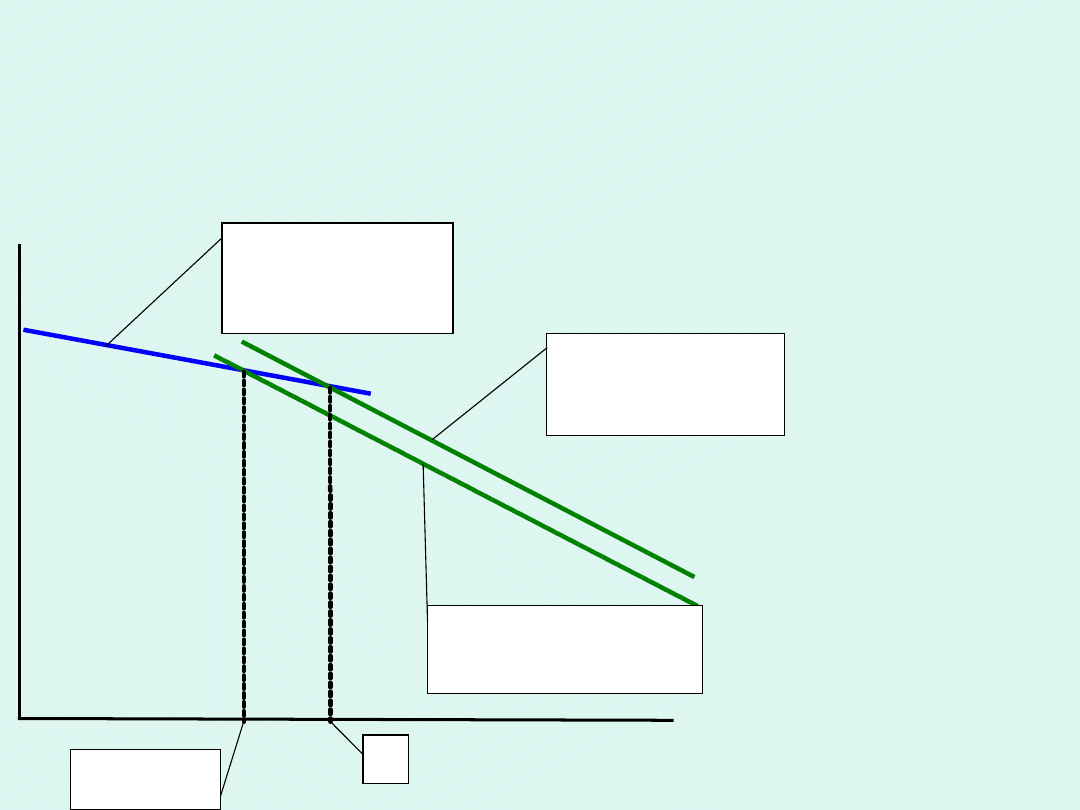
T
p =
const
czysty ciekły
rozpuszczal
nik
rozpuszczalnik
w roztworze
czysty stały
rozpuszczal
nik
T
t
*
T
t (roztwór)
c
1
c
1
1
1
c
1
c
1
1
x
x
RT
*
*
ln
W efekcie
roztwór
krzepnie
zawsze w
temperaturze
niższej niż
czysty
rozpuszczalnik
.

W stanie równowagi potencjał chemiczny
rozpuszczalnika w roztworze i w stanie stałym
są sobie równe.
1
c
1
s
1
s
1
c
1
x
RTln
*
*

2
m
K
k
c
K
T
Wzór kriometryczny
roztw
k
1
k
k
T
T
T
,
*
,
*
,
*
,
1
m
top
1
2
1
k
K
H
M
T
R
K
K
K
– stała krioskopowa (jednostka - kg·K/mol)
c
m2
– stężenie molarne substancji rozpuszczonej (w
mol/kg)
M
1
– masa cząsteczkowa rozpuszczalnika
top
H
*
m,1
– molowa entalpia topnienia rozpuszczalnika

Obniżenie
temperatury
krzepnięcia
roztworu
substancji
tworzącej
z
rozpuszczalnikiem układ eutektyczny w
stosunku do czystego rozpuszczalnika jest
wprost
proporcjonalne
do
stężenia
molarnego
substancji rozpuszczonej, a
współczynnik
proporcjonalności
(stała
krioskopowa) zależy tylko od własności
rozpuszczalnika.
Do pomiaru temperatury krzepnięcia
roztworu i czystego rozpuszczalnika służy
kriometr
np. Beckmanna.
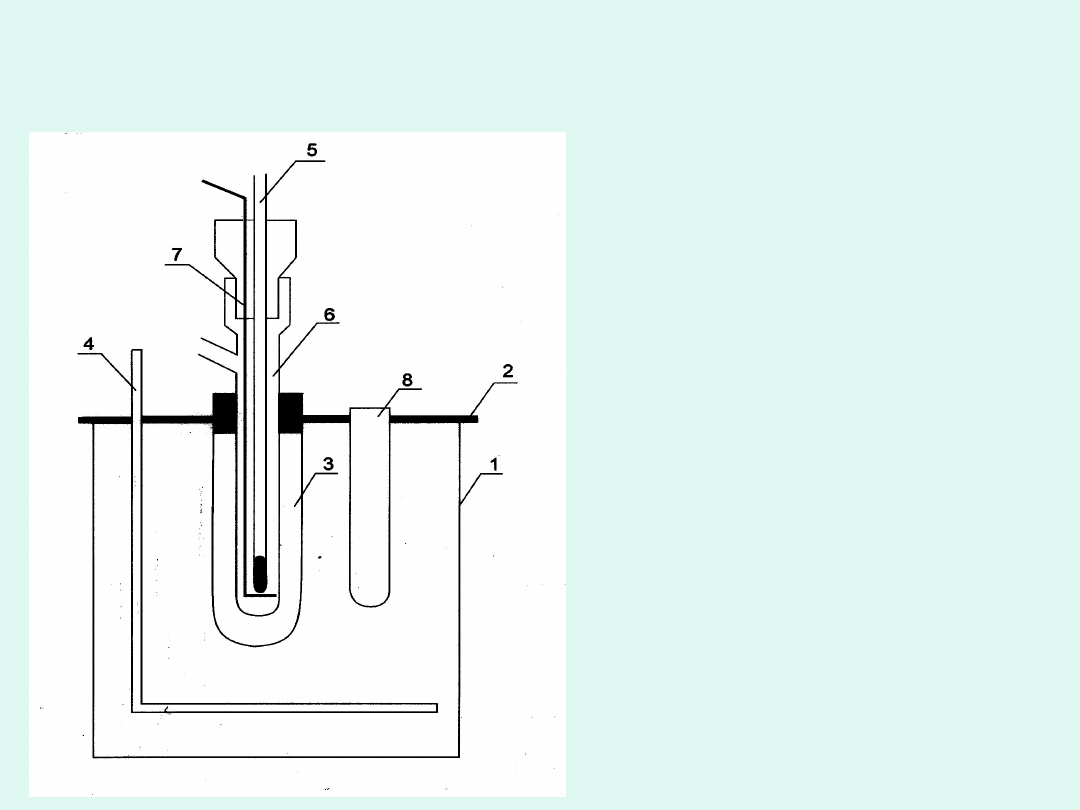
Kriometr Beckmana
1 - pojemnik z
mieszaniną
chłodzącą (NaCl +
lód)
2 - pokrywa
3 - probówka ochronna
4 - mieszadło
5 - termometr
Beckmana
6 - naczyńko
kriometryczne
7 - mieszadło
8 - probówka
Zarówno pomiar temperatury wrzenia roztworu jak
i krzepnięcia wykorzystywane są do wyznaczania
masy cząsteczkowej substancji rozpuszczonej. W
tym celu należy zmierzyć temperaturę wrzenia
(krzepnięcia) czystego rozpuszczalnika i roztworu.
1
k
2
K
2
1
w
2
E
2
1
2
2
K
k
1
2
2
E
w
2
m
K
k
2
m
E
w
1
M
m
1
2
2
m
m
T
m
K
M
m
T
m
K
M
m
M
m
K
T
m
M
m
K
T
c
K
T
c
K
T
m
m
n
c
2
2

Która metoda jest lepsza –
ebulioskopowa czy krioskopowa ?
Zawsze krioskopowa !
•
Stała krioskopowa dla każdego
rozpuszczalnika jest większa niż
ebulioskopowa, toteż dla tego samego roztworu
obserwujemy wyraźnie większą różnicę
temperatur.
•
Temperatura wrzenia zależy silnie od
ciśnienia, a temperatura krzepnięcia
praktycznie nie zależy.
•
Pomiar temperatury krzepnięcia jest
dokładniejszy niż temperatury wrzenia i
technicznie prostszy.
•
Praca z wrzącymi rozpuszczalnikami
organicznymi jest niebezpieczna.
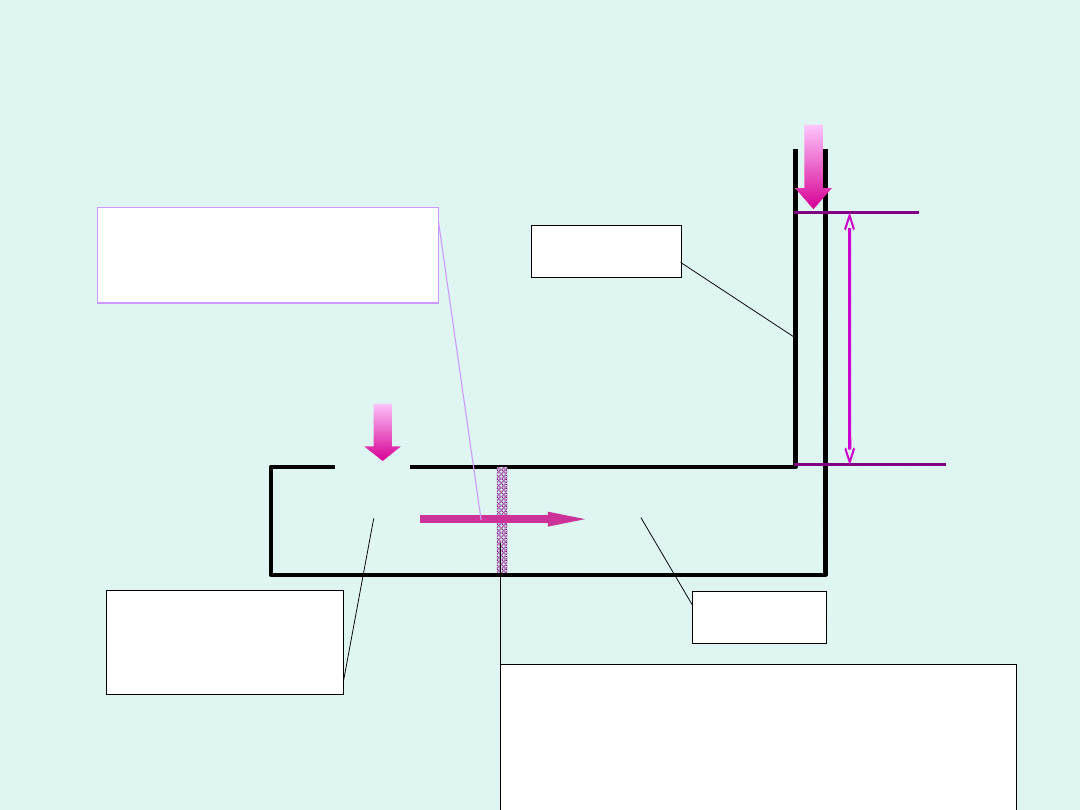
czysty
rozpuszczal
nik
roztwó
r
membrana
półprzepuszczalna
(przepuszcza tylko
cząsteczki rozpuszczalnika)
kapilar
a
h
T = const
kierunek
migracji
rozpuszczalnika
p
o
p
=p-
p
o
Zjawisko osmozy i schemat
osmometru

Osmoza i ciśnienie
osmotyczne
Osmoza
to samorzutna migracja cząsteczek
rozpuszczalnika od czystego rozpuszczalnika do
roztworu przez membranę półprzepuszczalną.
Ciśnienie osmotyczne
, to ciśnienie, jakie
należy przyłożyć do roztworu oddzielonego od
rozpuszczalnika membraną półprzepuszczalną,
aby zahamować całkowicie migrację
rozpuszczalnika przez nią.
Siłą napędową osmozy jest różnica potencjałów
chemicznych rozpuszczalnika po obu stronach
membrany.
c
1
c
1
1
1
c
1
c
1
1
x
x
RT
*
*
ln

Proces osmozy będzie zachodził tak długo, aż
potencjał chemiczny rozpuszczalnika przestanie się
zmieniać.
0
x
RTd
d
0
d
1
c
1
c
1
ln
*
Ciśnienie osmotyczne
2
c
RT
c
2
– stężenie molowe roztworu (w mol/m
3
)
Ciśnienie osmotyczne roztworu jest wprost
proporcjonalne
do
stężenia
molowego
roztworu, a współczynnik proporcjonalność
zależy tylko od temperatury.
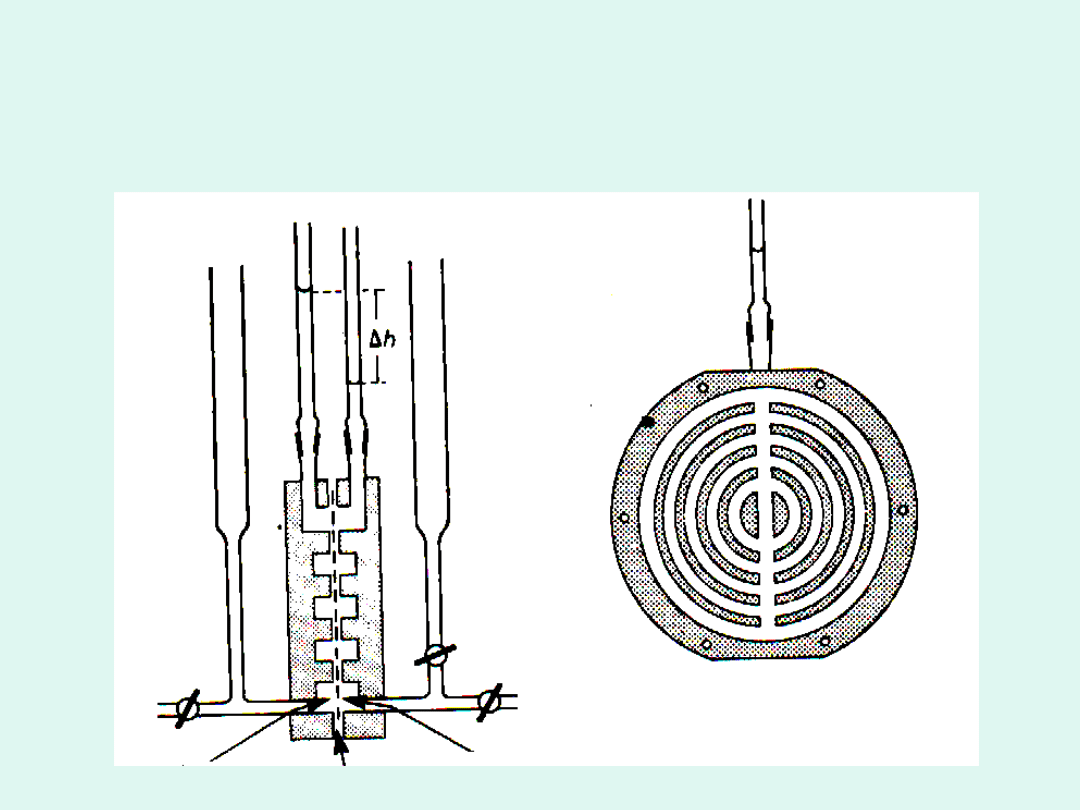
a)
b)
Schemat osmometru Fuossa-Meada
a) przekrój poprzeczny
b) wewnętrzna powierzchnia każdej polówki
osmometru

Na podstawie pomiaru ciśnienia osmotycznego można
wyznaczyć masę cząsteczkową substancji
rozpuszczonej.
2
w
2
2
2
w
2
2
2
w
2
2
M
m
2
2
c
RT
M
M
c
RT
c
RT
M
c
M
1
V
m
V
V
n
c
2
2
Pomiar ciśnienia osmotycznego jest szczególnie
przydatny do wyznaczania mas cząsteczkowych
substancji wielkocząsteczkowych (polimerów – białek,
polisacharydów itp.).

2
2
m
K
k
2
m
E
w
2
1
1
c
RT
c
K
T
c
K
T
x
p
p
*
Wspólne cechy własności koligatywmych :
•
Wielkość każdej z nich zależy tylko od ilości
moli substancji rozpuszczonej wyrażonej jako
stężenie w rozmaity sposób, a nie od rodzaju
substancji rozpuszczonej.
•
Współczynnik proporcjonalności zależy
tylko od własności rozpuszczalnika.
2
2
m
K
k
2
m
E
w
2
1
1
c
RT
i
c
K
i
T
c
K
i
T
x
p
i
p
*
Powyższe wzory zostały wyprowadzone przy
założeniu, że roztwór zachowuje się jak roztwór
idealnie rozcieńczony. Dla roztworów rzeczywistych
należy te wzory zmodyfikować.
i
– współczynnik izotoniczny van’t Hoffa
rzecz
idealna
wielkość koligatywna
i
wielkość koligatywna
mierz
2
form
2
M
M
i

Wielkość współczynnika izotonicznego
i
zależy od :
•
stanu substancji rozpuszczonej w
roztworze (jej dysocjacji jak w
przypadku elektrolitów lub asocjacji)
•
od oddziaływań cząsteczek
substancji rozpuszczonej z
cząsteczkami rozpuszczalnika czyli
odchyleń zachowania roztworu od
doskonałości. Dla roztworów
elektrolitów odchylenia od zachowania
doskonałego są też spowodowane
oddziaływaniami pomiędzy jonami.

Dla roztworów słabych elektrolitów
współczynnik izotoniczny
i
jest
powiązany ze stopniem dysocjacji
elektrolitu.
1
i
– stopień dysocjacji
– liczba jonów powstających w wyniku
rozpadu jednej cząsteczki elektrolitu

Do czego wykorzystujemy pomiar
wielkości koligatywnych ?
•
wyznaczanie masy cząsteczkowej
substancji rozpuszczonej
•
wyznaczanie stopnia dysocjacji słabych
elektrolitów lub też stopnia asocjacji
substancji w roztworze
•
wyznaczanie współczynnika aktywności
rozpuszczalnika
•
wyznaczanie współczynnika aktywności
substancji rozpuszczonej

Wyznaczanie współczynnika aktywności
rozpuszczalnika
Wyznaczanie współczynnika aktywności
substancji rozpuszczonej
1
i
1
1
x
(
)
m2
m2 0
c
2
m2
m2
c
g 1
g 1
dc
c
�
-
g = - +
�
ln
g
– współczynnik Bjerruma
Dla roztworów rozcieńczonych
i
g
2
g 1
g � -
ln
c
m2
0
2
m
2
m
c
0
c
2
m
2
m
dc
c
1
g
2
m
c
1
g
Wyznaczanie współczynnika aktywności
substancji rozpuszczonej w oparciu o
wielkości koligatywne
m2
m2
c
2
m2
m2
c
0
g 1
i
ln
g 1
dc gdzie g
c
�
-
g = - +
=
n
�
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
10 Wykład Ch F wielkości koligatywne 2id 11189 ppt
10 Wykład Ch F wielkości koligatywne
Wykład Ch F wielkości kol
2 Wykład Ch F gazy1 2id 20950 ppt
Wykład Ch F wielkości kol
10 10 2010 WYKŁAD Ćwiczenia lecznicze w kinezyterapiiid 10720 ppt
10 Ch organiczna LIPIDYid 10801 ppt
10 WYKŁAD Xid 10652 ppt
1 Wykład Ch F wstępid 10087 ppt
10 profilaktyka ch zakaźnychid 11296 ppt
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
1Ochr srod Wyklad 1 BIOLOGIA dla studid 19101 ppt
10 Reprezentacja liczb w systemie komputerowymid 11082 ppt
Psychologia ogólna Historia psychologii Sotwin wykład 7 Historia myśli psychologicznej w Polsce
10 Relacja wspomagaj cy i wspomaganyid 11081 ppt
1 wykład1 gosodarcze znaczenie gorzelnid 10093 ppt
więcej podobnych podstron