
Transformacja
nowotworowa

Wyłamanie się komórki spod kontroli
mechanizmów decydujących o jej
podziałach i lokalizacji.

Zmiany w komórce
Biochemiczne
zmiany aktywności enzymów
Fizjologiczne
możliwość nieograniczonej proliferacji, także w
zawiesinie
zmniejszenie adhezji
Genetyczne
zmiany w ekspresji genów
mutacje, utrata materiału genetycznego
Morfologiczne
zmiany barwliwości
pleomorfizm komórkowy

Etapy kancerogenezy
Preinicjacja
ekspozycja na kancerogeny przez całe życie
Inicjacja
nagromadzenie mutacji przez kilka-kilkadziesiąt lat
Promocja
selekcja klonalna, nabycie zdolności do migracji
(<kilka lat)
Progresja
dalsza selekcja mutacji, nabycie zdolności przerzutowania
(kilka miesięcy - lat)

Czynniki karcynogenne
Biologiczne
Chemiczne
Fizyczne

Karcynogeny biologiczne
Wirusy onkogenne:
papillomawirusy
HPV 16, 18
retrowirusy
HTLV (human T-cell laeukemia virus)
adenowirusy
Hormony
np. estrogeny - rak szyjki macicy

Karcynogeny chemiczne
policykliczne węglowodory aromatyczne
aminy aromatyczne
aflatoksyny
czynniki alkilujące

Karcynogeny fizyczne
Promieniowanie jonizujące
Promieniowanie rentgenowskie
nowotwory szpiku i układu limfatycznego
promieniowanie UV
nowotwory skóry

Faza inicjacji
Początek - wraz z pierwsza mutacją
Tor mutacyjny -
mutacje niezbędne do
przemiany zdrowej komórki w nowotworową
(zwykle kilka - kilkanaście genów)
Obecność wrodzonych dziedzicznych mutacji
skraca przebieg toru mutacyjnego!
Nowotwory dziedziczne

Funkcje genów toru
mutacyjnego
Transmisja sygnału
Aktywacja innych genów
Geny replikacji i naprawy DNA
Geny wzrostu, różnicowania i
apoptozy
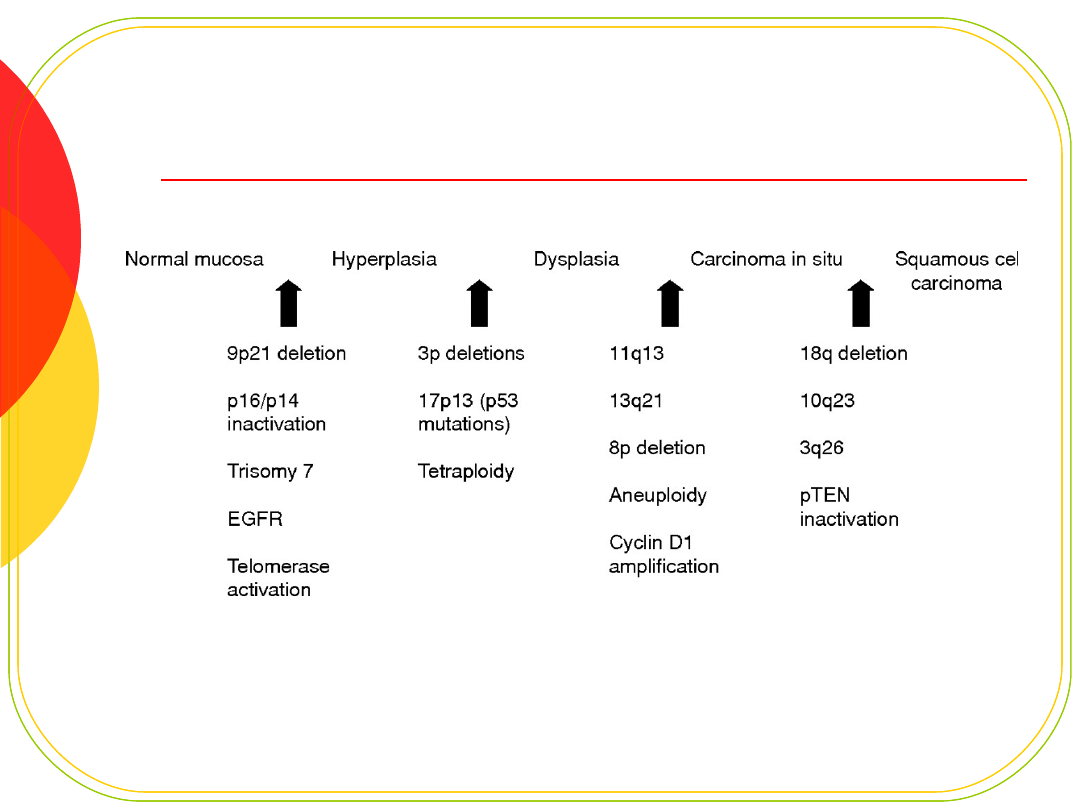
Przykładowy tor mutacyjny

Nowotwory dziedziczne
Obecność dziedzicznych mutacji
skracająca tor karcynogenezy
Cechy:
zachorowania w młodym wieku
często zmiany mnogie/wieloogniskowe
w narządach parzystych - obustronne
zmiany

Nowotwory dziedziczne -
przykłady
Dziedziczny siatkówczak
(retinoblastoma)
dziedziczna mutacja genu RB
Zespół Li - Fraumeni
dziedziczna mutacja genu p53
w dzieciństwie - mięsaki, białaczki, guzy
mózgu
u dorosłych - różne nowotwory

Onkogeny
Geny kontrolujące pozytywnie
(promujące) wzrost i podziały komórek
Ich prawidłowe allele - protoonkogeny
Homologi onkogenów - obecne w
genomie wirusów onkogennych, inaczej
onkogeny wirusowe (v-onc)
w genomie kręgowców - onkogeny
komórkowe (c-onc)

Onkogeny - rola
Udział we wzroście i różnicowaniu
analogi czynników wzrostu
analogi receptorów czynników wzrostu
analogi białek sygnałowych (transmisja
sygnałów do jądra)

Aktywacja onkogenów
Następuje poprzez:
mutacje
amplifikacje
insercję promotora
np. przez retrowirus
translokacje
np. geny immunoglobulinowe

Geny supresorowe -
antyonkogeny
Utrata ich funkcji powoduje
transformacje nowotworową
ich produkty uczestniczą w:
proliferacji
różnicowaniu
są czynnikami transkrypcyjnymi
są elementami struktur komórkowych

Geny supresorowe - przykłady
TP53
„strażnik genomu”; czynn. transkrypcyjny, kontrola
proliferacji
RB1
czynnik transkrypcyjny, kontrola proliferacji
APC
cząsteczka adhezyjna, przekazywanie sygnału
NF1
białko aktywujące GTP
NF2
białko cytoszkieletu
VHL
supresor elongacji transkrypcji, degradacja białek
BRCA1
aktywator transkrypcji, naprawa DNA
BRCA2
aktywator transkrypcji, acetylotransferaza histonów
PTEN
antagonista kinaz, fosfataza

LOH - Loss of heterozygoticy
Utrata heterozygotyczności
Dotyczy osób z genetyczną predyspozycją
do nowotworów
Posiadają one dziedziczną mutację w
jednym z alleli genu (są wobec tego genu
heterozygotami)
Mutacja w drugim allelu powoduje
transformacje nowotworową

Gany mutatorowe
Ich mutacje nasilają mutacje innych
genów
np. MSH2 - koduje białka uczestniczące w
naprawie źle sparowanych zasad MMR
MSH6
PMS1
PMS2

Siatkówczak - Retinoblastoma
Wywodzi się z retinoblastów (prekursory czopków)
Do zachorowania potrzebna jest mutacja w obu allelach
genu RB
postać spontaniczna
starsi pacjenci
zmiana jednoogniskowa
w jednej gałce ocznej
postać dziedziczna
(wrodzona mutacja RB)
małe dzieci
wieloogniskowość
często w obu gałkach ocznych

Gen RB
Pierwszy opisany gen supresorowy
Locus 13q14 (na długim ramieniu
chromosomu 13)
Pojedyńcza kopia w genomie, 27 eksonów
motywy wiązania z DNA:
palce cynkowe
zamek leucynowy
mutacje w RB - zwykle nonsensowne,
przesunięcie ramki odczytu

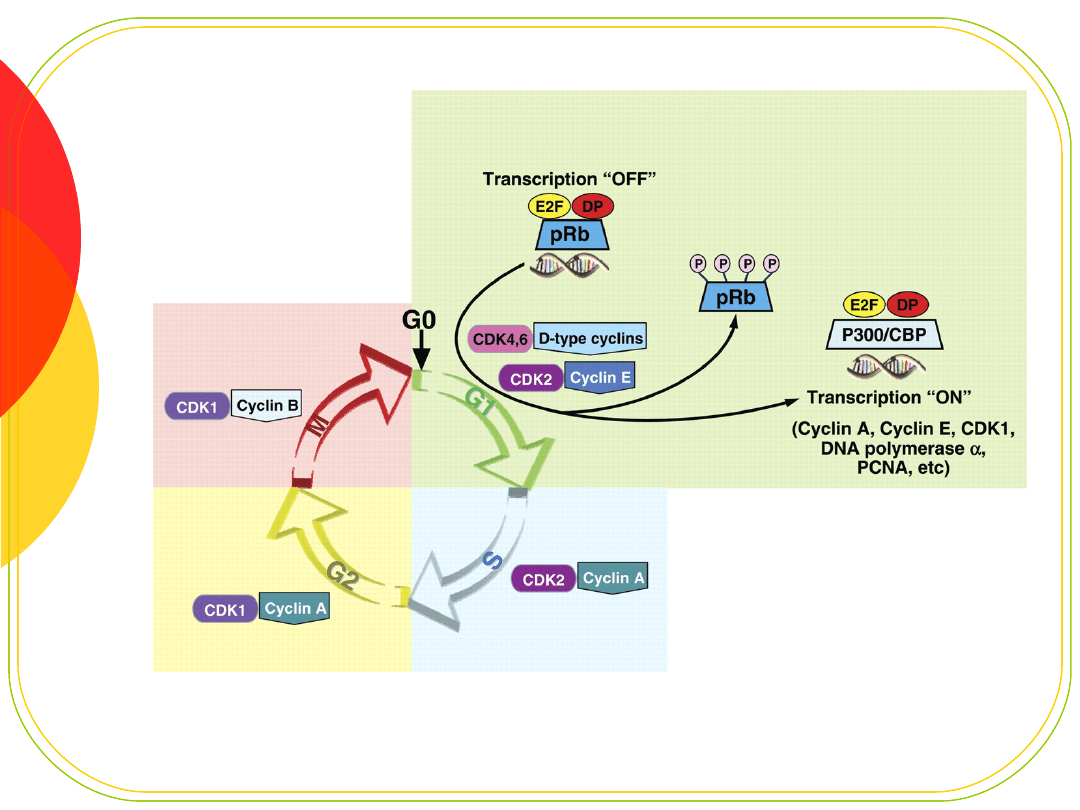
Białko Rb
Białko kieszeniowe (pocket protein) - zdolność wiązania
z innymi białkami
czynnik E2F - kontroluje przejście komórki przez punkt
restrykcyjny R fazy G1
E2F stymuluje ekspresję genów replikacji - cykliny i
kinazy CDK
E2F jest inaktywowane przez przyłączenie białka Rb
(pRb)
fosforylacja pRb przez kompleksy cyklina - CDK
„uwalnia” E2F pod koniec fazy G1 i umożliwia
aktywację transkrypcji

Gen p53
Locus 17p13.1
11 eksonów; 20,3 kpz (kilo par zasad)
gen konserwatywny (duża homologia
międzygatunkowa)
mutacje zwykle punktowe, zmiany sensu
75% mutacji w „gorących miejscach”
mutacje p53 - najczęstszy defekt we
wszystkich typach nowotworów!

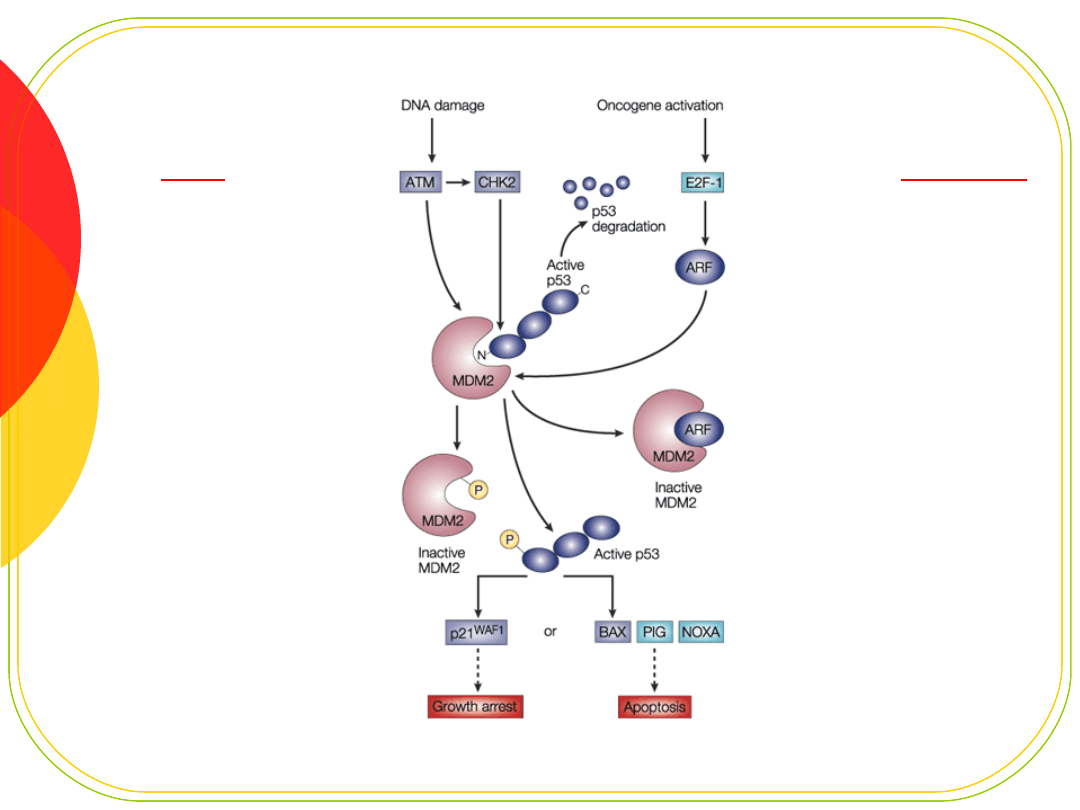
Białko p53
„molekularny strażnik genomu”
czynnik transkrypcyjny dla ok.. 30 genów
hamujących cykl komórkowy
uczestniczących w naprawie DNA
uczestniczących w apoptozie
hamuje cykl w odpowiedzi na uszkodzenie
zatrzymuje cykl w później fazie G1
daje komórce czas na naprawę
jeśli nie dojdzie do naprawy - kieruje do apoptozy

Xeroderma pigmentosum
Rzadkie zaburzenie (1:100000)
dziedziczone AR
uszkodzone geny XP (wiele typów)
defekt naprawy DNA po uszkodzeniu przez
promieniowanie UV
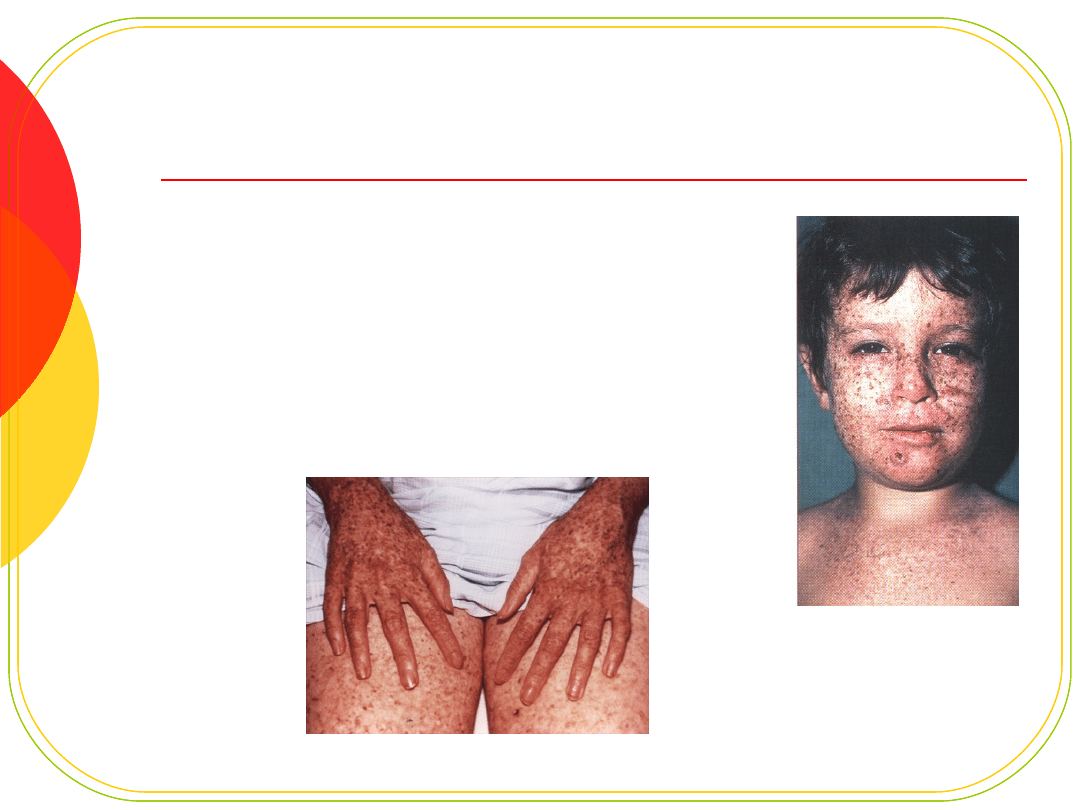
Xeroderma pigmentosum
Postępująca degeneracja skóry i
oczu
ok. 1000x większa skłonność
do
nowotworów skóry
degeneracja układu nerwowego
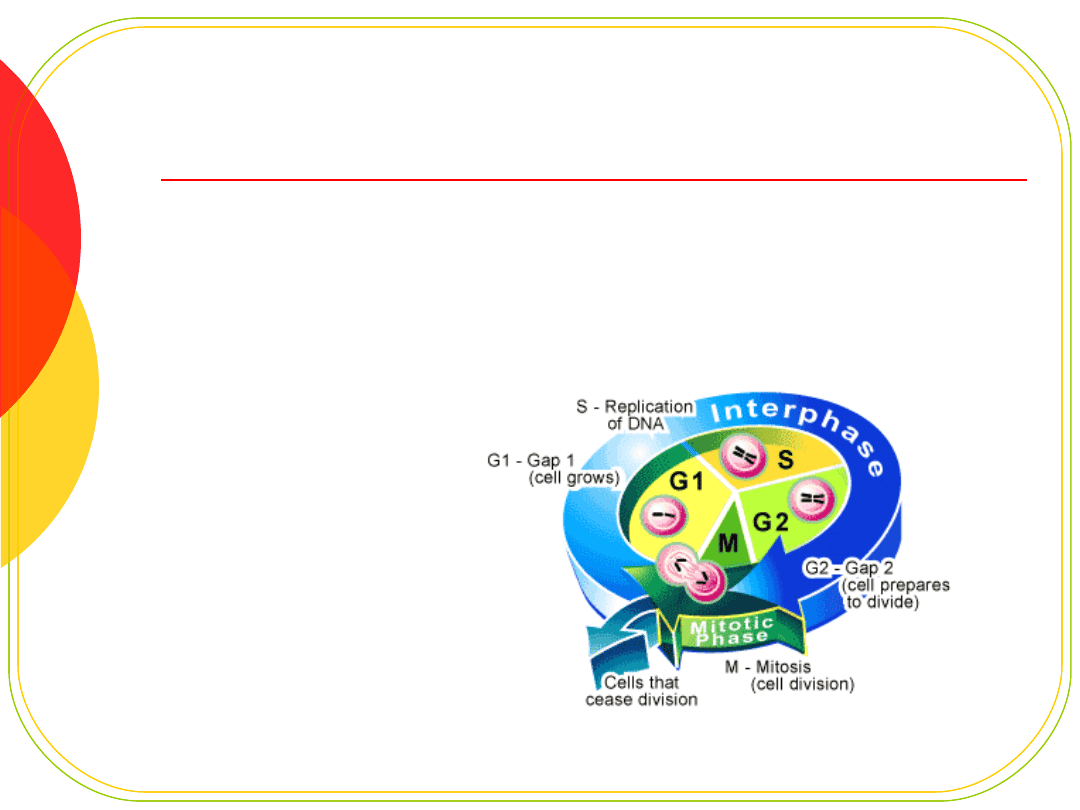
Cykl komórkowy
Powtarzające się cykle replikacji
DNA i podziałów komórki

Fazy cyklu komórkowego:
G1 - najdłuższa, przygotowanie do replikacji
S - synteza DNA
G2 - krótka, przygotowanie do podziału
M - mitoza
G1-G2 interfaza
faza „0” - spoczynkowa; wyjście z cyklu po
mitozie, bez podziałów
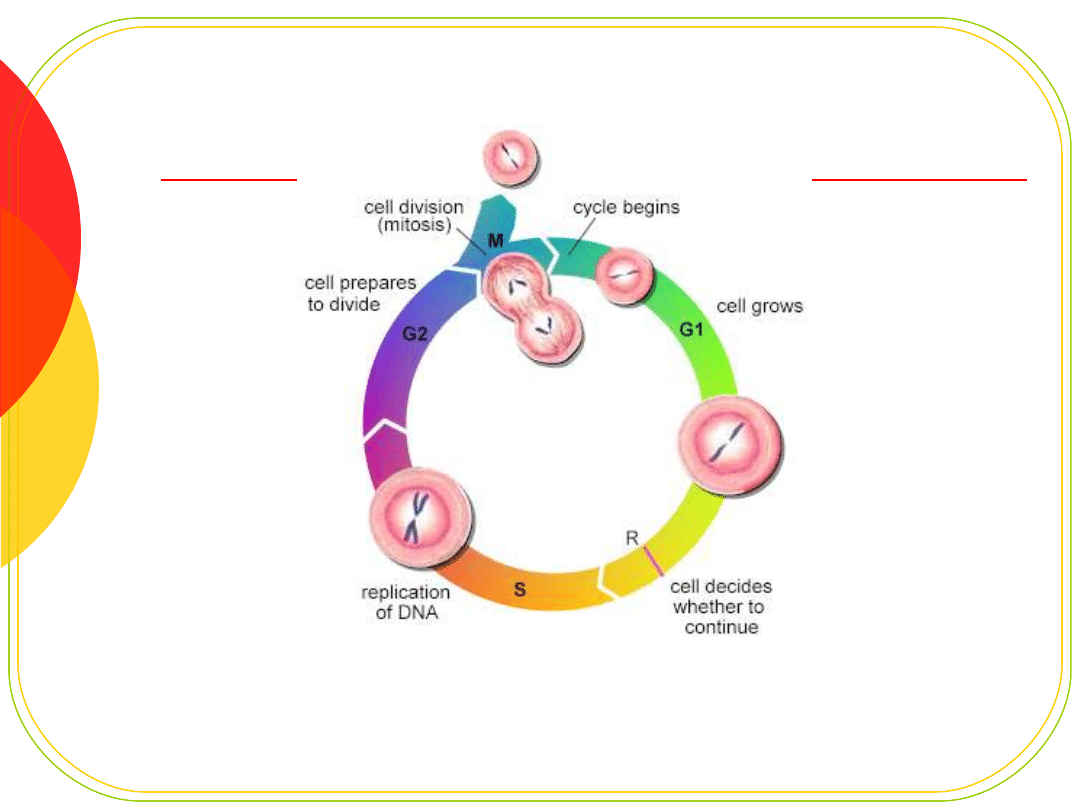

Cykl komórkowy - punkty
kontrolne
Punkt G1/S - kontrola integralności
DNA;
Punkt G2/M - kontrola prawidłowej
segregacji materiału genetycznego i
tworzenia wrzeciona

Kontrola cyklu przez
fosforylację
Fosforylacja białek - aktywuje je
jej zaburzenia - często powodują transformację
nowotworową!
W cyklu białka fosforylowane sa przez CDK -
kinazy zależne od cyklu komórkowego
aktywnym CDK towarzyszą cykliny
kompleksy cyklina-kinaza same są fosforylowane
przez kinazę CAK (CDK activating kinase), w
wyniku czego nabywają zdolność do fosforylacji

CDK podlegają negatywnej kontroli
przez inhibitory kinaz (CDI, INK)
INK przyłączają się do kompleksu
CDK-cyklina i inaktywują go
Inhibitory kinaz - rodziny:
rodzina INK4
hamują specyficznie CDK4 i CDK6
rodzina CIP/KIP
niespecyficznie hamuja wszystkie typy CDK

Promocja
Zwiększona aktywność mitotyczna
Wzrasta ilość mutacji
Aberracje strukturalne i liczbowe
chromosomów
Powstawanie subklonów komórek
Selekcja komórek ze zwiększoną
zdolnością do wzrostu

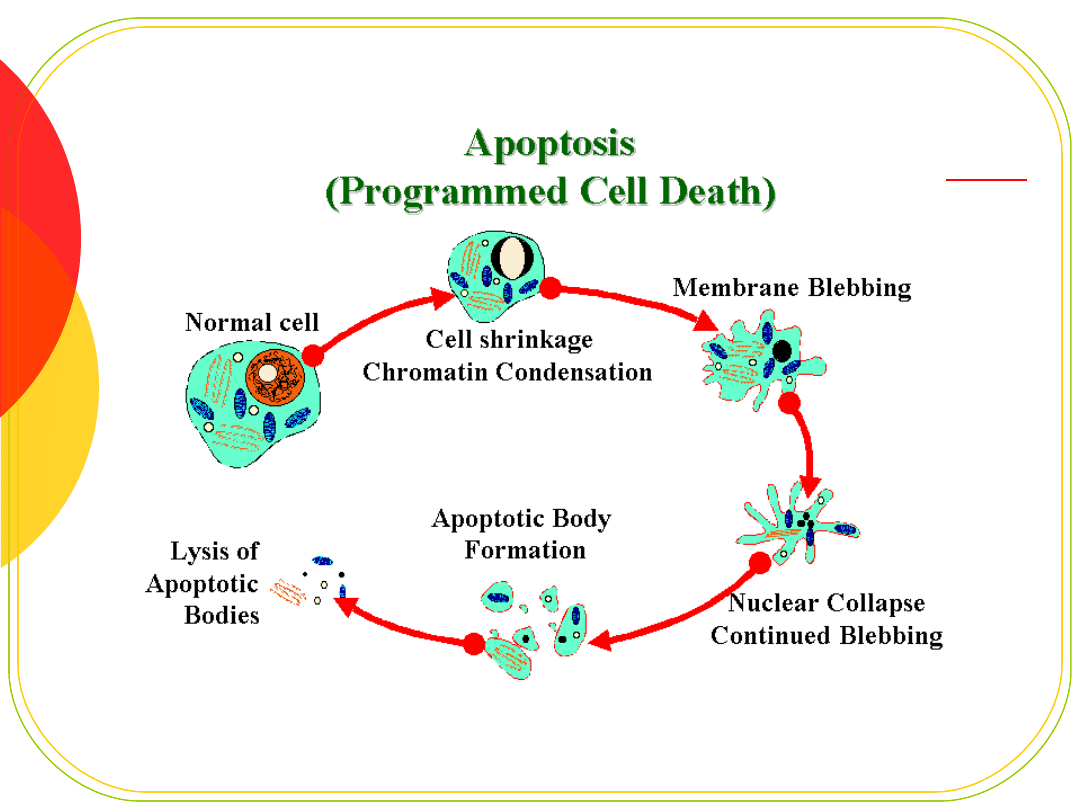
Apoptoza -
programowana śmierć
komórki
Rola w embriogenezie
Usuwanie starych i chorych komórek
geny kontrolujące apoptozę:
BCL
MYC
TP53 (p53) - aktywują białko bax - indukuje
kaskadę kaspaz
APOI (FAS) - receptor błonowy, aktywacja
kaspaz

Apoptoza c.d.
Geny przeżycia - antyapoptotyczne
BAC2, BCLX-L, BCLW, MCL1, CED9
Geny śmierci - proapoptotyczne
BAX, BCLX-5, BAK, BOK, BAG, BID

„Unieśmiertelnienie” komórek
nowotworowych
Telomery - obszary na końcach chromosomów gdzie
odbywa się terminacja replikacji
Telomeraza - enzym syntetyzujący telomery; zawiera
RNA - matryce do syntezy telomerów
w kolejnych cyklach ulegają skróceniu do długości
krytycznej - 1,5 kpz
po jej przekroczeniu - powstają asocjacje
telomeryczne - umożliwiają one przeżycie komórki z
krańcowo małą ilością telomerów (M2)
po przekroczeniu punktu M2 komórka staje się
nieśmiertelna
w komórkach nowotworowych - wzrost aktywności telomerazy
jej inhibitory mogą być zastosowane w leczeniu

Angiogeneza
Czynniki proangiogenne
VEGF
FGF
TGF
IL8
Czynniki antyangiogenne
angiotensyna
endostatyna
trombospondyna
tkankowe inhibitory metaoproteinaz
Il -1, 2, 6, 10

Progresja
Rozpoczyna ją wnikanie naczyń w masę
guza
coraz większe zmiany w genomie
selekcja komórek zdolnych do migracji
zmniejszona adhezja
wzrost poziomu enzymów proteolitycznych

Przerzuty - zaangażowane
geny
Geny oddziaływań
międzykomórkowych i komórka -
macierz
geny związane z adhezją
geny związane z sekrecją
geny kodujące enzymy niszczące
ściany komórkowe (ściany naczyń!)

Przerzuty - przykłady genów
NME - koduje kinazę NDP oddziaływującą z białkami G;
w kom. nowotworowych
Kadheryna E (L-CAM) białko błonowe łączące
komórki;
Kolagenaza IV
receptory oddziaływania z macierzą
zewnątrzkomórkową - zmiany ilościowe lub jakościowe
receptory lamin
integryny
CD44 - oddziaływania komórka - komórka i komórka -
macierz

BRCA1
Ludzki gen supresorowy
locus 17q21
bardzo duzy gen, 80 kpz
naprawa uszkodzonego DNA
zawiera palec RING i 2 domeny BRCT

Mutacje BRCA1
Często spotykane
w Polsce - efekt założyciela - bo populacja jednorodna
etnicznie, więc homogenna genetycznie
kobiety z odziedziczoną wadliwą kopią genu - wieksza
podatność na raka jajnika (40%) i piersi (50-80%); także
prostaty, jajowodu, okrężnicy, otrzewnej. Średni wiek
zachorowania - 40 rż.
Predyspozycja do raka piersi rdzeniastego, z niską
ekspresja rec. estrogenowego; protekcyjny efekt
tamoxifenu

BRCA2
Gen supresorowy
13q12.3
naprawa uszkodzeń typu przerw w
dwuniciowym DNA

NOTCH
Szlak przekazywania sygnałów
NOTCH - b. konserwatywny
receptory NOTCH 1-4 to białka
przezbłonowe
przekazywanie sygnałów związane z
jonami Ca

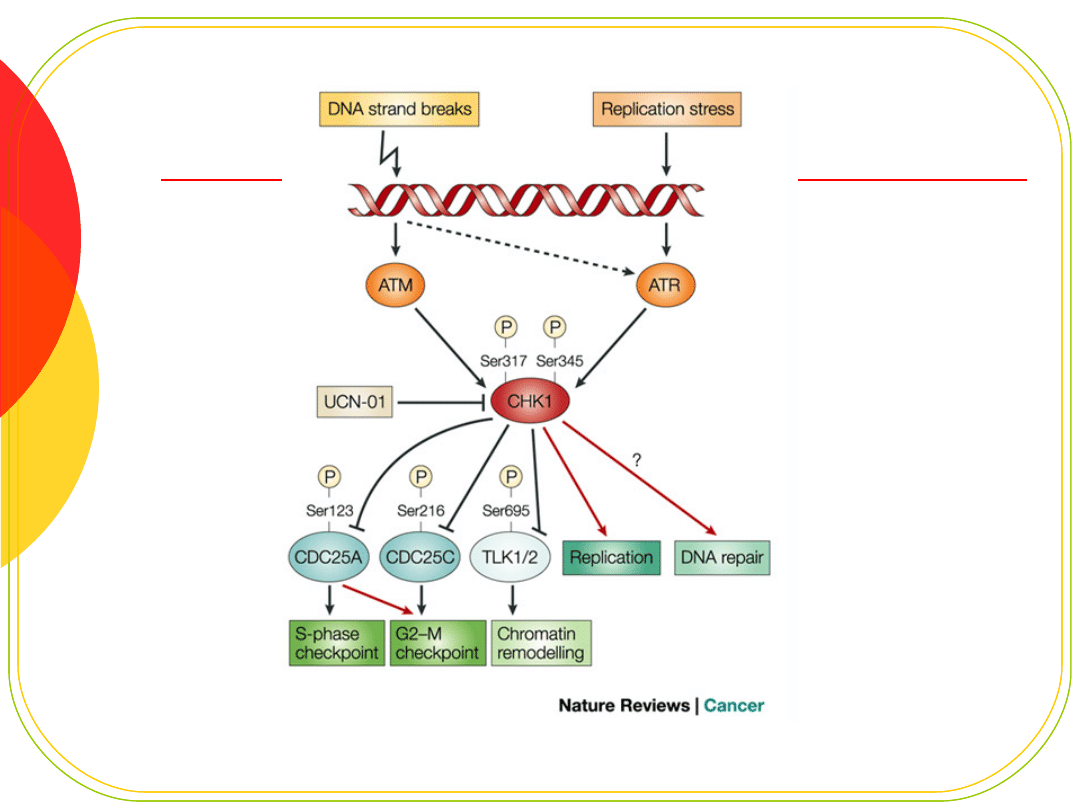
CHK1, CHK2
Kodują kinazy serynowo-treoninowe
Regulują podstawowe funkcje
komórki:
replikację
cykl komórkowy
zmiany struktury chromatyny
apoptozę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
Wyszukiwarka
Podobne podstrony:
Genetyka Nowotworów
Niestabilność genetyczna w nowotworach 1
genetyka nowotworow
genetyka nowotworow
Niestabilność genetyczna w nowotworach., Niestabilność chromosomowa:
03 Genetyka w nowotworachid 4362 ppt
Genetyka nowotworów
Niestabilność genetyczna w nowotworach, NIESTABILNOŚĆ GENETYCZNA W NOWOTWORACH
14 Genetyka nowotworow
Niestabilność genetyczna w nowotworach 1
Genetyka nowotworzenia 01
Genetyka nowotworów
Genetyczne podstawy nowotworów, Biologia medyczna
Diagnostyka predyspozycji genetycznych do chorob nowotworowych
GENETYCZNE PODSTAWY NOWOTWORÓW(1)
GENETYKA KLINICZNA V rok seminarium Nowotwory dziedziczne wprowadzenie Nowotwory jelita grubeg
nowotwory dla studentów, psychologia, Genetyka
IG.4 - Uszkodzenia i naprawa DNA w komórkach nowotworowych, Genetyka, Inżynieria genetyczna
więcej podobnych podstron