
Wykład 7
Otrzymywanie i metody
badania związków
koordynacyjnych



Metody syntezy związków
kompleksowych
• Reakcje, w których wzrasta liczba koordynacyjna metalu,
nazywamy reakcjami przyłączania (addycji), a reakcje, w
których liczba ta nie zmienia się - reakcjami podstawiania
(substytucji).
W reakcjach dysocjacji (eliminacji) liczba koordynacyjna maleje.
Reakcje związane ze zmianami stopnia utlenienia noszą nazwę
reakcji utleniania lub reakcji redukcji.
• Klasyfikacja kompleksów oparta na szybkości reakcji
podstawienia, w których kompleksy te uczestniczą.
Gdy do roztworu siarczanu miedzi(II) w wodzie doda się wodnego
roztworu amoniaku, następuje niemal natychmiast zmiana barwy z
bladoniebieskiej na ciemnoniebieską w wyniku bardzo szybkiego
utworzenia aminakompleksu (w reakcji tej amoniak zastępuje część
cząsteczek wody skoordynowanych z jonem miedzi(II)). Jest to
przykład tworzenia przez miedź(II) kompleksów kinetycznie
labilnych.
Z drugiej strony, wielu godzin (a nawet dni w temperaturze
pokojowej) wymaga zastąpienie cząsteczek wody skoordynowanych
z jonem chromu(III) przez inne ligandy. Można tu również ogólnie
stwierdzić, że chrom(III) tworzy kompleksy kinetycznie inertne.
• Kompleksy kinetycznie labilne – czas półtrwania ≤ 1 minuta
• Kompleksy kinetycznie inertne – czas półtrwania > 1 minuta

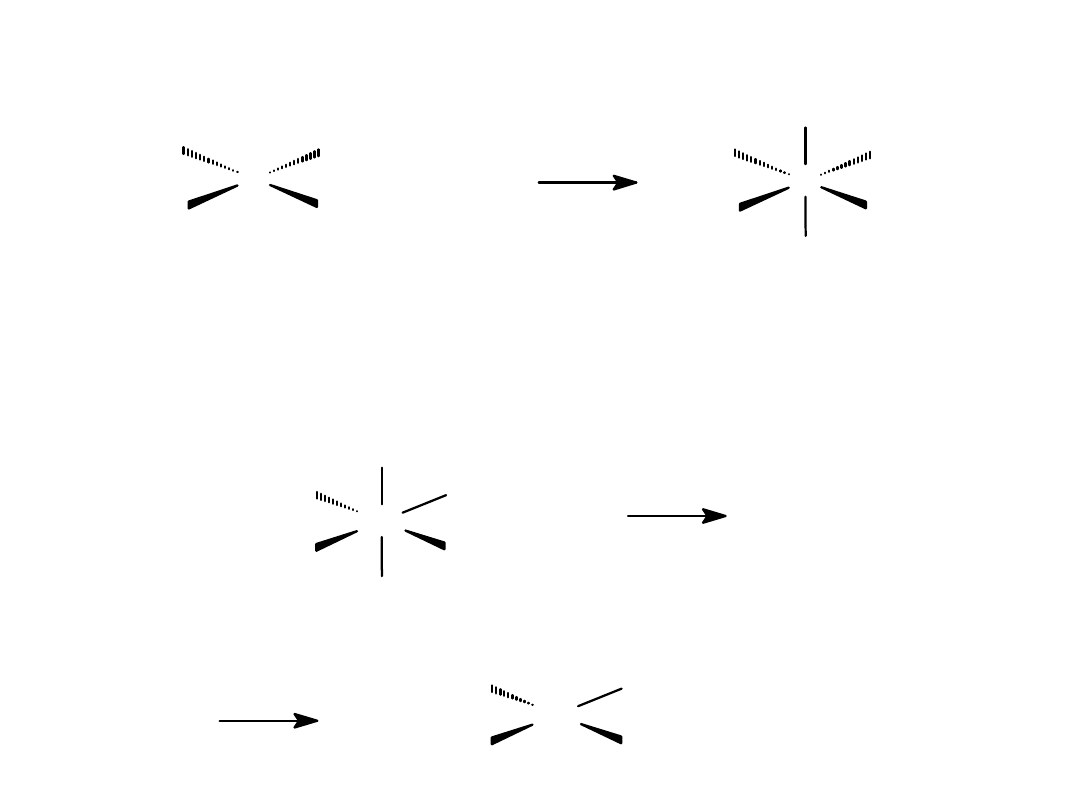
CO
Ir
Br
Cl
PPh
3
H
Ph
3
P
Ir
Cl
PPh
3
CO
Ph
3
P
+ HBr
Co
(H
3
CO)
3
P
P(OCH
3
)
3
P(OCH
3
)
3
(H
3
CO)
3
P
P(OCH
3
)
3
Co
H
(H
3
CO)
3
P
P(OCH
3
)
3
CH
3
(H
3
CO)
3
P
+ CH
4
Reakcja addycji utleniającej
Reakcja reduktywnej
eliminacji
Reakcje dysocjacji termicznej:
CuSO
4
96,5°C
102°C
115°C
220°C
CuSO
4
CuSO
4
CuSO
4
CuSO
4
• Termiczna analiza różnicowa
(DTA)
• Analiza termograwimetryczna
(TGA)
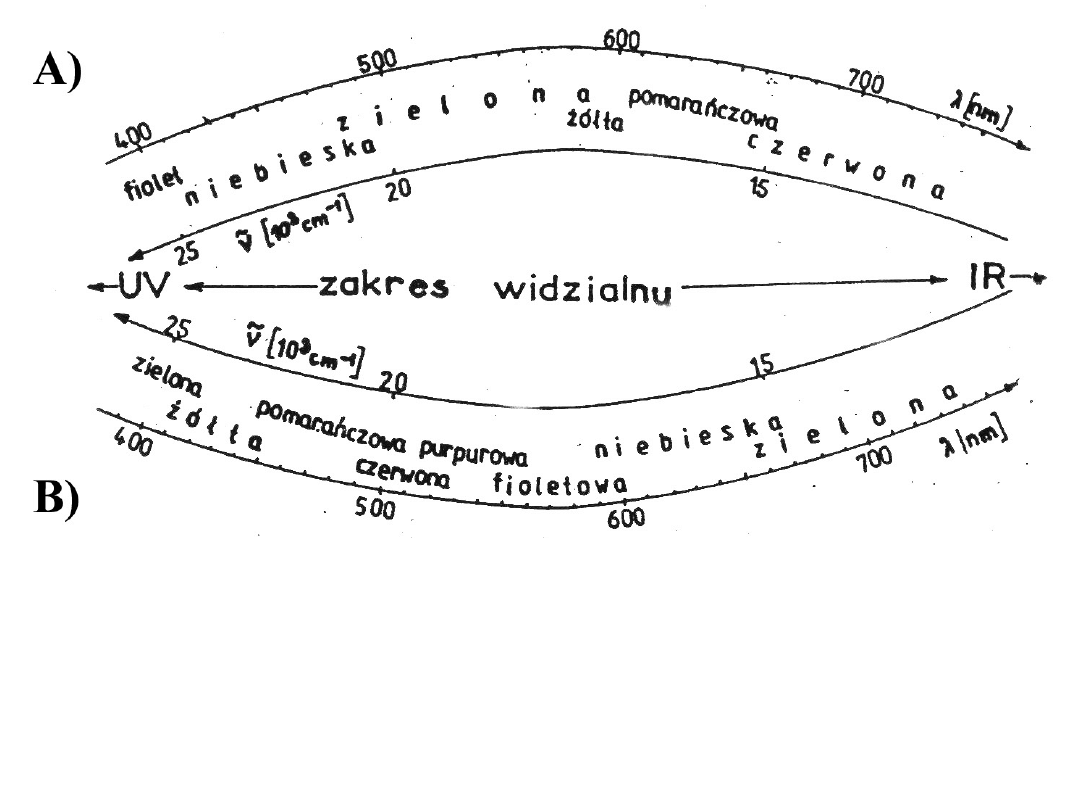
Barwy odpowiadające różnym zakresom widzialnej
części widma:
A. kolor światła emitowanego przy danej długości fali,
B. kolor związku absorbującego promieniowanie z podanego
zakresu długości fal


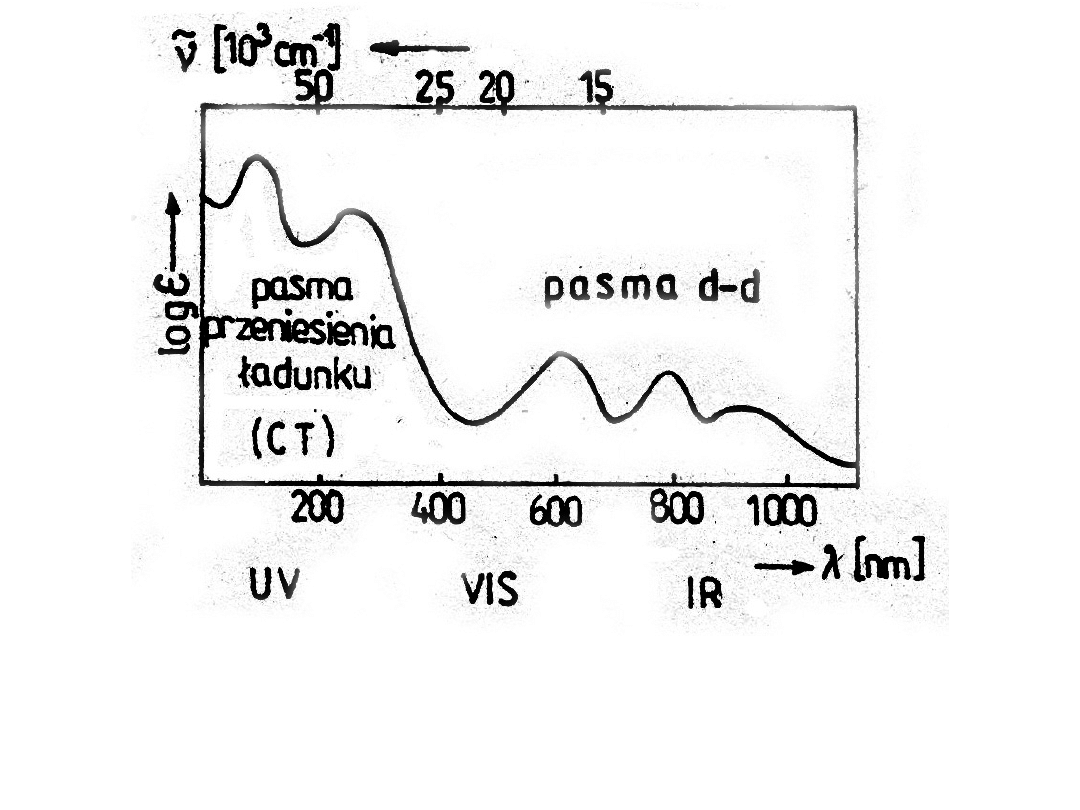
Widmo absorpcyjne
kompleksu
Document Outline
Wyszukiwarka
Podobne podstrony:
1 Dydaktyka, pojęcia, metody badaniaid 9187 ppt
1 Dydaktyka, pojęcia, metody badaniaid 9187 ppt
01 Badania neurologicz 1id 2599 ppt
METODY BADANIA PRACY poziome 2
Metody badania antybiotykoopornoci
J Kossecki, Cele i metody badania przeszłości w różnych systemach sterowania społecznego
METODY BADANIA UKŁADU LIMFATYCZNEGO
związki koordynacyjne
METODY BADANIA UKŁADU LIMFATYCZNEGO, Mieszanka Mareckiego
Interpretacja czynnikowa CPQ, psychologia, studia psychologia, semestr V, materiały gmail, Brachowic
podanie rodzica dziecka zameldowanego i zamieszkalego p, PWR, Zarządzanie, SEMESTR IV, Metody badani
Metody badania białek, Materiały - Biotechnologia
Testy psychologiczne - Metody badania klinicznego, PSYCHOLOGIA, Etyka zawodowa
Chemia związków koordynacyjnych
METODY BADANIA POWIERZCHNI KATALIZATORÓW TECHNIKI SKANINGOWE
objawy zaburzeń percepcji słuchowej i metody badania percepcji słuchowej
więcej podobnych podstron