
Ługowa
nie
Ługowaniem nazywamy proces selektywnego rozpuszczania
składników surowca w rozpuszczalniku
.
MO + 2 H
+
= M
2+
+ H
2
O
2 M + 4 H
+
+ O
2
= 2 M
2+
+ 2 H
2
O
wprowadzamy utleniacz do metalu aby metal był jonowy.
W procesach hydrometalurgicznych można odzyskać wszystko co wartościowe, a w
pirometalurgicznych – nie.
Stąd hydrometalurgia jest bardzo korzystna.
Ługowanie – pierwszy etap hydrometalurgii. Podstawowe ługowanie to doprowadzenie
składnika do roztworu jonowego.

Ługowa
nie
Cechy dobrego rozpuszczalnika:
1. Selektywność wobec ekstrahowanego metalu lub kompleksowe
przeprowadzanie do roztworu grupy metali
.
Nie może rozpuszczać całości.
2
.
Duża szybkość rozpuszczania w możliwie niskich temperaturach przy
małej lepkości roztworów
.
Przy ługowaniu parują toksyczne składniki –
stąd proces musi być możliwie szybki i w niskich temperaturach. Większość
procesów realizuje się przy niskich temperaturach ze względu na to, że to
procesy egzotermiczne (efekt cieplny powoduje podgrzewanie się roztworu).
Nie potrzeba dodatkowych kosztów na ogrzewanie, ale temperatura zbyt
wysoka jest niedobra dla sprzętu.
3. Uzyskiwanie możliwie wysokich koncentracji metalu w roztworze.
Czyli rozcieńczanie bez zwiększania objętości, np. w procesie elektrolizy uzupełniamy
roztwór roztworem o większym stężeniu.
4. Łatwość regeneracji.
Wymogi ochrony środowiska: wszystkie procesy muszą
zachodzić w obiegu zamkniętym, nie można produkować ścieków. Nie stosuje się
sodowych roztworów, bo trudno jest przeprowadzić sód w postać pierwotną.
.

5. Nie rozpuszczający bezużytecznych składników surowca.
Skała
płona powinna zostać nierozpuszczona.
6. Łatwo rozpuszczalny w wodzie
– dla wysokich koncentracji metalu
,
nielotny, nietoksyczny, bezpieczny w użyciu, łatwy do
magazynowania, niepalny, nie korodujący aparatury i nie
zanieczyszczający środowiska.
7. Trwałość
.
Dobry jest roztwór kwasu siarkowego.
Ługowanie proste:
MSO
4
+ woda = MSO
4
(roztwór)
– rozpuszczanie składników, materiałów
MCl
2
+ woda = MCl
2
(roztwór)
reakcja dla niklu
Rozpuszczanie z reakcją wymiany:
MO + H
2
SO
4
= MSO
4
+ H
2
O
MS + H
2
SO
4
= MSO
4
+ H
2
S
ługowanie trudne, rzadko stosowane i przy
zwiększonym ciśnieniu. Ale -
MSO4 rozpuszcza się w wodzie.
MCO
3
+ H
2
SO
4
= MSO
4
+ H
2
CO
3
kwas węglowy, słaby nietrwały więc rozpada
się na CO2 i pieni się – - trzeba intensywnie
mieszać.
CaWO
4
+ Na
2
CO
3
= CaCO
3
+ Na
2
WO
4
forma anionowa. Składnik szelit
CaWO4 – dla wolframu rozpuszcza się w roztworze wodnym Na
2
CO
3
i powstaje stały
CaCO
3
– rozpuszczalny w wodzie wolframian.
Powstaje nam inna faza stała dla wolframianu. Selektywne wydzielanie metalu.
Ługowa
nie

Rozpuszczanie związane z utlenianiem metalu:
M + H
2
SO
4
= MSO
4
+ H
2
rzadko prowadzi się tę reakcję, bo wydzielający się wodór
tworzy stałe związki z arsenem – arseniany.
M + H
2
SO
4
+ ½ O
2
= MSO
4
+ H
2
O
otrzymuje się przez przedmuchiwanie procesu
aby dostarczyc tlen – proces ważny dla miedzi.
M + Fe
2
(SO
4
)
3
= MSO
4
+ 2 FeSO
4
Takie procesy mogą służyć do ługowania
niektórych koncentratów (hałdy w Chile - Cu). Utlenianie takiego roztworu powoduje
utlenienie Fe do trójwartościowego i zawrócić do procesu zwiększając koncentracje
metalu.
(Działanie solą siarczkiem żelaza – czynnik ługujący. Powstaje siarczan tego metalu)
M + H
2
SO
4
+ H
2
O
2
= MSO
4
+ 2 H
2
O –
bardzo agresywne. Powstaje woda, która
jest czystym składnikiem – stosowana do odzyskiwania czystego składnika. Stosowane w
recyklingu, gdy chcemy odzyskać metal rzadki (duży koszt nadtlenku wodoru)
Rozpuszczanie związane z utlenianiem anionu:
MS + MSO
4
+ ½ O
2
= MSO
4
+ MO + S
siarka elementarna
MS + 2 M’Cl
2
= MCl
2
+ 2 M’Cl + S
stosowana do ługowania cynku z siarczku
cynku
Ługowa
nie

Rozpuszczanie z redukcją metalu:
3 CuO + 2 FeCl
2
+ 3 H
2
O = CuCl
2
+ 2 CuCl + 2 Fe(OH)
3
Cu na 2gim stopniu utlen. Cu na 2gim st utl Cu na 1wszym st utlen.
Reakcja może być łatwo regenerowana: Fe(OH)
3
zawraca się po połączeniu z kwasem jako
FeCl
Rozpuszczanie z tworzeniem związków kompleksowych:
2 Cu + O
2
+ n NH
3
= 2CuO.nNH
3
rozpuszcza się czysta miedź
CuO + 2 NH
4
OH + (NH
4
)
2
CO
3
= [Cu(NH
3
)
4
]CO
3
+ 3 H
2
O
Pozwala na
usunięcie miedzi z roztworu, a pozostanie kobaltu itp.. – trwały kompleks
[Cu(NH
3
)
4
]CO
3
+ Cu = [Cu
2
(NH
3
)
4
]CO
3
Ługowa
nie

Ługowa
nie
Podział odczynników ługujących:
Odczynniki kwaśne:
•Silnie agresywne i stężone roztwory kwasów(siarkowy,
fluorowodorowy, azotowy, woda kr
•ólewska)
•Kwasy rozcieńczone (H
2
SO
4
, HCl)
•Sole hydrolizujące kwaśno (Fe
2
(SO
4
)
3
, FeCl
3
)
•Ługowanie bakteryjne (utlenianie jonów żelaza i siarczków przez
bakterie Thiobacillus-thiooxidans i –ferrooxidans)
Pierwszy rodzaj bakterii do
roztworów siarczków, drugi do roztworów żelaza. Proces ten trwa tygodniami w środowisku
kwaśnym, bakterie utleniają Fe do trójwartościowego, aby można było zawrócić je do
procesu.
Wiele związków nie chce rozpuszczać się w stężonych kwasach (bądź w rozcieńczonych).
Czasami ługowanie rozpoczyna się np.. Rozcieńczonym kwasem, a potem stężonym – zależy
to od właściwości związku rozpuszczanego.
Odczynniki obojętne:
•Woda
oczyszcza materiał ze składników, które rozpuszczają się dobrze w wodzie i są
niepożądane, np. chlorki.
•Sole obojętne (NaCl, CaCl
2
)

Odczynniki kompleksowe:
•Sole amonowe i amoniak
– najczęściej stosowane
•Cyjanki (w warunkach utleniających i beztlenowych)
tylko do złota –bardzo
trujące
•Węglany w warunkach utleniających (ługowanie U
3
O
8
, UO
2
)
do ługowania
rud amonu
•Substancje organiczne (EDA, EDTA, gliceryna, glikol etylenowy)
mają
znaczenie w procesach wymiany jonowej – tworzy się odpowiednie kompleksy do
wyekstrahowania.
Odczynniki alkaliczne:
•Roztwory węglanów i amoniaku w warunkach utleniających w
podwyższonych temperaturach i pod ciśnieniem)
amoniak paruje – proces
przeprowadza się pod ciśnieniem. Ponieważ paruje to łatwo usunąć go z roztworu. Zawraca
się go do procesu rozpuszczając w wodzie
•Wodorotlenki alkaliczne, często w warunkach utleniających i w
podwyższonych temperaturach
Ługowa
nie

Ługowa
nie
Kinetyka procesów ługowania
Głównym czynnikiem jest temperatura. Wraz z jej wzrostem wzrasta rozpuszczalność
związków.
W typowym procesie heterogenicznym występuje faza ciekła i faza stała.
Materiał do procesu ługowania musi być rozdrobniony.(!!!) aby szybko przebiegały procesy.
Procesy rozdrabniania można łączyć z procesami kompleksowania związków. Np. rudy
glinonośne (Al) spieka się z wapnem aby powstał materiał łatwy do ługowania krzemian
wapna. Spiek ulega samorozkładowi przy ługowaniu – nie trzeba go rozdrabniać.
Proces mieszania pulpy ma duże znaczenie, bo likwiduje efekt polaryzacji cząsteczek.
Roztwór przy cząsteczce będzie się nasycał – ilość jonów rozpuszczalnika będzie mniejsza i
proces spowolnieje. Mieszając zapobiegamy temu, bo rozpuszczalnik jest ciągle dostarczany
do cząsteczek i jej najbliższego środowiska. Nie należy przesadzać z ilością obrotów
mieszadła.
Ciśnienie – część procesów prowadzi się pod ciśnieniem – aby uzyskać wysoką temperaturę
korzystną dla procesu. Proces przeprowadza się w autoklawie, ciśnienie wynosi około 3-4
atmosfer – rzadko więcej.
dT
k
d
RT
E
)
(ln
2
RT
E
ae
k
T
f
k
1
ln

Ługowa
nie
Warunkiem przeprowadzenia ługowania jest dostarczenie reagentów
do powierzchni fazy stałej. Z tego względu oprócz zależności
termodynamicznych istotne są czynniki regulujące szybkość
przenoszenia masy między rozpuszczaną fazą stałą a roztworem.
Najważniejszymi czynnikami są:
•Wielkość powierzchni fazy stałej
•Szybkość transportu reagentów do powierzchni fazy stałej
•Szybkość transportu rozpuszczonych produktów w głąb roztworu.
Jeżeli najwolniejszymi etapami ługowania są procesy transportu do
granicy faz, mówi się, że kontrolują one proces rozpuszczania lub, że
rozpuszczanie biegnie w obszarze dyfuzyjnym.

Ługowa
nie
Procesy zachodzące w obszarze dyfuzyjnym opisuje I prawo Ficka:
dy
dc
V
DS
dt
dc
dt
dc
szybkość rozpuszczania mierzona przyrostem stężenia c
w czasie t
D
współczynnik dyfuzji
jest
charakterystyczny dla charakterystyczny dla rodzaju
rozpuszczalnika i jego gęstości (tym samym lepkości.
Może ograniczać stężenie i szybkość reakcji. Przy
siarczanach gęstość rośnie nieznacznie, lepkość jest
niewielka. Stężony kwas siarkowy ma dużą lepkość –
stąd nie jest dobrym czynnikiem ługującym
S
powierzchnia reakcji
V
objętość roztworu
dy
dc
gradient stężenia w warstewce dyfuzyjnej o grubości y
w
jaki sposób wpływa mieszanie, które zmniejsza grubość y

Ługowa
nie
Jeżeli etapem najpowolniejszym jest reakcja na granicy ciało stałe –
roztwór to ona kontroluje proces ługowania. Objawia się to znaczącym
wzrostem szybkości ługowania ze wzrostem temperatury oraz wysoką
energią aktywacji (rzędu kilkunastu kcal/mol).
Obniżanie energii aktywacji jest zadaniem katalizy i prowadzi w efekcie
do zwiększenia szybkości ługowania. W procesach ługowania
najczęściej mamy do czynienia z katalizą heterogeniczną, której
mechanizmy są bardzo złożone.

Ługowa
nie
Procesom ługowania towarzyszą często procesy hydrolizy. Hydroliza
polega na rozpadzie cząsteczek związku chemicznego w wyniku
reakcji z wodą. W przypadku soli jonowych są to wtórne reakcje
jonów tej soli prowadzące niekiedy do zmiany pH środowiska.
Reakcje te przebiegają zazwyczaj wg schematu:
A-B + H
2
O = H-B + A-OH
Hydrolizie mogą ulegać:
•Odczynnik ługujący
- niekorzystne
•Jony metalu ługowanego
- niekorzystne
•Inne substancje pochodzące z materiału rozpuszczanego
– korzystne,
po to własnie ten proces się przeprowadza – aby oczyścić metal z brudów.
Poprzez procesy hydrolizy usuwa się z roztworu zanieczyszczenia
metalu podstawowego.
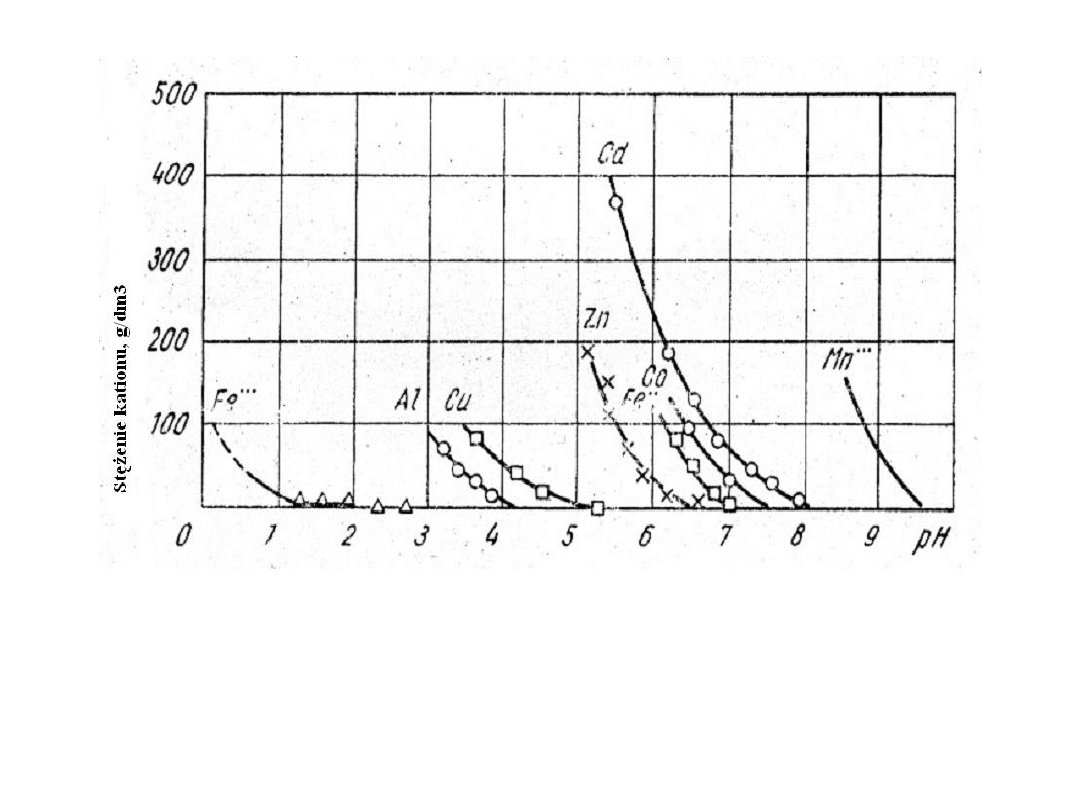
Ługowa
nie
Wpływ stężenia kationu w roztworze na pH początku wytrącanie
się jego wodorotlenku.
Istotne znaczenie ma pH roztworu. W miarę jak
wzrasta pH zmniejsza się stężenie kationu – ma to wpływ na rozpuszczalność.
Musimy patrzeć w jakich warunkach zacznie hydrolizować nam interesujący nas
metal. Np. dla Zn pH nie powinno przekraczać 5 (ale Cu nie usuniemy w całości bo
maleńki kawałek zachodzi poza 5). Fe dwuwartościowego nie bylibyśmy w stanie
usunąć, bo potrzeba pH 7 i wraz z Fe usunęlibyśmy cały Zn. Ale Fe można utlenić
do trójwartościowego i wtedy usunąć.

Ługowa
nie
pH początku hydrolizy:
Sb
3+
1,2
Sn
2+
1,4
Fe
3+
1,6
Al
3+
3,1
Cu
2+
4,5
Zn
2+
5,9
Co
2+
6,4
Fe
2+
6,7
Cd
2+
7,0
Ni
2+
7,1

Cementa
cja
Jeżeli nie usuniemy niepożądanego metalu za pomocą hydrolizy, to stosujemy inne
metody np. cementację. Metal wchodzący do roztworu jest w nim, a niepożądany jest
cementowany. Istotą cementacji jest szereg napięciowy metali – potencjały. !!! SZEREG
POTENCJAŁÓW NORMALNYCH JEST KRYTERIUM WYBORU METALU DO CEMENTACJI
!!! Aktywność pierwiastka się zmienia – rośnie dla metalu wypierającego.
Schemat procesu cementacji: Na aktywnym metalu (czyli o potencjale normalnym
niższym niż te, które chcemy wyeliminować) tworzy się na nim osad z cementowanych
metali. Warstwa dyfuzyjna będzie decydować o szybkości procesu, możemy ją regulować
przez mieszanie.
Cementacja – proces wypierania z roztworu jonów jednego metalu
przez drugi, przy czym pierwszy z nich przechodzi ze stanu jonowego
w metaliczny, a drugi z metalicznego w jonowy.
z
2
Me
1
z1+
+ z
1
Me
2
z
2
Me
1
+ z
1
Me
2
z2+
Przez cementację można usunąć zanieczyszczenia bardziej
elektrododatnie niż metal podstawowy, przy czym najczęściej
cementację prowadzi się metalem podstawowym. Wynika z tego, że
każdy metal bardziej elektroujemny powinien wypierać z roztworu
jony metali bardziej elektrododatnie.

Cementa
cja
Jeżeli metal wypierający stosowany jest w nadmiarze, to proces
będzie przebiegał do wyrównania potencjałów termodynamicznych
lub, co jest równoznaczne, do wyrównania potencjałów
elektrochemicznych.
2
2
2
1
1
1
ln
ln
2
0
1
0
z
Me
Me
z
Me
Me
a
F
z
RT
a
F
z
RT
0
0
2
1
,
Me
Me
2
2
1
1
,
z
Me
z
Me
a
a
- potencjały normalne metalu wypieranego i
wypierającego
- aktywności ich jonów w roztworze
R – stała gazowa
F – stała Faradaya
T – temperatura bezwzględna

Cementa
cja
Potencjały normalne metali, V:
magnez-2,38
glin
-1,71
cynk
-0,76
żelazo
-0,41
kobalt
-0,28
nikiel
-0,22
cyna
-0,14
ołów
-0,13
miedź
+0,34
srebro
+0,80
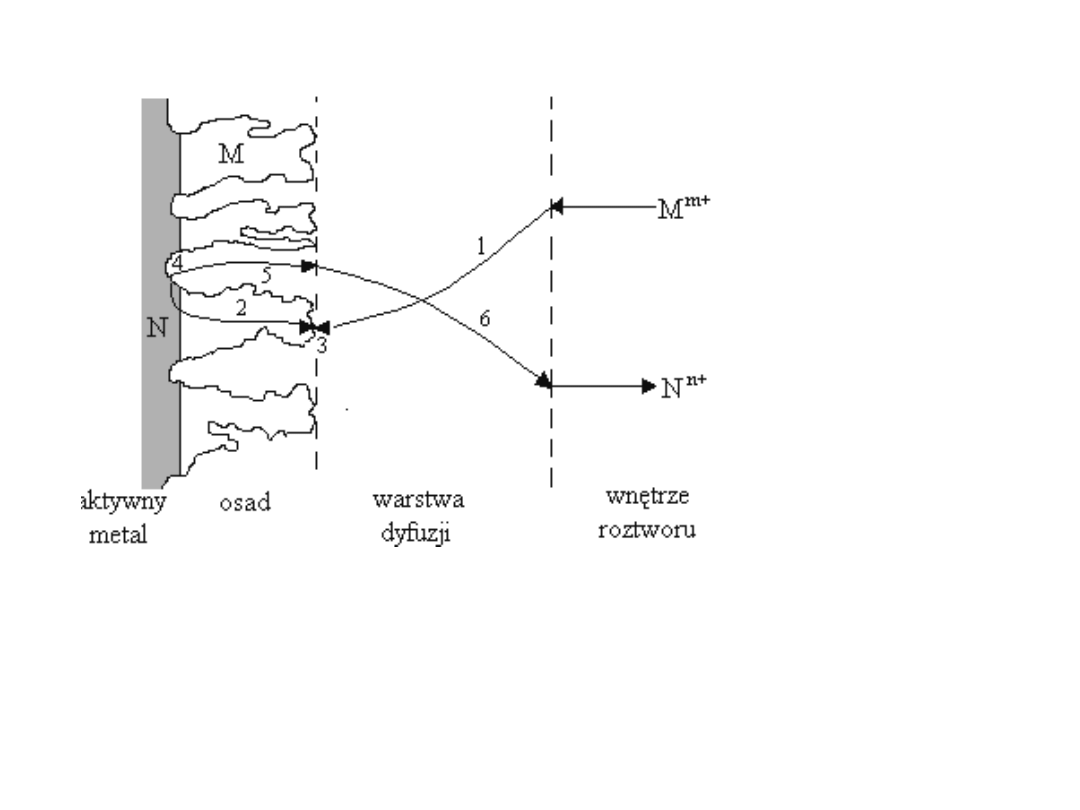
Ogólny schemat procesu cementacji jonów
metalu bardziej szlachetnego (M
m+
) na
podkładce z metalu mniej szlachetnego (N)
Cementa
cja

Cementa
cja
Czynniki wpływające na szybkość cementacji:
•Odległość między metalami w szeregu napięciowym (różnica
potencjałów normalnych)
•Temperatura
•pH roztworu
•Mieszanie
•Powierzchnia metalu cementującego
Pył cynkowy będzie stanowił
mieszaninę ale gdy chcemy uzyskać czysty metal nie warto stosować pył, bo będzie
zanieczyszczał. Wtedy stosuje się płyty, które odbierają zanieczyszczenia i po
przefiltrowaniu roztworu uzyskamy gąbkę czystego metalu.
•Wpływ pH i temperatury na proces:
Wzrost temperatury i obniżanie pH roztworu wpływa na szybkość procesu. Ale do
pewnych granic: pH 3 – 4 i podwyższymy temperaturę to nastąpi moment, że będzie
rozpuszczać tworząca się gąbka. Im niższe pH roztworu tym większa tendencja do
kwasowego rozpuszczania. Trzeba tak wypośrodkować, aby proces był optymalny.
Proces cementacji prowadzi się obecnie w sposób ciągły rozpylając cementator,
zawartość niepożądanych metali systematycznie spada

Elektroli
za
Elektroliza jest jednym z wielu sposobów wydzielania metali z roztworów. Elektroliza jest
stosowana gdy chcemy uzyskać metal o dużej czystości, nie potrzeba po niej
rafinacji (elektroliza sama uznawana jest za proces rafinacji). Elektrolizą rządzą
dwa prawa Faraday’a.
Prawa elektrolizy Faradaya:
I.
Masa produktu elektrolizy m wydzielona na elektrodzie jest
proporcjonalna do ładunku Q przepływającego przez elektrolit.
m = kQ
ta teoria mówi o maximum jakie możemy osiągnąć, gdyby nie było strat prądowych.
2gie prawo mówi o współwydzielaniu, czyli jeśli mamy 2 różne roztwory, to przy takim
samym natężeniu prądu i w tym samym czasie otrzymamy masy proporcjonalne do
ich równoważników chemicznych.
II.
Masa m substancji wydzielonej przez prąd elektryczny jest wprost
proporcjonalna do natężenia prądu I i czasu jego przepływu t przez
elektrolit
.
m = kIt
k – równoważnik elektrochemiczny (ilość substancji wydzielająca się przy
przepływie ładunku 1 C)
M – masa atomowa
z – wartościowość
F – stała Faradaya 96500 C
Jednakowe ładunki wydzielają z roztworów różnych substancji masy
proporcjonalne do równoważników chemicznych
.
zF
M
k
Elektroli
za
Procesy elektrochemiczne w metalurgii:
•Elektrolityczne wydzielanie metali z roztworów
•Elektrolityczna rafinacja metali
Różnice między procesami elektrolizy i elektrorafinacji: w przypadku elektrolizy źródłem
metalu na katodzie jest roztwór elektrolitu, w przypadku rafinacji źródłem jest anoda.
Krótko: elektroliza – nierozpuszczalna anoda, rafinacja elektrolityczna – rozpuszczalna
anoda.
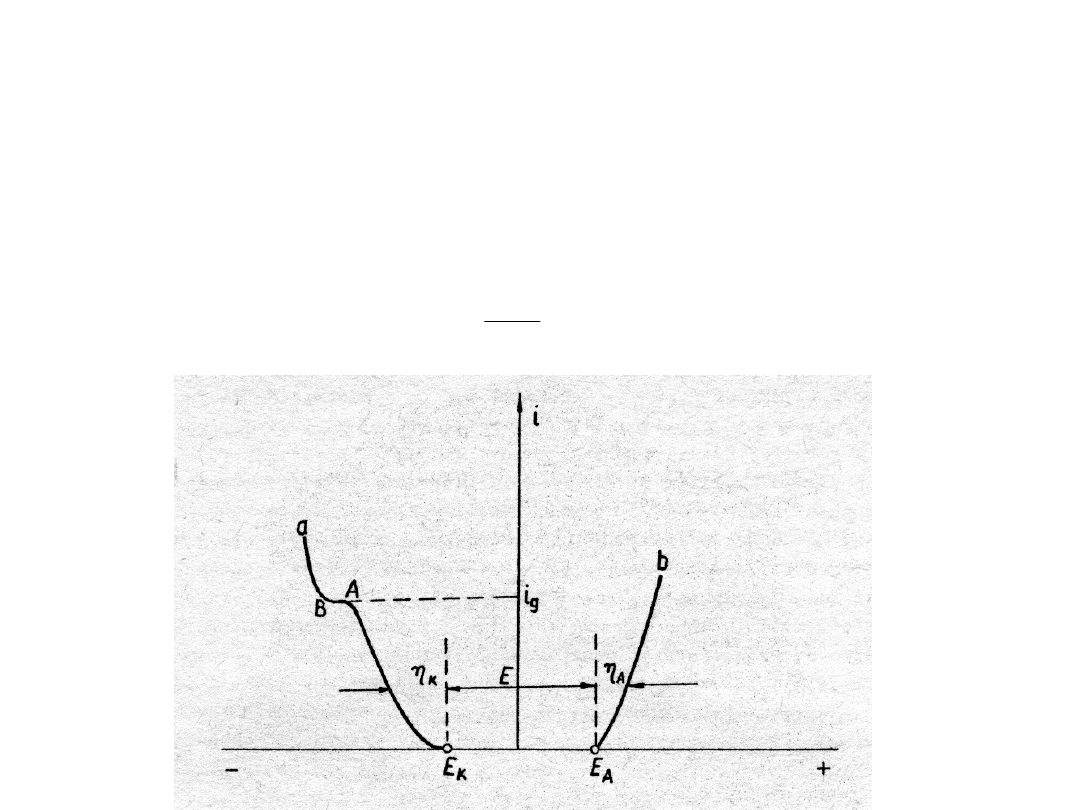
Różnica
potencjałów
Elektroliza
Aby
na katodzie wydzieliła się masa musimy wytworzyć nadnapięcie! Dodatkowe nadnapięcie –
gęstość rośnie do wartości krytycznej i będzie wydzielać się tylko jeden rodzaj kationu. Gdy
potencjały się wyrównają zacznie wydzielać się drugi metal (punkt i
g
na wykresie). Prąd graniczny
limituje wydzielanie drugiego metalu – nie dopuszczamy do tego bo chcemy tylko metal
podstawowy (wydajność prądowa decyduje o stężeniu metalu). Wybieramy takie warunki aby mieć
jak najmniejsze straty prądowe. Nie prowadzi się procesu zaniżając gęstość roztworu – np.
zrezygnowano z kaskadowego ułożenia wanien w hucie cynku, bo gęstość była od 120 g/l w
pierwszej wannie do 30 g/l na ostatniej. Na każdej wannie na nowo przeprowadzano proces
elektrolizy, co było bardzo nieekonomiczne. Obecnie ten proces jest prowadzony w sposób ciągły.
a
zF
RT
E
E
ln
0

Elektroli
za
Polaryzacja elektrod:
•Stężeniowa – zmiana stężenia jonów w bezpośrednim sąsiedztwie
elektrody spowodowana ich rozładowaniem
•Aktywacyjna – powolny przebieg procesu elektrodowego lub jednego
z jego etapów.
O stężeniowej: gdy mamy elektrodę, to w bezpośrednim jej sąsiedztwie zachodzi elektroliza
i stężenie roztworu spada. Dlatego stosuje się odpowiednią szybkość przepływu elektrolitu.
Burzliwy przepływ elektrolitu, za względu na pływające szlamy, niszczyłby ten proces (bo
szlamy powinny opaść, a przy burzliwym mieszaniu pływają). Likwiduje się tę polaryzację
nie mieszając zbyt burzliwie (odpowiednio). Widać to na powierzchni elektrody po rafinacji
– elektroid przepływa przy brzegach, a nie na jej środku.
O aktywizacyjnej: spowodowana jest powolnym przebiegiem procesu lub jego jednego
etapu. Elektroda nie nadąża z rozładowaniem nadpływających jonów. Ta polaryzacja jest
trudna do usunięcia, bo nie można określić jej parametrów.

Elektroli
za
Nadnapięcie
E
w
= E +
E
w
– potencjał wydzielania
Nadnapięcie stężeniowe
Nadnapięcie aktywacyjne
Gdy do procesu elektrolizy bierzemy metal elektroujemny, to musimy dodać
dodatkowe nadnapięcie i przesunąć jego elektroujemność bliżej wodoru.
Dotyczy się to siarczków cynkowych (- 0,76). Napięcie pomiędzy
elektrodami musi być wyższe, aby ten proces mógł zachodzić. Musimy
liczyć się też, że na katodzie zawsze będzie wydzielał się wodór (ze względu
na położenie w szeregu napięciowym).
k
a
a
zF
RT
log
I
b
a
log

Elektroli
za
Energia dostarczana do elektrolizera zostaje zużyta:
•na spolaryzowanie elektrod do wartości potencjałów wydzielania
•do rozładowania kationów i anionów
•do wytwarzania sieci krystalicznej osadów metalicznych
•do pokonania oporów omowych

Elektroli
za
Procesy katodowe:
najważniejszą
reakcją jest proces wydzielania się metalu,
drugim proces wydzielania się wodoru (dla
ujemnych)
M
z
+
+ 2e = M
w środowisku kwaśnym
rozkład
jonu H
3
O
H
3
O
+
+ e = ½ H
2
+ H
2
O
w środowisku zasadowym
rozkład
wody
H
2
O + e = ½ H
2
+ OH
-

Elektroli
za
Procesy anodowe:
z rozpuszczalną anodą
•rozpuszczanie metalu
najważniejszy proces
M = M
z+
+ z e
•tworzenie tlenków metali (utlenianie)
M + z H
2
O = MO
z/2
+ z H
+
+ z/2 H
2
O + z e
Reakcje wydzielania tlenu wg różnych reakcji w zależności od
środowiska:
•wydzielanie tlenu w środowisku kwaśnym
– tlen i jon
wodorowy
2 H
2
O = O
2
+ 4 H
+
+ 4 e
•wydzielanie tlenu w środowisku zasadowym
–
rozładowanie jonów OH
-
(powstaje tlen i woda)
4 OH
-
= O
2
+ 2 H
2
O + 4 e
•utlenianie anionów
dla chlorkowych roztworów
2 Cl
-
= Cl
2
+ 2 e
•podwyższenie wartościowości jonu
na katodzie redukcja
do niższego stopnia, na anodzie podwyższenie wartościowości, np.
Fe dwuwartościowe na anodzie podwyższa swą wartościowość o 1,
aby potem na katodzie ponownie ją obniżyć. Powoduje to wydajność
prądową procesu.
M
z+
= M
(z+n)+
+ n e
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
Wyszukiwarka
Podobne podstrony:
proc met ekstr 3 cz 3
proc met ekstr 3 cz 2
zagadnienia III rok met ekstr, Studia
Harm Lab Gr 3 met ekstr
Kapitał proc
A dane,inf,wiedza,uj dyn stat proc inf w zarz 2008 9
ST14 20010 Met ppt
met PCD
Jama brzuszna c d 17 12 06 komentarz
Sp asp proc kom cz VII 2010
H Bankowość ele platnosci ele proc inf w zzarz 2008 9
Komentarz praktyczny do Nowego Testamentu LIST DO FILIPIAN
KM W 25 lekkie konst met stud
Dostosuj zakład do przepisów prawa pracy Komentarz do ankiety kontrolnej bhp na budowie, 2005 cz3
Komentarz do kodeksu prawa kanonicznego, tom II 1, Księga II Lud Boży , cz 1 Wierni chrześcijanie, P
więcej podobnych podstron