
…::SALICYLANY::…

• Zajmują obecnie pierwsze miejsce wśród leków pod
względem wielkości spożycia:
– dostępne
– często przepisywane przez lekarzy ze względu na ich
szerokie spektrum działania.
Pochodne kwasu salicylowego
Pochodne kwasu salicylowego
•Toksyczność salicylanów jest
niestety powszechnie
niedoceniana: co przy łatwej
dostępności sprawia, że mogą
być przyczyną zatruć ostrych

• W lecznictwie zastosowanie znalazły:
– Salicylan metylu (stosowany wyłącznie zewnętrznie)
– Salicylan fenylu
– Salicylan sodu
– Salicylamid
– Kwas p – aminosalicylowy (właściwości
przeciwgruźlicze)
– Kwas acetylosalicylowy (Polopiryna, Aspiryna)
Pochodne kwasu salicylowego
Pochodne kwasu salicylowego

• Mechanizm przeciwbólowego działania
– hamujący wpływ na ośrodki podkorowe mózgu
– oraz percepcję bólu w zakończeniach czuciowych.
• Ich działanie przeciwzapalne
– hamowanie syntezy prostaglandyn w ognisku
zapalnym.
• Działając na podwzgórze, powodują utratę ciepła z
organizmu przez zwiększenie przepływu krwi na
obwodzie i zwiększone pocenie się.
• Miejscowe działanie
– Podrażnienie błon śluzowych, czego, skutkiem
może być m. in. lekkie krwotoczne zapalenie
żołądka lub mikrohematuria (wynik drażnienia
błon śluzowych dróg moczowych) - krwiomocz
Działanie sacylanów…
Działanie sacylanów…

• Salicylany dobrze wchłaniają się z żołądka (jako
pochodne słabego kwasu pozostają głównie nie
zjonizowane), w znacznej mierze jednak proces ten
zachodzi w górnym odcinku jelita cienkiego.
• Maksymalne stężanie salicylanów po 1 – 2 h od przyjęcia
• Wiążą się w 50 – 80 % z albuminami krwi, stąd
w gośćcu przewlekłym postępującym, często
przebiegającym z hipoalbuminemią, dochodzi do
znacznego podwyższenia poziomu salicylanów we krwi, co
może spowodować zatrucie podczas podawania
terapeutycznych dawek tych leków
• Salicylany łatwo przechodzą do tkanek i płynów
ustrojowych, a także przez łożysko do organizmu płodu.
Wchłanianie, dystrybucja…
Wchłanianie, dystrybucja…

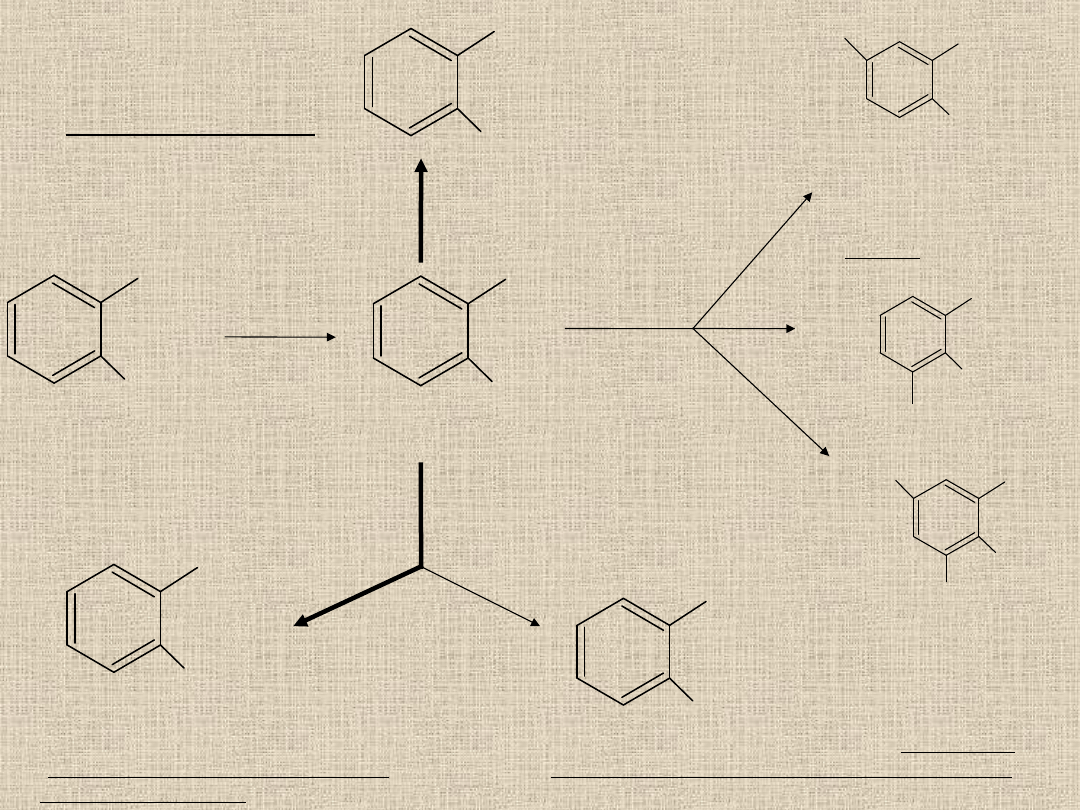
Biotransformacja salicylanów
• Salicylany ulegają biotransformacji w:
głównie wątrobie
częściowo w nerkach.
• Pochodne kwasu salicylowego są szybko i całkowicie
hydrolizowane do kwasu salicylowego
ściana jelita,
krew,
wątroba
esterazy (hydrolazy – rozrywają wiązania
estrowe)
• Ulegają procesowi sprzęgania z kwasem
glukuronowym, glicyną jak i hydroksylacji
COOH
OCOCH
3
COOH
OH
COOH
O * C
6
H
9
O
6
Hydroliza
ściana jelita,
krew, wątroba
Kwas acetylosalicylowy
Kwas salicylowy
Sprzęganie z kwasem glukuronowy
O – karboksyfenyloglukuronid
(glukuronid kwasu salicylowego -
pochodna fenolowa)
COO * C
6
H
9
O
6
OH
O – hydroksybenzoiloglukuronid (Glukuronid
kwasu salicylowego – pochodna benzoilowa)
Sprzęganie z glicyną
Kwas salicylurowy
Ulega sprzężeniu z
kwasem glukuronowym
dając glukuronid kwasu
salicyluronowego
COOH
OH
O
H
COOH
OH
OH
hydroksylacja
COOH
OH
OH
O
H
CO -- NH -- CH
2
-- COOH
OH
Kwas
gentyzynowy
Ulega sprzężeniu z
glicyną dając kwas
gentyzurynowy
– Kwas salicylowy i jego metabolity
• związki łatwo rozpuszczalnymi w wodzie
• wydalane głównie przez nerki
– Głównym metabolitem wydalanym przez nerki, po
dawkach terapeutycznych, jest kwas salicyluronowy (60
– 70%).
– Tylko niewielka część kwasu salicylowego (ok. 7%)
wydalana jest w formie nie zmienionej.
– Po zatruciach ostrych wydalanie kwasu
salicyluronowego zmniejsza się (30%) a kwas salicylowy
może stanowić nawet 70% wszystkich metabolitów.
Wydalanie salicylanów
CO -- NH -- CH
2
-- COOH
OH
Wydalanie salicylanów
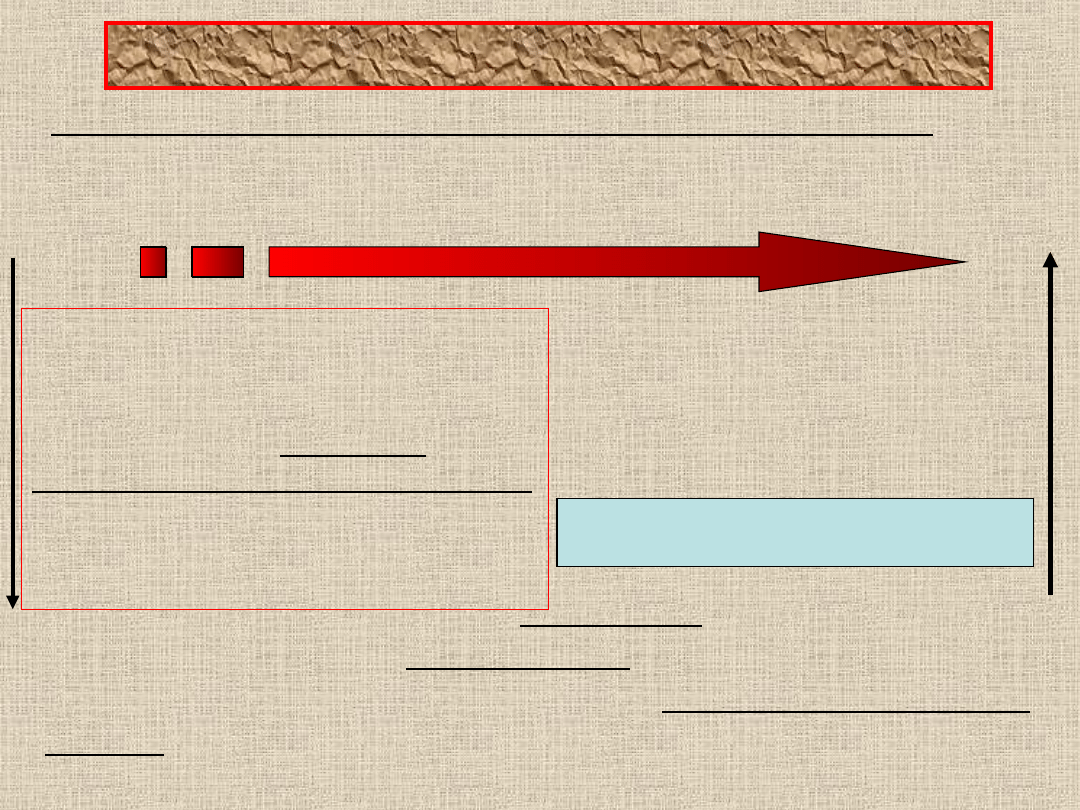
• Wydalanie salicylanów jest zależne od pH moczu, z
czym wiąże się stopień zjonizowania cząsteczek w
świetle kanalika dalszego.
Wzrost pH
Niskie pH
Cząstki mało zdysocjowane
Kanalik dalszy – absorpcja
zwrotna na drodze dyfuzji biernej
substancji o wysokim
współczynniku podziału
olej/woda
Wzrost stopnia jonizacji
cząstek
Obniżenie współczynnika
podziału olej/woda
Zmniejszenie absorpcji
zwrotnej
Wzrost wydalania salicylanów
Przy zmianie pH moczu z 6,4 do 8,0 wydalanie kwasu
salicylowego wzrasta 4 – 6 krotnie. Lecz w wyniku zatrucia
ostrego salicylanami dochodzi do silnego zakwaszenia
moczu, w tych warunkach maleje stopień zjonizowania
cząsteczek kwasu salicylowego (wzrost absorpcji
zwrotnej)
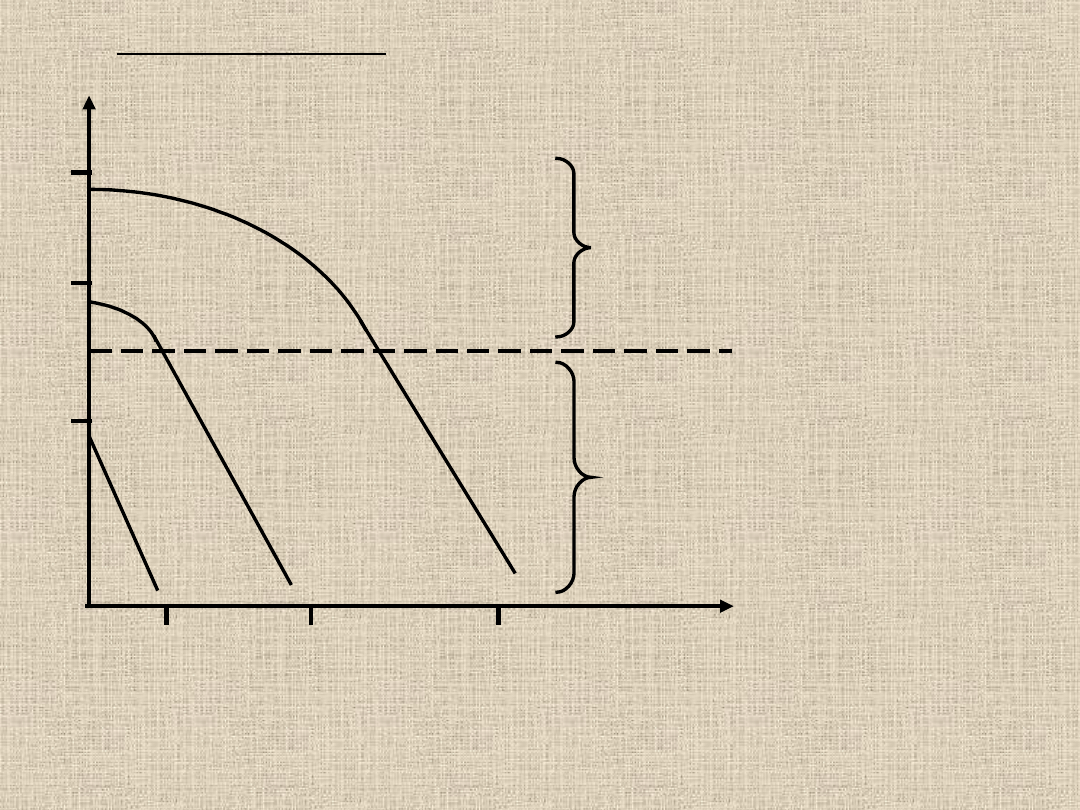
Po podaniu niskich dawek
salicylanów (do 1 g dziennie)
proces eliminacji przebiega
szybko (czas półtrwania
salicylanów w surowicy 2 – 5
godzin). Eliminacja salicylanów
przebiega zgodnie z kinetyką I
rzędu.
Log C
T
0,5
w przypadku kinetyki I rzędu nie zależy od przyjętej dawki
leku. Dla procesów 0 rzędu wartość okresu półtrwania leku jest
zależna od stężenia początkowego – powiększenie dawki leku
prowadzi do wydłużenia czasu półtrwania.
1
10
10
0
2
6
16
Czas (godz.)
Po wyższych dawkach
występuje wydłużenie czasu
eliminacji, co wyraża się w
podwyższonej wartości t
0,5
.
W przypadku ostrych zatruć
okres półtrwania leku rośnie
nawet 10 – krotnie.
Kinetyka „wysycenia” – kinetyka
0 rzędu.
Eliminacja salicylanów jest
uzależniona od procesów
ulegających łatwo wysyceniu –
biotransformacja, aktywny
transport, wiązanie z białkami
Przejście od kinetyki I rzędu do kinetyki 0 rzędu
jest bardzo istotne w toksykologii, ponieważ
dawka przy której następuje zmiana może
być dawką krytyczną, od której rozpoczyna
się niebezpieczeństwo toksycznego działania
na skutek osiągania wysokich stężeń w
wyniku ograniczonej eliminacji.
kinetyka I
rzędu
kinetyka 0
rzędu
dawka krytyczna
ograniczenie eliminacji

Stężenie salicylanów w
surowicy:
• 35 – 65 mg / 100 ml lekkie
• 65 – 90 mg / 100 ml
średniociężkie
• 90 – 120 mg / 100 ml
ciężkie
Z
A
T
R
U
C
I
E
Powyżej 120 mg / 100 ml to zwykle zatrucie
śmiertelne.
Dawka śmiertelna dla człowieka dorosłego to 25 – 35
g.
Dawka śmiertelna dla dzieci – dawka powyżej 10 g.
Dawkę śmiertelną wszystkich pochodnych kwasu
salicylowego ocenia się na 0,2 – 0,5 g/kg mc.
Śmierć spowodowana jest zwykle niewydolnością oddechową, towarzyszy
Śmierć spowodowana jest zwykle niewydolnością oddechową, towarzyszy
temu wstrząs sercowo – naczyniowy.
temu wstrząs sercowo – naczyniowy.

0 mg%
10
30
50
80
110
160
-przeciwbólowe,
przeciwgorączkowe,
hamujące krzepliwość
krwi
- Przeciwzapalne, zwiększone
wydalanie kwasu moczowego,
przeciwreumatyczne
śmiertelne
ciężkie
Umiarkowan
e
Lekkie
Z
a
t
r
u
c
i
e
Efekt
(działanie)
Niewydolność nerek i oddechowa,
wstrząs sercowo - naczyniowy
W początkowym okresie – pobudzenie
OUN. Następnie – depresja OUN i
porażenie ośrodka oddechowego. Mogą
wystąpić halucynacje wzrokowo-
słuchowe, wysoka gorączka, pocenie się,
drgawki. Zapaść, śpiączka,
hypoprotrombinemia.
Gorączka, odwodnienie, kwasica
metaboliczna
Brak łaknienia, uczucie zmęczenia,
zawroty i bóle głowy, nieostre
widzenie, występują nudności i
wymioty, może wystąpić biegunka.
Skóra jest zaczerwieniona pokryta
zlewnym potem. Hyperwentylacja
ośrodkowa, dzwonienie w uszach
Podrażnienie przewodu
pokarmowego, nadwrażliwość,
zaburzenia hemostazy
S
p
o
tk
a
n
e
o
b
ja
w
y
za
tr
u
ci
a
S
tę
że
n
ie
l
e
ku
w
e
k
rw
i

• Często pojawiają się objawy nadwrażliwości na
salicylany – reakcje uczuleniowe:
– uogólniona pokrzywka,
– alergiczny nieżyt nosa,
– objawy astmy.
• Czasem dawka jednorazowa (0,5 – 1,0 g) kwasu
acetylosalicylowego może wywołać reakcje
alergiczną z zapaścią i zaburzeniami oddychania,
aż do wstrząsu anafilaktycznego włącznie
• Może dojść ponadto do zwiększenia czasu
krzepnięcia krwi – jest to wynikiem
współzawodnictwa salicylanów z witaminą K,
niezbędną do syntezy protrombiny w wątrobie.

Czyli pierwsza
pomoc:
Przy spożyciu:
• podać dużą ilość wody
• wywołać wymioty
• wezwać lekarza
Przy kontakcie z oczami: spłukać dużą ilością
wody przy szeroko odciągniętej powiece. Skorzystać z
pomocy okulisty.
Przy kontakcie ze skórą: zmyć dużą ilością wody.
Zdjąć zanieczyszczoną odzież
Przy wdychaniu: świeże powietrze.

Analiza salicylanów.
Tok postępowania przy wykrywaniu w materiale
biologicznym:
1. Pobranie materiału do badania (mocz, surowica,
popłuczyny z żołądka)
2. Przygotowanie materiału biologicznego do badań.
3. Podział trucizn na grupy – ekstrakcja z materiału
biologicznego rozpuszczalnikami organicznymi ze
środowisk o różnym pH.
4. Wykrywanie i identyfikacja trucizn w grupach
metodami chromatograficznymi (TLC, HPLC).
5. Przygotowanie protokołu przeprowadzonego badania
chemiczno – toksykologicznego.
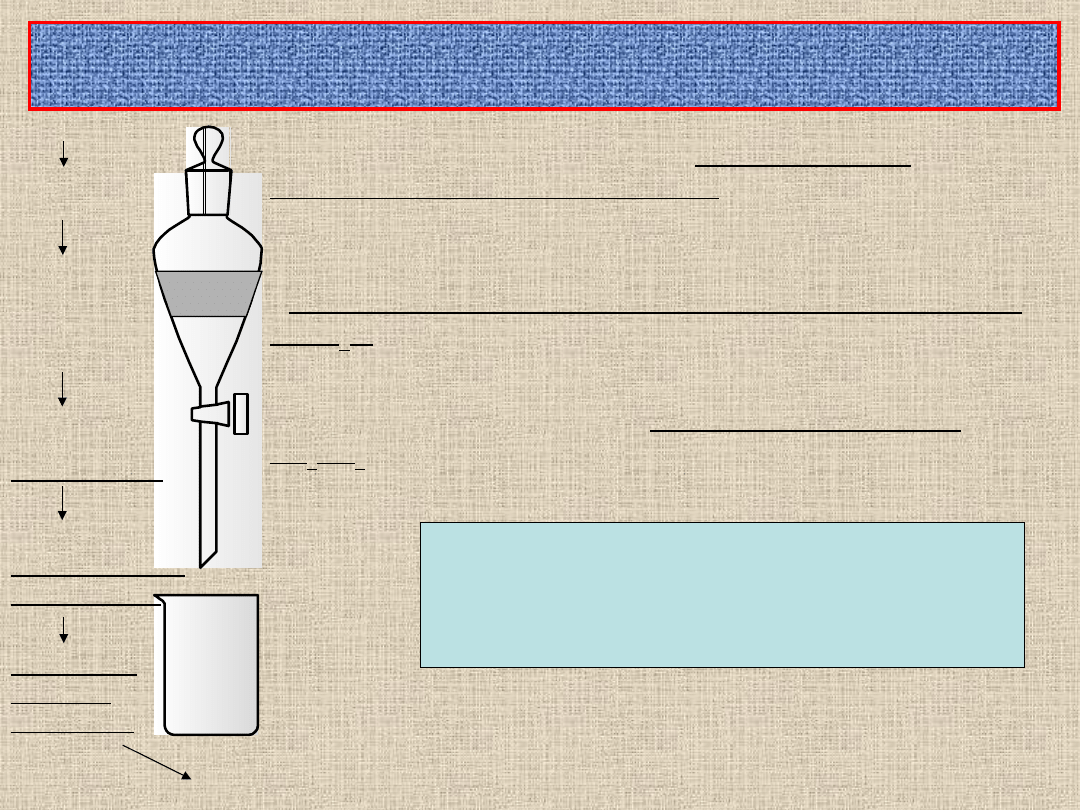
Przygotowanie moczu do badań (mocz pobrany przyżyciowo):
- Do badania służą próby moczu po zmierzeniu objętości, a w razie
potrzeby po uprzednim odwirowaniu przez 10 minut przy 5000 obr./min.,
(Mocz po odwirowaniu dekantuje się do cylindra miarowego i wtedy
mierzy się objętośćbada odczyn)
- badanie odczynu moczu
- z materiały biologicznego oddziela się 2 ml jako rezerwę służącą do
badań HPLC,
- do poszukiwania nieznanej trucizny pobiera się 20 ml moczu i
zakwasza 1 M HCl do pH 3 (poszukiwanie nieznanej trucizny –
analiza TLC).
Przygotowanie surowicy i popłuczyn z żołądka:
- Surowicę otrzymuje się przez wirowanie krwi pełnej (pobranej bez środka
antykoagulacyjnego) przez 10 minut przy 3000 – 4000 obr./min.,
- mierzy się objętość surowicy i popłuczyn z żołądka,
- z materiału biologicznego oddziela się 2 ml jako rezerwę służącą do
badań HPLC,
- pozostałość zakwasza 1 M HCl do pH 3.
1. Przygotowanie materiału biologicznego do
badań.
- Przygotowane, zakwaszone (pH 3) próby moczu,
surowicy i popłuczyn z żołądka ekstrahuje się
dwukrotnie eterem etylowym (EtO) po 10 min.,
używając każdorazowo 2 krotną objętość rozpuszczalnika
w stosunku do objętości próby,
- warstwy eterowe zbiera się razem i przemywa 5
ml H
2
O, która dołącza do pozostałej po ekstrakcji
kwaśnej warstwy wodnej,
- następnie wyciąg eterowy osusza się bezwodnym
Na
2
SO
4
- sączy do suchego cylindra miarowego z korkiem, po
czym Na
2
SO
4
przemywa się 5 ml EtO i dołącza się do
wcześniej zebranego wyciągu
- Jest to wyciąg A zawierający trucizn o
charakterze kwaśnym i obojętnym oraz
niektóre trucizny o charakterze słabych
zasad, częściowo przechodzące do EtO ze
środowiska kwaśnego.,
-Z pozostałej kwaśnej warstwy wodnej
otrzymuje się wyciąg B z truciznami o
charakterze zasadowym i amfoterycznym.
2. Podział trucizn na grupy – ekstrakcja z materiału
biologicznego
Mocz o pH 3
ekstrakcja
Przemyci
e wodą i
osuszenie
Wyciąg A
ASPIRYNA
Usunięcie
rozpuszczalnik
a w wyparce
Rozp. 96%
alkoholu
etylowego
TLC
3. Wykrywanie i identyfikacja trucizn w grupach metodami
chromatografii cienkowarstwowej
-Z otrzymanego do badania wyciągu eterowego usuwa się rozpuszczalnik
w rotacyjnej wyparce próżniowej do sucha,
- pozostałości wyciągu rozpuszczone w 1 ml 96% alkoholu etylowego
służą do wykrywania trucizn metodą TLC.
Badanie wstępne (wykrywanie aspiryny, fenacetyny, paracetamolu,
propyfenazonu):
- Faza stacjonarna: I: DC – Alufolien Kieselgel 60 F254 f-my Merck (20 na
20 cm)
II: DC – Plastikfolien Kieselgel 60 F254 f-my Merck (20 na
20 cm)
- Faza ruchoma:
A: benzen : dioksan : 25% NH
4
OH ( 60 : 35 : 5 )
- Odczynnik wywołujący:
5% roztwór chlorku żelazowego (a) i 1 %
roztwór
żelazicyjanku potasowego (b) –
bezpośrednio przed
użyciem należy zmieszać
równe objętości a i b.
Zabarwienie Aspiryny z odczynnikiem FIOLETOWE
Wykorzystując fazę stacjonarną, na punkty startowe wyznaczone na
wysokości 15 mm od dolnej krawędzi płytki nanosi się w odstępach, co 20
mm po 0,01 i 0,02 ml badanych wyciągów oraz po 10 ug wzorców
poszukiwanych trucizn.
Badania potwierdzające – wykrycie trucizny należy potwierdzić
wykonaniem drugiego chromatogramu stosując:
Fazy stacjonarne: I DC – Alufolien Kieselgel 60 F254 f-my Merck (20 na 20
cm)
II DC – Plastikfolien Kieselgel 60 F254 f-my Merck (20 na
20 cm)
Faza ruchoma: C: Aceton : CHCl3 (4 : 9)
Odczynnik wywołujący: 5% roztwór chlorku żelazowego (a) i 1 % roztwór
żelazicyjanku potasowego (b) –
bezpośrednio przed
użyciem należy zmieszać
równe objętości a i b.
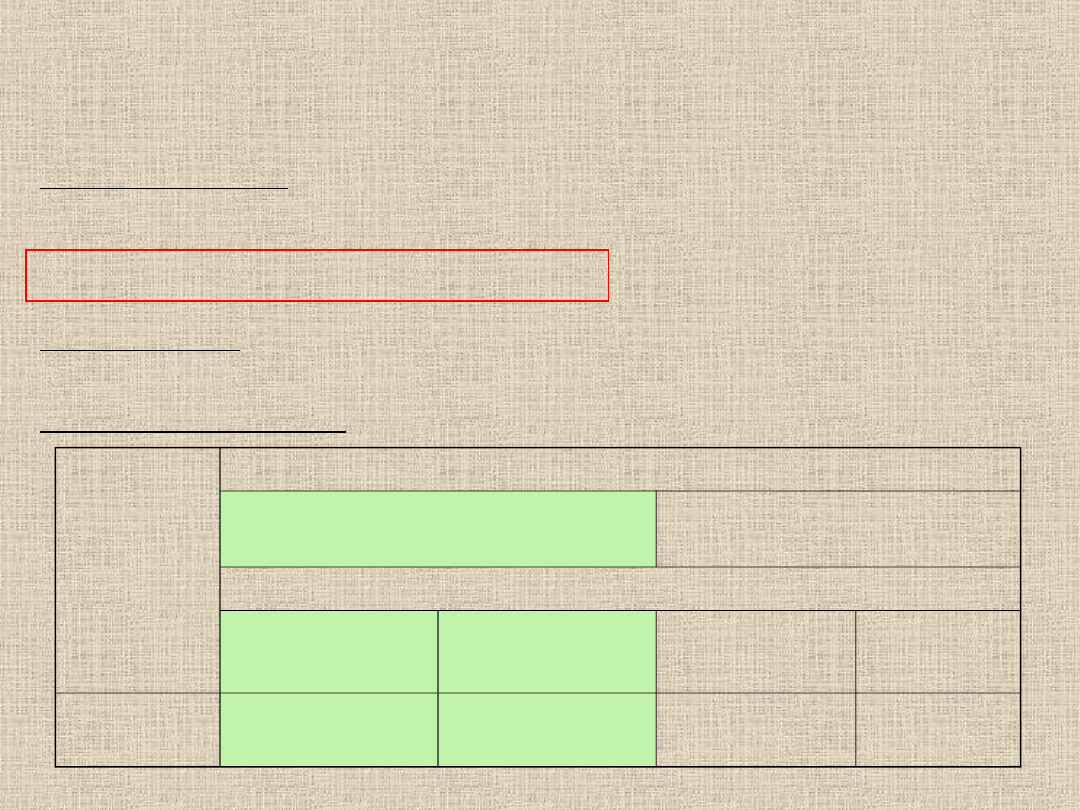
Związek
Faza ruchoma
benzen:dioksan:25% NH4OH
(60:35:5 )
Aceton:CHCl3 (4:9)
Faza stacjonarna
I
II
I
II
Aspiryna
(Wartości Rf)
0,14
0,10
0,00
0,00

- Salicylany ten można stosunkowo łatwo ekstrahować z
osocza,
- stosując mieszaninę chlorku metylenu i propanolu
(9:1), i w ten sposób określić jego stężenie osoczowe.
- Powyższa metoda ekstrakcji nie jest swoista dla
salicylanów.
- Wraz z nimi ekstrahują się i inne leki, przykładowo
-paracetamol
-teofilina.
Oznaczanie salicylanów metodą HPLC
Leki te są często przyjmowane przez
pacjentów w terapii skojarzonej i należy
oczekiwać ich obecności w trakcie
prowadzonej analizy.

-Ekstrahowany materiał rozdziela się techniką
odwróconej fazy, stosując kolumnę C18 (Ligand
alkilowy o długości łańcucha C18),
-pracującą w systemie izokratycznym (do kolumny
dostarczany jest solwent nie ulegający zmianie w czasie
rozdziału).
-Identyfikację salicylanu dokonuje się na podstawie
czasu retencji, natomiast określenie jego ilości
możliwe jest dzięki zastosowaniu wewnętrznego
standardu - 8-Cl-teofiliny
Oznaczanie salicylanów metodą HPLC
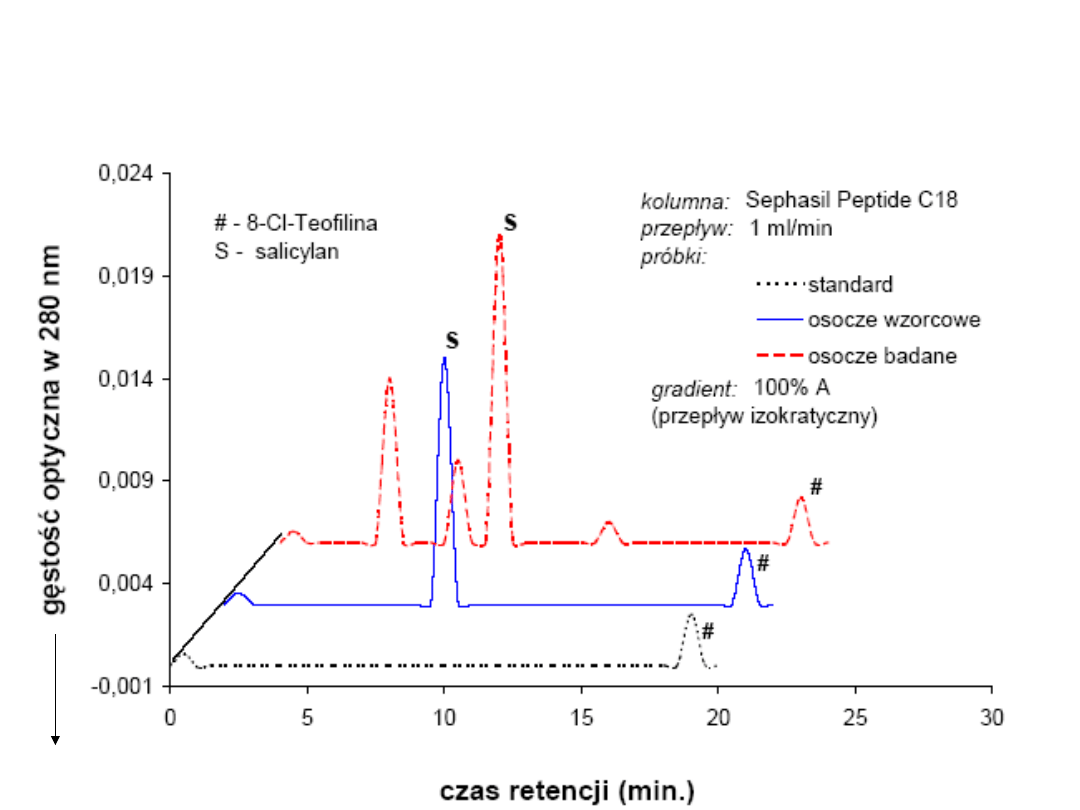
----- Jeden z chromatografów przedstawia rozdział materiału zawierającego jedynie
wewnętrzny standard (8-Cl-Teofilina). Środkowy chromatograf reprezentuje rozdział
osocza kontrolnego o znanej ilości salicylanu. Natomiast 3 z chromatografów
przedstawia separację różnych substancji z osocza pacjenta.
zwana inaczej absorbancją lub ekstyncją
Oznaczanie salicylanów metodą Trindera
Zasada oznaczania:
- Oznaczanie wykonuje się bezpośrednio w surowicy krwi
- Salicylany w środowisku słabo kwaśnym reagują z jonami żelaza, dając
zabarwienie fioletowo – purpurowe. Powstaje ono w wyniku utworzenia
chelatów jonów żelazowych z resztą fenolową.
- Oznaczone spektrofotometrycznie natężenie zabarwienia jest wprost
proporcjonalne do natężenia salicylanów w surowicy krwi.
Odczynnik Trindera: 4,0 g Fe(NO
3
)
3
* 9 H
2
O
4,0 g HgCl
2
12 ml 1 M HCl
rozpuścić w wodzie destylowanej
uzupełnić objętość do 100 ml
odsączyć
Przy użyciu odczynnika
Trindera zachodzi
odbiałczenie surowicy i
reakcja barwna.
Wykonanie oznaczenia:
- Do badanej surowicy (0,5 ml) w probówce wirówkowej dodaje się wodę
destylowaną (4,5 ml), a następnie przy ciągłym mieszaniu odczynnik
Trindera (5 ml).
- odstawić na 5 min, odwirować (10 minut. przy 2000 obr./min.), względnie
przesączyć
- pobiera się supernatant (2 ml) do probówki szklanej z korkiem na szlif (poj.
10 ml), dodaje się wodę destylowaną (2 ml) i miesza się
- pomiaru absorbancji dokonuje się wobec próby kontrolnej (zamiast
surowicy dodaje się 0,5 ml wody destylowanej) w kuwetach o grubości
warstwy 1 cm przy długości fali 540 nm.
- stężenie salicylanów odczytuje się z krzywej kalibracji
COOH
OH
COO-
0-
FeCl
3
3
Fe
3+
3H
+
3

Odczynnik SALY, jest stosowany do ilościowego
określenia stężenia Salicylanów w ludzkiej surowicy lub
osoczu.
SALY odczynnik jest używany do pomiaru stężenia SALY
metodą pomiaru punktu końcowego. W tej reakcji
hydroksylaza salicylanu katalizuje konwersję salicylanu i
NADH do katecholu i NAD w obecności tlenu.
SALICYLAN + NADH + H
+
+ O
2
katechol + NAD
+
+ CO
2
+ H
2
O
System(-y) SYNCHRON® automatycznie wydzieli odpowiednie objętości
próbki i odczynnika do kuwety. W użytej proporcji jedną część stanowi
próbka a 56 części odczynnik.
System monitoruje zmianę absorbancji przy 340
nanometrach. Ta zmiana absorbancji jest wprost
proporcjonalna do stężenia SALY w próbce i jest użyta
przez system do obliczenia i wyrażenia stężenia SALY.
hydroksylaza salicylanu

Metoda Lapiera w adaptacji Worwy
Zasada oznaczania:
- Po kwaśnej hydrolizie mocz ekstrahuje się
chloroformem,
- do oddzielonej warstwy chloroformowej dodaje się
10% roztwór pirydyny oraz odczynnik złożony z
roztworu siarczanu miedziowego i pirydyny,
- powstające zielononiebieskie zabarwienie jest
proporcjonalne do ilości kwasu salicylowego w próbce,
- oznacza się absorpcję roztworu przy długości fali 610
nm.

1.Woda bromowa wytrąca z rozcieńczonych
wodnych roztworów biały osad bromowanego
kwasu salicylowego, albo trójbromofenolu
przy równoczesnym wydzieleniu dwutlenku wegla.
2. Kwas salicylowy z alkoholem metylowym ogrzany
do temp. 60 stopni C, wobec stężonego kwasu
siarkowego, tworzy ester o charakterystycznym
zapachu.
3. Przy ogrzewaniu kwasu salicylowego z kwasem
azotowym roztwór barwi się na żółto, na skutek
powstania kwasu nitrosalicylowego.
4. Kwas salicylowy rozpuszcza się w roztworze
formaliny w stężonym kwasie siarkowym (1 kropla
formaliny + 2 ml stężonego kwasu siarkowego)
barwiąc go na kolor czerwony.
Kwas salicylowy – Wykrywanie
COOH
OH
COOH
OH
CH
2
OH
COOH
OH
OH
COOH
HCHO, H2SO4
COOH
OH
OH
COOH
[O]
Reakcja Marquisa polega na kondensacji formaldehydu z fenole w jego
czynnym położeniu orto- lub para-. Kwas siarkowy spełnia rolę
katalizatora i utleniacza.
COOH
OCOCH
3
COONa
OH
COONa
OH
1
. Substancje gotuje się 2 – 3 min. z 10% NaOH, a
następnie po ostudzeniu dodaje się 10% kwas
siarkowy w nadmiarze; w obecności kwasu
acetylosalicylowego wytrąca się biały, krystaliczny
osad kwasu salicylowego.
COOH
OH
+ 2 NaOH
+ CH
3
COONa +
H
2
O
2
H
2
SO
4
+ Na
2
SO
4
Kwas acetylosalicylowy – Wykrywanie
biały, krystaliczny osad kwasu salicylowego
2. Osad kwasu salicylowego rozpuszczony w
stężonym kwasie siarkowym po dodaniu alkoholu
metylowego wydziela po podgrzaniu
charakterystyczny zapach estru kwasu salicylowego.
COOH
OH
2CH
3
COONa + H
2
SO
4
2CH
3
COOH
+
H
2
SO
4
3. Przesącz po oddzieleniu wytrąconego kwasu
salicylowego wydziela zapach kwasu octowego, a po
ogrzaniu z alkoholem etylowym i kwasem siarkowym –
zapach estru etylowego.
H
2
SO
4
, C
2
H
5
OH
- H
2
0
OH
O
O
C
2
H
5
H
2
SO
4
- H
2
0
CH
3
COOH + C
2
H
5
OH
CH
3
COOC
2
H
5

KONIEC
Dziękuję za uwagę
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
Salicylany ppt
KWAS SALICYLOWY REFERAT ppt
Choroby układu nerwowego ppt
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
10 dźwigniaid 10541 ppt
03 Odświeżanie pamięci DRAMid 4244 ppt
Prelekcja2 ppt
2008 XIIbid 26568 ppt
WYC4 PPT
rysunek rodziny ppt
więcej podobnych podstron