Laboratoryjne metody
rozpoznawania chorób
zakaźnych
epidemiologia
II rok

Badania
bakteriologiczne
i mykologiczne

Mikroskopowe badania
preparatów
- rozmazy
- wymazy
- krople wiszące
- zawiesiny
- rozciery
- preparaty odciskowe

Rozmazy i wymazy
-
preparaty pobieramy bezpośrednio z
materiału chorobowego albo z
hodowli bakterii lub grzybów
-
mleko, krew lub mocz – wirujemy
(powoduje to zagęszczenie materiału,
preparat robimy z osadu)
-
ropa, wykrztusiny, tkanki, hodowle
bakterii na podłożach płynnych –
robimy bezpośrednio preparaty
mazane

- z hodowli na podłożach stałych
rozcieramy odrobinę materiału w
kropli płynu fizjologicznego
- preparaty wykonujemy na czystych i
odtłuszczonych szkiełkach
podstawowych
- materiał nanosimy wyjałowioną ezą i
rozprowadzamy po powierzchni
tworząc cienki rozmaz
- preparat suszymy i utrwalamy
( termicznie lub chemicznie )
- wykonujemy barwienie ( metoda
Grama, Giemsy, May-Grunwalda )

Barwienie pozytywne
: barwi się
komórki bakteryjne przy niezabarwionym
tle.
- może być przyżyciowe lub pośmiertne
Barwienie negatywne
: na
zabarwionym tle widać niezabarwione
komórki
- zastosowane przy obserwacji
drobnoustrojów
delikatnych,trudnobarwiacych się oraz
pewnych składników komórki np. otoczek

Obserwacja ruchu bakterii
-
oglądamy w mikroskopie świetlnym,
mikroskopie ciemnego pola widzenia i
fazowo-kontrastowym
-
przygotowujemy zwykle preparaty
wilgotne (otrzymane przez przykrycie
cienkim szkiełkiem nakrywkowym kropli
hodowli bakteryjnej) lub tzw. krople
wiszącą

Kropla wisząca
-
umieszczamy krople hodowli na środku
szkiełka nakrywkowego
-
z góry przykrywamy szkiełkiem
podstawowym z wgłębieniem
-
energicznym ruchem odwracamy
preparat szkiełkiem nakrywkowym do
góry
-
brzegi kropli odszukujemy pod
obiektywem o małym powiększeniu
-
następnie przechodzimy na większe

Mikroskop fazowo-
kontrastowy
-
potrafi przekształcić rożne prędkości
przechodzenia światła przez rożne
elementy komórki bakteryjnej i
środowiska na intensywność światła
-
przy tej samej zdolności rozdzielczej
umożliwia obserwacje przyżyciową i
pozwala na wyróżnienie szczegółów
budowy wewnętrznej

Mikroskop ciemnego pola
widzenia
-
pozwala on na uwidocznienie
niebarwiących się drobnoustrojów
-
oświetla obiekt pozostawiając ciemne
tło
-
obiekt oświetlony jest z boku, tak że do
obiektywu trafia tylko część promieni
rozproszonych przez komórki bakteryjne
-
na ciemnym tle silnie oświetlony
drobnoustrój

Zawiesiny i rozciery
badanego materiału
-
stosujemy do zakazania zwierząt
doświadczalnych, zarodków kurzych oraz
hodowli
-
materiał rozdrabniamy następnie
rozcieramy próbki z małą ilością płynu i
jałowym piaskiem lub rozbijamy za pomocą
odpowiednich młynków elektrycznych
-
po homogenizacji zawiesinę wirujemy
-
w celu izolacji wirusa z
zawiesiny,pozbywamy się bakterii
przepuszczając ją przez przez sączki
bakteryjne lub dodając antybiotyk

Preparaty odciskowe
-
bierzemy fragment badanej tkanki,
narządu
-
odciskamy na podłożu hodowlanym
-
inkubujemy

Hodowlane metody
izolacji zarazka
Podłoża
Płynne
Półpłynne
Stałe
Bulion
Bulion +
0,25-0,5%
agar-agaru
Żelatynowe
(bulion+żelat
yna)
Mleko
Agarowe
(bulion+agar)
Ścięta
surowica
Ścięte
podłoże
jajowe

Z punktu widzenia wartości
użytkowej podłoża dzielimy
na:
1.Podstawowe
2.Wzbogacone
3.Wybiorcze ( selektywne )
4.Różnicujące

Podłoża podstawowe:
Pozwalają na rozwój większości bakterii
o przeciętnych wymogach wzrostowych.
Stanowią podstawę do przygotowania
innych typów pożywek.Zaliczamy do
nich:
-
bulion odżywczy
-
agar odżywczy
-
żelatynę odżywczą

Podłoża wzbogacone:
Służą do hodowli drobnoustrojów o
znacznych wymaganiach odżywczych,
które słabo lub wcale nie rosną na
podłożach podstawowych.Jako
substancje je wzbogacające stosuje się:
-
krew
-
surowicę
-
wyciąg drożdżowy
-
glukozę
-
żółtko jaja

Podłoża wybiórcze:
Służą do wyosobniania tylko określonych
gatunków drobnoustrojów z materiału
zakażonego inna florą.Są to podłoża
podstawowe do których dodano czynniki
wzmagające wzrost danych bakterii (np.żółć w
pożywce Muller-Kauffmanna- wzmaga
namazanie pałeczek Salmonella) oraz hamujące
rozwój niepożądanych drobnoustrojów
( np.zieleń brylantowa w pożywce Muller-
Kauffmanna hamuje wzrost E.coli )Zaliczamy tu
tez podłoża:
-
Brylla-Szynkiewicza
-
SF z kwaśnym selenianem Na

Podłoża różnicujące:
Stosowane do rozróżnienia poszczególnych
gatunków bakterii na podstawie ich
odmiennych właściwości biochemicznych. Są
to pożywki podstawowe z dodatkiem
substratu umożliwiającego określenie
właściwości enzymatycznych
zarazków.Zaliczamy do nich:
-
Soltysa
-
McConkey’a
-
Edwards-Chodkowskiego

Identyfikacja drobnoustrojów:
Odbywa się na podstawie własności:
-
morfologicznych
-
hodowlanych
- biochemicznych
- antygenowych

Badanie morfologiczne:
Zwykle jest przeprowadzane w dwóch etapach:
1.
Wstępna obserwacja preparatów
wykonanych bezpośrednio z materiału
chorobowego (np.mleko,ropa,krew)
2. Obserwacja preparatów z hodowli
bakteryjnych wyrosłych na podłożu
sztucznym
W badaniu morfologicznym uwzględnia się:
Kształt,wielkość,ułożenie komórek,obecność
lub brak otoczek,rzęsek i zarodników a
także sposób barwienia się

Badanie hodowlane:
Wysianie próbki materiału hodowlanego
i inkubacja posiewów w odpowiedniej
temperaturze przez określony czas. Ma
ono na celu uzyskanie zarazka w czystej
kulturze i określenie właściwości
morfologicznych wyrosłych kolonii
bakteryjnych.W dalszym etapie
przeprowadza się charakterystykę jego
właściwości fizjologicznych poprzez
hodowle na specjalnych podłożach.

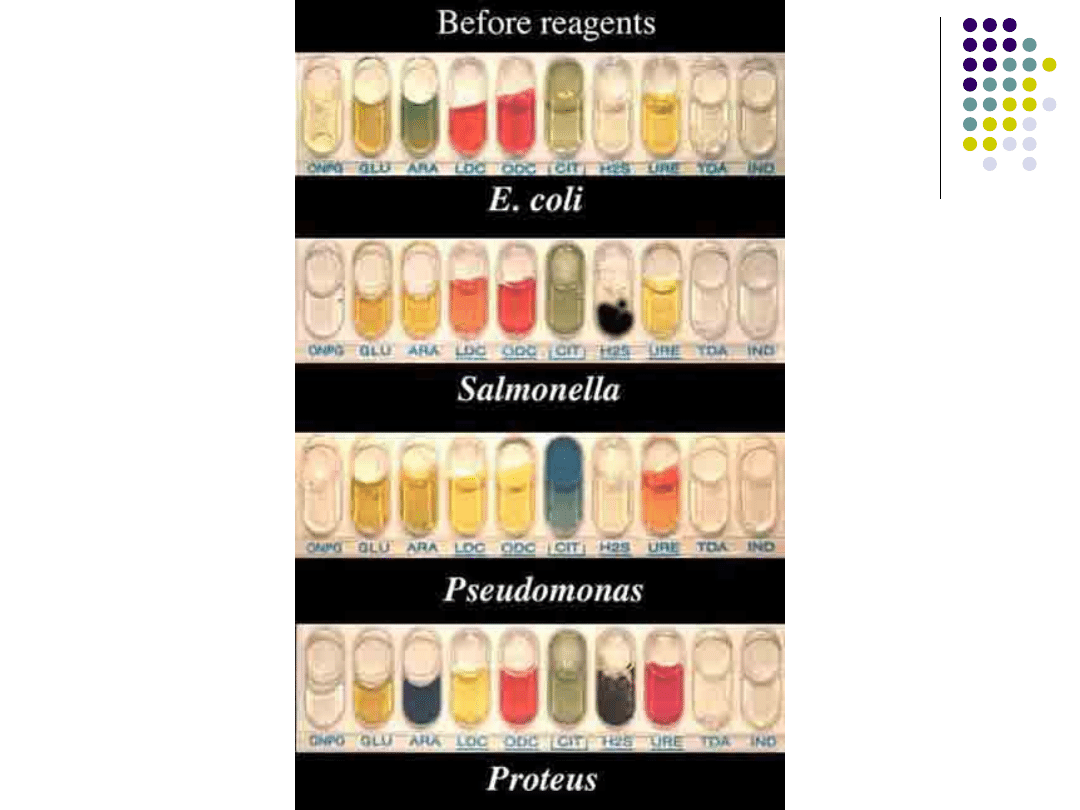
Badanie biochemiczne:
Mają na celu dokładniejsze określenie
rodzaju drobnoustroju na podstawie
charakteryzujących go reakcji
biochemicznych.Zaliczamy tutaj np.
testy API,próby na katalazę.

Antybiogram
Pozwala na wybór najlepszego
antybiotyku o największym zakresie
działania i największej skuteczności
przeciwko wyizolowanej
bakterii.Najczęściej stosujemy metodę
krążkową.Krążki nasycone antybiotykiem
nakładamy na zasianym podłożu
bakteryjnym i inkubujemy w
37C.Dyfundujący antybiotyk powoduje
powstanie wokół krążka stref
zahamowania wzrostu proporcjonalnych
do stopnia wrażliwości szczepu.


Badanie histopatologiczne
Rozstrzyga ono często w przypadkach
wątpliwych badań klinicznych i
sekcyjnych.Stosowane w rozpoznaniu wielu
chorób wirusowych,chorobach bakteryjnych,
które cechują się zapaleniem swoistym, w
niektórych chorobach pasożytniczych i
grzybicach.Obecność ciałek wtrętowych
Negriego wskazuje na wściekliznę,
sródjądrowe ciałka wtrętowe w
hepatocytach- ch.Rubartha,ciałka Joest-
Degena-ch.bornajska.Typowe zmiany w
postaci gruzełków występują w gruźlicy i
nosaciźnie.

Mikroskop elektronowy
Przyrząd elektronooptyczny, w którym
powiększony obraz przedmiotu
otrzymuje się za pomocą wiązki
elektronowej, odchylonej i skupionej
przez soczewki elektronowe; pozwala
uzyskać znacznie lepszą
rozdzielczość(0,2 nm) dzięki znacznie
krótszej od fal świetlnych (o kilka rzędów
wielkości) długości fal de Broglie`a
odpowiadających elektronom.

Główną częścią mikroskopu
elektronowego jest komora próżniowa.
Wyrzutnia elektronowa emituje wiązkę
elektronów, które są przyspieszane
wysokim napięciem i osiągają znaczną
prędkość. Wiązka elektronowa
skupiona przez soczewki elektronowe,
przenika przez badany preparat,
a następnie zostaje powiększona
przez układ soczewek elektronowych
i pada na ekran fluorescencyjny lub
błonę fotograficzną, tworząc b. silnie
powiększony obraz prześwietlanego
preparatu.

Izolacja wirusów w hodowli
tkankowej i efekt
cytopatogenny:
Istota metody polega na pobraniu tkanek i
komórek zwierzęcia żywego lub zabitego i
umieszczeniu ich w odpowiednich płynach
i warunkach zapewniających podtrzymanie
procesów życiowych.Hodowla tkankowa
pozwala otrzymać wirus w postaci
stosunkowo czystej,co jest ważne przy
sporządzaniu szczepionek oraz Ag do prób
serologicznych.Przez wielokrotne pasaże
są duże szanse na otrzymanie szczepów
atenuowanych przydatnych do produkcji
szczepionek.

Najważniejszą korzyść stanowi
znaczne ułatwienie i potanienie
diagnostyki
wirusologicznej.Rozpoznanie
opierające się na wykazaniu w
hodowli efektu cytopatycznego
badanego wirusa, ulęgającego
zahamowaniu pod wpływem surowic
swoistych, jest pewne i szybsze niż
na zwierzętach doświadczalnych.

Izolacja wirusa w zarodkach
kurzych
Do izolacji używamy jaj SPF ( specific
patogen free ).Kury od których pobieramy
jaja nie mogą być szczepione zapobiegawczo
przeciwko chorobie której czynnika
etiologicznego się poszukuje.Zarodki zakaża
się zwykle w 2-gim tyg.inkubacji, podając
wirus do woreczka żółtkowego,jamy
omoczniowej, owodniowej i na błonę
kosmówkowo-omoczniową. Zwykle po 2-7 dni
po zakażeniu zbiera się płyn zawierający
duże ilości wirusa.Często dochodzi do
zamierania zarodków.

Próby biologiczne

Dobór zwierząt wrażliwych
-
ideał: zwierzęta tego samego gat.co
zwierze chore
-
znajomość przeszłości
epizootiologicznej zwierząt
doświadczalnych
-
najlepsze z własnej hodowli lub
poddane dłuższej obserwacji i
ewentualnym badaniom stopnia ich
wrażliwości na zakażenie

LD
50
LD
50
( dosis letalis )- jest to ilość
substancji,wirusów, bakterii, która
powoduje śmierć 50% badanych
zwierząt doświadczalnych

Pasażowanie
pasażowanie bakterii i wirusów-
kolejne, wielokrotne przenoszenie
drobnoustrojów z jednej pożywki na
następną lub z jednego organizmu
żywego na drugi; ma na celu osłabienie
ich działania chorobotwórczego.Ma
zastosowanie w produkcji
atenuowanych szczepionek.

Przykłady zastosowania
Próba biologiczna w kierunku wścieklizny:
-
do badania:białe myszki,wiek:3-4tyg.masa:8-12g.
-
na każdy badany materiał:co najmniej 6 myszek
-
domózgowo badaną zawiesinę w ilości 0,03ml
-
okres obserwacji: ok. 30dni
-
okres inkubacji: 10-14 dni
-
pierwsze objawy: posmutnienie, nastroszenie sierści,
niedowłady tylnych kończyn,porażenia
-
wynik kliniczny badania musi być poparty
stwierdzeniem c.wtrętowych Negriego lub dodatnim
odczynem IF
- wynik ujemny nie wyklucza zakażenia

METODY POŚREDNIE WYKRYWANIA
METODY POŚREDNIE WYKRYWANIA
ZARAZKÓW
ZARAZKÓW

Podział:
Metody klasyczne:
aglutynacja
immunodyfuzja w żelu agarowym (AGID)
odczyn wiązania dopełniacza (OWD)
immunofluorescencja pośrednia i
bezpośrednia (IF)
odczyn seroneutralizacji (SN)
•
Metody nowsze:
ELISA
Immunobloting (Western Blot)
Sondy genetyczne

Materiał pobierany do badań:
krew
surowica
plazma
płyny ustrojowe (płyn mózgowo-rdzeniowy,
płyny wysiękowe)
wydzieliny
wydaliny
wymaz z błon śluzowych

Odczyny serologiczne – są to
metody, za pomocą których można
wykazać obecność i stężenie
przeciwciał w surowicy i innych
płynach tkankowych, bądź też
wykryć antygen przy użyciu znanej
surowicy odpornościowej
.

Odczyn precypitacji:
Polega na łączeniu się antygenu
koloidalnego (bezpostaciowego) ze
swoistym przeciwciałem (precypityną) w
obecności elektrolitów
.
Wynik reakcji
charakteryzuje się wytworzeniem
zmętnienia, a później tworzeniem się
delikatnego precypitatu. Modyfikacja tego
odczynu umożliwia określenie wysokości
miana przeciwciał w surowicy krwi, niekiedy w
innych płynach ustrojowych (śluz macicy).
Próba pierścieniowa stosowana do
wykrywania antygenu znajduje praktyczne
zastosowanie w diagnostyce wąglika
(odczyn Ascoliego).
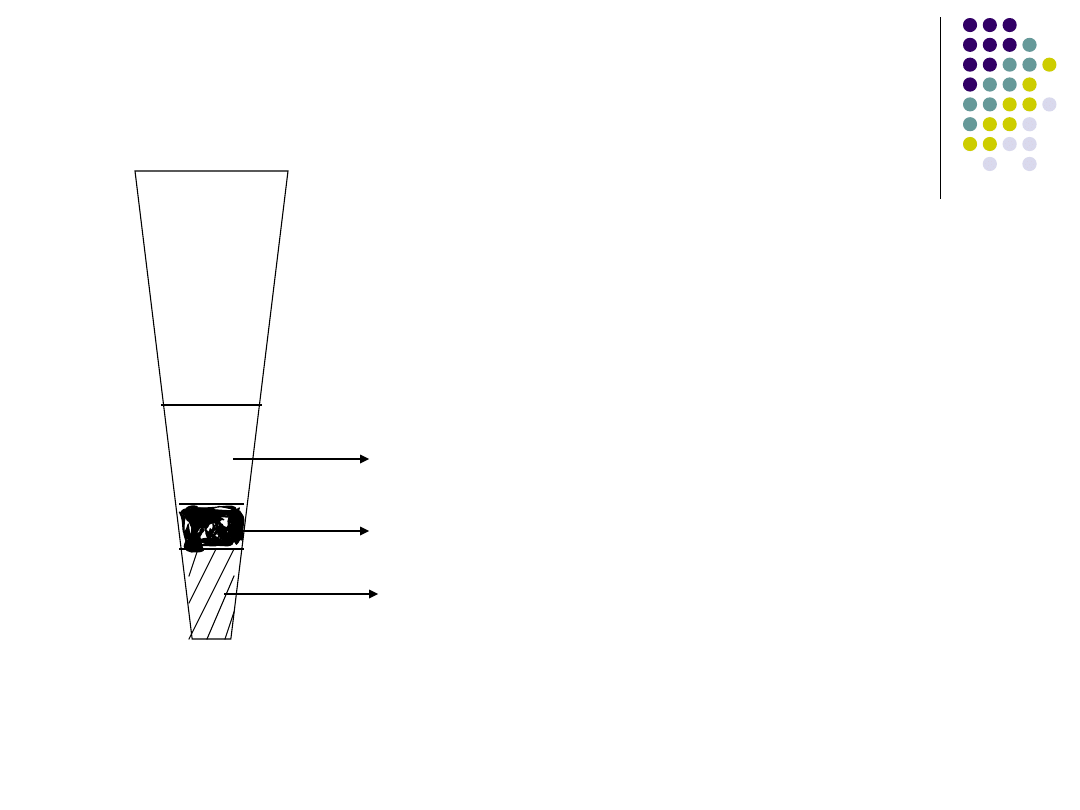
antygen
pierścień
precypitacyjny
surowica
Próba pierścieniowa

Odczyn precypitacji w żelu (Test podwójnej
immunodyfuzji):
Polega on na łączeniu się
koloidalnego antygenu
ze swoistym
przeciwciałem w
nośniku, jakim jest
najczęściej żel agarowy.
Modyfikacją tego testu
jest immunodyfuzja
radialna, w której
antygen migruje z
basenika do żelu
nasyconego swoistymi
przeciwciałami lub na
odwrót.

Immunoelektroforeza:
Odczyn przeprowadza się w cienkiej warstwie
agaru pokrywającego szkiełko podstawowe. Do
baseników wprowadza się badane antygeny i
poddaje elektroforezie. Poszczególne frakcje
antygenowe ulegają rozdzieleniu w polu
elektrycznym. Centralny rowek napełnia się
surowicą odpornościową zawierającą
przeciwciała przeciwko badanym antygenom. W
miejscu max. koncentracji kompleksu
przeciwciało – antygen powstają łuki
precypitacyjne
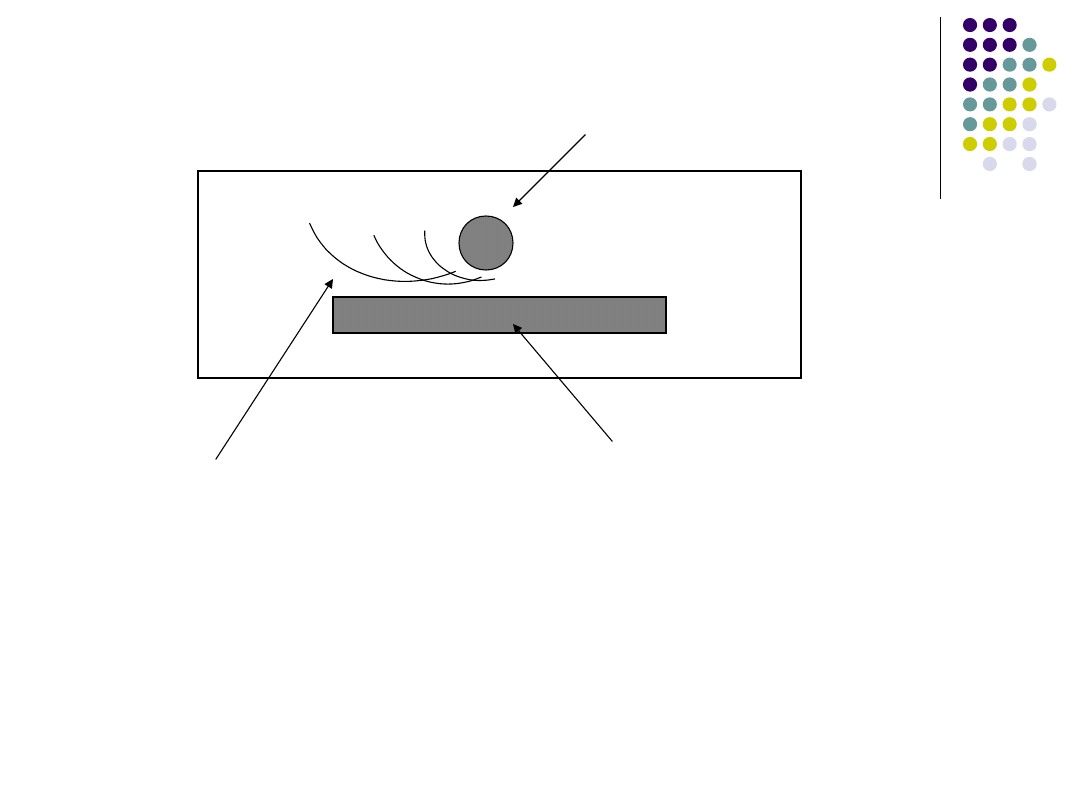
Antygen
Surowica
+
-
Prążki
precypitacyjne
IMMUNOELEKTROFOREZA

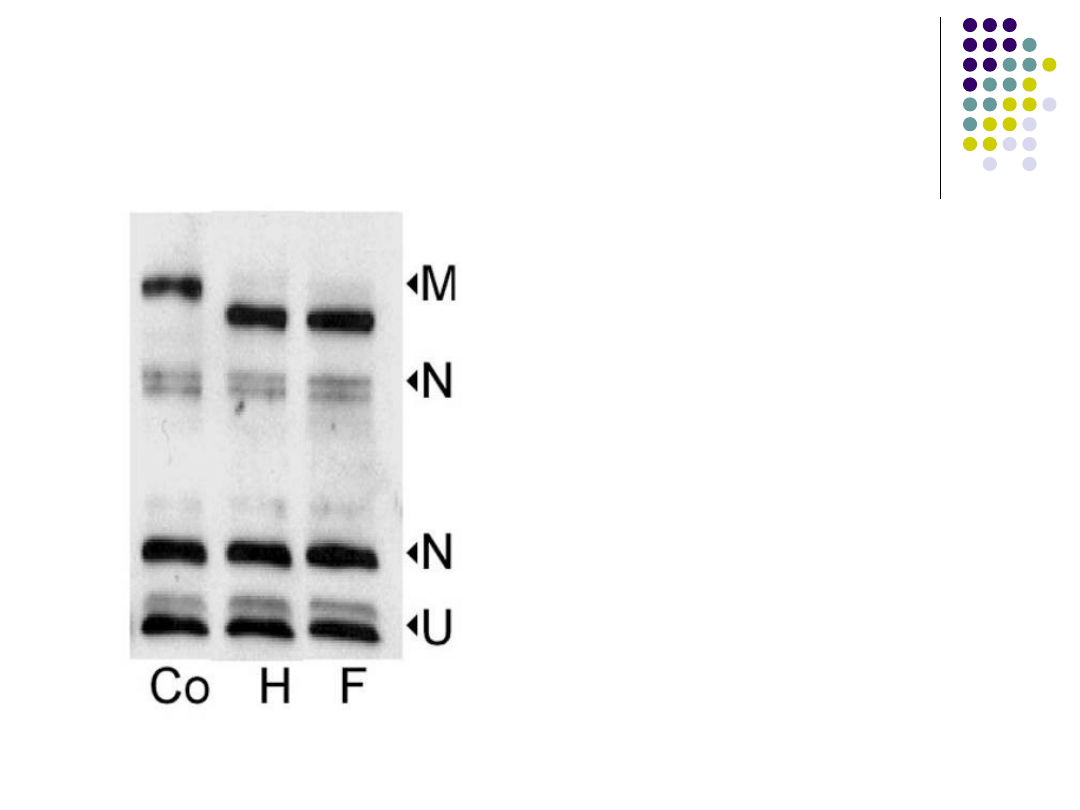
Immunoblotting
Immunoblotting - metoda
służąca do identyfikacji
antygenów.Polega na
przenoszeniu rozdzielonych
elektrolitycznie białek z
podłoża, na którym
wykonano elektroforezę, na
specjalna błonę, np.
nitrocelulozową.
Poszczególne antygeny
mogą być następnie
identyfikowane za pomocą
znakowanych swoistych
przeciwciał.
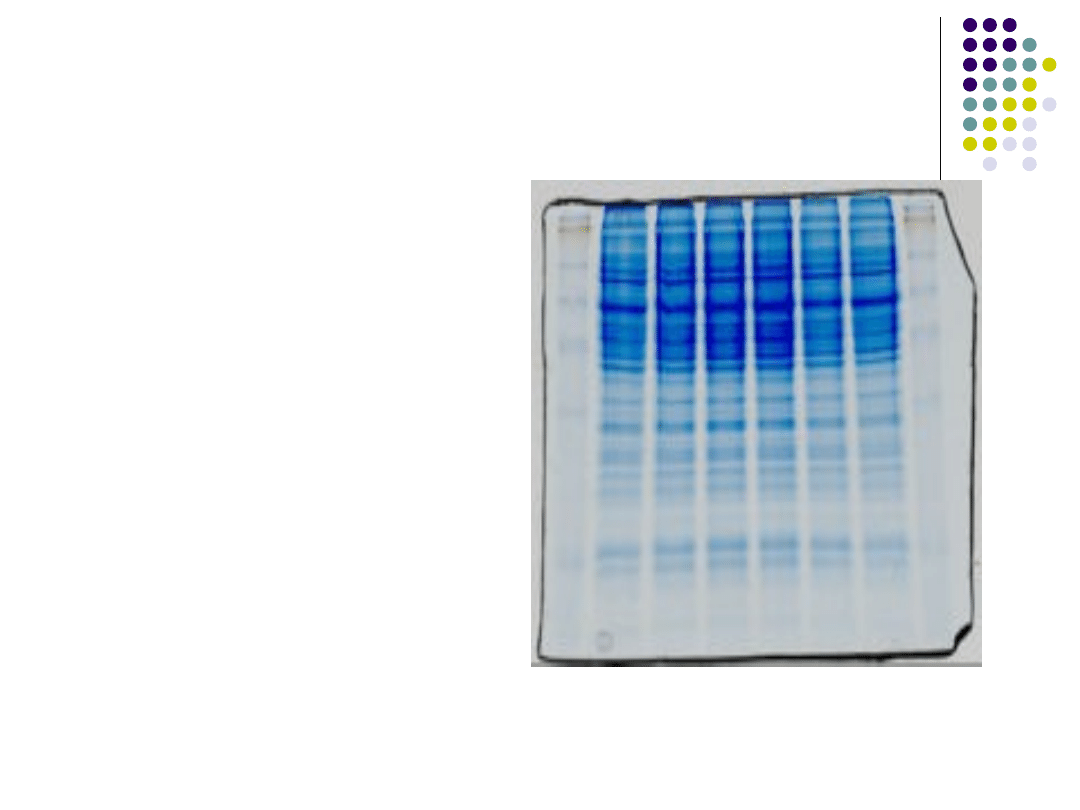
Jedną z odmian
immunoblottingu
jest Western
Blotting. (Western-
blot)
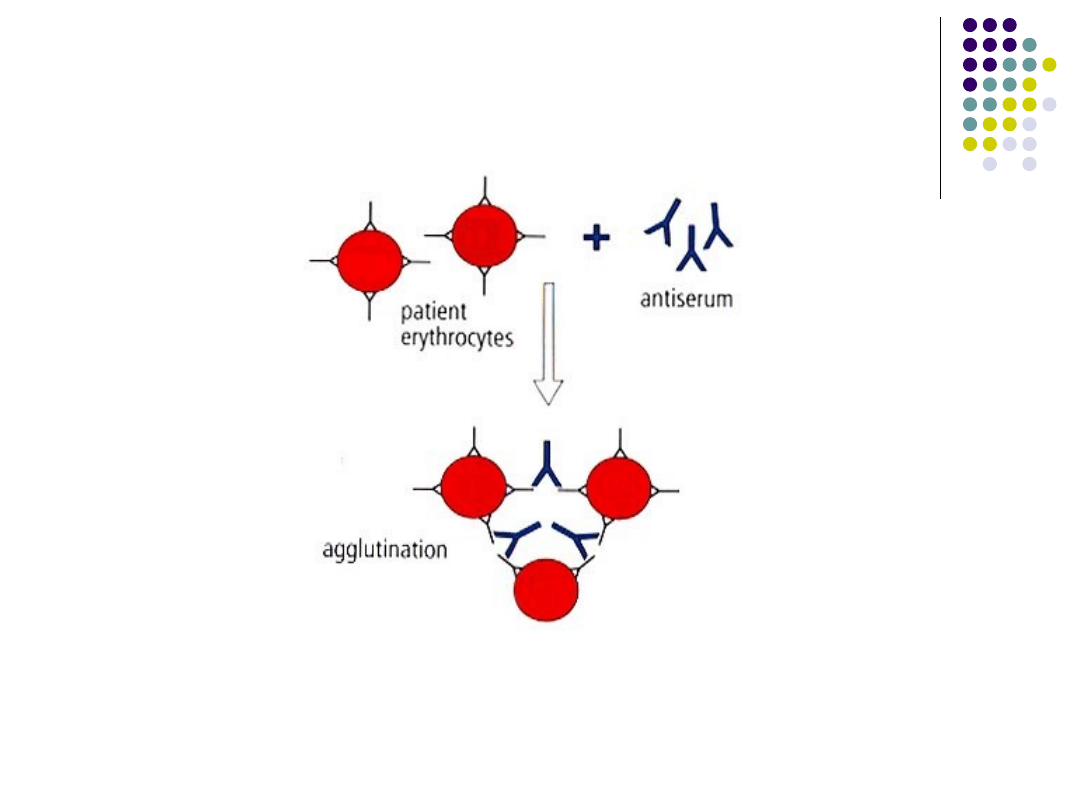
Odczyn aglutynacji:
Polega na wiązaniu się przeciwciała ze swoistym
antygenem na powierzchni takich cząstek jak:
bakterie, krwinki, plemniki itp. Co powoduje ich
zlepianie czyli aglutynacje. Cząstki muszą mieć
średnicę powyżej pół mikrometra – ograniczone
zastosowanie – wirusy są zbyt małe.
Aglutyniny – przeciwciała
Aglutynat – produkt aglutynacji (zlep)
Miano – odwrotność najwyższego
rozcieńczenia surowicy, przy którym następuje
jeszcze widoczny odczyn aglutynacji.

Techniki aglutynacji bezpośredniej:
Aglutynacja probówkowa
Aglutynacja płytkowa
Odczyn hemaglutynacji – polega na
wiązaniu się antygenów obecnych na
powierzchni krwinek przez przeciwciała
.
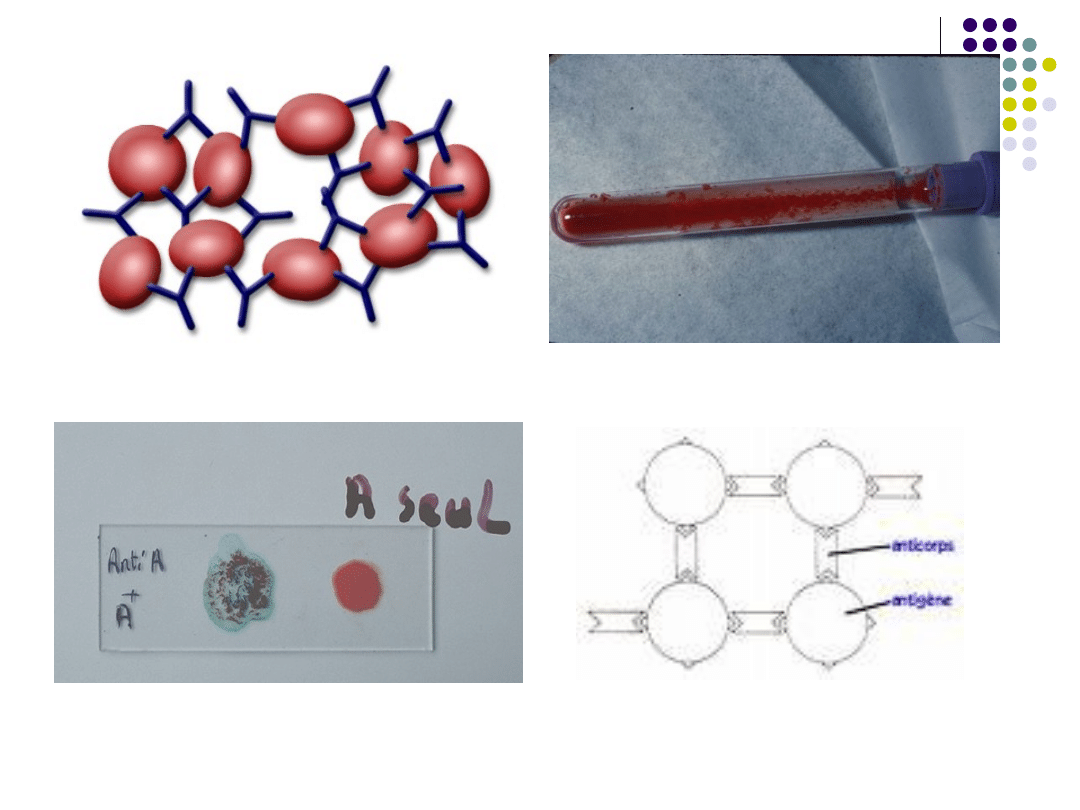
odczyn
hemaglutynacji
hemaglutynacja
probówkowa
hemaglutynacja
szkiełkowa

Techniki aglutynacji pośredniej:
Test antyglobulinowy Coombsa
Test ten służy do wykrywania niekompletnych
przeciwciał. Przeciwciała takie są
jednowartościowe, tzn, że mają tylko jedną
grupe chwytną i po połączeniu ze swoistym
antygenem tworzą małe kompleksy
niewypadające z roztworu (brak wyraźnej reakcji
aglutynacji).Aby uzyskać widoczne aglutynaty
należy użyć przeciwciał antyglobulinowych.
Odzczyn ten wykorzystywany jest w diagnostyce
brucelozy

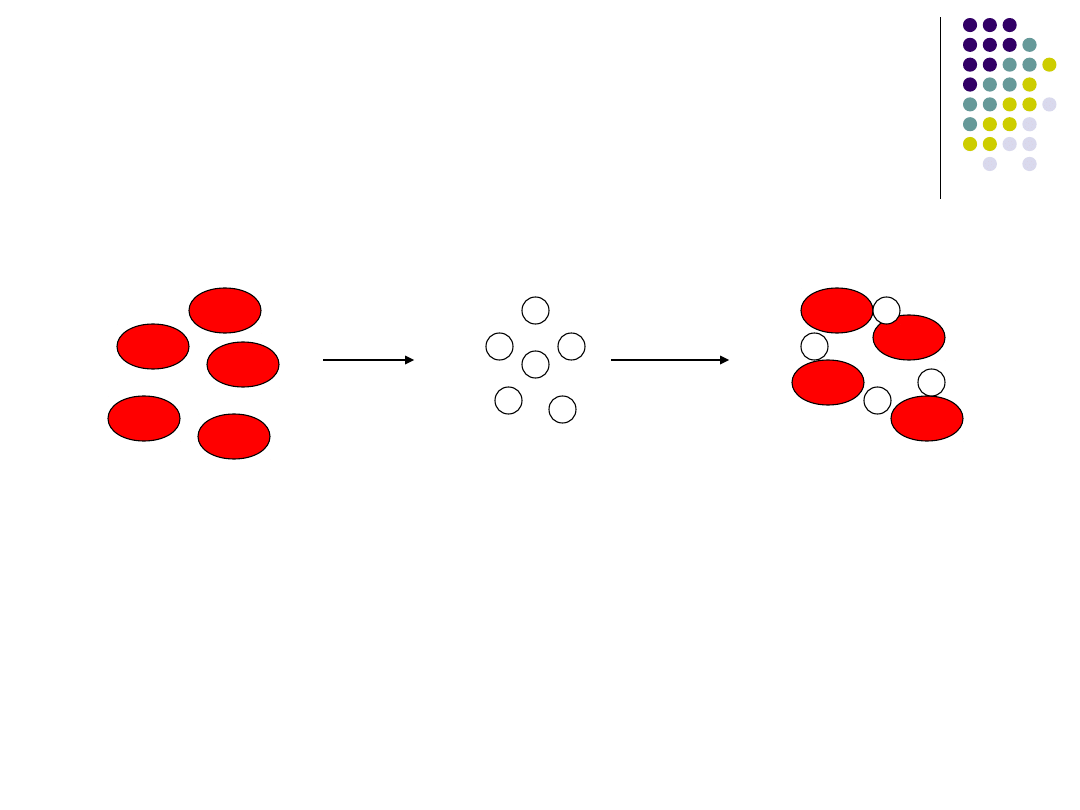
Odczyn hamowania hemaglutynacji:
Szereg drobnoustrojów ma zdolność
hemaglutynowania czerwonych krwinek ssaków
(E.Rhusiopathie, M.gallisepticum, wirus grypy,
wirus ND).Tracą one tą właściwość po związaniu ze
swoistym przeciwciałem. Odczyn ten jest
wykorzystywany do identyfikacji nieznanego
zarazka o właściwościach hemaglutynacyjnych,
przy użyciu swoistej surowicy lub do wykrywania
przeciwciał w swoistej surowicy przy użyciu znanego
wirusa.
Niektóre hemaglutyniny wirusowe:
hemaglutynina wirusa grypy,
hemaglutynina wirusa odry, świnki i
różyczki mają zdolność do zlepiania
erytrocytów:
erytrocyty
wirusy
aglutynacja
erytrocytow
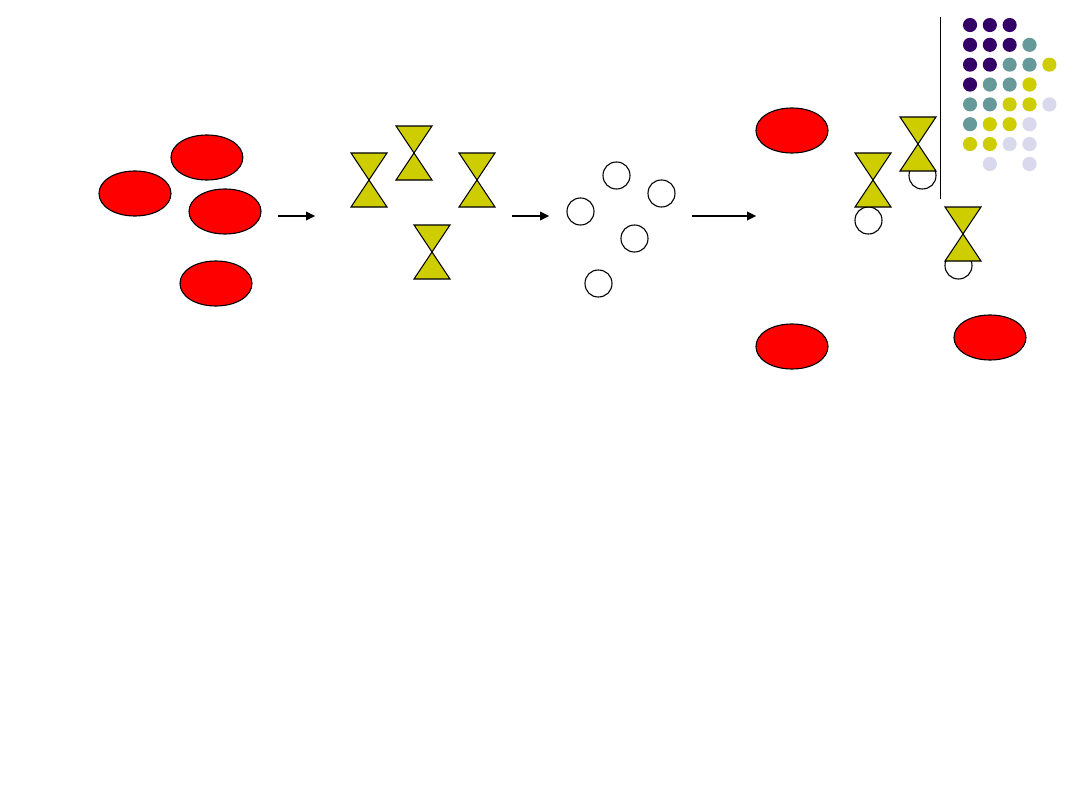
erytrocy
ty
Ig
wirusy
brak
hemaglutynacji
Właściwość ta nie ma nic
wspólnego z reakcjami
serologicznymi, jest jednak
wykorzystywana w
diagnostyce - w teście
hamowania
hemaglutynacji

Odczyn immunofluorescencji:
Jest niezwykle czułą metodą serologiczną, służącą
do wykrywania antygenu znajdującego się w
tkankach, płynach ustrojowych, a także w
wydalinach i wydzielinach. W tym celu stosuje się
tak zwane koniugaty, tj.swoiste przeciwciała
znakowane barwnikeim fluoryzujacym
(fluorochromem) np.:izocyjanianem fluoresceiny. Po
naświetlaniu promieniami UV barwnik emituje
intensywne światło widzialne barwy zielonej co
pozwala stwierdzić obecność kompleksów antygen
przeciwciało.

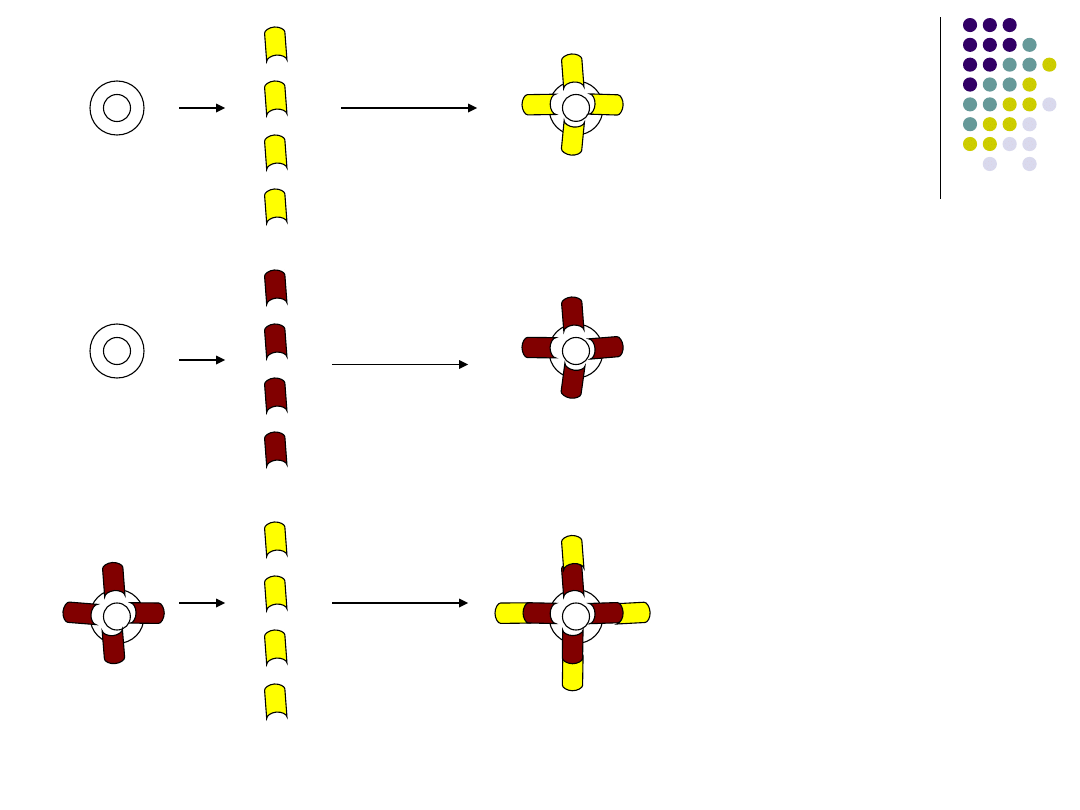
Bezpośredni odczyn IF:
Służy do wykazania obecności antygenu w
badanym materiale. Przeciwciała znakuje się
barwnikiem FITC i pokrywa nimi preparat np.:
rozmaz inkubuje się i następnie przemywa się
kilkukrotnie w celu usunięcia niezwiązanych z
preparatem przeciwciał. Po wysuszeniu ogląda
się w mikroskopie fluorescencyjnym.Obecność
zielono-żółtych kompleksów dowodzi
występowania antygenu. Zastosowanie w
badaniu na obecność prątków gruźlicy.

• Pośredni odczyn IF:
Stosuje się go do wykazania antygenu w
tkankach. Preparat pokrywa się swoistą
surowicą i po inkubacji spłukuje się
buforowanym r-m NaCl. Następnie pokrywa
się surowicą antyglobulinowa znakowaną
FITC i po ponownej inkubacji i przemyciu
preparat ogląda się pod mikroskopem
fluorescencyjnym. Obecność ognisk
fluorescencji dowodzi obecności antygenu.
A:
B:
odczyn IF
bezpośredni
odczyn IF
pośredni
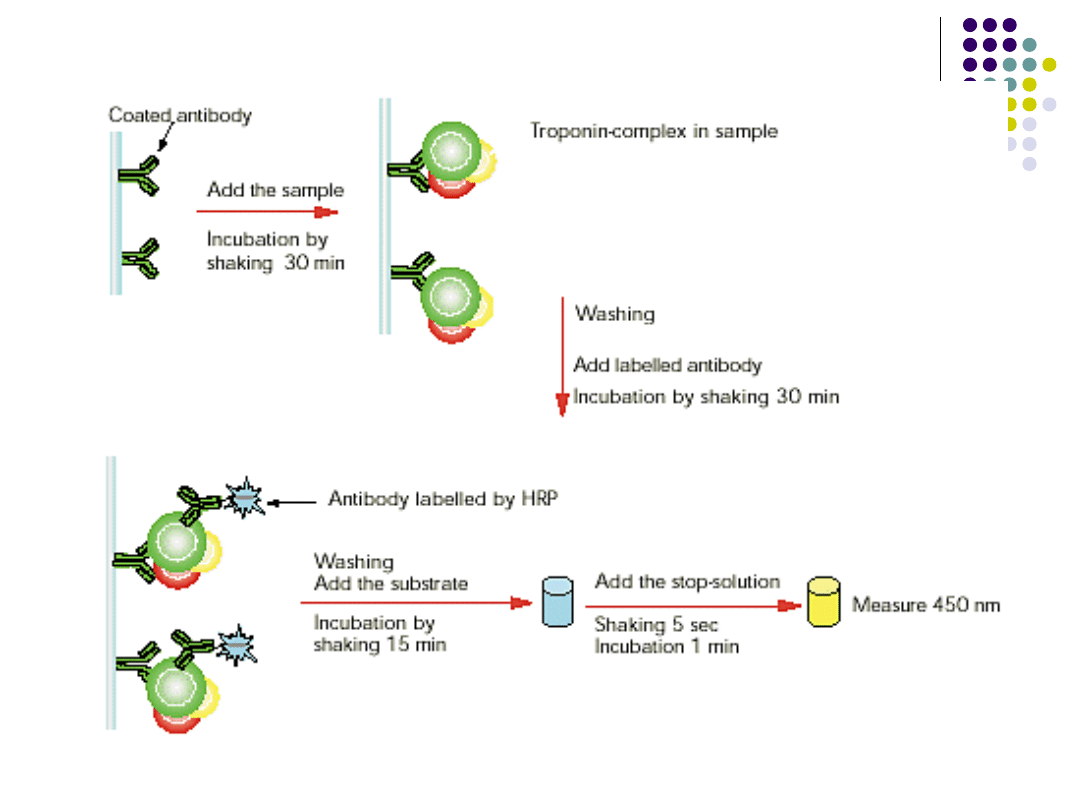
Test ELISA
Metoda polega na koniugacji enzymu z antygenem albo z
przeciwciałem i użyciu aktywności enzymatycznej tego
enzymu jako znacznika ilościowego. Aktywność
enzymatyczna mierzy się po dodaniu swoistego
substratu, natężenie reakcji barwnej mierzy się
kolorymetrycznie.
Pomiar stężenia przeciwciał - polega na
umieszczeniu znanego antygenu na mikropłytce i
inkubacji z rozcieńczeniami badanej surowicy, przemyciu
i ponownej inkubacji z anty-immunoglobulinną
znakowaną enzymem np.: peroksydaza chrzanowa.
Aktywność enzymatyczną mierzy się po dodaniu
swoistego substratu.

Pomiar stężenia antygenu – znane swoiste
przeciwciało umiejscawia się na fazie stałej,
dodaje się materiał badany, który zawiera
antygen, płucze się a następnie dodaje drugie
przeciwciało znakowane enzymem. Próba
wymaga użycia antygenu, który ma co najmniej
dwie determinanty. Po przemyciu dodaje się
substratu i mierzy aktywność enzymatyczną
odnosząc ją do stężenia antygenu

RIA – badania radioimmunologiczne
Jest to najczulsza metoda oznaczania
ilościowego substancji o właściwościach
antygenu lub haptenu, o których znakowania
wykorzystuje się izotopy radioaktywne.
Zasada metody podobna do testu ELISA.

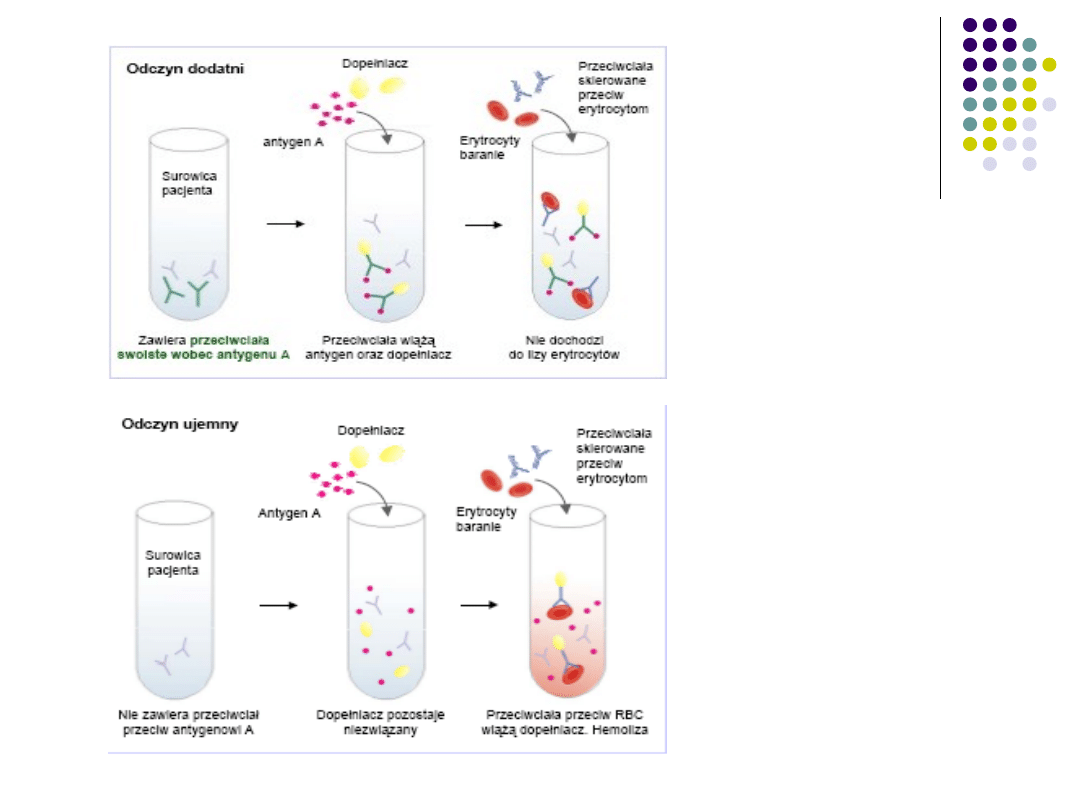
OWD – odczyn wiązania dopełniacza
Służy do wykrywania i określania przeciwciał lub
antygenu.
I układ – testowy: antygen + badana surowica
pozbawiona dopełniacza + świeża surowica świnki
morskiej. Jeżeli w badanej surowicy są przeciwciała
wiążą one antygen, a powstały kompleks przyłącza
w całości dopełniacz.
II układ – wskaźnikowy: zawiesina erytrocytów
barana + surowica królika uodpornionego
krwinkami barana bez dopełniacza (amboreceptor
hemolityczny)

W przypadku związania dopełniacza w pierwszym
układzie uczulone krwinki układu wskaźnikowego
nie ulegną lizie, natomiast liza krwinek w drugim
układzie świadczy o braku swoistych przeciwciał
w badanej surowicy układu testowy.
Przed nastawieniem OWD składniki obu układów
muszą być dokładnie wymiareczkowane. Dodanie
ściśle określonej ilości dopełniacza ma znaczenie
zasadnicze. Nadmiar komplementu będzie zawsze
powodował rozpuszczenie krwinek, natomiast zbyt
mała jego dawka wywoła niekompletną hemolizę.

OWD znajduje szerokie zastosowanie w
diagnostyce chorób zakaźnych np. brucelloza,
nosacizna, choroba pęcherzykowa świń;
oraz w określeniu serotypów
poszczególnych drobnoustrojów np. wirus
pryszczycy.
Pośredni OWD
Stosuje się go przy badaniu surowic ptaków,
które po związaniu się ze swoistym
antygenem nie przyłączają dopełniacza świnki
morskiej. Trudność tę rozwiązano
wprowadzając do odczynu szósty składnik –
surowicę odpornościową ssaka zawierającą
swoiste przeciwciała dla użytego antygenu
( surowica wskaźnikowa)

Odczyn konglutynacji
Układ pierwszy: zamiast surowicy świnki
morskiej jako źródła dopełniacza używa się
surowicy końskiej zawierającej
niekompletny dopełniacz
Układ drugi: miejsce amboceptora
hemolitycznego zajmuje surowica bydlęca,
zawierająca tzw. konglutyninę
wykorzystywaną jako wskaźnik wiązania
niekompletnego dopełniacza. Odczyn ten
znajduje zastosowanie przy badaniu
surowic źrebnych klaczy, osłów i mułów.

Zastosowanie niekompletnego dopełniacza
zapobiega nieswoistemu wiązaniu go przez
badane surowice. Jeżeli w surowicy badanego
zwierzęcia są obecne przeciwciała wiążą one
antygen i dopełniacz. Krwinki układu
wskaźnikowego nie ulegają wówczas aglutynacji.
W przypadku braku swoistych przeciwciał w
badanej surowicy nie związany dopełniacz z
pierwszego układu przechodzi do układu drugiego
wywołując wraz z konglutyniną silna aglutynację
krwinek barana.

PCR
Metoda ta sprowadza się do uzyskania
w jednej probówce, przy pomocy kilku
odczynników w ciągu kilku godzin z
jednej sekwencji DNA do biliona jego
kopii.
Amplifikacje DNA uzyskuje się w
wyniku równoczesnego kopiowania
przy pomocy odpowiedniego enzymu
dwóch komplementarnych nici DNA.
Pozwala na: uzyskanie mierzalnych
ilości DNA oraz powielenie ściśle
określonego odcinka DNA.

Mieszaninę reakcyjną stanowią: DNA
służące jako matryca i dwa startery –
to krótkie oligonukleotydy o
sekwencjach komplementarnych do
obu końców odcinka DNA
poddawanego amplifikacji.
Do powielenia DNA wykorzystuje się
polimerazę z termofilnej bakterii.
Enzym ten ze względu na swoją
termostabilność zachowuje
aktywność w trakcie kolejnych
denaturacji DNA w tem. 93ºC.
Ponadto deoksyrybonukleotydy i
odpowiedni układ buforowy.

Metody wykrywania
Powielone fragmenty DNA analizuje się
poprzez: elektroforeze w żelu
agarozowym, elektroforeze w żelu
poliakryloamidowym.
Do wykrywania DNA stosuje się bromek
etydyny dla żelu agarozowego i azotan
srebra dla żelu poliakryloamidowego.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
Wyszukiwarka
Podobne podstrony:
Diagnostyka zaburzeń hemostazy Praktyczna interpretacja wyników badań krwi psów i kotów
Badanie krwi - Morfologia krwi, interpretacja wyników
UKRYTY PROGRAM SZKOŁY W ŚWIADOMOŚCI UCZNIÓW INTERPRETACJA WYNIKÓW ANKIETY, Studia, Badania marketing
witaminy i składniki mineralne, diagnostyka, badania, normy
INTERPRETACJA WYNIKÓW, Pielęgniarstwo 1 rok
16PF - INTERPRETACJA WYNIKOW, Testy psychologiczne, materialy do druku
CATTELL - INTERPRETACJA WYNIKÓW, psychologia
14 Interpretacja wynikow ekspertyzy JW
DOJRZAŁOŚĆ SZKOLNA, Diagnoza, badanie dojrzałości szkolnej
Instrukcja i punktacja, Diagnoza, badanie dojrzałości szkolnej
Interpretacja wynikow id 218994 Nieznany
Hildebrand Interpretacja wyników?dań
diagnoza na radę - wzór formularza(1), Diagnoza, badanie dojrzałości szkolnej
(10) Realizacja zasady ostrożności interpretacyjnej wyników badań psychologicznych, PSYCHOLOGIA, Mat
Interpretacja wyników Kwestionariusza Uzależnienia od Nikotyny Fagerstrőma, socjologia, promocja zdr
INTERPRETACJA WYNIKÓW BADAŃ AMBULATORYJNYCH, Pielęgniarstwo
ZASADY INTERPRETACJI WYNIKÓW SPIROMETRII
więcej podobnych podstron