

U wszystkich organizmów
żywych w odpowiedzi na
reakcje stresowe dochodzi do
indukcji
syntezy
grupy
polipeptydów.
Ponieważ
odkrycia
tego
dokonano w związku ze
zjawiskiem
hipertermii,
opisywane peptydy zostały
nazwane
białkami
szoku
cieplnego.

Białka szoku cieplnego (HSP - ang. Heat shock
proteins) są grupą białek, których ekspresja
wzrasta, kiedy komórki są narażone na działanie
czynników stresowych, takich jak:
podwyższona temperatura (10% ponad wartość
fizjologiczną),
infekcje wirusowe,
zmiana pH środowiska,
czynniki uszkadzające DNA,
zapalenia,
działanie toksyn,
obecność etanolu,
promieniowanie UV,
brak substancji odżywczych,
niedotlenienie, itp.

Odpowiedź szoku termicznego jest
charakterystyczna
dla
wszystkich
organizmów, a wzrost stężenia HSP
zachodzi
w wyniku podwyższenia transkrypcji
genów szoku termicznego. Niektóre z
genów szoku termicznego mogą być
aktywowane
podczas
normalnego
wzrostu i rozwoju organizmu.
HSP pochodzące z różnych organizmów
charakteryzują się wysokim stopniem
homologii
zarówno
na
poziomie
sekwencji
aminokwasowej
jak
i
struktury. Wiele z tych protein to białka
opiekuńcze, proteazy lub białka z nimi
współpracujące.

W komórkach eukariotycznych odpowiedź na szok
termiczny regulowana jest na etapie inicjacji
transkrypcji
przez
uaktywnienie
czynnika
transkrypcyjnego,
zwanego
czynnikiem
szoku
cieplnego HSF (Heat Shock Factor).
W
komórkach
drożdży
i
muszki
owocówki
zidentyfikowano
tylko
jeden
czynnik
szoku
termicznego (HSF). W komórkach innych organizmów
eukariotycznych zidentyfikowano ich przynajmniej
dwa (mysz, człowiek- HSF1, HSF2) lub trzy (pomidor,
kura – HSF1, HSF2, HSF3).
Czynniki
szoku
termicznego
różnią
się
funkcjonalnością, np.:
HSF1 odpowiada za indukcję odpowiedzi szoku
termicznego,
HSF2 jest aktywowany podczas specyficznych
etapów rozwoju i różnicowania komórek.

W zależności od wielkości wyróżnia się pięć klas
białek szoku cieplnego (HSP):
Hsp 110 - białko to znajduje się w jądrze
komórkowym
i produkowane jest jedynie przez komórki
ssaków. Sugerowano, że hsp 110 może odgrywać
pewną
rolą
w odnowie aktywności jądra komórkowego,
Hsp 90 - białko to związane jest z receptorami
hormonalnymi oraz z co najmniej dwoma
białkami związanymi z glukozą. Białko to wywiera
głównie działanie ochronne poprzez różnorodne
typy interakcji z białkami, które nie wymagają
hydrolizy ATP. Jest ono obecne także w
komórkach nie eksponowanych na czynniki
stresowe, jednakże jego stężenie może wzrosnąć
nawet pięciokrotnie w wyniku zadziałania stresu
cieplnego. Hsp 90 współdziała z niektórymi
receptorami dla hormonów steroidowych i
kinazami białkowymi.

Hsp 70 - w skład rodziny hsp 70 wchodzi 21
białek.
Jedno
z tych białek - HSP 73 jest jednym z genów, do
którego ekspresji dochodzi na wczesnym etapie
zarodkowym w czasie aktywacji genomu zygoty.
Inne białko z tej grupy - HSP 72 zwiększa swoją
ekspresję
w
warunkach
stresu
oraz
w odpowiedzi na transfekcję onkogenów,
Hsp o średniej masie cząsteczkowej - do ich
ekspresji na niewielkim poziomie dochodzi w
mitochondriach i błonach komórkowych w
warunkach nieobecności czynników stresowych,
Hsp o niskiej masie cząsteczkowej - tworzą
różnorodną grupę, włączając oksygenazę hemu,
statminę oraz mały polipeptyd - ubikwitynę,
białka
odgrywające
rolę
w nie lizosomalnym procesie usuwania
agregatów zdenaturowanych białek.

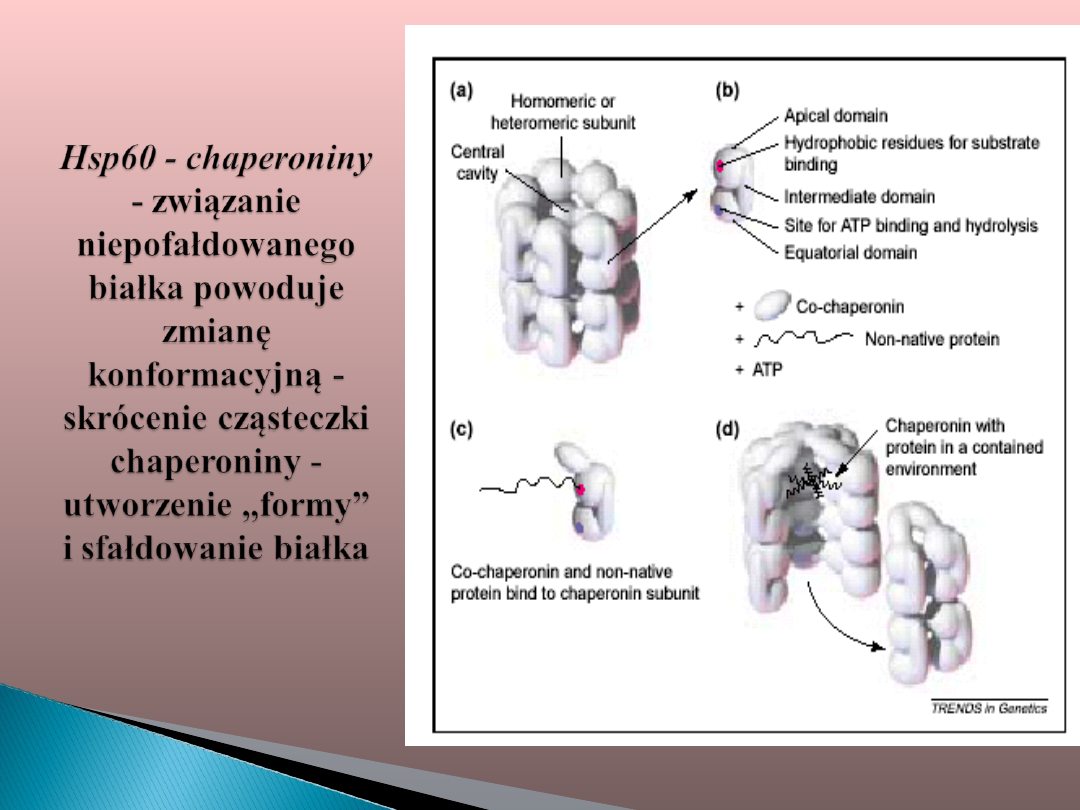
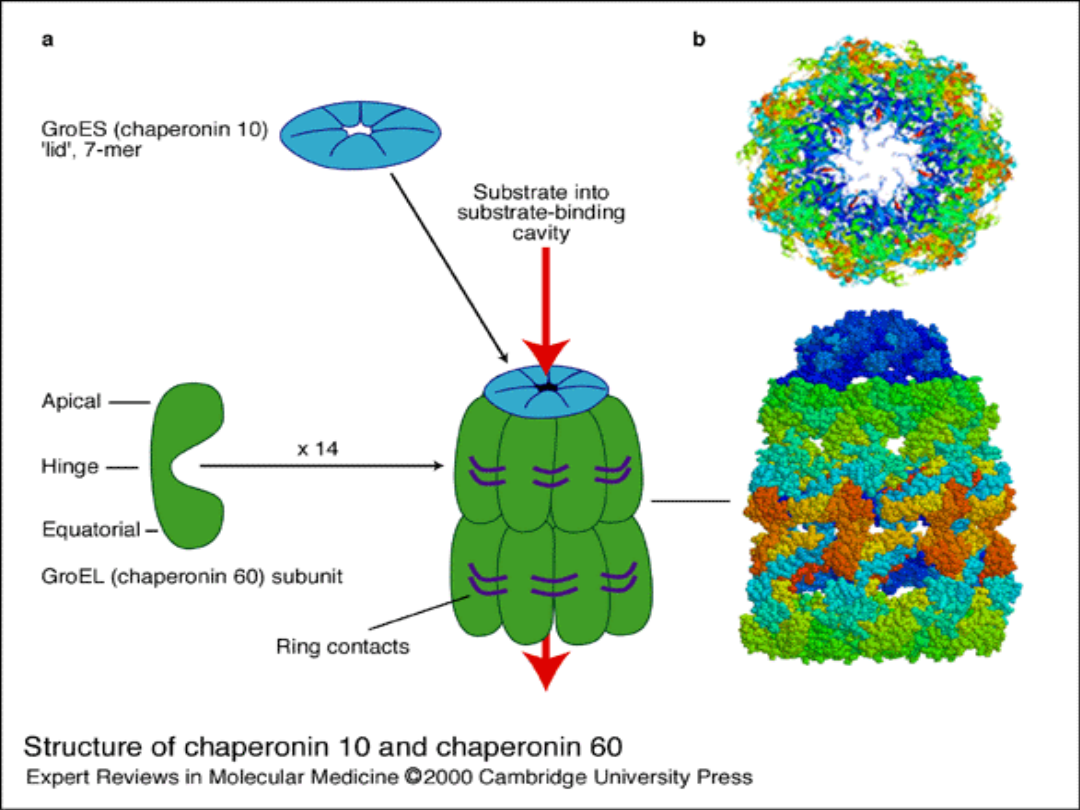
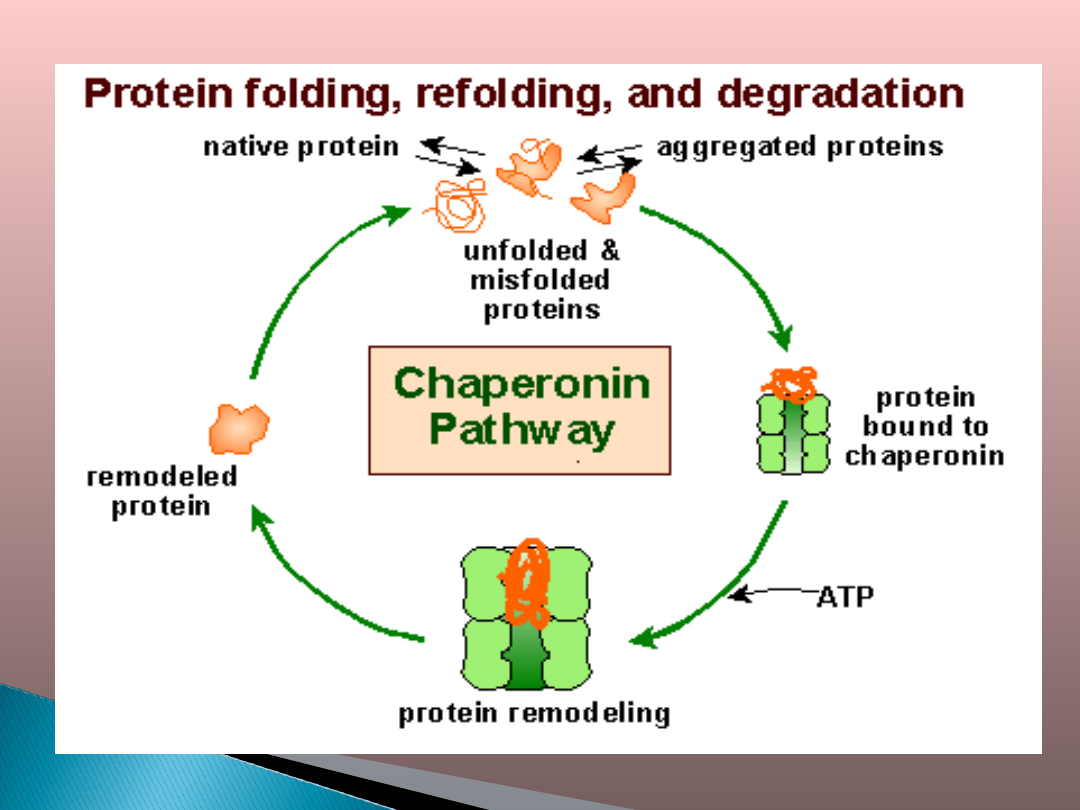
Dużą grupę białek szoku cieplnego
tworzą
tzw. białka chaperonowe.
Białka opiekuńcze (chaperony) to
białka
uczestniczące
w
wielu
procesach komórkowych, związanych
głównie
z
utrzymaniem
odpowiedniej
konformacji oddziałujących z nimi
białek.

Białka opiekuńcze asystują przy:
replikacji i transkrypcji DNA ,
prawidłowym fałdowaniu się nowych
białek i ich transporcie do organelli,
wydzielaniu białek poza komórkę i
transporcie substancji do jej wnętrza,
biorą udział w rozbijaniu agregatów
białkowych , aktywacji receptorów i
degradacji białek,
umożliwiają także funkcjonowanie tzw.
kompleksów MHC,
odpowiedzialnych za prawidłowe reakcje
układu odpornościowego.

Regulacja ekspresji genów przez hormony
steroidowe
Znaczącą rolę w regulacji ekspresji genów
odgrywają hormony steroidowe, które wpływają
na wzrost i różnicowanie się komórek u wyższych
organizmów eukariotycznych. Sygnał hormonalny
(ligand) przekazywany jest do genu docelowego
przez receptory wewnątrzkomórkowe. Wiązanie
ligand do odpowiedniego receptora uruchamia
interakcję
tak
powstałego
kompleksu
z
charakterystyczną regulatorową sekwencją DNA
w
genie
docelowym,
zwaną
elementem
odpowiedzi
hormonalnej
(HRE,
Hormon
Response Element). Receptor związany z
ligandem ułatwia tworzenie się kompleksu
z innymi czynnikami transkrypcyjnymi i
stymuluje transkrypcję.

Elementy odpowiedzi na hormon regulują
ekspresję sąsiadujących genów oraz inne
miejsca kontroli transkrypcji
HRE dzieli się na 4 klasy:
GRE – element odpowiedzi
glikokortykoidów, wiąże on też receptory
AR, PR, MR;
ERM – element odpowiedzi estradiolu;
TRE – element odpowiedzi hormonu
tarczycy, do którego dołącza się również
receptor RAR;
DRE – ostatnią grupę stanowi sekwencja,
która wiąże „receptory sieroce” (receptory
białek o nieznanej funkcji i ligandach).

Podczas
nieobecności
liganda
większość
receptorów ER, PR, AR zlokalizowanych jest w
cytoplaźmie, a kompleks receptor-hormon migruje
do jądra komórkowego, aby modulować ekspresję
genów. Pewna ilość receptorów występuje też
w jądrze, niezależnie od obecności hormonu.
Receptory GR, MR, TR, RAR występują w jądrze
niezależnie od obecności ligand.
Receptory jądrowe hormonów steroidowych są
typowym przykładem białek transregulatorowych
transkrypcji. Umożliwiają one interakcję z innymi
białkami,
a
zwłaszcza
z uniwersalnymi czynnikami transkrypcyjnymi
(polimeraza
RNA II i czynnikTFII) i działają stabilizująco na
czynniki wiążące w pobliżu promotora. Ten sposób
interakcji cząsteczek steroidowych receptorów
jądrowych nazywa się transaktywacją.

Wykonały:
Marta Bienasz
Jolanta Gutowska
Justyna Lipińska
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
Regulacja funkcji genów pod wpływem temperatury
Regulacja funkcji genów pod wplywem temperatury
Genetyka regulacja funkcji genow
2 Regulacja funkcji genów Zmienność i mutacje
10 WYK X Regulacja funkcji genów u bakterii1id 10654 ppt
10 WYK X Regulacja funkcji genów u?kterii1
2 Regulacja funkcji genów Zmienność i mutacje
Genetyka regulacja funkcji genow
2 Regulacja funkcji genów Zmienność i mutacje
JAK?ENEZER SCROOGE ZMIENIŁ SIĘ POD WPŁYWEM WIZYT DUCHÓW
Mechanizm wyzwalania reakcji biologicznych pod wpływem działania promieni UV
JAZDA POD WPŁYWEM ALKOHOLU, NAUKA, WIEDZA
Reformowanie oświaty zostało zapoczątkowane pod wpływem radykalnej zmiany ustroju społeczno
Zagrożenia gleb w Polsce pod wpływem działalności człowieka
Badanie śliny przy podejrzeniu prowadzenia pojazdów pod wpływem narkotyków
Prowadzenie pojazdów pod wpływem narkotyków nowe zagrożenie
gr3, Elektroliza - proces rozkładu związków chemicznych i separacji produktów tego rozkładu pod wpły
więcej podobnych podstron