
Układ obronny wymienia
krów
Prof. dr hab.Władysław Wawron
Katedra i Klinika Rozrodu Zwierząt Wydz. Med. Wet. UP
w Lublinie

Gruczoł mlekowy krowy jest narządem izolowanym
anatomicznie, który posiada swoiste mikrośrodowisko.
Odrębna anatomicznie jest także każda ćwiartka wymienia
krowy co sprawia, że proces zapalny może dotyczyć tylko
części gruczołu.
Ochronę wymienia przed drobnoustrojami stanowi bariera
anatomiczna oraz komórkowe i humoralne mechanizmy
odporności
nieswoistej
i
swoistej
odpowiedzi
immunologicznej.

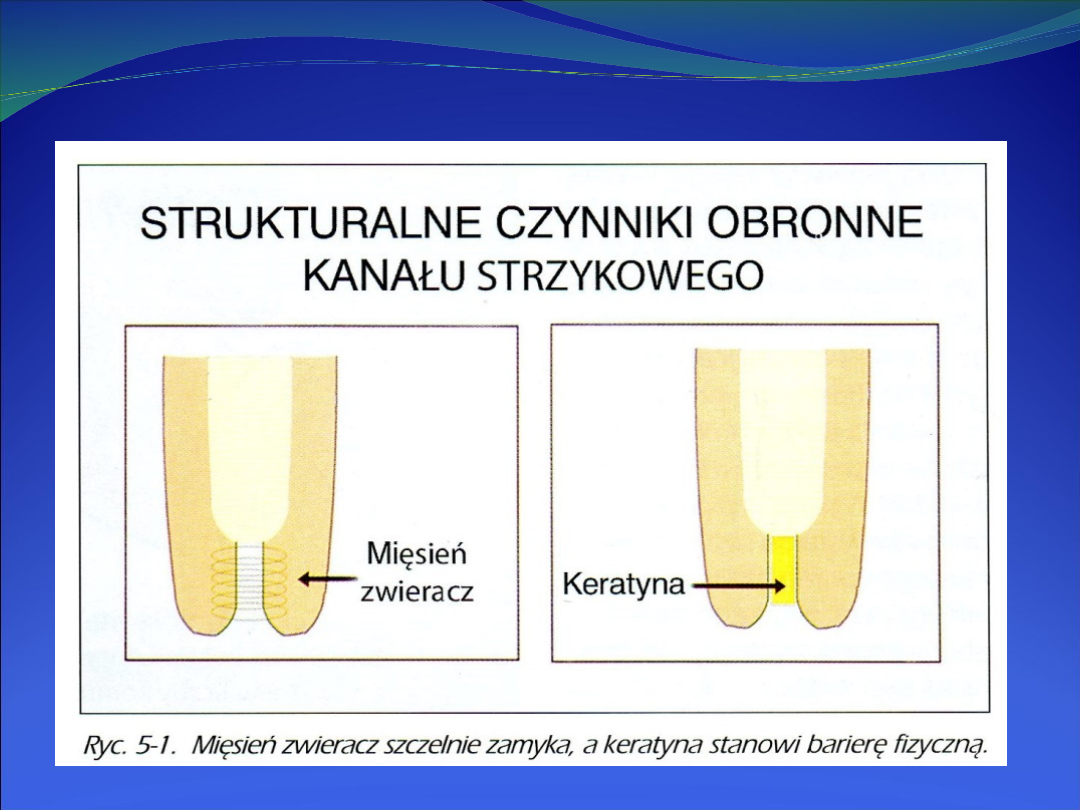
Pierwszą barierą
zapobiegającą wnikaniu drobnoustrojów
do wymienia jest
mięsień zwieracz strzyku
oraz
usytuowany za nim
przewód
/kanał/
strzykowy
, pokryty
warstwą keratyny, zawierającą białka zasadowe i
antybakteryjne kwasy tłuszczowe, która wychwytują i wiążą
bakterie, co zapobiega ich przechodzeniu do zatoki.
Bakterie Gram-dodatnie są
bardziej wrażliwe niż bakterie
Gram-ujemne
na
bakteriobójcze
i
bakteriostatyczne
działanie keratyny.
Ponadto pod nabłonkiem kanału strzykowego, szczególnie
wokół
rozety Fürstenberga
, akumulowane są limfocyty i
komórki plazmatyczne, co wskazuje na miejscową
aktywność immunologiczną.

Selekcja hodowlana, która ma na celu podniesienie
wydajności mlecznej krów przyczynia się jednocześnie do
obniżenia sprawności tych barier.
Osłabienie mięśnia zwieracza ułatwia dój mechaniczny
(cecha preferowana w hodowli), ale sprzyja urazom
mechanicznym strzyków i zakażeniom.

Immunologiczne mechanizmy obronne
Komórkowe mechanizmy obronne
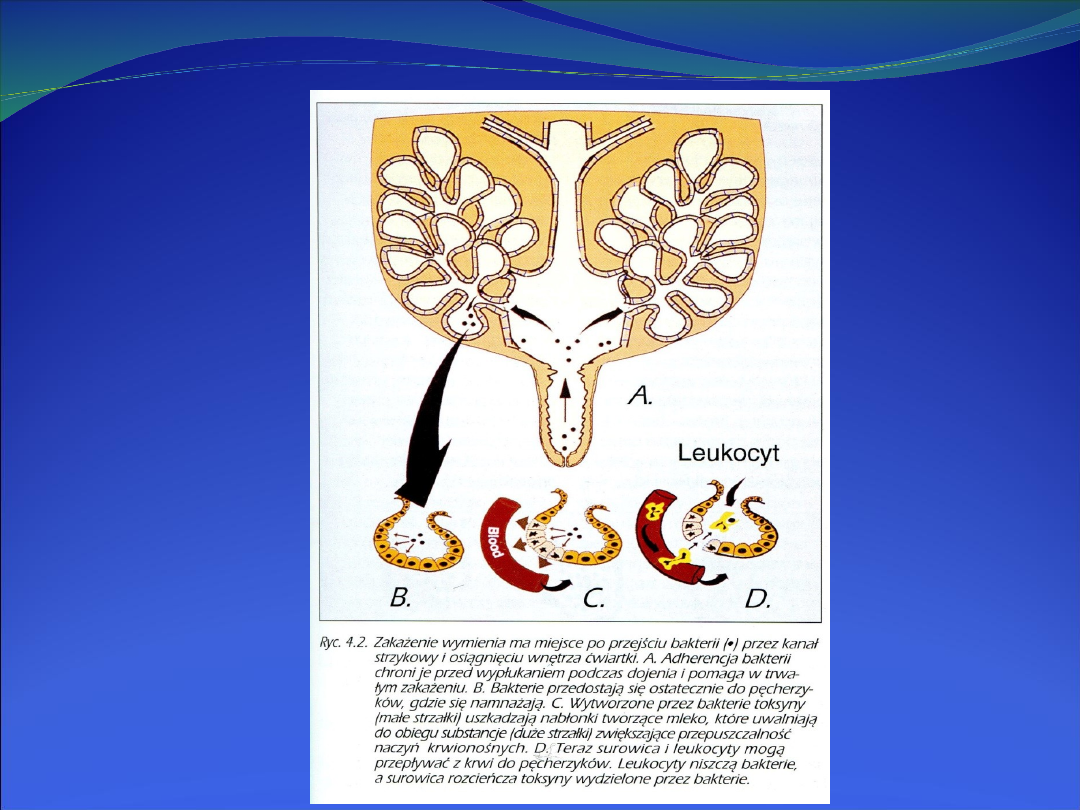
Podstawową rolę obronną w gruczole mlekowym pełnią
przechodzące z krwi leukocyty
. Nasilenie procesu
zapalnego i czas jego trwania zależy bezpośrednio od
zdolności leukocytów do migracji z naczyń włosowatych
oraz aktywności bójczej tych komórek w miejscu zakażenia.

Dominującą rolę w zapaleniu wymienia wśród leukocytów
odgrywają
neutrofile
. Wraz z nimi do ogniska zapalnego
napływają również
makrofagi oraz limfocyty
.
Migracja tych komórek z krwi zależy od ekspresji receptorów
adhezyjnych na leukocytach i ich powinowactwa do ligandów
na komórkach śródbłonka naczyń oraz od obecności w
tkankach mediatorów zapalenia: cytokin, składników
dopełniacza i leukotrienów. Receptory adhezyjne to
białka z rodziny integryn, zbudowane z dwóch łańcuchów α i
β. W przejście leukocytów przez śródbłonek naczyń
zaangażowane są przede wszystkim integryny posiadające
łańcuch β
2
, dla których ligandami są cząsteczki adhezyjne na
powierzchni śródbłonka naczyń ICAM 1i2.

Migrację leukocytów w tkankach wymienia umożliwia
obecność czynników chemotaktycznych, spośród których
najważniejszą rolę odgrywają: IL-8, składowa C5a dopełniacza
i LTB4.
Proces ten jest możliwy dzięki receptorom z rodziny
integryn posiadających łańcuch β
1
, których ligandy poza
fibronektyną nie są znane.
Typ, liczba i powinowactwo receptorów adhezyjnych na
powierzchni leukocytów zależą od sposobu pobudzenia
komórek,
czyli
od
rodzaju
produktów
bakteryjnych
(metabolitów, toksyn, składników ściany komórkowej) oraz
obecności cytokin.

Pierwszą linię obrony gruczołu mlekowego stanowią
fagocyty (neutrofile i makrofagi).
Ich zadaniem jest
fagocytoza i zabicie pochłoniętych bakterii oraz usuwanie
kruszywa komórkowego.
W
początkowej fazie zakażenia do
gruczołu mlekowego migruje duża
ilość
neutrofili
,
które
mogą stanowić nawet 100% komórek
somatycznych mleka
w tym okresie.
W przypadku skutecznej eliminacji czynników zakaźnych
proces przechodzenia neutrofili z krwi do wymienia zostaje
zatrzymany, a liczba komórek somatycznych wraca do
normy. W przeciwnym wypadku proces zapalny rozwija się, a
neutrofile migrują pomiędzy komórkami wydzielniczymi
gruczołu mlekowego w kierunku światła pęcherzyków
powodując uszkodzenie tych komórek i zmniejszenie
produkcji mleka.

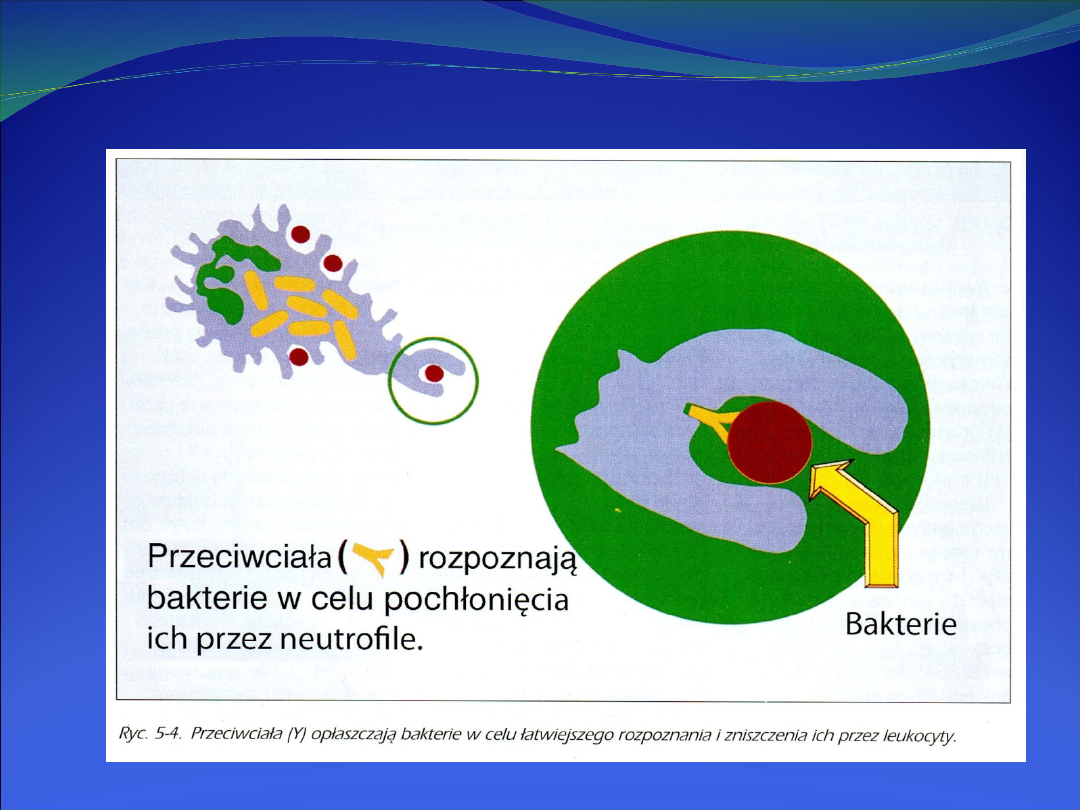
Reakcja
fagocytów jest natychmiastowa, ale nieprecyzyjna, nie
wymaga wcześniejszej prezentacji antygenu.
Komórki te nie rozpoznają patogenów, a jedynie niektóre
markery na powierzchni bakterii
tzw. wzorce molekularne
związane z patogenami (pathogen associated molecular
patterns – PAMP): mannany, lipopolisacharyd – LPS czy kwasy
tejchojowe albo czynniki opłaszczające komórkę bakteryjną
(opsoniny). Rolę opsonin mogą pełnić przeciwciała, fragmenty
dopełniacza lub białka wiążące składniki ścian bakterii (np.
lektyny, białko wiążące LPS). Receptory dla PAMP oraz dla
opsonin znajdują się na powierzchni fagocytów, wiele z nich to
integryny biorące udział w migracji leukocytów.

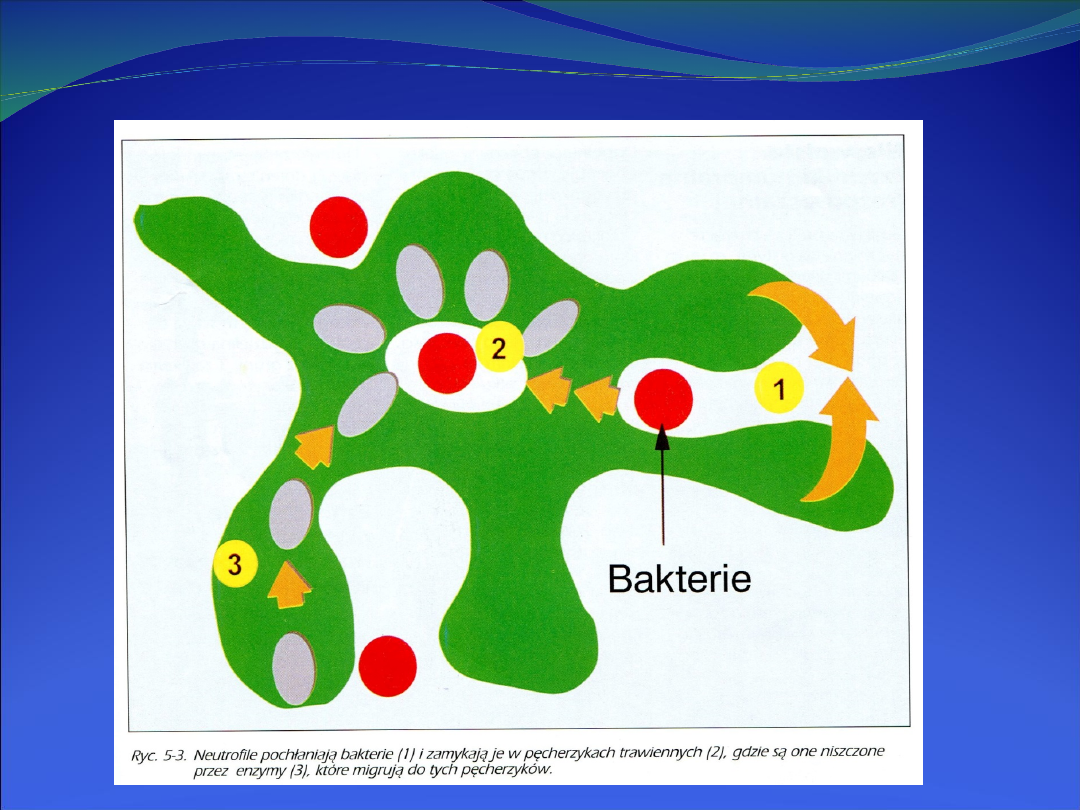
Fagocyty posiadają dwa rodzaje mechanizmów umożliwiających
zabicie bakterii.
Pierwszy
z nich - zależny od tlenu /wybuch tlenowy /
- polega na
aktywacji oksydazy NADPH i wytwarzaniu reaktywnych form
takich jak: rodnik hydroksylowy, tlen singletowy, aniony
ponadtlenkowe i nadtlenek wodoru.
Drugi
mechanizm bakteriobójczy,
niezależny od tlenu
, opiera się
na działaniu białek znajdujących się w lizosomach (peroksydaza,
lizozym, enzymy proteolityczne, laktoferyna, defensyny, N-
acetylo- β-glukozamidaza) oraz zjawisku degranulacji czyli ich
uwalniania.
Mechanizm zależny od tlenu jest wysoce efektywny w eliminacji
bakterii gram-ujemnych, w tym E.coli. Inne bakterie np. Staph.
aureus są bardziej oporne na zabijanie oksydacyjne ponieważ
wytwarzają katalazę, która rozkłada nadtlenek wodoru do tlenu i
wody.

Aktywność fagocytów może zostać osłabiona przez
pochłonięte
oprócz bakterii składniki mleka np. kazeinę czy tłuszcz. Ponadto
składniki mleka, głównie tłuszcz mogą blokować receptory na
leukocytach, co utrudnia rozpoznawanie patogenu i jego
fagocytozę. W przypadku zablokowania receptorów na
fagocytach dla fragmentów Fc immunoglobulin np. przez
tłuszcz mleka może dochodzić do niepotrzebnej degranulacji
leukocytów i uwolnienia enzymów hydrolitycznych czego
skutkiem jest pobudzenie zapalenia.
Aktywność
fagocytarną
obniżają
również
antybiotyki,
wydzielina zapalna, związki ketonowe oraz antygeny
bakteryjne, a pobudzają cytokiny, kwas acetylosalicylowy,
dopełniacz, surowica, dimer lizozymu.

Swoistą odpowiedź immunologiczną zapoczątkowują limfocyty.
Dzięki
obecności
swoistych
receptorów
w
błonie
cytoplazmatycznej limfocyty posiadają zdolność precyzyjnego
rozpoznawania poszczególnych antygenów.
Ich reakcja trwa
znacznie dłużej ponieważ wymaga wcześniejszej prezentacji
antygenu głównie przez komórki dendrytyczne i makrofagi.
Pozostawia jednak pamięć immunologiczną i przy ponownym
kontakcie z antygenem odpowiedź rozwija się szybko.
Występują dwie podstawowe populacje limfocytów: T i B.
W zdrowym gruczole mlekowym
komórki B stanowią ok. 20%
zaś komórki
T ok. 47%
populacji limfocytów. W grupie
limfocytów T wyróżnia się limfocyty TCRαβ, do których należą
komórki
pomocnicze
CD4
+
(Th)
i
komórki
cytotoksyczne/supresorowe CD8
+
(Tc/s) oraz limfocyty TCRγβ. W
mleku zdrowych krów stosunek TCRγβ do TCRαβ wynosi 0.37,
zaś u krów z mastitis wzrasta do wartości 0.44.

Limfocyty Th w odpowiedzi na rozpoznanie antygenu,
wytwarzają cytokiny
za pośrednictwem których mogą
aktywować limfocyty B, makrofagi, inne limfocyty T oraz
pozostałe komórki biorące udział w reakcji organizmu na
czynnik zakaźny.
Stosunek limfocytów CD4
+
do pozostałych limfocytów w
gruczole mlekowym jest inny niż we krwi obwodowej krowy.
W mleku pochodzącym ze zdrowego wymienia przeważają
limfocyty
CD8
+
,
a stosunek CD4
+
/CD8
+
wynosi 0.68.
W wydzielinie zakażonego gruczołu mlekowego przeważają
limfocyty
CD4
+
,
a stosunek CD4
+
/CD8
+
wynosi 1.39.

Limfocyty Tc wykazują zarówno działanie cytotoksyczne jak
i supresorowe
, rozpoznają i zabijają komórki
identyfikowane na podstawie obecności na powierzchni
antygenów połączonych z białkami MHC klasy I.
Supresorowe komórki T uważane są za nadzorujące i
modulujące
przebieg
miejscowej
odpowiedzi
immunologicznej.

Limfocyty B odpowiedzialne są za wytwarzanie przeciwciał.
W
mleku zdrowych krów ich udział wśród komórek somatycznych
nie przekracza 5%.
W przebiegu procesu zapalnego w wymieniu odsetek
limfocytów B we krwi obwodowej wyraźnie spada natomiast
wzrasta w węzłach chłonnych nadwymieniowych co potwierdza
ich znaczenie w ochronie gruczołu mlekowego.
W przeciwieństwie do makrofagów i neutrofilów, limfocyty B
wykorzystują
własne
receptory
powierzchniowe
do
rozpoznawania antygenów bakteryjnych
.
Mają zdolność wiązania, przekształcania i prezentowania
antygenów pomocniczym limfocytom T. W wyniku tego procesu
limfocyty Th wytwarzają interleukiny (IL-2, IL-4, IL-6, IL-10) oraz
inne cytokiny, które z kolei oddziałują na limfocyty B
zapoczątkowując ich proliferację i różnicowanie w komórki
plazmatyczne produkujące przeciwciała lub przekształcają się w
komórki pamięci immunologicznej.

Współdziałanie zarówno komórkowych jak i humoralnych
mechanizmów
odpowiedzi immunologicznej opiera się na
przekazywaniu sygnałów
(
pobudzających lub hamujących) za
pośrednictwem cytokin
.
Wykazano, że w procesie zapalnym gruczołu mlekowego u krów
wytwarzane są przez komórki somatyczne mleka następujące
cytokiny:
IL-1, IL-6, IL-8, IL-10, IL-12, IFN-γ
oraz
TNF-α
.

W początkowej fazie zapalenia główną rolę odgrywają: IL-1, IL-
6, IL-8 oraz TNF-α
.
Cytokiny te wraz z wydzielanym przez makrofagi IFN-γ
indukują migrację i gromadzenie się leukocytów w ognisku
zapalenia w gruczole mlekowym oraz pobudzają aktywność
fagocytarną i bakteriobójczą neutrofilów.
W następnej kolejności pojawiają się limfocyty.
Pod wpływem antygenu ulegają one aktywacji i uwalniają IL-1,
IL-4, IFN-γ oraz TNF-α, których zadanie polega na nasileniu i
ukierunkowaniu odpowiedzi immunologicznej.
Przebieg zapalenia regulują IL-10 i IL-12.
IL-12 stymuluje m.in.
proliferację i aktywację limfocytów T zaś IL-10 hamuje
produkcję cytokin przez pobudzone limfocyty pomocnicze
CD4
+
Th1.

Humoralne mechanizmy obronne
Czynniki humoralne współdziałają z komórkami obrony
immunologicznej obecnymi zarówno w mleku jak i w miąższu
gruczołu mlekowego.
Do grupy humoralnych czynników obronnych wymienia należą:
przeciwciała wiążące się ze swoistymi antygenami oraz
przeciwbakteryjne białka (laktoferyna, lizozym, dopełniacz, N-
acetylo-β-glukozoamidaza
oraz
system
laktoperoksydaza/tiocyjanian/nadtlenek wodoru).

Najważniejszą rolą przeciwciał w mleku jest opsonizacja
antygenów.
Ponadto neutralizują toksyny, niekiedy wykazują
także działanie bakteriobójcze (wspólnie z komplementem lub
lizozymem i komplementem).
Ogólna pula immunoglobulin w mleku zmienia się w
poszczególnych fazach laktacji
.
Najwyższe stężenie wszystkich klas przeciwciał występuje w
siarze i wynosi nawet
100mg/ml
, co ma pozytywny wpływ na
ochronę noworodka, ale spada podczas pierwszego tygodnia po
porodzie poniżej 1 mg/ml i ten poziom nie ma znaczenia w
obronie wymienia.

Przeciwciała
wytwarzane
są
w
gruczole
mlekowym
(
większość IgA i IgG
) a także wybiórczo transportowane z
krwi do mleka (
IgG1
).
W mleku przeważa
charakterystyczna dla przeżuwaczy klasa
IgG1
,
podczas gdy u zwierząt
monogastryczncyh dominuje
IgA
.
Jednak u krów jest proporcjonalnie więcej IgA w mleku niż we
krwi obwodowej. Oznacza to, że nabłonek wydzielniczy
aktywnie transferuje IgA do mleka.
Właściwością przeciwciał
sekrecyjnych w tym IgA i IgM
jest opłaszczanie bakterii, co
zapobiega ich adherencji do powierzchni struktur nabłonka
wydzielniczego i dróg wyprowadzających mleko
.
Immunoglobulina A, która jest wysoce hydrofobowa, grupuje
bakterie w mleku krowim na powierzchni kuleczek tłuszczu,
dzięki czemu są one usuwane przez kanał strzykowy wraz ze
śmietaną. Immunoglobuliny G1 jak i G2 stymulują fagocytozę
makrofagów, ale zdolność do opsonizacji IgG2 jest wyższa niż
IgG1.

Laktoferyna
jest najważniejszym białkiem wiążącym żelazo w
mleku.
Pochodzi z komórek wydzielających mleko oraz z fagocytów. Jej
poziom znacznie wzrasta w czasie zapalenia dzięki czemu
znacznie
ogranicza
wzrost
bakterii
coliform
oraz
drobnoustrojów
z
rodzaju
Staphylococcus
,
których
zapotrzebowanie na żelazo jest duże w porównaniu z innymi
patogenami.
Antybakteryjne działanie laktoferyny zależy od koncentracji
jonów dwuwęglowych i cytrynianowych.
Najwyższą aktywność
wykazuje w okresie zasuszenia kiedy stężenie dwuwęglanów
jest
największe
jednocześnie
przy
wysokim
stężeniu
laktoferyny.

W tym samym czasie cytryniany ograniczające działanie
laktoferyny absorbowane są z mleka do krwi.
Gruczoł mlekowy w okresie zasuszenia jest
zatem oporny na
bakterie, które wymagają do wzrostu dużej ilości żelaza (np.
E.coli).
W okresie poporodowym poziom laktoferyny w mleku jest
niewielki przy wysokim poziomie cytrynianów w nabłonku
wymienia, które posiadają zdolność tworzenia kompleksów z
żelazem. Pierwiastek ten staje się wówczas łatwo dostępny dla
drobnoustrojów, stąd
najczęście
j
colimastitis rozwija się
bezpośrednio po porodzie
.

Produkowana przez wątrobę transferyna także
posiada zdolność wiązania żelaza w płynach
ustrojowych m.in. w mleku.
W czasie procesu zapalnego poziom tego białka
wzrasta, a wskutek przepuszczalności tkanek
przedostaje się z krwi do mleka i tworząc
kompleksy
z
żelazem
wspomaga
ochronę
przeciwbakteryjną wymienia.

Lizozym (N-acetylmuralihydrolaza) jest niskocząsteczkowym
białkiem zasadowym, które hydrolizuje wiązania pomiędzy
kwasem muramidowym i N-acetyloglukozaminą wewnątrz
struktury peptydoglikanu ściany bakterii.
Poziom lizozymu w mleku krowy jest stosunkowo niski w
porównaniu do innych płynów ustrojowych, zatem jego
działanie przeciwbakteryjne jest niewielkie.
Lizozym jednakże wspomaga działanie laktoferyny,
bakteriolizę w której uczestniczą przeciwciała i komplement,
stymuluje opsonizację drobnoustroju przez immunoglobulinę
klasy M oraz wprowadza kompleks IgM-bakteria do komórki
fagocytującej.

Działanie antybakteryjne
laktoperoksydazy
jest skutkiem
utleniania enzymów ściany komórkowej bakterii.
Enzym ten
wykazuje aktywność
jedynie w obecności tiocyjanianów (SCN
-
)
oraz nadtlenku wodoru.
Zawartość tiocyjanianów zmienia się w zależności od żywienia,
np. skarmianie roślin z grupy krzyżowych powoduje wzrost
zawartości tych substratów w mleku. Natomiast nadtlenek
wodoru - produkt metabolizmu komórek w gruczole mlekowym,
wytwarzany jest przez zaktywowane komórki fagocytujące
mleka w obecności tlenu, powstaje m.in. w procesie fagocytozy
kazeiny i tłuszczu w granulocytach obojętnochłonnych.
Nieodpowiednie stężenie potrzebnego do reakcji H
2
0
2
jest
czynnikiem ograniczającym działanie laktoperoksydazy w
przebiegu zapalenia wymienia.
Wykazano, że patogenem najbardziej wrażliwym na system LP
jest Streptococcus uberis.

System dopełniacza funkcjonuje w gruczole mlekowym jako
typowa kaskada proteolityczna, której zadanie polega na
rozpoznaniu i niszczeniu drobnoustrojów
(opsonizacja) oraz kierowaniu fagocytów do antygenu
(chemotaksja).
Koncentracja pojedynczych składników dopełniacza w mleku
zdrowych krów jest niewielka. Natomiast w odpowiedzi na
zapalenie przenikają one do mleka na skutek zwiększonej
przepuszczalności bariery krew-mleko.
Wykazano, że
system dopełniacza odgrywa ważną rolę w
mastitis wywołanym przez E. coli ponieważ bakterie
gramujemne aktywują dopełniacz na drodze alternatywnej
.

Obrona immunologiczna wymienia w poszczególnych
fazach laktacji
Skład populacji komórek w wydzielinie gruczołu mlekowego
ulega zmianie w poszczególnych fazach laktacji.
Gruczoł
mlekowy najbardziej jest podatny
na zapalenie w okresie
poporodowym oraz w czasie zasuszenia
. Wykazano, że w tych
dwóch fazach dochodzi do wzrostu liczby neutrofilów, czego
skutkiem jest wzrastająca również ogólna liczba komórek
somatycznych.
Podczas inwolucji wymienia
przez ok. 4 tygodnie od początku
zasuszenia granulocyty obojętnochłonne stanowią ok. 60% LKS.
Aktywność fagocytarna tych komórek jest jednak niewielka.
W okresie okołoporodowym
odsetek limfocytów w mleku jest
niewielki, następnie wzrasta i w szczycie laktacji osiąga
najwyższe miano, po czym stopniowo spada. W czasie
zasuszenia poziom limfocytów jest jednak większy niż w
początkowej fazie laktacji.

Stymulacja odporności wymienia
Z uwagi na możliwość uzyskania
rekombinowanych cytokin
sprawiła, że podjęto próby ich wykorzystania w leczeniu
zapaleń gruczołu mlekowego krów. Badania in vitro i in vivo
wskazują, że
IL-2 bydlęca
stymuluje aktywność limfocytów w
wymieniu. Ponadto podana dowymieniowo indukuje napływ
neutrofilów do ogniska zapalnego oraz wzmaga ich właściwości
fagocytarne.
Opracowano również liczne preparaty pobudzające aktywność
mechanizmów odpowiedzi nieswoistej przede wszystkim
makrofagów.
W leczeniu i zapobieganiu poleca się między innymi polski
preparat
Biomast
oparty na niechorobotwórczym szczepie
Corynebacterium bovis
.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
Wyszukiwarka
Podobne podstrony:
Grzybicze i prototekowe zapalenie wymienia u krów
Grzybicze i prototekowe zapalenie wymienia u krów
Farmakologiczne przyspieszanie inwolucji wymienia u krów
Uklad pokarmowy
Czynności obronne i reakcje stresowe
Układ mięśniowy
układ moczowy
Układ nerwowy
oddechowy uklad
Uklad oddechowy2
Wymienialność
T5 UKŁAD HYDRAYLICZNY PODNOSZENIA OSPRZĘT DODATKOWY
UKŁAD PŁCIOWY MĘSKI ptt
układ naczyniowy wstep
Uklad oddech wyklad
więcej podobnych podstron