
Wykład Nr 2
Zagadnienia
•Wiązania chemiczne w związkach organicznych
(zlokalizowane, zdelokalizowane). Hybrydyzacja.
Elektroujemność, polaryzacja wiązań. Wiązania słabsze od
wiązań chemicznych (wiązania wodorowe, związki
inkluzyjne).
•Struktura i właściwości fizyczne
•Izomeria (szkieletowa, konstytucyjna, położeniowa, grup
funkcyjnych, geometryczna, konformacyjna, optyczna,
atomy prochiralne).

Dr K. Khachatryan
Katedra
Chemii AR
2
Wiązania chemiczne
Wiązania chemiczne w związkach organicznych (zlokalizowane,
zdelokalizowane). Hybrydyzacja. Elektroujemność, polaryzacja wiązań.
Wiązania słabsze od wiązań chemicznych (wiązania wodorowe, związki
inkluzyjne).
Dr K. Khachatryan
Katedra
Chemii AR
3
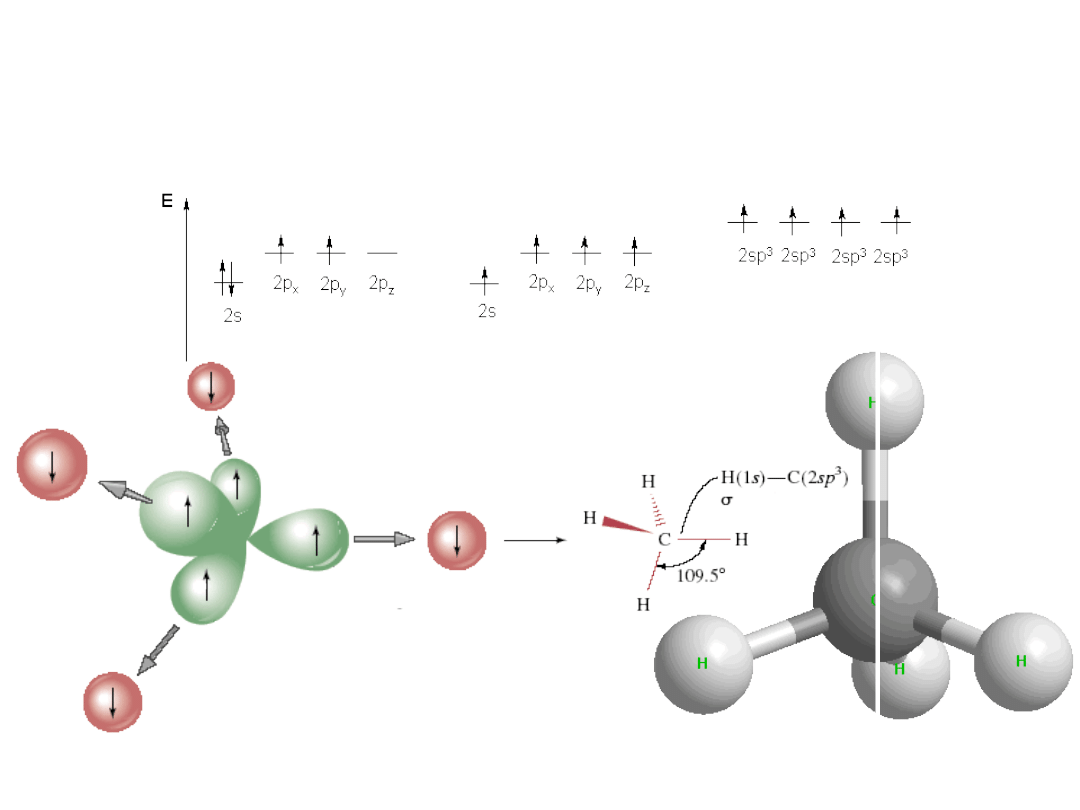
Wiązania chemiczne - sp
3
sp
3
_ struktura tetraedryczna
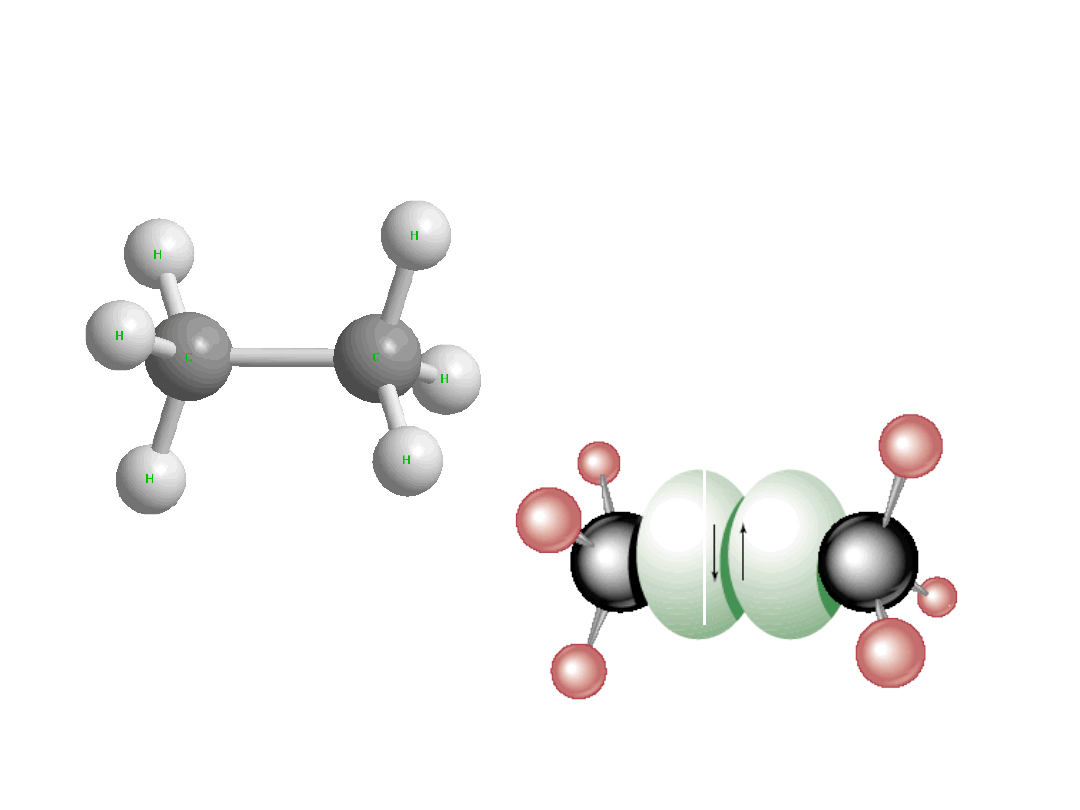
Dr K. Khachatryan
Katedra
Chemii AR
4
Wiązania chemiczne - sp
3
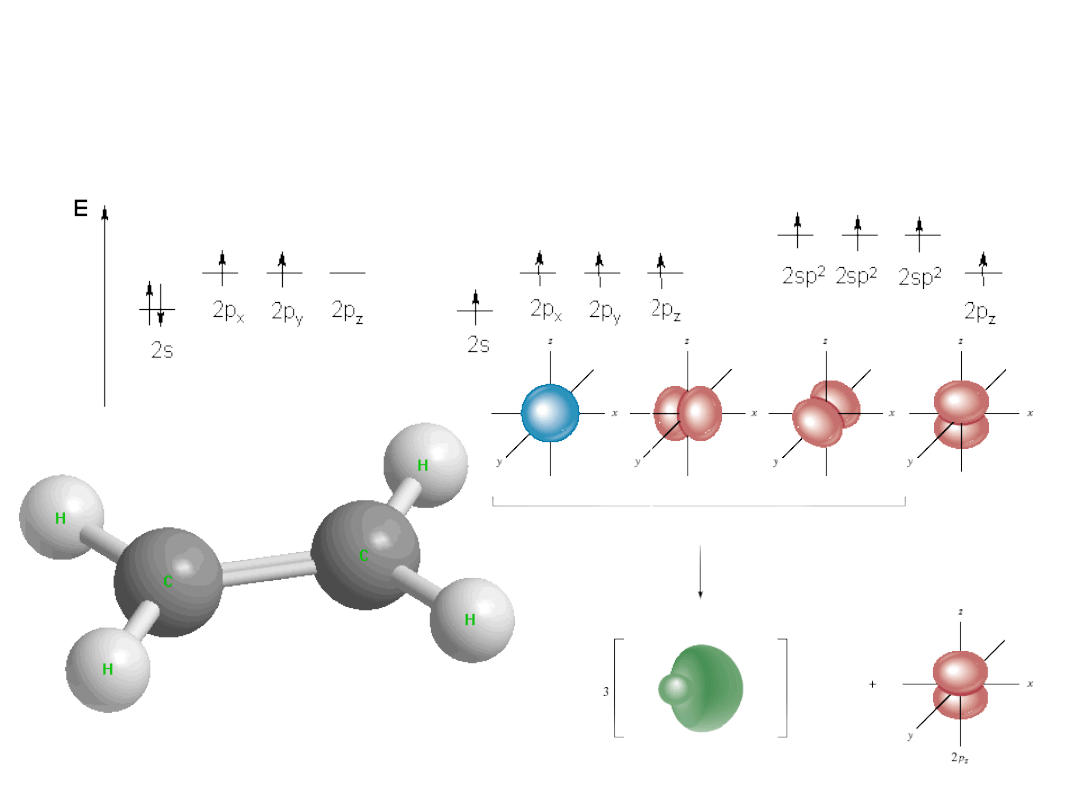
Dr K. Khachatryan
Katedra
Chemii AR
5
Wiązania chemiczne - sp
2
Dr K. Khachatryan
Katedra
Chemii AR
6
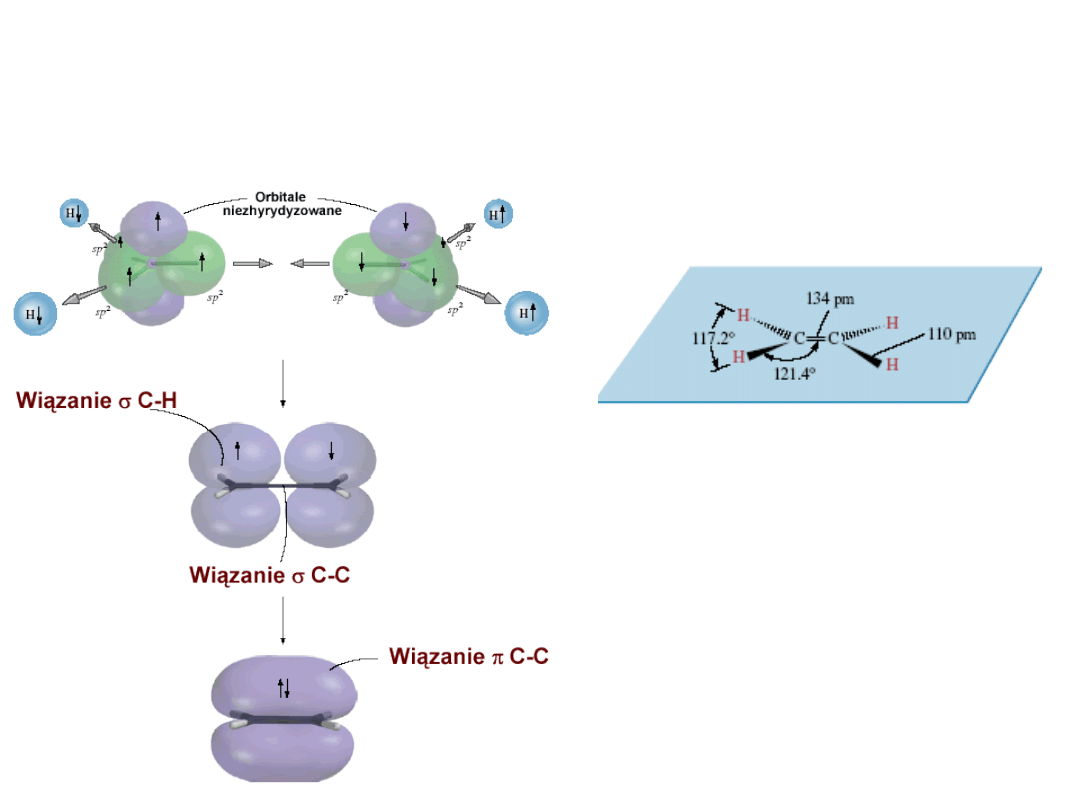
Wiązania chemiczne - sp
2
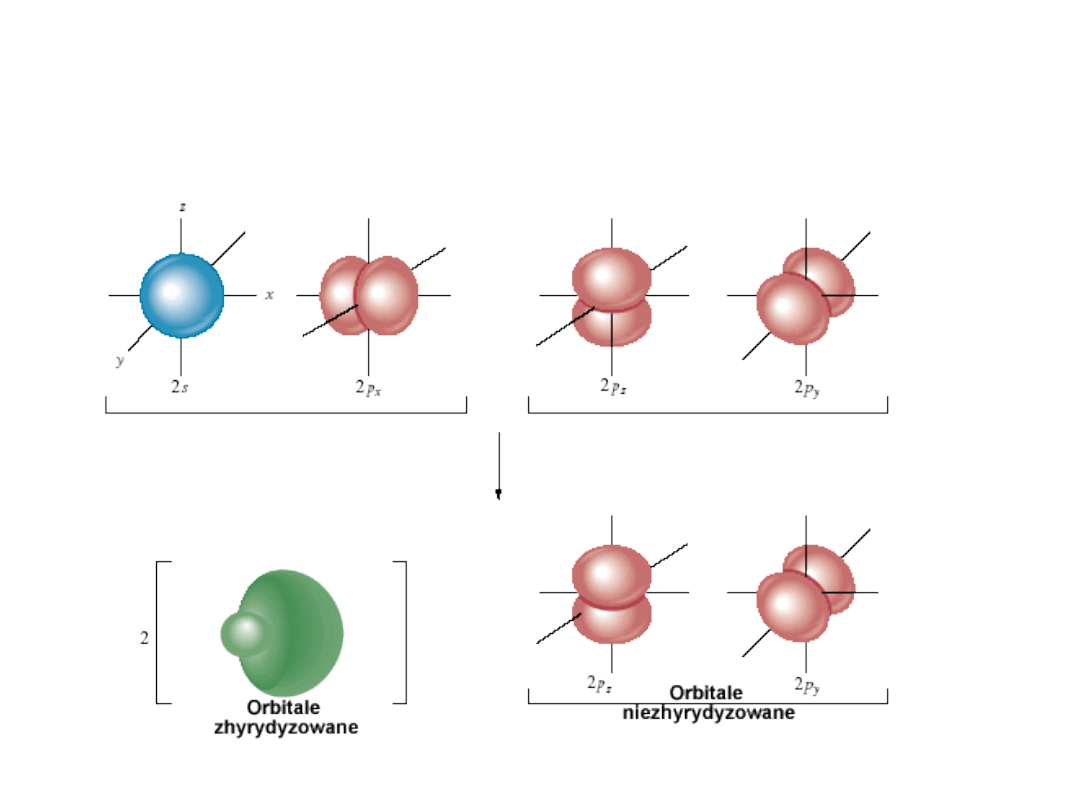
Dr K. Khachatryan
Katedra
Chemii AR
7
Wiązania chemiczne - sp
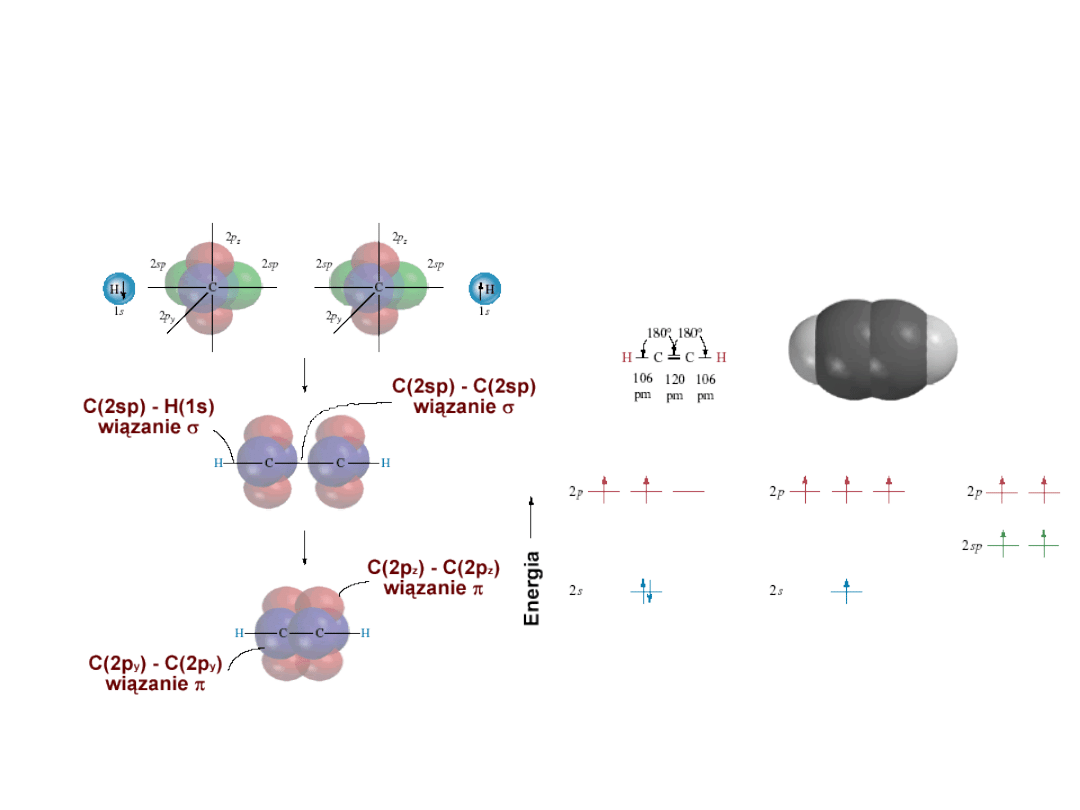
Dr K. Khachatryan
Katedra
Chemii AR
8
Wiązania chemiczne - sp
Dr K. Khachatryan
Katedra
Chemii AR
9
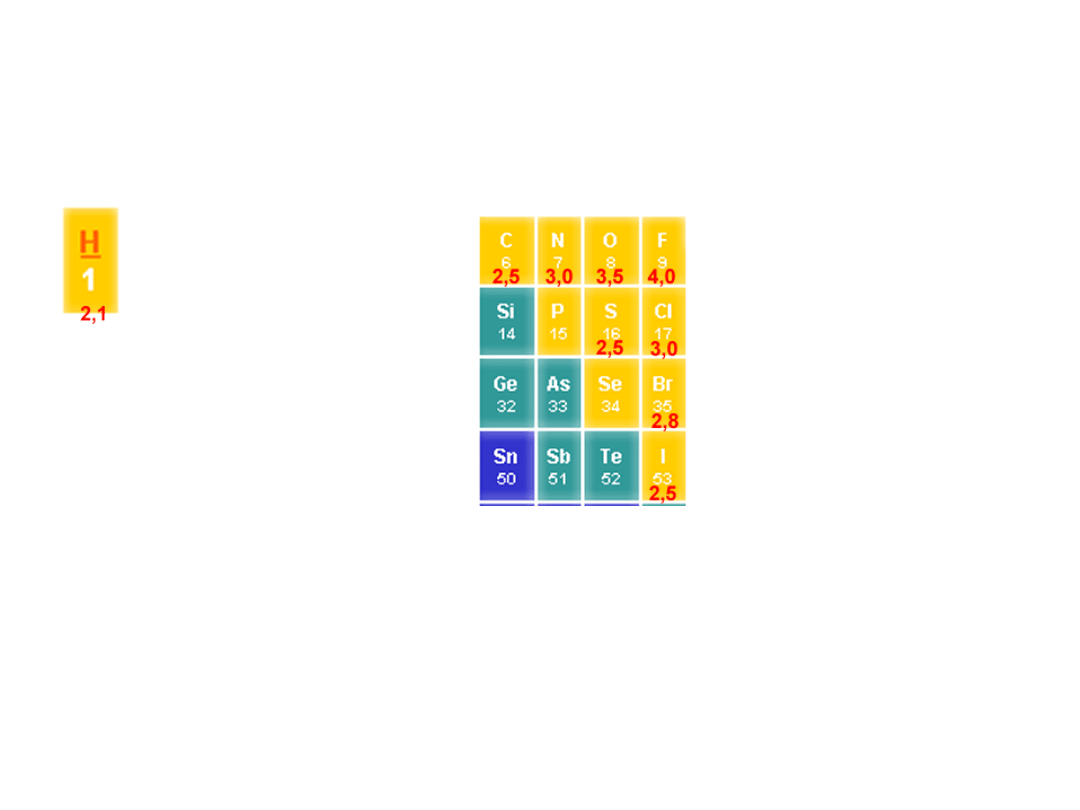
Elektroujemność, polarność
wiązań
F > O > Cl, N > Br > C, H
Dr K. Khachatryan
Katedra
Chemii AR
10
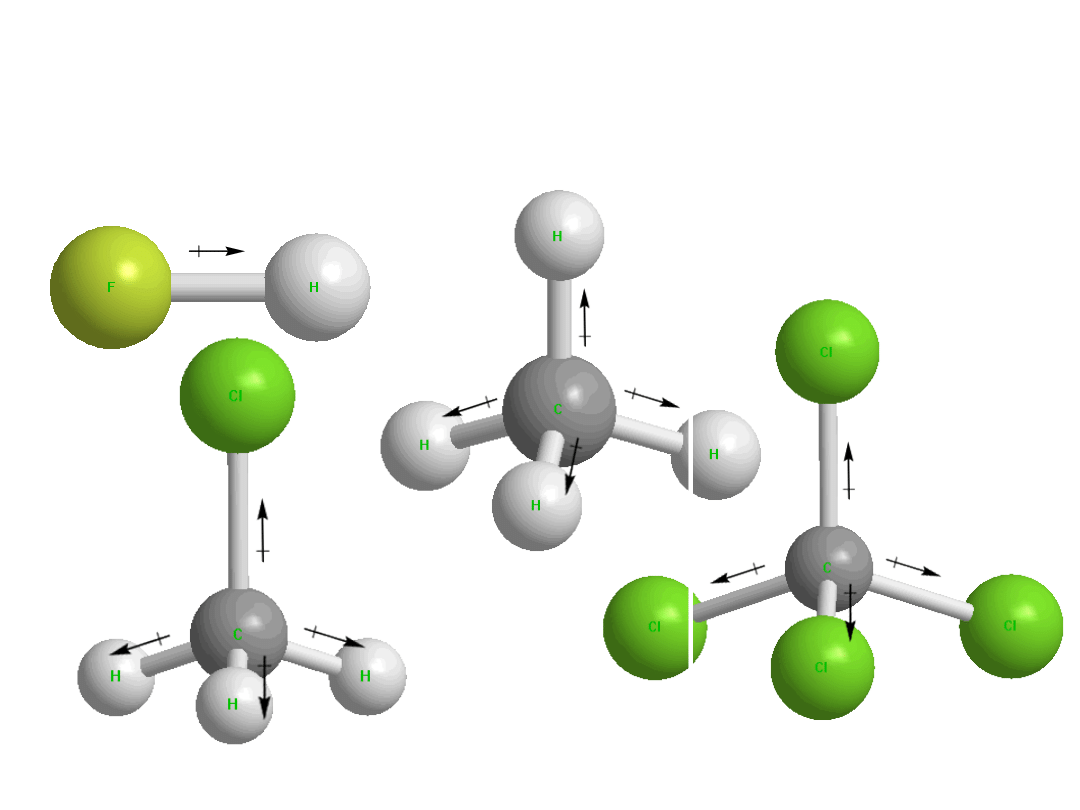
Polarność cząsteczek, moment
dipolowy

Dr K. Khachatryan
Katedra
Chemii AR
11
Struktura i właściwości fizyczne
• Temperatura topnienia
• Temperatura wrzenia
• Rozpuszczalność

Dr K. Khachatryan
Katedra
Chemii AR
12
Kwasy i zasady
• Teoria Brönsteda-Lowry’ego
• Teoria Lewisa
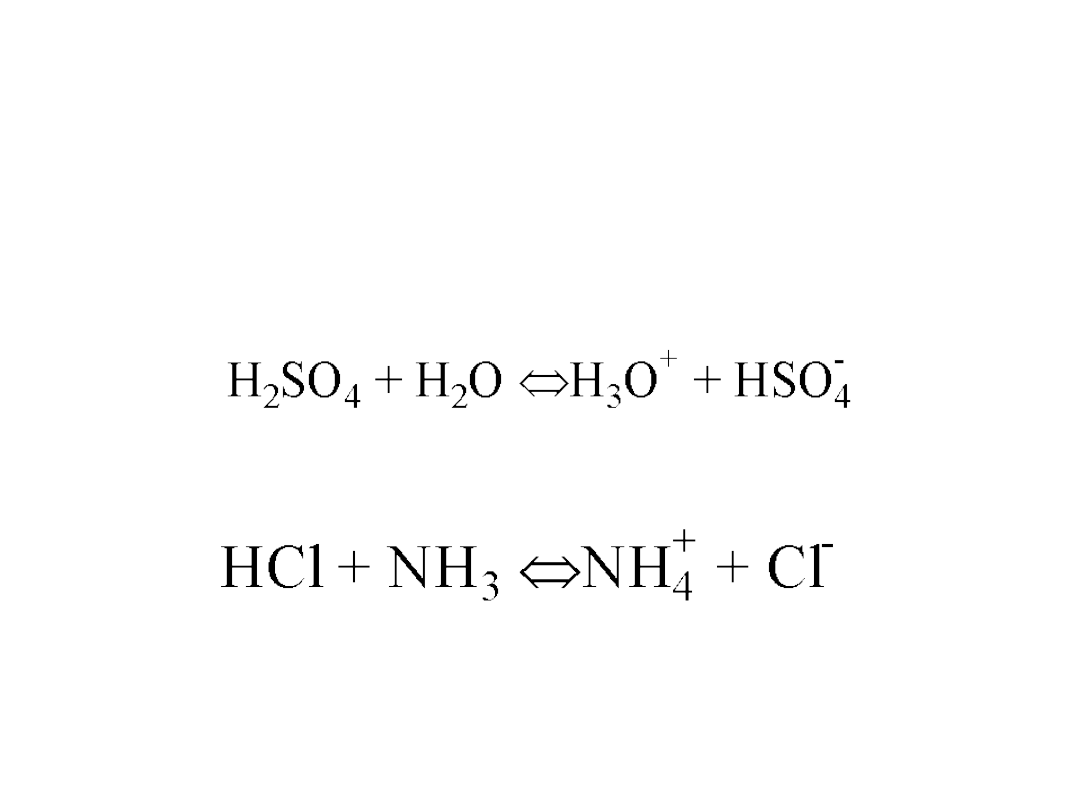
Dr K. Khachatryan
Katedra
Chemii AR
13
Teoria Brönsteda-Lowry’ego
Kwas
to substancja, która oddaje protony, a
zasada
to
związek który przyjmuje protony.
Mocniejsz
y
kwas
Mocniejsz
a
zasada
Słabszy
kwas
Słabsza
zasada
Mocniejsz
y
kwas
Mocniejsz
a
zasada
Słabszy
kwas
Słabsza
zasada
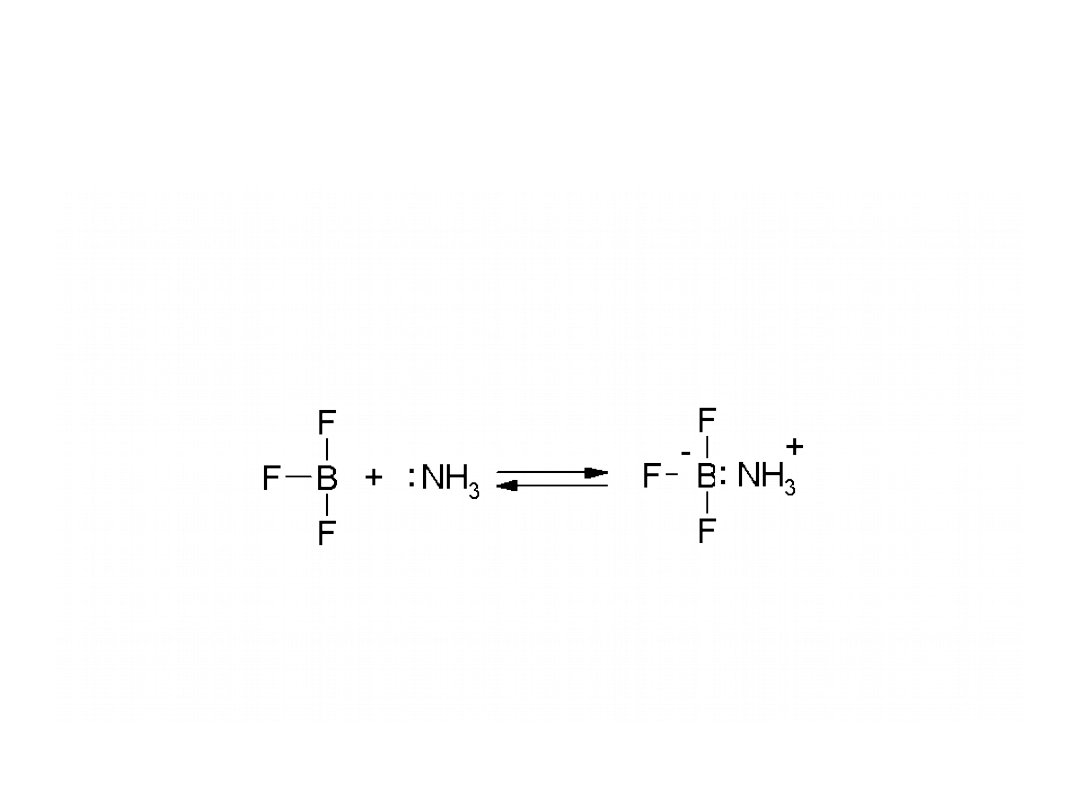
Dr K. Khachatryan
Katedra
Chemii AR
14
Teoria Lewisa
Zasada
jest substancją, która może dostarczyć pary
elektronowej do utworzenia wiązania
kowalencyjnego, a
kwas
to substancja, która może
przyjąć tą parę.

Dr K. Khachatryan
Katedra
Chemii AR
15
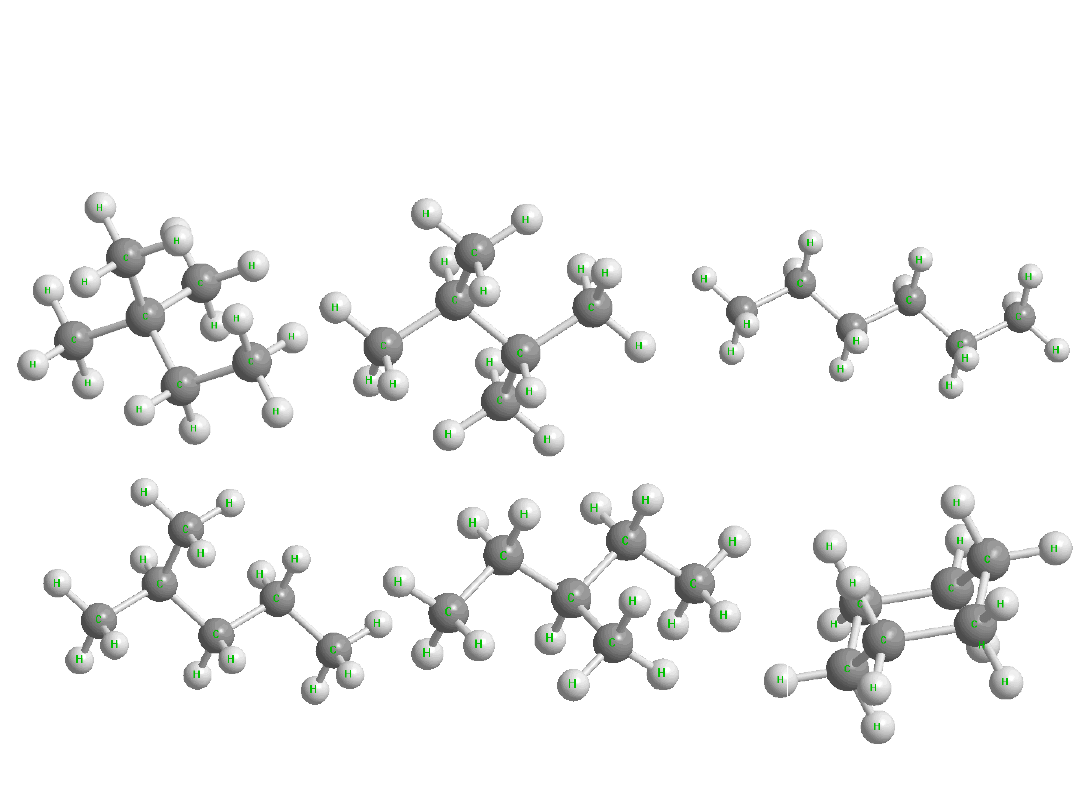
Izomeria
Różne związki o takim samym wzorze
sumarycznym nazywamy izomerami
Dr K. Khachatryan
Katedra
Chemii AR
16
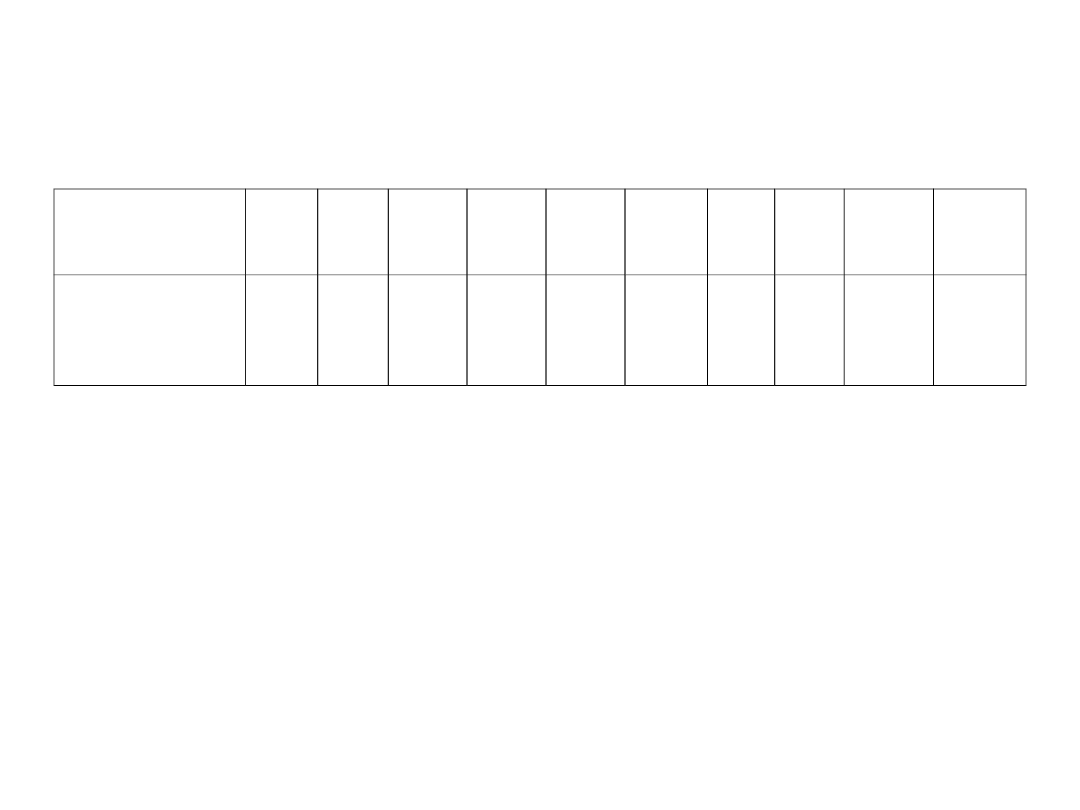
Izomery konstytucyjne
(strukturalne)
Liczba atomów
węgla
1
2
3
4
5
6
……
10
20
30
Liczba
izomerycznych
alkanów
1
1
1
2
3
5
……
75
366319
4,11
.
10
9
Dr K. Khachatryan
Katedra
Chemii AR
17
Izomery konstytucyjne
(strukturalne)
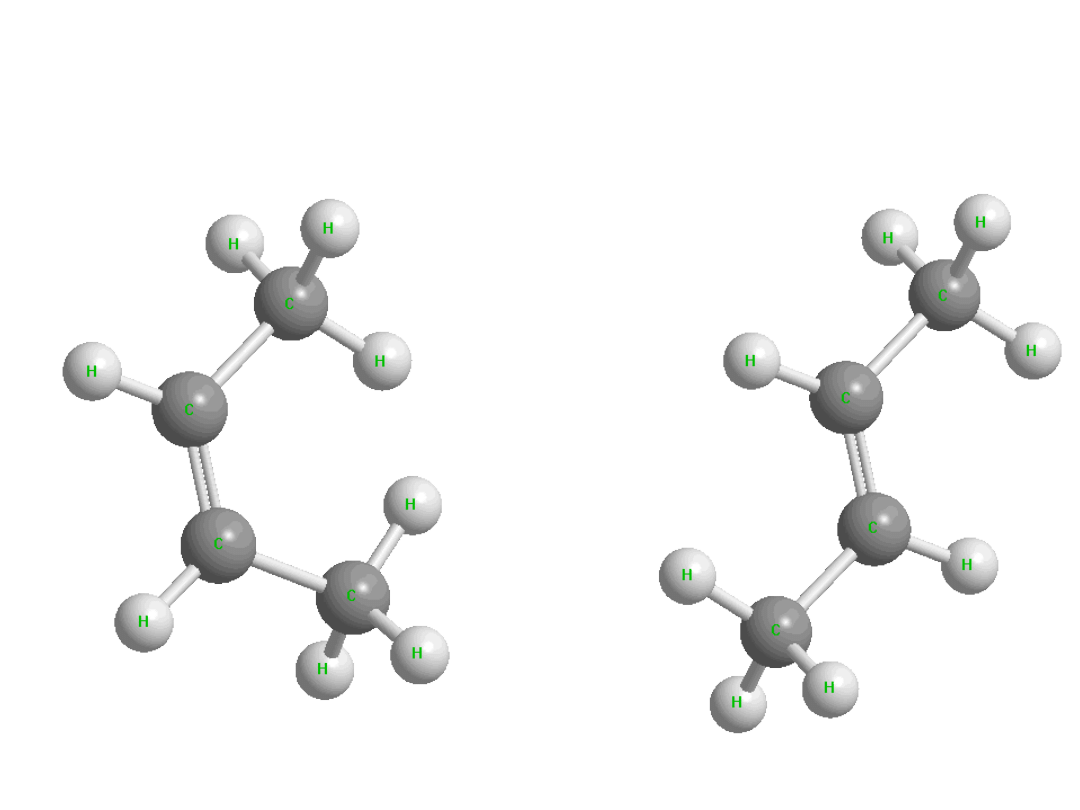
Dr K. Khachatryan
Katedra
Chemii AR
18
Stereoizomery
Dr K. Khachatryan
Katedra
Chemii AR
19
Stereoizomery
Stereoizomery
Enancjomery
Diastereoizomery
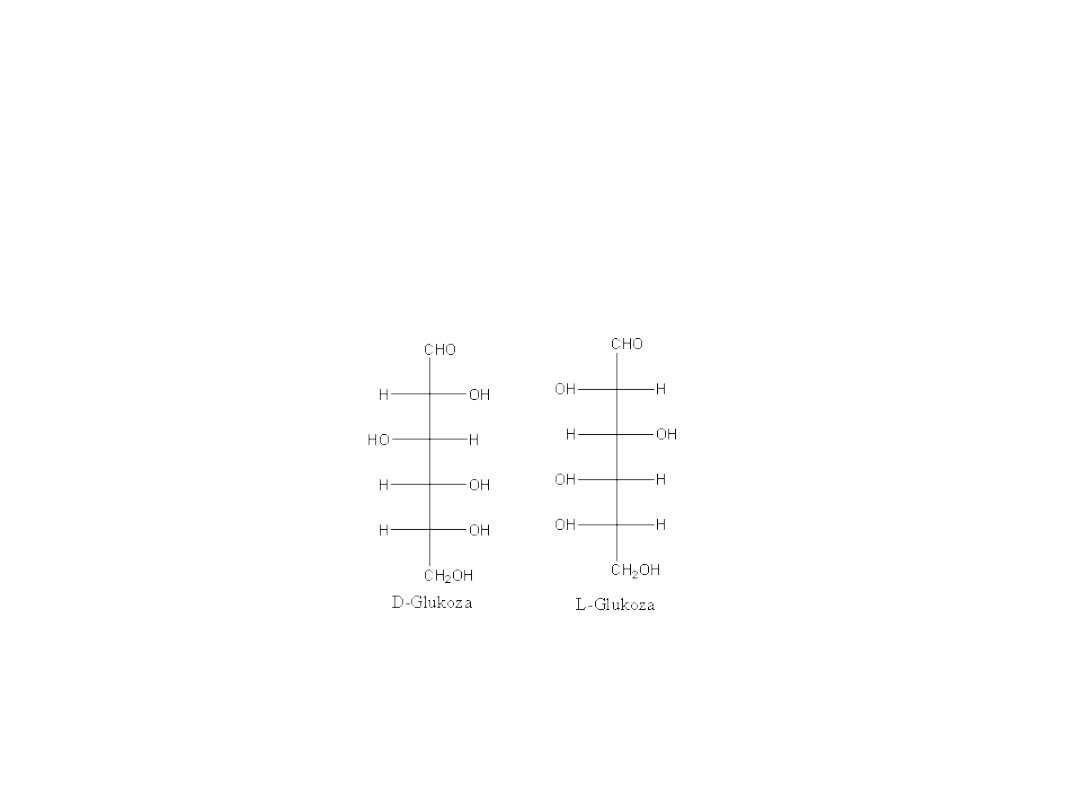
Dr K. Khachatryan
Katedra
Chemii AR
20
Enancjomery
Stereoizomery stanowiące odbicia lustrzane
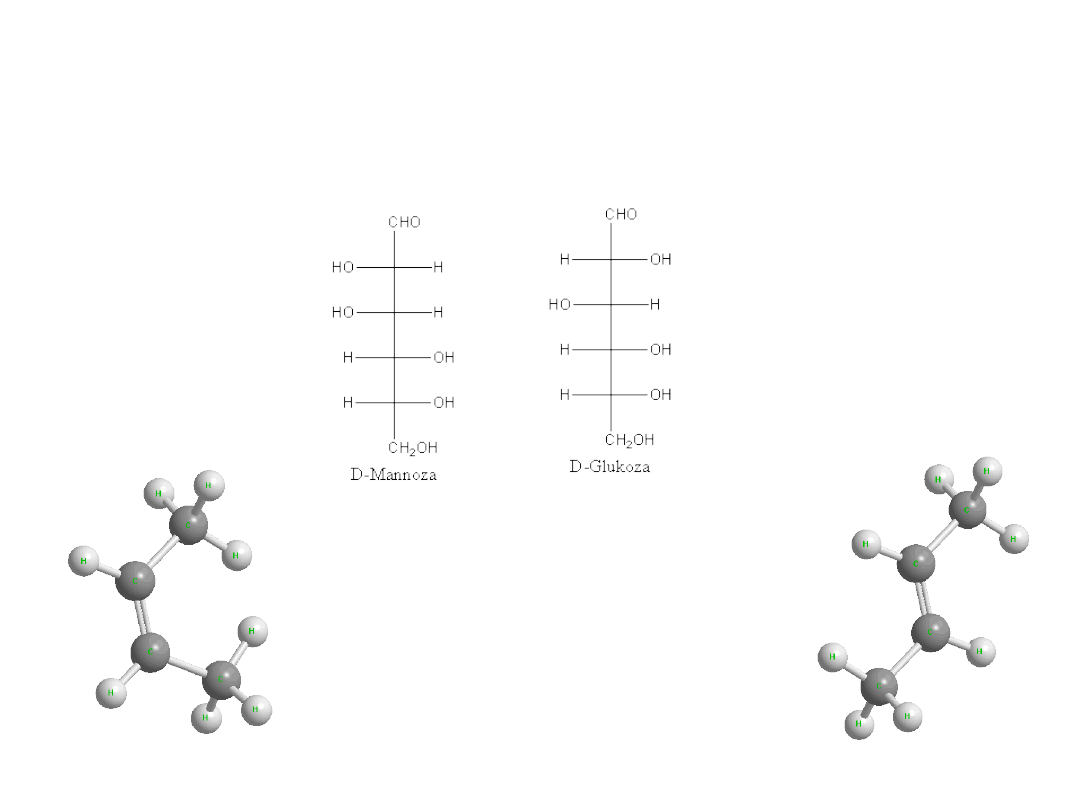
Dr K. Khachatryan
Katedra
Chemii AR
21
Diastereoizomery
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
Wyszukiwarka
Podobne podstrony:
Chemia organiczna czesc I poprawiona
chemia organiczna wykład 6
Wykład 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
CHEMIA- CHEMIA ORGANICZNA, CHEMIA
bromoacetanilid, Studia, Sprawozdania, Chemia organiczna
Przykladowy egzamin chemia organiczna - ICiP - 2010-zima. , Egzamin
I POPRAWKA EGZAMINU Z CHEMII ORGANICZNEJ, Technologia chemiczna, Chemia organiczna, 4 semestr, organ
chemia organiczna 2003 cała PDF(1)
Egzamin Chemia organiczna zestawy 1 8
więcej podobnych podstron