Prawo Hessa
Wartości ciepła reakcji U
r
lub H
r
są jednoznacznie określone
stanem układu przed rozpoczęciem i po zakończeniu reakcji,
(tj.składem jakościowym i ilościowym, temperaturą i objętością
(ciśnieniem) układu). Nie zależą od sposobu przebiegu reakcji :
substr
aty
1
H
D
���
�
produkty
pośrednie
2
H
D
���
�
produkty końcowe
H
3
Standardowym molowym ciepłem (entalpią) tworzenia związku
pod ciśnieniem l atm,
nazywa się ciepło reakcji syntezy jednego mola cząsteczek tego związku z pierwiastków (pierwiastki
w swych najtrwalszych, w danych warunkach ciśnienia i temperatury, postaciach fazowych).
H
3
= H
1
+H
2
.
o
r
i
twi
i
H
n
D
=
D
�
H
o
.
o
r
i
sp i
i
H
n
D
=-
D
�
H
o
Standardowym molowym ciepłem (entalpią) spalania
związku
nazywamy ciepło spalania 1 mola cząsteczek
tego związku w tlenie, pod ciśnieniem l atm, przy czym powstają
CO
2
, H
2
O(ciekła), SO
2
, N
2
.
.
sp i
DH
o
o
.
.
.
.
r
tw prod
twsub
H
D
= D
-
D
�
�
H
H
o
o
.
.
.
o
r
sp subs
sp prod
H
D
= D
-
D
�
�
H
H
o
o
CH
4
+ 2O
2
=CO
2
+2H
2
O
C + 2H
2
= CH
4
.
twi
DH
o
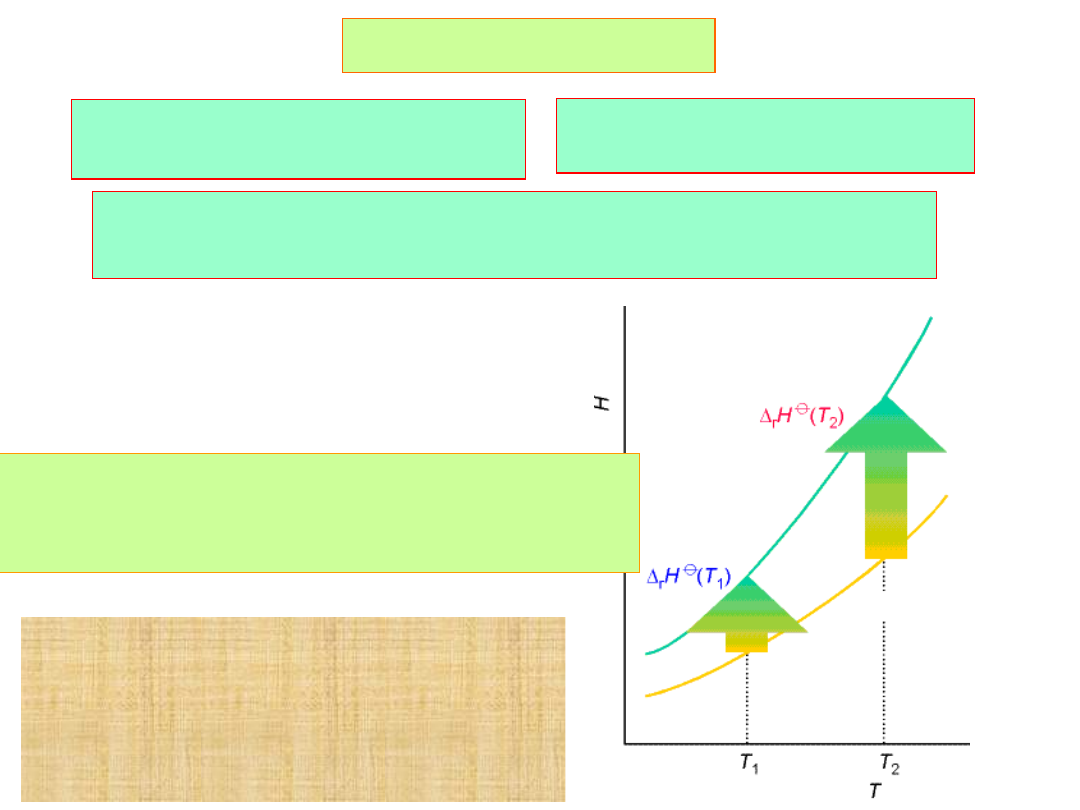
Prawa Kirchhoffa
2
1
2
1
,
( )
( )
d
T
o
r
r
i
p i
T
i
H T
H T
C
T
D
D
n
=
+
�
�
2
1
2
1
,
( )
( )
d
T
o
r
r
i V i
T
i
U T
U T
C
T
D
D
n
=
+
�
�
'
2
'
1
2
1
,
. .,
,
( )
( )
d
d
T
T
o
o
o
r
r
i
p i
k
p f k
i
p i
T
T
i
i
H T
H T
C
T
H
C
T
n
n
n
D
=D
+
+ D
+
�
�
�
�
-molowe ciepło przemiany
fazowej
k -tego reagenta,
T
’
-temperatura przemiany fazowej
produkty
substraty
Ze wzrostem temperatury
rośnie
entalpia
produktów i substratów,
jednakże w różnym stopniu.
. .,
o
p f k
H
D
Zmiana entalpii reakcji z
temperaturą odzwierciedla
zmiana entalpii wszystkich
reagentów.

1.Obliczyć ciepło reakcji syntezy kwasu akrylowego: (CH)
2
+CO+H
2
O
( c)
= CH
2
CHCOOH
(c )
pod ciśnieniem 1,01310
5
Pa i w temperaturze 298 K na podstawie ciepeł tworzenia oraz na podstawie
ciepeł spalania. Obliczyć również U
r
O
reakcji syntezy w 298 K.
Substancja
H
tw
o
[kJ/mol]
H
sp
o
[kJ/mol]
(CH)
2
226,90
-1300,60
CO
-110,60
-283,17
H
2
O
( c)
-286,04
0,0
CH
2
CHCOOH
( c)
-382,66
-1371,20
2.Standardowa entalpia tworzenia ciekłego metanolu wynosi 238,7 kJ/mol w temp.
298K. Znając standardowe entalpie tworzenia CO
2
(373,77kJ/mol) i H
2
O(c)
(285,77 kJ/mol) obliczyć standardową entalpię spalania tego związku.
3.Ciepła spalania 1,1-dichloroetanu (CHCl
2
CH
3
) węgla i wodoru w warunkach
standardowych
wynoszą odpowiednio: 1206,78 kJ/mol, 373,77kJ/mol i 285,77 kJ/mol, a ciepło
tworzenia
1,2-dichloroetanu (CH
2
ClCH
2
Cl) wynosi 165,7 kJ/mol. Obliczyć ciepło reakcji
izomeryzacji
2 moli 1,1-dichloroetanu do 1,2-dichloroetanu.
4.Wyznaczyć efekt cieplny reakcji CO (g) +1/2O
2
(g) CO
2
(g) w temperaturze T =
500 K
i pod ciśnieniem p
o
= 1,013105 Pa.
2
,
( )
o
twCO g
H
D
,
( )
o
twCO g
H
D
2
,
( )
o
p CO g
C
,
( )
o
p CO g
C
2
,
( )
o
p O g
C
(298K)= −393,77kJ·mol
−1
,
(298K)= −110.60kJ·mol
−1
,
= 37,1 J·K
−1
·mol
−1
,
= 29,2 J · K
−1
· mol
−1
.
= 29,4·K
−1
·mol
−1
5.Do termicznie izolowanego naczynia zawierającego 6 kg wody o temperaturze
303 K
wprowadzono 1 kg śniegu o temperaturze 263 K. Obliczyć temperaturę, jaka się
ustali w naczyniu,
jeżeli ciepło topnienia śniegu wynosi 333,5 Jg
-1
, ciepło właściwe śniegu jest
równe 2,017 Jg
-1
K
-1
a wody 4,184 Jg
-1
K
-1
.

6.Standardowa entalpia tworzenia ciekłej wody w temperaturze 298 K jest równa –
285,9kJmol
–1
,
standardowa entalpia parowania w temperaturze wrzenia (373 K) 40,66 kJmol
–1
,
molowe pojemności cieplne wody ciekłej i pary wodnej można przedstawić
wyrażeniami:
2 (c)
2 (g)
1
1
3
1
1
, H O
, H O
75,15 J K
mol ,
30,13 11,30 10
J K
mol
o
o
p
p
C
C
T
-
-
-
-
-
=
� �
=
+
�
� �
Obliczyć standardową entalpię tworzenia pary wodnej w temperaturze 298 K
7.Przeciętny człowiek w ciągu doby w wyniku przemian metabolicznych wytwarza
około 10MJ ciepła. Zakładając, że ciało ludzkie o masie 65 kg jest układem
izolowanym i ma pojemność cieplną wody
(1 cal/gK), oszacuj, o ile wzrosłaby jego temperatura. Ciało ludzkie jest w
rzeczywistości układem otwartym, a strata ciepła odbywa się głównie przez
odparowanie wody.
Jaka masa wody musi ulec odparowaniu każdej doby, aby utrzymać stałą
temperaturę ciała?
H
o
,par
(H
2
O)=2427 kJ/kg.
8.Obliczyć ciepło, pracę, U i H w procesie ogrzania 2 moli CS
2
od 0 do 100
o
C pod
stałym
ciśnieniem równym p
o
, zakładając niezależność objętości fazy ciekłej od
temperatury i traktując
fazę gazową jako gaz doskonały.CS
2
wrze w temperaturze 319,4 K, zaś H
o
par
w
temperaturze
wrzenia wynosi 26,77 kJ/mol. Przyjąć, że:
2
(
, ) 75,65 /
o
p
C CS c
J mol K
=
�
3
5
2
2
(
, ) 52,1 6,7 10
7,53 10
/
o
p
C CS g
T
T J mol K
-
-
=
+
�
-
�
�
9.Obliczyć standardową entalpię tworzenia KBr w 298 K znając efekty cieplne pod
stałym ciśnieniem
następujących reakcji w tej temperaturze:
a) H
2
(g) + Br
2
(g) = 2HBr(g) H
a
0
= 64,4 kJ
b) K(s) + H
2
O(c) = KOH(aq) +1/2 H
2
(g) H
b
0
= 182,7 kJ
c) KOH(aq) + HBr(aq) = KBr (aq) + H
2
O(c) H
c
0
= 55,0 kJ
Ciepła rozpuszczania KBr i HBr wynoszą odpowiednio 21,0 i –83,8 kJ/mol a ciepło
parowania bromu
jest równe 31,2 kJ/mol.
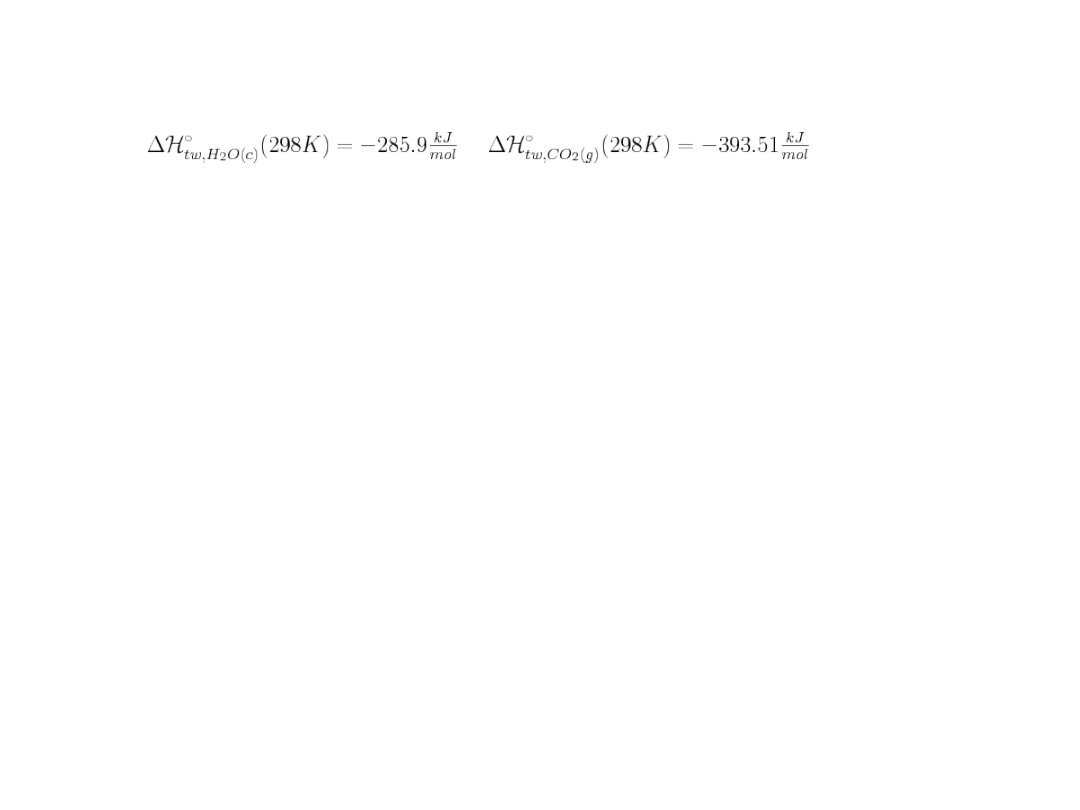
10.W wyniku spalenia w bombie kalorymetrycznej (w stałej objętości) 1 g
związku organicznego
(ciekłego) o wzorze sumarycznym C
6
H
12
w temperaturze 25
o
Cwydzieliło się 46,59
kJ ciepła.
Produktami reakcji były wyłącznie H
2
O(c) i CO
2
. Znając wartości standardowych
entalpii
tworzenia
obliczyć standardową entalpię tworzenia tego związku.

o
o
r
sp,
( 1371,2 1300,6 283,17)
212,57 /
i
i
i
H
H
kJ mol
n
D
=-
D
=- -
+
+
=-
�
o
o
r
tw,
( 382,66 226,9 110,6 286,04)
212,92 /
i
i
i
H
H
kJ mol
n
D
=
D
=+-
-
+
+
=-
�
1.Obliczyć ciepło reakcji syntezy kwasu akrylowego: (CH)
2
+CO+H
2
O
( c)
= CH
2
CHCOOH
(c )
pod ciśnieniem 1,01310
5
Pa i w temperaturze 298 K na podstawie ciepeł tworzenia
oraz na podstawie ciepeł spalania:
H
tw
o
ciepła tworzenia [kJ/mol]
H
sp
o
ciepła spalania [kJ/mol]
(CH)
2
226,90 - 1300,60
CO -110,60 - 283,17
H
2
O
( c)
- 286,04 0,0
CH
2
CHCOOH
( c)
- 382,66 - 1371,20
Obliczyć również U
r
O
reakcji syntezy w 298 K.
Odp.:212,92 kJ/mol, 212,57 kJ/mol

,
393,77 /
o
sp C
H
kJ mol
D
=-
2
,
285,77 /
o
sp H
H
kJ mol
D
=-
3
,
?
o
sp CH OH
H
D
=
3
,
238,7 /
o
twCH COOH
H
kJ mol
D
=-
(
)
3
2
3
o
o
o
tw,i
sp,
,
,
,
tw,CH
2
o
o
o
i
i
sp CH OH
sp C
sp H
OH
i
H
H
H
H
H
H
n
D
=-
D
=- D
- D
- D
=D
�
3
3
2
o
,
tw,CH
,
,
2
238,7 393,77 2 285,77
726,61 /
o
o
o
sp CH OH
OH
sp C
sp H
H
H
H
H
kJ mol
D
=- D
+D
+ D
=
-
- �
=-
2.Standardowa entalpia tworzenia ciekłego metanolu wynosi 238,7 kJ/mol w temp. 298K.
Znając standardowe entalpie tworzenia CO
2
(373,77kJ/mol) i H
2
O
(c)
(285,77 kJ/mol)
obliczyć standardową entalpię spalania tego związku. Odp.: 726,61 kJ/mol
H
2
+ ½O
2
→
H
2
O
(c)
CH
3
OH + 1½O
2
→ CO
2
+ 2H
2
O
(c
)
C + 2H
2
+½O
2
→
CH
3
OH
C + O
2
→ CO
2
Rozwiązanie:

2
2
2
3
o
o
o
r
tw,CH Cl-CH Cl
tw,CHCl -CH
H
H
H
D
=D
- D
2
3
,
1206,78 /
o
sp CHCl CH
H
kJ mol
-
D
=-
2
,
285,77 /
o
sp H
H
kJ mol
D
=-
,
393,77 /
o
sp C
H
kJ mol
D
=-
2
3
2
,
,
,
,
2
2
[1206,78 2 (393,77 285,77)]
152,3 /
o
tw
sp CHCl CH
sp C
sp H
H
H
H
H
kJ mol
-
D
=- D
+ D
+ D
=
- �
+
=-
2
2
2
3
o
o
o
r
tw,CH Cl-CH Cl
tw,CHCl -CH
165,7 152,3
13,4 /
H
H
H
kJ mol
D
=D
- D
=-
+
=-
3.Ciepła spalania 1,1-dichloroetanu (CHCl
2
CH
3
) węgla i wodoru w warunkach standardowych
wynoszą odpowiednio: 1206,78 kJ/mol, 373,77kJ/mol i 285,77 kJ/mol, a ciepło tworzenia
1,2-dichloroetanu (CH
2
ClCH
2
Cl) wynosi 165,7 kJ/mol. Obliczyć ciepło reakcji izomeryzacji
2 moli 1,1-dichloroetanu do 1,2-dichloroetanu.Odp.:26,8 kJ/mol
CHCl
2
CH
3
+ O
2
→ 2CO
2
+2H
2
O
(c)
+Cl
2
H
2
+ ½O
2
→ H
2
O
(c)
C + O
2
→ CO
2
2C + 2H
2
+Cl
2
→ CHCl
2
CH
3
Izomeryzacja 2 moli = 26,8 kJ/mol
Rozwiązanie:
CHCl
2
CH
3
→ CH
2
ClCH
2
Cl

o
g
CO
tw
H
)
(
2
,
o
g
CO
tw
H
)
(
,
o
g
CO
p
C
)
(
2
,
o
g
CO
p
C
)
(
,
o
g
O
p
C
)
(
2
,
o
o
r
tw,
i
i
i
H
H
n
D
=
D
�
2
2
1
1
o
o
o
r,
,
C d
T
T
r T
i
p,i
i
T
H
H
T
n
D
=D
+
�
�
2
500
o
3
r,
298
1
( 393,77 110,60) 10
(37,1 29,2
29,4)
284,47 /
2
T
H
dT
kJ mol
D
= -
+
� +
-
-
�
=-
�
4.Wyznaczyć efekt cieplny reakcji CO
(g)
+1/2O
2(g)
CO
2(g)
w temperaturze T = 500 K
i pod ciśnieniem p
o
= 1,01310
5
Pa.
(298K)= −393,77kJ·mol
−1
,
(298K)= −110.60kJ·mol
−1
,
= 37,1 J·K
−1
·mol
−1
,
= 29,2 J · K
−1
· mol
−1
,
= 29,4·K
−1
·mol
−1
.
Odp.: 284,47 kJ/mol
Rozwiązanie:

(
)
,
,
,
273
(
273)
(
) 0
o
o
o
o
śn p śn
śn
śn
top
śn p w
x
w p w
x
w
m C
T
m H
m C
T
m C T T
-
+ D
+
� -
+
-
=
(
)
(
)
,
,
,
,
273
273
o
o
o
o
w p w wśn
p w
śn
p śn
śn
śn
top
x
o
wśn
p w
m C T
m C
m C
T
m H
T
m
m C
+
� -
-
-
D
=
+
5. Do termicznie izolowanego naczynia zawierającego 6 kg wody o temperaturze 303 K
wprowadzono 1 kg śniegu o temperaturze 263 K. Obliczyć temperaturę, jaka się ustali w naczyniu,
jeżeli ciepło topnienia śniegu wynosi 333,5 Jg
-1
, ciepło właściwe śniegu jest równe 2,017 Jg
-1
K
-1
a wody
4,184 Jg
-1
K
-1
.
Odp.:T=286,6 K
Rozwiązanie:

2 (c)
2 (g)
1
1
3
1
1
, H O
, H O
75,15 J K
mol ,
30,13 11,30 10
J K
mol
o
o
p
p
C
C
T
-
-
-
-
-
=
� �
=
+
�
� �
298
373
)
(
2
373
298
)
373
(
,
)
(
2
)
289
(
2
,
298
,
dT
C
H
dT
C
H
H
o
g
O
H
o
K
par
o
c
O
H
o
K
O
H
tw
o
K
par
2
2
3
373
298
2
10
30
,
11
6.Standardowa entalpia tworzenia ciekłej wody w temperaturze 298 K
jest równa
–285,9kJmol
–1
,standardowa entalpia parowania w temperaturze wrzenia
(373 K) 40,66 kJmol
–1
, molowe pojemności cieplne wody ciekłej i pary
wodnej można przedstawić wyrażeniami:
Obliczyć standardową entalpię tworzenia pary wodnej w temperaturze 298 K
(wielkość rachunkową, często stosowaną w obliczeniach fizykochemicznych).
Odp.: 242,15 kJ/mol
= -285,910
3
+ 75,15 (373-298) + 40,6610
3
+
30,13(298-373) +
=242,15 kJmol
-1
Rozwiązanie:

6
3
10 10
65 10 4,184
p
Q mC T
J
T
=
D = �
= � �
D
36,77
T
K
D =
2
6
3
10 10
4,12
2427 10
H O
m
kg
kg
�
=
=
�
7. Przeciętny człowiek w ciągu doby w wyniku przemian metabolicznych wytwarza
około 10MJ ciepła. Zakładając, że ciało ludzkie o masie 65 kg jest układem izolowanym
i ma pojemność cieplną wody (1 cal/gK), oszacuj, o ile wzrosłaby jego temperatura.
Ciało ludzkie jest w rzeczywistości układem otwartym, a strata ciepła odbywa się głównie
przez odparowanie wody.
Jaka masa wody musi ulec odparowaniu każdej doby, aby utrzymać stałą temperaturę ciała?
H
o
par
(H
2
O)=2427 kJ/kg.
Odp.: T = 36,8 K, m = 4,12 kg
Rozwiązanie:

2
(
, ) 75,65 /
o
p
C CS c
J mol K
=
�
3
5
2
2
(
, ) 52,1 6,7 10
7,53 10
/
o
p
C CS g
T
T J mol K
-
-
=
+
�
-
�
�
2
2
319,4
373,15
( )
,(319,4 )
( )
273,15
319,4
o
o
o
o
CS c
par
K
CS g
H
n
C
dT n H
n
C
dT
D
=
+ D
+
�
�
(
)
3
2
2
6,7 10
373,15 319,4
2
-
�
-
5
1
1
7,53 10
373,15 319,4
�
�
�
-
�
�
�
�
3
3
65,71 10 2 8.314 373,15 59,51 10 J
U
H p V
H nRT
D =D - D =D -
=
� - �
�
=
�
3
2 8.314 373,15
6,20 10 J
6,20kJ
W
p V
nRT
=- D =-
= �
�
=-
�
=-
8. Obliczyć ciepło, pracę, U i H w procesie ogrzania 2 moli CS
2
od 0 do 100
o
C pod stałym
ciśnieniem równym p
o
, zakładając niezależność objętości fazy ciekłej od temperatury i traktując
fazę gazową jako gaz doskonały.CS
2
wrze w temperaturze 319,4 K, zaś H
o
par
w temperaturze
wrzenia wynosi 26,77 kJ/mol. Przyjąć, że:
i
Odp.:65,71 kJ, 6,20 kJ, 59,51 kJ, 65,72
kJ.
= 275,65 (319,4-273,15) + 226,7710
3
+
252,1(373,15-319,4) +2
+2
=65,71 kJ
Rozwiązanie

9.Obliczyć standardową entalpię tworzenia KBr w 298 K znając efekty cieplne pod stałym ciśnieniem
następujących reakcji w tej temperaturze:
a) H
2 (g)
+ Br
2 (g)
= 2HBr
(g)
H
a
0
= 64,4 kJ
b) K
(s)
+ H
2
O
(c)
= KOH
(aq)
+1/2 H
2 (g)
H
b
0
= 182,7 kJ
c) KOH
(aq)
+ HBr
(aq)
= KBr
(aq)
+ H
2
O
(c)
H
c
0
= 55,0 kJ
Ciepła rozpuszczania KBr i HBr wynoszą odpowiednio 21,0 i –83,8 kJ/mol a ciepło parowania bromu
jest równe 31,2 kJ/mol. Odp.:
o
s
KBr
tw
H
)
(
,
d) KBr
(s)
KBr
(aq)
H
d
o
= 21,0 kJ/mol
e) HBr
(g)
HBr
(aq)
H
e
o
= 83,8 kJ/mol
f) Br
2(c)
Br
2(g)
H
f
o
= 31,2 kJ/mol
Nr reakcji
Strona lewa
Strona prawa
+ b
K
(s)
+ H
2
O
(c)
KOH
(aq)
+1/2 H
2 (g)
+½ f
½Br
2(c)
½ Br
2(g)
d
KBr
(aq)
KBr
(s)
+½ a
½H
2 (g)
+ ½Br
2 (g)
HBr
(g)
+ c
KOH
(aq)
+ HBr
(aq)
KBr
(aq)
+ H
2
O
(c)
+ e
HBr
(g)
HBr
(aq)
K
(s)
+ ½Br
2(c)
KBr
(s)
= 359,1 kJmol-1
Reakcja tworzenia: x) K(s) + ½Br2(c)
KBr(s)
Sumowanie reakcji:
,
( )
( )
( )
( )
( ) ,
( )
( )
( )
1
1
2
2
o
o
o
o
o
o
o
tw KBr s
b
f
d
a tw HBr g
c
e
H
H
H
H
H
H
H
D
=D
+ D
- D
+ D
+D
+D
182,7 + ½31,2 21,0 + ½(64,4) + (55,0) + (83,8) = 359,1kJ/mol
=

6
12( )
2( )
2( )
2 ( )
9
6
6
c
g
g
c
C H
O
CO
H O
+
=
+
3
i
i
n =-
�
6 12
6 12
,
C H
o
sp C H
q M
U
m
�
D
=-
(
)
6 12
6 12
2
2
,
,
( )
,
6
C H
o
o
o
twC H
i
tw H O c
twCO
i
q M
H
RT
H
H
m
n
�
�
�
D
=- -
+
- �D
+D
�
�
�
�
�
(
)
6 12
3
,
6
3
6
3
46590 84
8,314 298,15( 3) 6
285,9 393,51 10
1,0
3,91356 10 7,4327 10 4,0765 10
155,5 10 /
o
twC H
H
J mol
�
�
�
D
=- -
+
�
- - �-
-
�
=
�
�
�
�
�
�
- -
� -
� +
�
=
�
�
�
10.W wyniku spalenia w bombie kalorymetrycznej (w stałej objętości) 1 g związku organicznego
(ciekłego) o wzorze sumarycznym C
6
H
12
w temperaturze 25
o
Cwydzieliło się 46,59 kJ ciepła.
Produktami reakcji były wyłącznie H
2
O
(c)
i CO
2.
Znając wartości standardowych entalpii
tworzenia
Odp.: -155,5 kJ/mol
obliczyć standardową entalpię tworzenia tego związku.
Rozwiązanie
( )
2( )
6
12( )
6
6
s
g
c
C
H
C H
+
=
6 12
6 12
6 12
,
,
C H
o
o
sp C H
sp C H
i
i
i
i
q M
H
U
RT
RT
m
n
n
�
D
=D
+
=-
+
�
�
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
Wyszukiwarka
Podobne podstrony:
14 15 Obróbka cieplnaid 15624 ppt
3 TEMPERATURA I EFEKT CIEPLNY SPALANIA 32
ST4 2010 Cieplne ppt
03 Sejsmika04 plytkieid 4624 ppt
Choroby układu nerwowego ppt
10 Metody otrzymywania zwierzat transgenicznychid 10950 ppt
10 dźwigniaid 10541 ppt
03 Odświeżanie pamięci DRAMid 4244 ppt
Prelekcja2 ppt
2008 XIIbid 26568 ppt
WYC4 PPT
rysunek rodziny ppt
więcej podobnych podstron