
MODYFIKACJA
MODYFIKACJA
FIZYCZNA I
FIZYCZNA I
CHEMICZNA
CHEMICZNA
BIAŁEK
BIAŁEK

Denaturacja
Denaturacja
Denaturacją białka możemy przeprowadzić metodami
Denaturacją białka możemy przeprowadzić metodami
fizycznymi lub chemicznymi, zmian w strukturze białka,
fizycznymi lub chemicznymi, zmian w strukturze białka,
które prowadza do mniejszej lub większej utraty
które prowadza do mniejszej lub większej utraty
aktywności biologicznej białka, przy czym jego struktura
aktywności biologicznej białka, przy czym jego struktura
pierwszorzędowa nie zostaje zmieniona. Podczas
pierwszorzędowa nie zostaje zmieniona. Podczas
denaturacji w dużej mierze zniszczeniu ulegają wiązania
denaturacji w dużej mierze zniszczeniu ulegają wiązania
wodorowe, a w obecności odczynników redukcyjnych
wodorowe, a w obecności odczynników redukcyjnych
rozszczepieniu ulegają wiązania disiarkowego. Często
rozszczepieniu ulegają wiązania disiarkowego. Często
denaturacja jest odwracalna i po usunięciu czynnika
denaturacja jest odwracalna i po usunięciu czynnika
denaturującego białko wraca do pierwotnej postaci.
denaturującego białko wraca do pierwotnej postaci.
Proces ten nazywa się renaturacją. Renaturacja jest też
Proces ten nazywa się renaturacją. Renaturacja jest też
możliwa w przypadku denaturacji redukcyjnej. Podczas
możliwa w przypadku denaturacji redukcyjnej. Podczas
denaturacji zachodzą takie zmiany jak: zmniejszenie
denaturacji zachodzą takie zmiany jak: zmniejszenie
rozpuszczalności, może się w wyniku wyeksponowania
rozpuszczalności, może się w wyniku wyeksponowania
nowych zjonizowanych grup przesunąć pH punktu
nowych zjonizowanych grup przesunąć pH punktu
izoelektrycznego. Rozwinięcie łańcucha może prowadzić
izoelektrycznego. Rozwinięcie łańcucha może prowadzić
do zwiększenia się lepkości, a także absorpcji w
do zwiększenia się lepkości, a także absorpcji w
nadfiolecie. Obserwuje się też procesy agregacji i
nadfiolecie. Obserwuje się też procesy agregacji i
wytrącania, co jest związane z ze zmianą stopnia
wytrącania, co jest związane z ze zmianą stopnia
hydratacji i rozpuszczalności białek, a także zmianami w
hydratacji i rozpuszczalności białek, a także zmianami w
mostkach disiarkowych.
mostkach disiarkowych.

•
Fizycznymi metodami denaturacji białek
Fizycznymi metodami denaturacji białek
są:
są:
Silne mieszanie, ogrzewanie, naświetlanie
Silne mieszanie, ogrzewanie, naświetlanie
promieniami UV, rentgenowskimi lub
promieniami UV, rentgenowskimi lub
działanie ultradźwiękami.
działanie ultradźwiękami.
•
Denaturacja chemiczna zachodzi pod
Denaturacja chemiczna zachodzi pod
wpływem takich związków jak:
wpływem takich związków jak:
Roztwór mocznika (6-8 mol/dm3) lub
Roztwór mocznika (6-8 mol/dm3) lub
guanidyny (4 mol/dm3), na skutek działania
guanidyny (4 mol/dm3), na skutek działania
kwasów lub zasad (pH poniżej 3 lub powyżej
kwasów lub zasad (pH poniżej 3 lub powyżej
9), na skutek działania detergentów,
9), na skutek działania detergentów,
roztworów soli ciężkich lub niektórych
roztworów soli ciężkich lub niektórych
substancji organicznych takich jak: aceton,
substancji organicznych takich jak: aceton,
benzen, formaldehyd, benzyna. Poszczególne
benzen, formaldehyd, benzyna. Poszczególne
białka różnią się zdolnością do denaturacji.
białka różnią się zdolnością do denaturacji.

Hydroliza
Hydroliza
•
Hydroliza białek polega na depolimeryzacji białek na
Hydroliza białek polega na depolimeryzacji białek na
poszczególne aminokwasy. Hydrolizę białek można
poszczególne aminokwasy. Hydrolizę białek można
przeprowadzać na trzy sposoby: pod wpływem
przeprowadzać na trzy sposoby: pod wpływem
kwasu, zasady lub enzymu.
kwasu, zasady lub enzymu.
Hydroliza kwasowa polega na ogrzewaniu białka w
Hydroliza kwasowa polega na ogrzewaniu białka w
roztworze HCl o stężeniu 2 mol lub roztworze H2SO4
roztworze HCl o stężeniu 2 mol lub roztworze H2SO4
o stężeniu 4 mol przez 18-24 h. Jednak w warunkach
o stężeniu 4 mol przez 18-24 h. Jednak w warunkach
tych całkowitemu rozkładowi ulega tryptofan.
tych całkowitemu rozkładowi ulega tryptofan.
Podczas hydrolizy zasadowej najczęściej ogrzewa się
Podczas hydrolizy zasadowej najczęściej ogrzewa się
białko z NaOH o stężeniu 2 mol. Metoda ta jest
białko z NaOH o stężeniu 2 mol. Metoda ta jest
praktycznie nie stosowana, ponieważ zupełnie
praktycznie nie stosowana, ponieważ zupełnie
niszczy argininę, cysteinę i treoninę.
niszczy argininę, cysteinę i treoninę.
Najlepszą metodą hydrolizy białek jest hydroliza
Najlepszą metodą hydrolizy białek jest hydroliza
enzymatyczna, gdyż zniszczeniu nie ulegają żadne
enzymatyczna, gdyż zniszczeniu nie ulegają żadne
aminokwasy. Wadą tej metody jest powolność
aminokwasy. Wadą tej metody jest powolność
procesu, a co za tym idzie długi czas
procesu, a co za tym idzie długi czas
depolimeryzacji białka.
depolimeryzacji białka.
Metoda hydrolizy enzymatycznej znalazła
Metoda hydrolizy enzymatycznej znalazła
zastosowanie w określaniu sekwencji białek.
zastosowanie w określaniu sekwencji białek.

Reakcja plasteinowa
Reakcja plasteinowa
Kazeinę enzymatyczną wykorzystuje się do
Kazeinę enzymatyczną wykorzystuje się do
przekształcania białek w reakcji polegającej na
przekształcania białek w reakcji polegającej na
amidowym wiązaniu pożądanych reszt
amidowym wiązaniu pożądanych reszt
aminokwasów do peptydów hydrolizatu białkowego.
aminokwasów do peptydów hydrolizatu białkowego.
Za pomocą reakcji plasteinowej można z białka o
Za pomocą reakcji plasteinowej można z białka o
składzie ubogim z reszty aminokwasów
składzie ubogim z reszty aminokwasów
niezbędnych wytworzyć produkt o większej wartości
niezbędnych wytworzyć produkt o większej wartości
biologicznej. Można zmniejszyć gorzkość hydrolizatu
biologicznej. Można zmniejszyć gorzkość hydrolizatu
przez „ukrycie” hydrofobowych aminokwasów w
przez „ukrycie” hydrofobowych aminokwasów w
długich peptydach plastein. Stosując reakcję
długich peptydach plastein. Stosując reakcję
plasteinową katalizowaną papainą wobec
plasteinową katalizowaną papainą wobec
dietylowego estru kwasu glutaminowego można
dietylowego estru kwasu glutaminowego można
około dwukrotnie zmniejszyć gorzkość hydrolizatu z
około dwukrotnie zmniejszyć gorzkość hydrolizatu z
krwinek.
krwinek.
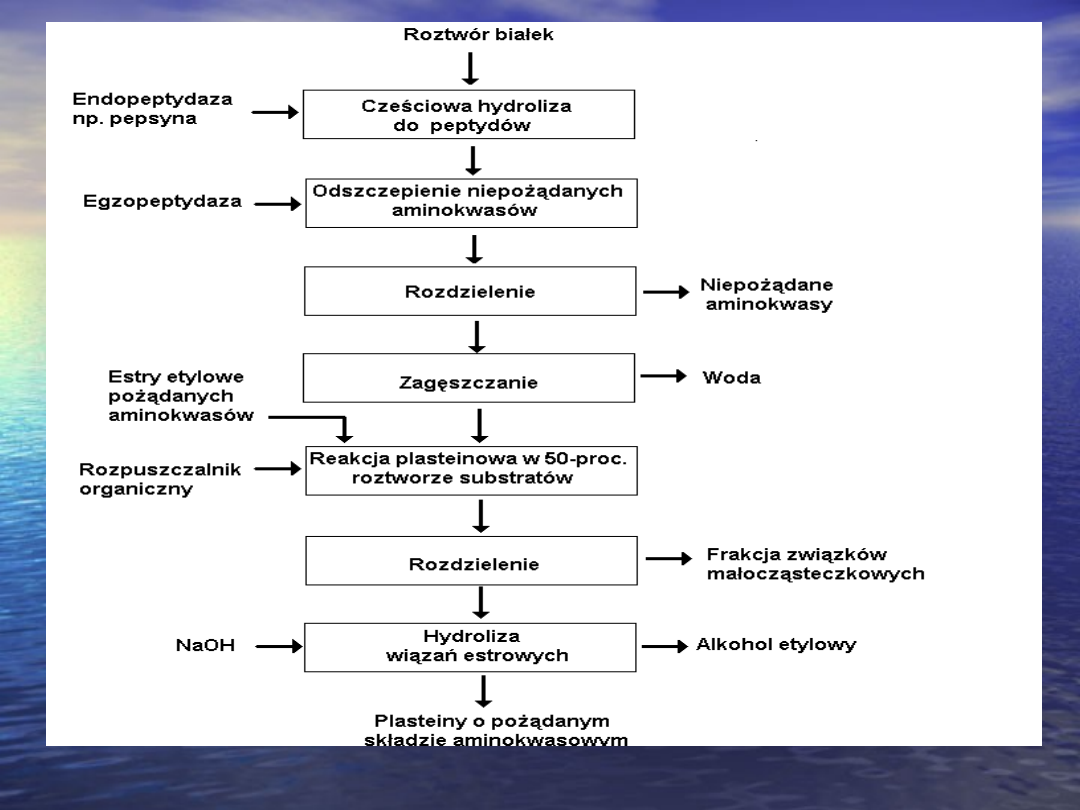
Schemat technologiczny otrzymywanie plastein.
Schemat technologiczny otrzymywanie plastein.

Reakcje katalizowane
Reakcje katalizowane
transglutaminazą
transglutaminazą
Transglutaminaza katalizuje reakcję przeniesienia acylu, w której
Transglutaminaza katalizuje reakcję przeniesienia acylu, w której
donorem jest grupa karboksyamidowa reszty glutaminy, a
donorem jest grupa karboksyamidowa reszty glutaminy, a
akceptorami mogą być pierwszorzędowe grupy aminowe w różnych
akceptorami mogą być pierwszorzędowe grupy aminowe w różnych
związkach.
związkach.
Białko – (CH2)2 – CONH2 + H2N – R→transglutaminaza→ Białko –
Białko – (CH2)2 – CONH2 + H2N – R→transglutaminaza→ Białko –
(CH2)2 – CONHR + NH3
(CH2)2 – CONHR + NH3
Białko – (CH2)2 – CONH2 + H2N – (CH2)4 – Białko→transglutaminaza→
Białko – (CH2)2 – CONH2 + H2N – (CH2)4 – Białko→transglutaminaza→
Białko – (CH2)2 – CONH(CH2)4 – Białko + NH3
Białko – (CH2)2 – CONH(CH2)4 – Białko + NH3
Białko – (CH2)2 – CONH2 + H2O →transglutaminaza→ Białko – (CH2)2 –
Białko – (CH2)2 – CONH2 + H2O →transglutaminaza→ Białko – (CH2)2 –
COOH + NH3
COOH + NH3
Jeśli akceptorem jest wolny aminokwas, następuje wzbogacenie białka
Jeśli akceptorem jest wolny aminokwas, następuje wzbogacenie białka
o ten aminokwas, natomiast reakcja z grupą aminową reszty lizyny
o ten aminokwas, natomiast reakcja z grupą aminową reszty lizyny
związanej w białku powoduje sieciowanie. Istnieje również możliwość
związanej w białku powoduje sieciowanie. Istnieje również możliwość
deaminacji reszt glutaminowych, jeśli w nieobecności wolnych grup
deaminacji reszt glutaminowych, jeśli w nieobecności wolnych grup
aminowych acylu jest woda.
aminowych acylu jest woda.

Alkilowanie
Alkilowanie
Reakcje z grupami karbonylowymi wykorzystuje się
Reakcje z grupami karbonylowymi wykorzystuje się
do modyfikowania białek. Aldehydy glutarowy i
do modyfikowania białek. Aldehydy glutarowy i
mrówkowy służą do wiązania enzymów na
mrówkowy służą do wiązania enzymów na
nośnikach. Traktowanie aldehydem mrówkowym
nośnikach. Traktowanie aldehydem mrówkowym
zapobiega nadmiernej hydrolizie i deaminacji białek.
zapobiega nadmiernej hydrolizie i deaminacji białek.
W reakcjach z innymi związkami karbonylowymi
W reakcjach z innymi związkami karbonylowymi
wytwarzanie w swerze przez bakterie kwasu
wytwarzanie w swerze przez bakterie kwasu
mlekowego tworzą się inne pochodne. W kąpielach
mlekowego tworzą się inne pochodne. W kąpielach
do utwardzania włókien przy teksturowaniu biełek
do utwardzania włókien przy teksturowaniu biełek
roślinnych stosuje się róne aldehydy, np. skrobię
roślinnych stosuje się róne aldehydy, np. skrobię
dialdehydową.
dialdehydową.
Reakcje z aldehydami i cukrami redukującymi, w
Reakcje z aldehydami i cukrami redukującymi, w
warunkach redukujących wykorzystuje się do
warunkach redukujących wykorzystuje się do
alkilowania białek.
alkilowania białek.
Do alkilowania grup aminowych, hydroksylowych,
Do alkilowania grup aminowych, hydroksylowych,
imidazolowych, tiulowych i tioeterowych w resztach
imidazolowych, tiulowych i tioeterowych w resztach
aminokwasów służą również reakcje z kwasami
aminokwasów służą również reakcje z kwasami
chlorowcooctowymi lub chlorowcoacetamidami.
chlorowcooctowymi lub chlorowcoacetamidami.

Reakcje z polisacharydami
Reakcje z polisacharydami
Kowalencyjne wiązanie z odpowiednim polisacharydem
Kowalencyjne wiązanie z odpowiednim polisacharydem
może znacznie polepszyć właściwości funkcjonalne
może znacznie polepszyć właściwości funkcjonalne
białek. Produkt reakcji Maillarda miedzy aminowymi
białek. Produkt reakcji Maillarda miedzy aminowymi
grupami reszt lizyny i redukującą grupą polisacharydu
grupami reszt lizyny i redukującą grupą polisacharydu
otrzymywany podczas 2-tygodniowego inkubowania
otrzymywany podczas 2-tygodniowego inkubowania
mieszaniny suszonej albuminy jaj z galaktomannanem
mieszaniny suszonej albuminy jaj z galaktomannanem
ma właściwości jako emulgator niż wyjściowe białko.
ma właściwości jako emulgator niż wyjściowe białko.
W kompleksach z agarem, furcelaranem, karageniną,
W kompleksach z agarem, furcelaranem, karageniną,
kwasami alginowymi i karboksymetylocelulozą
kwasami alginowymi i karboksymetylocelulozą
występują wiązania jonowe, natomiast obojętne
występują wiązania jonowe, natomiast obojętne
polisacharydy tworzą z białkami wiązania wodorowe i
polisacharydy tworzą z białkami wiązania wodorowe i
hydrofobowe.
hydrofobowe.
Reakcje białek z polisacharydami wykorzystuje się do
Reakcje białek z polisacharydami wykorzystuje się do
modyfikowania właściwości wielu przetworów
modyfikowania właściwości wielu przetworów
żywnościowych, frakcjonowania i strącania białek z
żywnościowych, frakcjonowania i strącania białek z
roztworów oraz do osadzania enzymów na nośnikach.
roztworów oraz do osadzania enzymów na nośnikach.

Acylowanie grup
Acylowanie grup
nukleofilowych w bialkach
nukleofilowych w bialkach
Szybkość acylowania zależy od własności czynnika acylującego
Szybkość acylowania zależy od własności czynnika acylującego
i grupy nukleofilowej, od pH środowiska, konformacji
i grupy nukleofilowej, od pH środowiska, konformacji
acylowanego białka oraz od obecności inhibitorów. Najłatwiej
acylowanego białka oraz od obecności inhibitorów. Najłatwiej
acylują się pierwszorzędowe grupy aminowe, zwłaszcza
acylują się pierwszorzędowe grupy aminowe, zwłaszcza
aminowe grupy reszty lizyny, grupa fenolowa trozyny.
aminowe grupy reszty lizyny, grupa fenolowa trozyny.
Jako czynnik acylujący stosuje się bezwodniki kwasowe w
Jako czynnik acylujący stosuje się bezwodniki kwasowe w
słabo zasadowym środowisku lub inne pochodne dobrane do
słabo zasadowym środowisku lub inne pochodne dobrane do
charakteru wprowadzanej grupy. Przy wyborze czynnika
charakteru wprowadzanej grupy. Przy wyborze czynnika
acylującego uwzględnia się szybkość i wydajność reakcji
acylującego uwzględnia się szybkość i wydajność reakcji
głównej.
głównej.
Poprzez acylowanie można zwiększyć lub zmniejszyć
Poprzez acylowanie można zwiększyć lub zmniejszyć
hydrofobowność białka, zmienić pI, wzbogacić cząsteczkę w
hydrofobowność białka, zmienić pI, wzbogacić cząsteczkę w
reaktywne grupy funkcyjne lub pożądane reszty
reaktywne grupy funkcyjne lub pożądane reszty
aminokwasowe włańcuchach bocznych, spowodować
aminokwasowe włańcuchach bocznych, spowodować
dodatkowe usieciowanie i zwiększyć zdolność wiązania jonów
dodatkowe usieciowanie i zwiększyć zdolność wiązania jonów
metali.
metali.

Reakcje z fosforanami
Reakcje z fosforanami
Fosforany w różnych warunkach środowiska
Fosforany w różnych warunkach środowiska
mogą reagować z białkami albo wpływać na
mogą reagować z białkami albo wpływać na
właściwości białek przez oddziaływanie na
właściwości białek przez oddziaływanie na
inne składniki żywności. Maja duże
inne składniki żywności. Maja duże
zastosowanie jako dodatki do żywności, mogą
zastosowanie jako dodatki do żywności, mogą
służyć jako dodatek buforujący,
służyć jako dodatek buforujący,
podwyższający lub obniżający pH, wiążące
podwyższający lub obniżający pH, wiążące
jony metali, zwiększyć zdolność białek do
jony metali, zwiększyć zdolność białek do
emulgowania lipidów, stabilizujące białka w
emulgowania lipidów, stabilizujące białka w
roztworach lub koagulujące, zwiększyć
roztworach lub koagulujące, zwiększyć
wodochłonność produktów mięsnych.
wodochłonność produktów mięsnych.
Fosforany, zwłaszcza polifosforany, wiążą się
Fosforany, zwłaszcza polifosforany, wiążą się
elektrostatycznie z dodatnio naładowanymi
elektrostatycznie z dodatnio naładowanymi
resztami aminokwasów. Grupy hydroksylowe,
resztami aminokwasów. Grupy hydroksylowe,
dzięki wiązaniom wodorowym z cząsteczkami
dzięki wiązaniom wodorowym z cząsteczkami
wody, tworzą warstwę hydratacyjną
wody, tworzą warstwę hydratacyjną
zapobiegającą koagulacji białek.
zapobiegającą koagulacji białek.

Modyfikacje potranslacyjne
Modyfikacje potranslacyjne
I.
I.
Obróbka proteolityczna odbywa się przy
Obróbka proteolityczna odbywa się przy
pomocy enzymów zwanych peptydazami,
pomocy enzymów zwanych peptydazami,
które są odpowiedzialne za cięcie łańcuchów
które są odpowiedzialne za cięcie łańcuchów
polipeptydowych na końcu łańcucha
polipeptydowych na końcu łańcucha
(egzopeptydazy) lub w jego środku
(egzopeptydazy) lub w jego środku
(endopeptydazy). Większość tych enzymów
(endopeptydazy). Większość tych enzymów
jest bardzo specyficzna - rozpoznają one
jest bardzo specyficzna - rozpoznają one
miejsce cięcia na podstawie sekwencji
miejsce cięcia na podstawie sekwencji
aminokwasowej. Dobrym przykładem może
aminokwasowej. Dobrym przykładem może
posłużyć proinsulina, której pierwotny
posłużyć proinsulina, której pierwotny
łańcuch polipeptydowy jest przecinany w
łańcuch polipeptydowy jest przecinany w
określonych miejscach, następnie dwa
określonych miejscach, następnie dwa
produkty są łączone za pomocą "mostków"
produkty są łączone za pomocą "mostków"
dwusiarczkowych.
dwusiarczkowych.
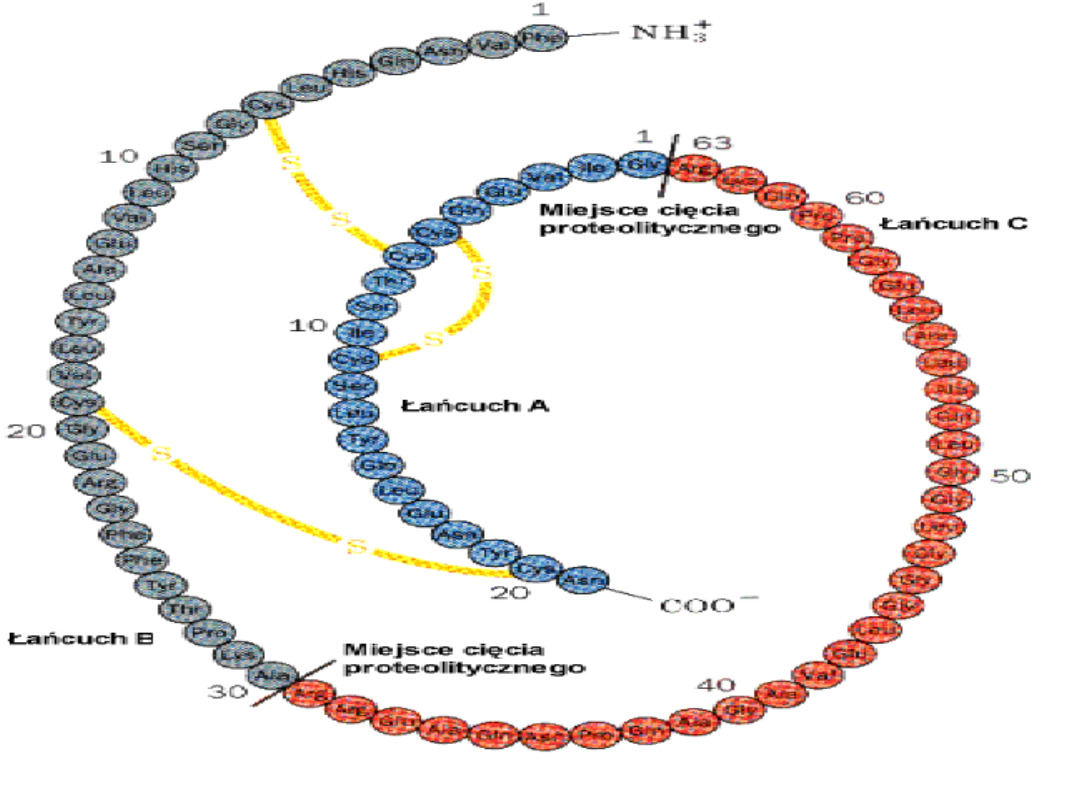

Istnieje kilka innych przykładów obróbek
Istnieje kilka innych przykładów obróbek
proteolitycznych:
proteolitycznych:
•
- aktywacja białka, poprzez wycięcie
- aktywacja białka, poprzez wycięcie
niepotrzebnego fragmentu łańcucha
niepotrzebnego fragmentu łańcucha
polipeptydowego
polipeptydowego
•
- usunięcie sekwencji liderowych
- usunięcie sekwencji liderowych
(fragmentów łańcucha, które kierują białko
(fragmentów łańcucha, które kierują białko
do odpowiedniego przedziału komórkowego)
do odpowiedniego przedziału komórkowego)
•
- w przypadku poliprotein płaszcza niektórych
- w przypadku poliprotein płaszcza niektórych
wirusów - pocięcie na fragmenty, aktywuje
wirusów - pocięcie na fragmenty, aktywuje
każdy z otrzymanych fragmentów
każdy z otrzymanych fragmentów
•
- rzadko występujący splicing polipeptydowy
- rzadko występujący splicing polipeptydowy
(podobnie jak obróbka preRNA) - wycinanie
(podobnie jak obróbka preRNA) - wycinanie
fragmentów ze środka łańcucha
fragmentów ze środka łańcucha
polipeptydowego
polipeptydowego
•
- usuwanie pierwszego podstawnika
- usuwanie pierwszego podstawnika
(metioniny lub formylometioniny)
(metioniny lub formylometioniny)
występujące u prawie 50% wszystkich białek
występujące u prawie 50% wszystkich białek

II.
II.
N-acetylacja , N-formylacja, N-
N-acetylacja , N-formylacja, N-
metylacja
metylacja
są rodzajami modyfikacji
są rodzajami modyfikacji
potranslacyjnych białek, w których
potranslacyjnych białek, w których
następuje przyłączenie do N-końca
następuje przyłączenie do N-końca
łańcucha polipeptydowego grup
łańcucha polipeptydowego grup
acetylowych (acetylacja),
acetylowych (acetylacja),
metylowych (metylacja) lub
metylowych (metylacja) lub
metioniny (formylacja).
metioniny (formylacja).
III.
III.
Glikozylacja
Glikozylacja
- w tym procesie następuje dołączenie reszt
- w tym procesie następuje dołączenie reszt
cukrowcowych do białek (Np.: białek błonowych).
cukrowcowych do białek (Np.: białek błonowych).

IV.
IV.
Hydroksylacja
Hydroksylacja
- w przypadku
- w przypadku
aminokwasów proliny i lizyny - dołączenie
aminokwasów proliny i lizyny - dołączenie
grupy -OH
grupy -OH
V.
V.
Poli (ADP)-rybozylacja
Poli (ADP)-rybozylacja
- dołączanie
- dołączanie
reszt adeninowych.
reszt adeninowych.
VI.
VI.
Fosforylacja
Fosforylacja
- aktywacja białka poprzez
- aktywacja białka poprzez
dołączenie reszty fosforanowej przez
dołączenie reszty fosforanowej przez
specyficzne enzymy - kinazy. Bardzo
specyficzne enzymy - kinazy. Bardzo
powszechnie występujące wśród białek
powszechnie występujące wśród białek
(Np.: czynniki transkrypcyjne).
(Np.: czynniki transkrypcyjne).

VII.
VII.
Defosforylacja
Defosforylacja
- deaktywacja białka
- deaktywacja białka
przez usunięcie reszty fosforanowej przez
przez usunięcie reszty fosforanowej przez
specyficzne enzymy - fosfatazy.
specyficzne enzymy - fosfatazy.
VII.
VII.
Ubikwitynacja
Ubikwitynacja
- (u organizmów
- (u organizmów
Eukariotycznych) dołączenie innego białka
Eukariotycznych) dołączenie innego białka
- ubikwityny powoduje, że białko jest
- ubikwityny powoduje, że białko jest
przeznaczone do degradacji. W procesie
przeznaczone do degradacji. W procesie
ubikwitynacji są usuwane (degradowane)
ubikwitynacji są usuwane (degradowane)
białka źle sfałdowane, wadliwe oraz takie
białka źle sfałdowane, wadliwe oraz takie
których "życie" dobiegło końca. Czas
których "życie" dobiegło końca. Czas
półtrwania białka jest zależny od rodzajów
półtrwania białka jest zależny od rodzajów
aminokwasów występujących na jego N-
aminokwasów występujących na jego N-
końcu.
końcu.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
Wyszukiwarka
Podobne podstrony:
potranslacyjna modyfikacja białek s
2014 BPEG część 9 fałdowanie i modyfikacje białek
potranslacyjna modyfikacja białek s
modyfikacje białek ptm1
7 Przedziały komórkowe biorące udział w procesie biosyntezy modyfikacji białek
Modyfikacja białek przez stres
Biotechnologiczna modyfikacja biologicznych wlasciwosci bialek zboz
Przykłady roli biologicznej białek
Właściwości fizykochemiczne białek
1 Przyswajanie białek przez organizmid 8658 ppt
właściwości białek mięśniowych
Budowa Chemiczna Białek
07 Modyfikacje struktury enzymówid 7062 ppt
Funkcje białek, Biochemia
19.Budowa białek, Notatki AWF, Biochemia
Amoniak można oznaczyć z krwi i moczu produkt rozkładu białek
Projektowanie nowych białek o zadanych właściwościach katalitycznych
więcej podobnych podstron