
Teorie kwasów i zasad

Teoria Arrheniusa
• Kwas
– substancja która w roztworze wodnym dysocjuje na
jony wodorowe
• Zasada
– substancja która w roztworze wodnym dysocjuje
na jony wodorotlenowe
• Ograniczenia teorii:
– Dotyczy tylko roztworów wodnych
– Nie uwzględnia w sposób właściwy roli wody w procesie
dysocjacji kwasu (zasady) i jej wpływu na moc kwasu (zasady)
– W swojej pierwotnej postaci:
• nie tłumaczy właściwości kwasowo-zasadowych soli
• Nie tłumaczy właściwości kwasowo-zasadowych jonów

Teoria Brönstedta
• Kwas
– dawca (donor) protonów
• Zasada
– biorca (akceptor) protonów
• Reakcje odłączania i przyłączania protonów są odwracalne
– w rekcji odłączenia protonu od cząsteczki kwasu powstaje
zasada, a w reakcji przyłączenia protonu do cząsteczki
zasady powstaje kwas.
Kwas ↔ zasada + proton
Kwas i zasadę jaka z niego powstaje po odłączeniu protonu
nazywamy
sprzężoną parą kwas – zasada
Przykłady sprzężonych par
• Kwasy Zasady
H
3
O
+
↔
proton
+ H
2
O
CH
3
COOH ↔
proton
+ CH
3
COO
-
H
2
CO
3
↔
proton
+ HCO
3-
HSO
4-
↔
proton
+ SO
42-
H
2
O ↔
proton
+ OH
-
• Kwasem lub zasadą może być zarówno cząsteczka obojętna jak i jon
Kwasy
Zasady
Cząsteczkowe
HCl, HNO
3
, H
2
SO
4
NH
3
, H
2
O
Kationowe
NH
4
+
, H
3
O
+
,
[Zn(H
2
O)
6
]
2+
[Zn(H
2
O)
5
(OH)
]
+
Anionowe
HSO
4
-
, HCO
3
-
, H
2
PO
4
-
CH
3
COO
-
, OH
-
, CN
-

Teoria Brönstedta
• Proton nie może istnieć w roztworze w stanie wolnym
,
może być jedynie wymieniany między kwasem i zasadą.
W roztworze zachodzą więc jednocześnie dwie reakcje:
kwas
1
↔ zasada
1
+ proton
zasada
2
+ proton↔ kwas
2
sumarycznie: kwas
1
+ zasada
2
↔ zasada
1
+ kwas
2
• Istotną rolę w reakcjach przenoszenia protonu odgrywają
cząsteczki rozpuszczalnika, które przyjmują lub oddają
protony.
• Kwas zasada zasada kwas
HCl + H
2
O ↔ Cl
-
+ H
3
O
+
H
2
O + NH
3
↔ OH
-
+ NH
4+

Teoria Brönstedta
• Nie zawsze rola rozpuszczalnika jest dominująca. Jeżeli
roztwór zawiera więcej substancji to wymiana protonów
może się odbywać bez udziału rozpuszczalnika.
• Np. CH
3
COOH + NH
3
↔ CH
3
COO
-
+ NH
4+
• Ogólna reguła jest taka:
Kwas reaguje w pierwszej kolejności z najmocniejszą w
danym środowisku zasadą, a zasada z najmocniejszym
kwasem.

Teoria Brönstedta
• Teoria Brönstedta odnosi się do rozpuszczalników zdolnych
do reakcji autodysocjacji, polegającej na przeniesieniu
protonu od jednej cząsteczki rozpuszczalnika do drugiej.
• Takie rozpuszczalniki nazywamy amfiprotycznymi.
Przykłady rozpuszczalników amfiprotycznych:
2 H
2
O ↔ H
3
O
+
+ OH
-
2 NH
3
↔ NH
4+
+ NH
2-
2 CH
3
OH ↔ CH
3
OH
2+
+ CH
3
O
-
2 H
2
SO
4
↔ H
3
SO
4+
+ HSO
4-

Teoria Brönstedta
Moc kwasów (zasad)
• Miarą zdolności kwasu do oddawania protonu (mocy kwasu)
powinna być stała równowagi reakcji:
HA ↔ A
-
+ proton
• Wyizolowanie takiej reakcji jest jednak niemożliwe i nie można
mierzyć takich stałych.
• Mierzyć możemy jedynie stałe równowagi reakcji:
HA + zasada
2
↔ A
-
+ kwas
2
gdzie: zasada
2
i kwas
2
oznaczają obojętną i sprotonowaną
cząsteczkę rozpuszczalnika.
Np. Dla kwasu octowego możemy zmierzyć stałą równowagi reakcji:
CH
3
COOH + H
2
O ↔ CH
3
COO
-
+ H
3
O
+
COOH]
[CH
]
O
[H
]
COO
[CH
K
3
3
3
a

Teoria Brönstedta
Moc kwasów (zasad)
• Podobnie dla jonu octanowego nie można zmierzyć stałej
równowagi reakcji:
CH
3
COO
-
+ proton ↔ CH
3
COOH
a jedynie stałą dla reakcji:
CH
3
COO
-
+ H
2
O ↔ CH
3
COOH + OH
-
]
COO
[CH
]
[OH
COOH]
[CH
K
3
3
b

Teoria Brönstedta
Moc kwasów (zasad)
• Obie zmierzone stałe nie charakteryzują bezwzględnych
zdolności:
– Kwasu do oddawania protonu
– Zasady do przyłączania protonu
• Charakteryzują jedynie zdolność:
– Cząsteczki kwasu do oddawania protonu cząsteczce rozpuszczalnika
– Cząsteczki zasady do odbierania protonu cząsteczce rozpuszczalnika
• Zmierzone stałe dostarczają więc jedynie informacji jak mocny
jest kwas (zasada) w stosunku do rozpuszczalnika w którym
zachodzi dysocjacja.

Teoria Brönstedta
• Dla sprzężonej pary iloczyn K
a
* K
b
nie zależy od
właściwości tej pary i jest równy iloczynowi jonowemu
rozpuszczalnika
Np. Dla sprzężonej pary CH
3
COOH – CH
3
COO
-
O
H
3
3
3
3
3
3
b
a
2
K
]
[OH
]
O
[H
]
COO
[CH
]
[OH
COOH]
[CH
COOH]
[CH
]
O
[H
]
COO
[CH
K
K
Teoria Brönstedta
• Iloczyn jonowy rozpuszczalnika określa:
– skalę pH dla tego rozpuszczalnika
– wartość pH roztworu obojętnego w tym rozpuszczalniku
Rozpuszczalni
k
Iloczyn
jonowy
Zakres pH
pH roztworu
obojetnego
H
2
SO
4
10
-4
0 – 4
2.0
CH
3
COOH
10
-13
0 – 13
6.5
H
2
O
10
-14
0 – 14
7.0
C
2
H
5
OH
10
-20
0 – 20
10.0
NH
3
10
-29
0 - 29
14.5

Słabe kwasy i zasady
• Im mocniejszy kwas tym słabsza jest sprzężona z nim zasada.
• Podobnie im mocniejsza zasada tym słabszy jest sprzężony z nią kwas
• Najsilniejszym akceptorem protonu (zasadą) jest w roztworze wodnym jon
OH
-
, a więc sprzężony z nim kwas H
2
O jest najsłabszy.
• Ma on stałą dysocjacji kwasowej K
a
= 1.8 * 10
-16
.
• Jeżeli wprowadzimy do wody potencjalnego dawcę protonu , który jest
słabszy od wody, to nie będzie on przejawiał w wodzie właściwości
kwasowych. Dodana do takiego roztworu zasada będzie odbierała protony
od cząsteczek wody.
• Najsilniejszym dawcą protonów (kwasem) jest w wodzie jon H
3
O
+
, a więc
sprzężona z nim zasada H
2
O jest najsłabsza.
• Jeżeli wprowadzimy do wody potencjalnego biorcę protonu , który jest
słabszy od wody, to nie będzie on przejawiał w wodzie właściwości
zasadowych. Dodany do takiego roztworu kwas będzie oddawał protony
cząsteczkom wody.

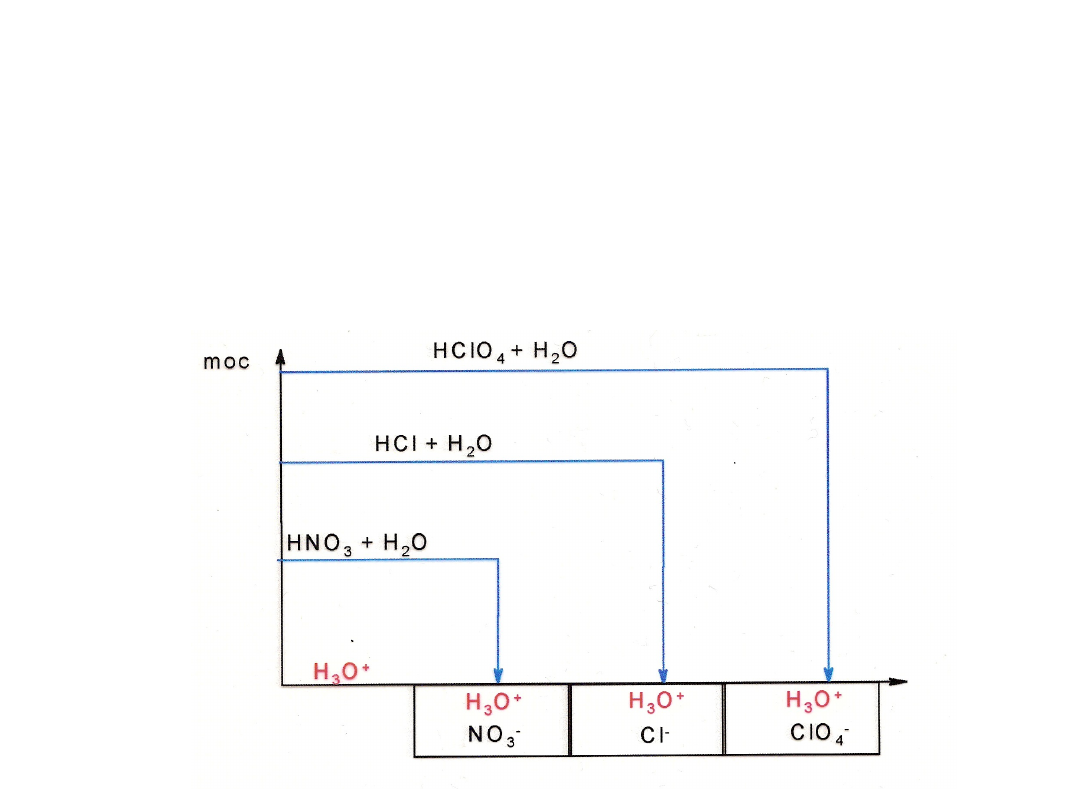
Mocne kwasy
• Jeżeli do wody wprowadzimy jakąkolwiek substancje, która jest
silniejszym dawcą protonów niż jon H
3
O
+
, to przereaguje ona z
cząsteczkami wody z utworzeniem jonów H
3
O
+
.
• Reakcja ta wobec dużego nadmiaru wody przebiegnie ilościowo.
• Dlatego też roztwory takich substancji będą wykazywały (przy
tych samych stężeniach) jednakowe właściwości kwasowe.
• W roztworach tych nie można wykryć niezdysocjowanych
cząsteczek.
• Reakcje dysocjacji takich substancji możemy uważać za
nieodwracalne.
HNO
3
+ H
2
O → H
3
O
+
+ NO
3-
HCl + H
2
O → H
3
O
+
+ Cl
-
HClO
4
+ H
2
O → H
3
O
+
+ ClO
4-
H
2
SO
4
+ H
2
O → H
3
O
+
+ HSO
4-
Mocne kwasy
• W wodzie moc wszystkich tych kwasów jest jednakowa i równa mocy
H
3
O
+
.
• Mówimy że woda dla tej grupy kwasów jest rozpuszczalnikiem
wyrównującym.
• Rozpuszczalnik który jest w stanie zróżnicować moc danej grupy
kwasów nazywamy różnicującym.
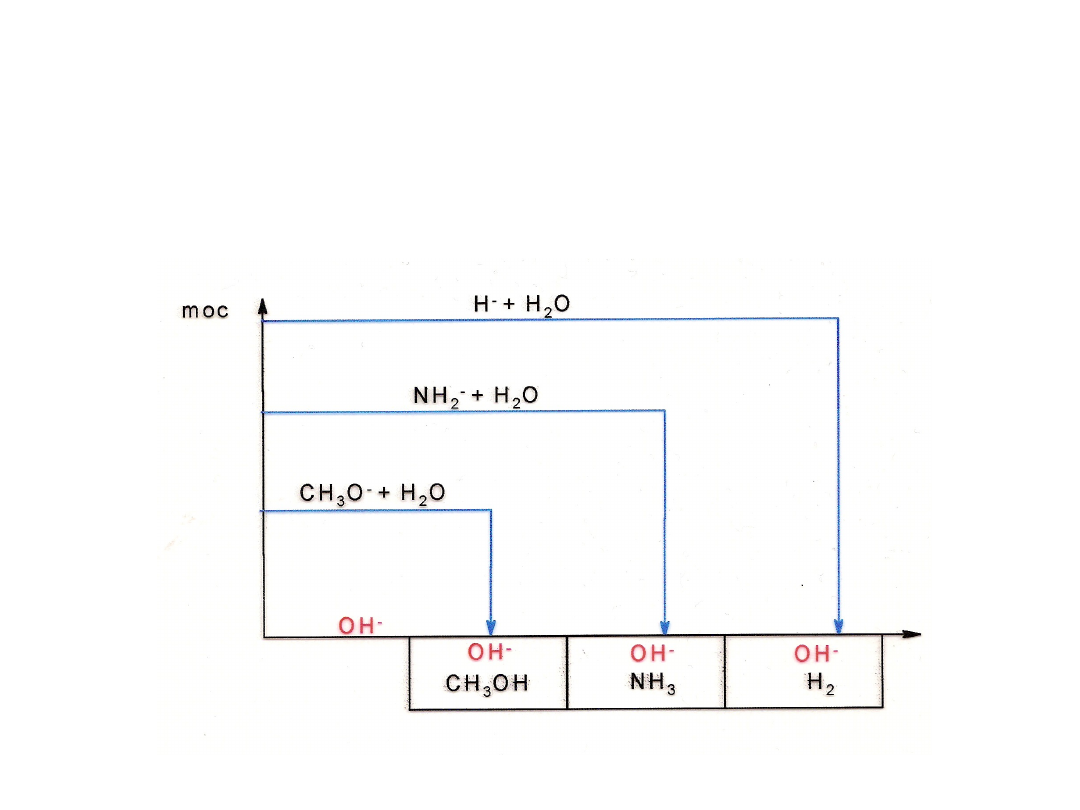
Mocne zasady
• Woda wykazuje również właściwości wyrównujące w
stosunku do zasad mocniejszych od jonu OH
-

Rozpuszczalniki różnicujące
• Stosowanie rozpuszczalników różnicujących pozwala wyznaczyć w nich stałe
dysocjacji mocnych kwasów i zasad.
• Ponieważ dla różnych rozpuszczalników stosunek stałych dysocjacji danej
pary kwasów jest w przybliżeniu stały, to na tej podstawie można obliczać
hipotetyczne wartości stałych dysocjacji mocnych kwasów (zasad) w wodzie
• Chociaż nie mają one sensu fizycznego to jednak są często przytaczane dla
zobrazowania właściwości protonodawczych kwasu. (protonobiorczych
zasady).
• Na tej podstawie można np. uszeregować względem mocy następujące
kwasy:
• HClO
4
> HI > HBr > HCl > H
2
SO
4
> HNO
3
> H
3
O
+
wodzie)
(w
K
K
)
SO
H
(w
K
K
etanolu)
(w
K
K
HCl
COOH
CH
4
2
HCl
COOH
CH
HCl
COOH
CH
3
3
3

Reakcje protolityczne
• W teorii Arrheniusa rozróżniamy reakcje dysocjacji, hydrolizy, zobojętniania
itp.
• W teorii Brönstedta tego typu rozróżnianie traci sens.
• Wszystko to są reakcje protolityczne przebiegające według ogólnego
równania:
kwas
1
+ zasada
2
↔ zasada
1
+ kwas
2
•
Dysocjacja: CH
3
COOH + H
2
O ↔ CH
3
COO
-
+ H
3
O
+
•
Hydroliza: HB
+
+ H
2
O ↔ B + H
3
O
+
A
-
+ H
2
O ↔ HA + OH
-
•
Zobojętnianie: H
3
O
+
+ OH
-
↔ 2 H
2
O
HA + OH
-
↔ A
-
+ H
2
O
H
3
O
+
+ B ↔ H
2
O + HB
+
HA + B ↔ A
-
+ HB
+
Klasyfikacja rozpuszczalników
Rozpuszczalniki
Protolityczne
(protyczne)
Aprotonowe
(aprotyczne)
Protono-
donorowe
(kwasowe)
HF, CH
3
COOH,
H
2
SO
4
Protono-
akceptorowe
(zasadowe)
NH
3
, aminy
Amfi-
protonowe
H
2
O, alkohole
Niepolarne,
niezdolne
do solwatacji
Oktan, benzen,
cykloheksan
Polarne,
zdolne do
autodysocjacji
BrF
3
, SO
2,
NO
2
Niezjonizowane,
zdolne do
Solwatacji
CH
3
CN, DMSO

Porównanie teorii
• Pojęcie kwasu w obu teoriach jest takie samo:
– Każdy kwas Arrheniusa jest kwasem również według Brönstedta
– Każdy kwas Brönstedta jest kwasem również według Arrheniusa
• Pojęcie zasady w teorii Brönstedta jest szersze:
– Każda zasada Arrheniusa jest zasadą również według Brönstedta
– Istnieją substancje będące zasadami według Brönstedta, które nie są
zasadami według Arrheniusa
• Teoria Brönstedta dotyczy nie tylko wody ale dowolnego
rozpuszczalnika protolitycznego.
• Teoria Brönstedta właściwie tłumaczy rolę rozpuszczalnika w
reakcjach dysocjacji kwasów i zasad.

Inne teorie
• Teoria rozpuszczalnikowa – rozszerzenie na rozpuszczalniki zdolne
do autodysocjacji.
–
Kwas – substancja, która po dodaniu do rozpuszczalnika zwiększa
stężenie kationów charakterystycznych dla jego autodysocjacji
–
Zasada - substancja, która po dodaniu do rozpuszczalnika zwiększa
stężenie anionów charakterystycznych dla jego autodysocjacji
2 BrF
3
↔ BrF
2+
+ BrF
4-
• Teoria Usanowicza – rozszerzenie zakresu reakcji kwas - zasada o
reakcje utleniania i redukcji
–
kwas – substancja która: odszczepia protony lub odszczepia kationy
lub przyłącza aniony lub jest biorcą pary elektronowej przy tworzeniu
wiązania koordynacyjnego lub przyłącza elektrony
–
zasada - substancja która: odszczepia jony wodorotlenowe lub
przyłącza protony lub przyłącza kationy lub odszczepia aniony lub jest
dawcą pary elektronowej przy tworzeniu wiązania koordynacyjnego
lub oddaje elektrony

Teoria Lewisa
• Jeżeli spojrzeć na teorię Brönstedta od strony tworzonych i
zrywanych wiązań to można zauważyć że:
– Zasada przyłączając proton wiąże go za pomocą swojej wolnej pary
elektronowej. Powstaje wiązanie koordynacyjne.
– Podczas oddawania protonu przez kwas wiązanie koordynacyjne
zostaje zerwane
• Lewis zaproponował żeby reakcji kwasowo – zasadowych nie
ograniczać do przenoszenia protonów.
• Według jego definicji
reakcją kwasowo – zasadową będzie
każda w której powstaje wiązanie koordynacyjne
– Kwasem
jest substancja, która podczas tworzenia wiązania
koordynacyjnego jest
biorcą (akceptorem) pary elektronowej
– Zasada
jest w tym procesie
dawcą (donorem) pary elektronowej
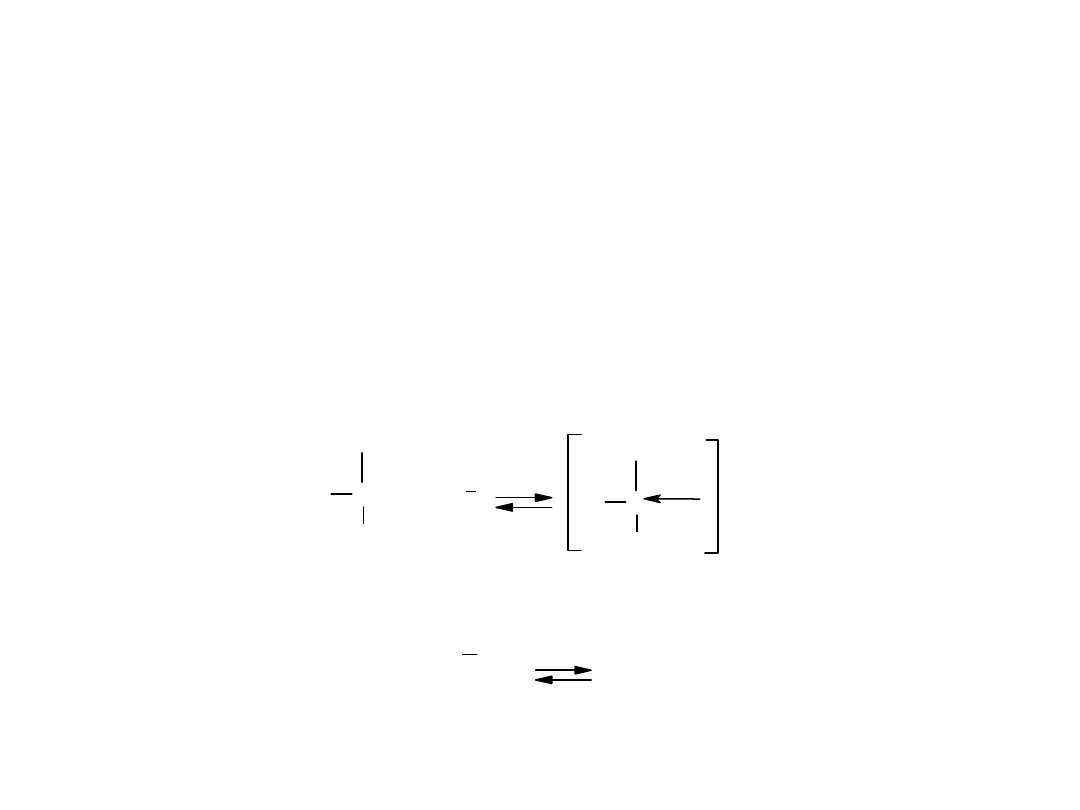
Teoria Lewisa
• W tym ujęciu przeniesienie protonu jest szczególnym przypadkiem
reakcji kwasowo – zasadowej.
HCl + H
2
O → Cl
-
+ H
3
O
+
• Teoria Brönstedta zawiera się więc w teorii Lewisa
• Teoria Lewisa jest jednak szersza. Istnieją reakcje kwasowo – zasadowe
według Lewisa, które nie są takimi według Brönstedta
B
F
F
F
F
B
F
F
F
F
[Cu(NH
3
)
4
]
2
+
+
-
kwas zasada
Cu
2+
+ 4 NH
3
kwas zasada

Teoria Lewisa
• Teoria Lewisa jest bardzo popularna w chemii związków
kompleksowych i w chemii organicznej.
• Powodzenie w tej ostatniej zawdzięcza temu że w ogóle
abstrahuje od rozpuszczalnika.
• Według Lewisa reakcja kwasowo – zasadowe mogą zachodzić
nie tylko w roztworach ale także w fazie gazowej i w między
ciałami stałymi.

Porównanie teorii
• Każdy kwas (zasada) Brönstedta jest kwasem (zasadą) Lewisa.
• Teoria Lewisa rozszerza klasę reakcji kwasowo – zasadowych o
reakcje tworzenia związków kompleksowych i wszystkie inne,
w których mamy do czynienia z tworzeniem wiązania
koordynacyjnego.
• Każdy dawca pary elektronowej jest teoretycznie zdolny do
przyłączenia do niej protonu. Zasada Lewisa może być więc
także zasadą według Brönstedta.
• Pojęcie kwasu według Lewisa jest szersze i obejmuje oprócz
kwasów Brönstedta także kationy metali i wszystkie inne
cząsteczki posiadające atomy o wolnych orbitalach zdolne do
przyjęcia pary elektronowej.

Koncepcja twardych i miękkich kwasów i zasad
Pearsona
• Teoria Pearsona bazuje na definicjach kwasu i zasady
wprowadzonych przez Lewisa.
• Nowością jest wprowadzenie podziału na miękkie i twarde
zasady, a w ślad za tym odpowiedni podział kwasów.
• Przez twardą zasadę Pearson rozumie taką której atomy
donorowe:
–
wykazują dużą elektroujemność
–
są odporne na utlenianie
–
są mało polaryzowalne
• Miękkie zasady mają atomy donorowe:
–
o małej elektroujemności
–
łatwe do utlenienia
–
łatwo ulegające polaryzacji w polu elektrycznym
Koncepcja twardych i miękkich kwasów i zasad
Pearsona
• Podział kwasów na miękkie i twarde był pochodną podziału zasad.
• Twarde kwasy to te które reagują przede wszystkim z twardymi
zasadami.
• Miękkie kwasy preferują w reakcjach miękkie zasady
Twarde
Pośrednie
Miękkie
Kwasy
H
+
, kationy I i
II grupy, Mn
2+
,
Fe
3+
, Al
3+
, SO
3
,
CO
2
Fe
2+
, Cu
2+
,
SO
2
, Sn
2+
, Ni
2+
,
Zn
2+
Cu
+
, Ag
+
, Tl
+
,
I
2
, Br
2
Zasady
H
2
O, OH
-
, F
-
,
Cl
-
, NO
3
-
, ClO
4
-
,
RO
-
, NH
3
Br
-
, NO
2
-
,
SO
3
2-
, C
5
H
5
N
I
-
, R
2
S, CO,
CN
-
, S
2
O
3
2-

Koncepcja twardych i miękkich kwasów i zasad
Pearsona
• Teoria Pearsona nie ma jeszcze wystarczającej obudowy
matematycznej pozwalającej na ilościową interpretację
twardości – miękkości.
• Pozwala jednak trafnie przewidywać np:
– względną trwałość tlenków i siarczków
– trwałość związków kompleksowych
– kierunki reakcji między kompleksami (reakcje wymiany
ligandów).
• Ma ona coraz większe znaczenie w chemii związków
kompleksowych
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
Wyszukiwarka
Podobne podstrony:
Egzamin diagnozujący teorie kwasów i zasad
1 6 Teorie kwasów i zasad +Odpowiedzi
teorie kwasów i zasad
Teorie kwasów i zasad, CHEMIA, semestr 1, chemia ogólna, wykłady
Egzamin diagnozujący teorie kwasów i zasad
1 6 Teorie kwasów i zasad +Odpowiedzi
Teorie kwasów i zasad
12 Teorie kwasów i zasad
12900-różne teorie na temat kwasów i zasad, chemia
Analiza ilościowa-objętościowe oznaczanie kwasów i zasad, Energetyka, I rok, chemia
moc kwasów i zasad
3 Dializa Dyfuzyjna rozdzial kwasow i zasad id 3306 (2)
02 Teorie kwasów i zasad ppt
Obliczanie pH roztworów mocnych oraz słabych kwasów i zasad oraz mieszanin buforowych, UWM Weterynar
Teoria kwasów i zasad
Teoria kwasów i zasad IV
03 4 Folia Teorie kwasowo zasadowe zadania do lekcji nr 1
7 4b Stała dysocjacji kwasów i zasad
więcej podobnych podstron