
2. Termiczne równanie stanu,
2. Termiczne równanie stanu,
przemiana termodynamiczna
przemiana termodynamiczna
Pod pojęciem stanu rozumiemy
zwykle zespół wielkości, które mogą
przybierać różne wartości, a których
zmiana wiąże się ze zmianą stanu.
2.1. Stan termodynamiczny czynnika
2.1. Stan termodynamiczny czynnika
Stan termodynamiczny czynnika
określany jest zespołem
parametrów
stanu
- określane na podstawie
pomiarów lecz bez znajomości
historii układu.
Parametry stanu:
ilość substancji
objętość
ciśnienie
temperatura
składowe prędkości
współrzędna położenia
stężenia
objętość
właściwa

Objętość właściwa
2.2. Termiczne parametry stanu
2.2. Termiczne parametry stanu
Równania termodynamiki dogodniej
jest zapisywać za pomocą objętości
właściwej, podczas gdy w równaniach
mechaniki płynów, częściej występuje
gęstość.
1
m
V
v
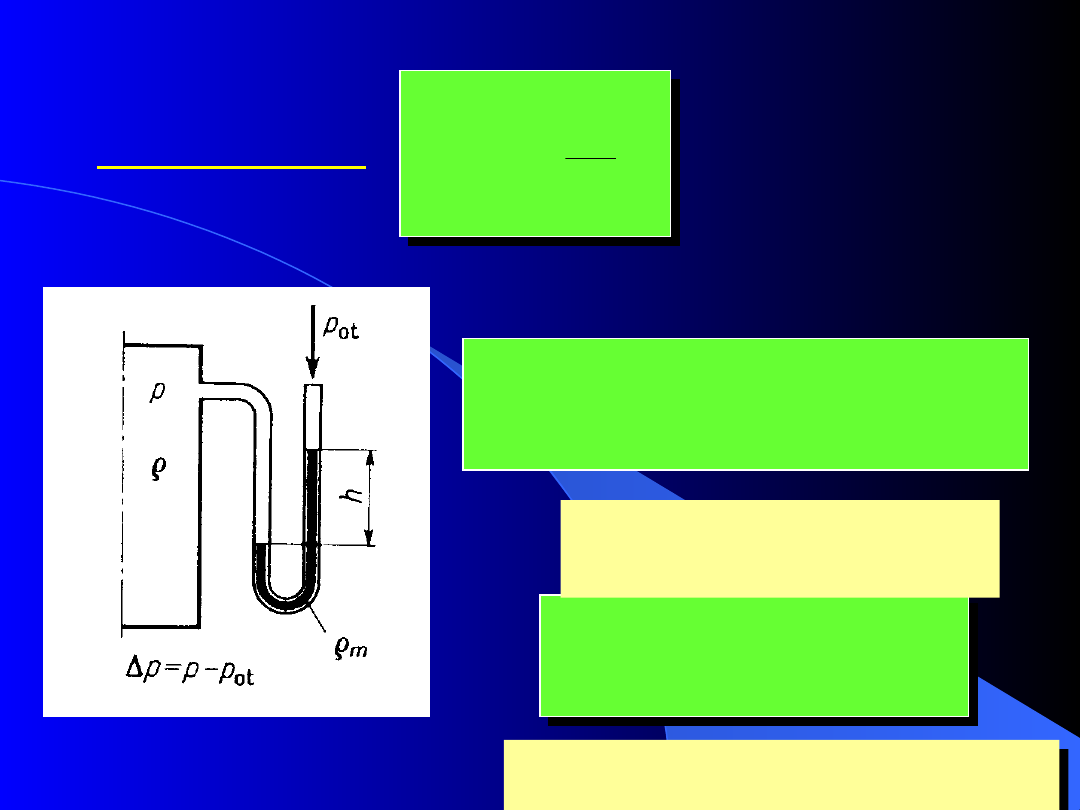
Ciśnienie:
A
F
p
g
h
p
m
m
ot
m
p
p
p
ciśnienie
manometryczne
bezwzględne ciśnienie
statyczne
bezwzględne ciśnienie
statyczne
ot
m
p
p
p
ot
m
p
p
p
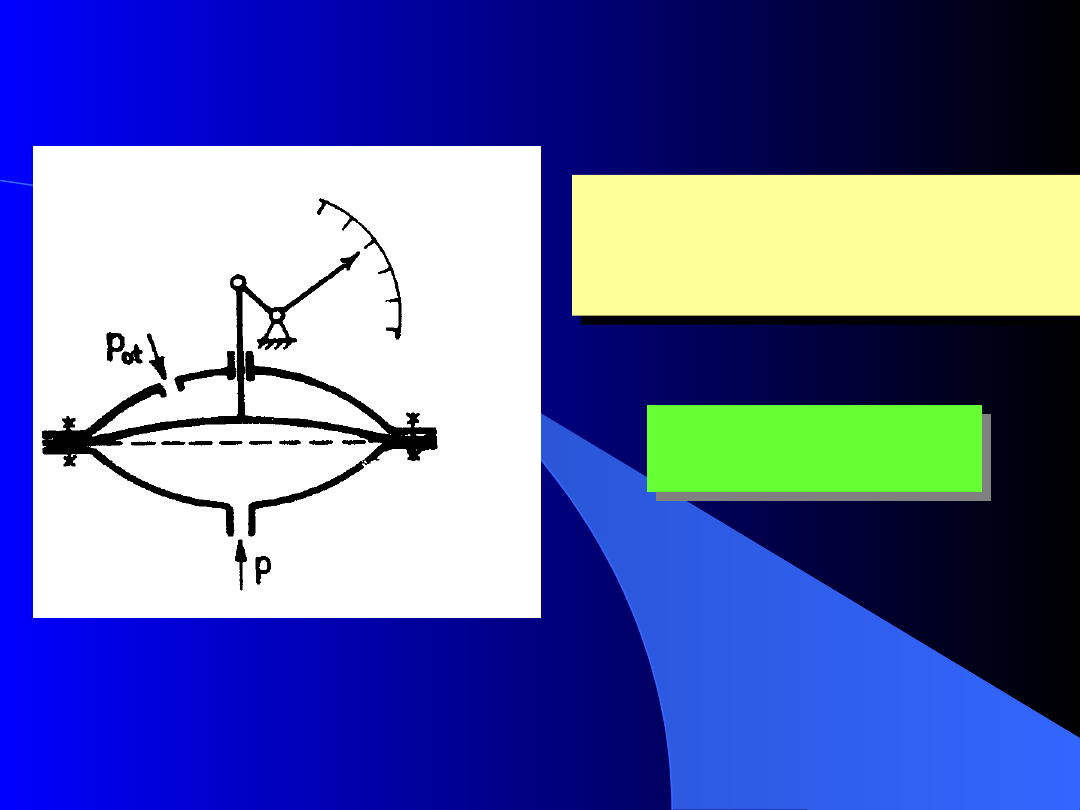
Membrana reaguje na
różnicę
ciśnień
Membrana reaguje na
różnicę
ciśnień
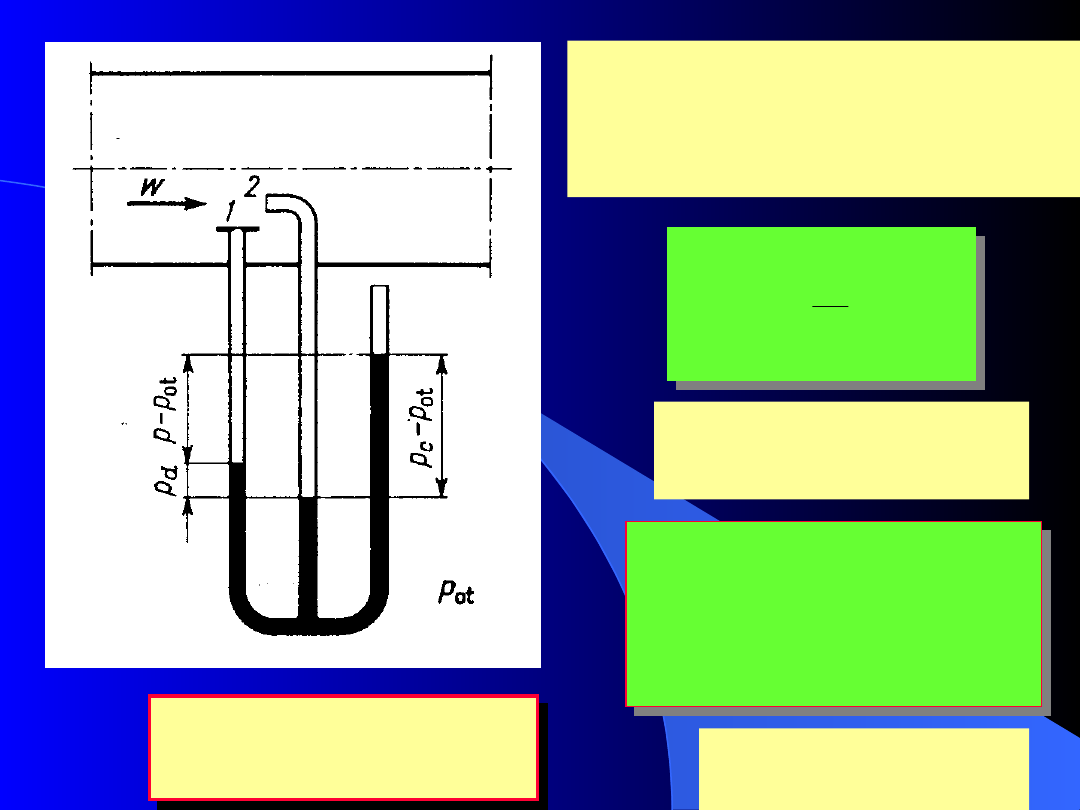
Rurka Pitota służy
do pomiaru
prędkości płynu
2
2
1
w
p
d
2
2
1
w
p
d
d
ot
m
d
s
c
p
p
p
p
p
p
d
ot
m
d
s
c
p
p
p
p
p
p
ciśnienie
dynamiczne
ciśnienie
całkowite
parametr stanu to
p
s
parametr stanu to
p
s
Temperatura
Pojęcie to nie zostało wprowadzone przez mechanikę
i jest
wielkością typowo termodynamiczną.
Istnienie parametru termicznego zwanego
temperaturą
wynika
z tzw.
zerowej zasady termodynamiki
lub
tranzytywności równowagi termicznej
.
A
B
C
A
C
R
R
R
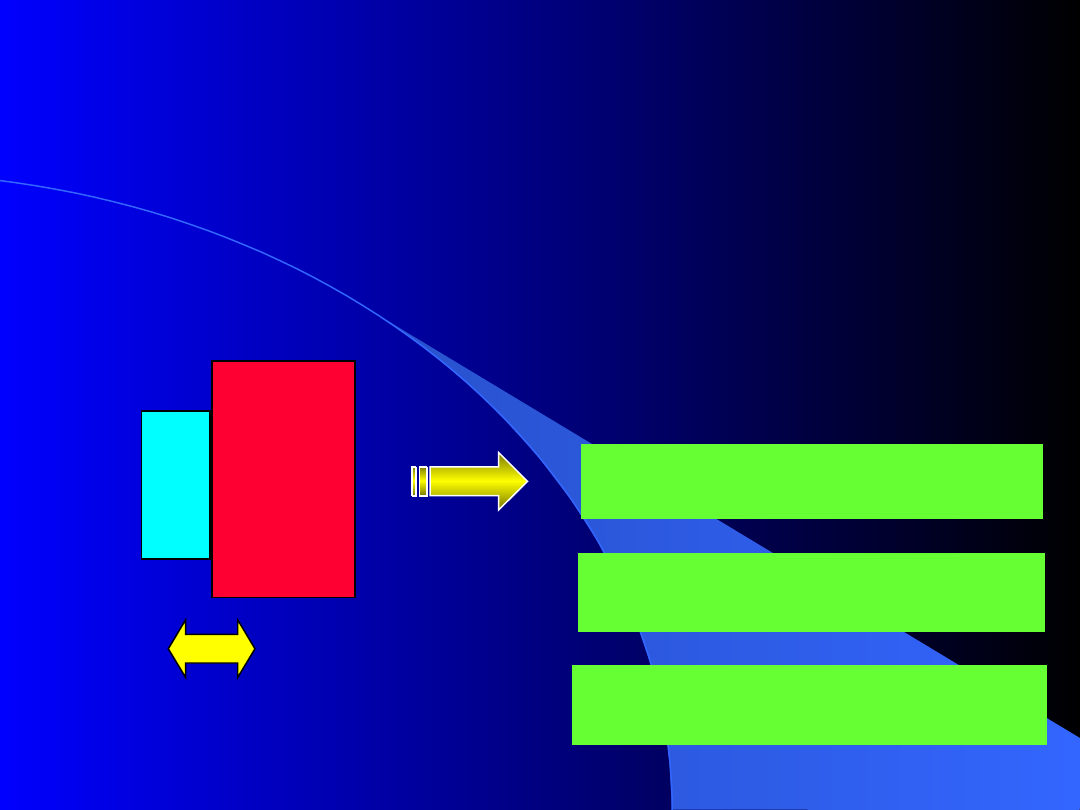
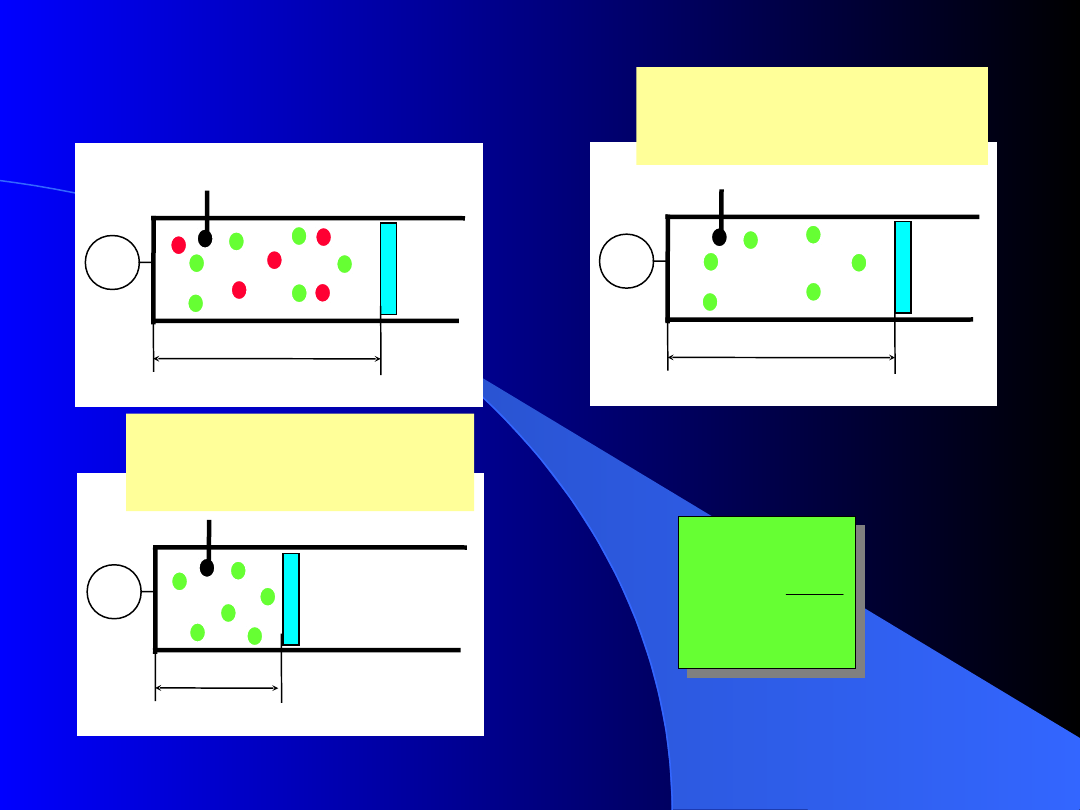
Nie każde dwa stany termiczne ciał są stanami wzajemnej
równowagi. Oznacza to, że wystąpienie równowagi stanowi
ograniczenie wyboru parametrów p
A
, v
A
, p
B
, v
B
tych ciał.
Równowaga termiczna
to stan, w którym pomiędzy ciałami nie
jest przekazywana żadna energia, a parametry termiczne nie
zmieniają się.
A
B
R
0
,
,
,
f
1
B
B
A
A
v
p
v
p
0
,
,
,
f
2
C
C
B
B
v
p
v
p
0
,
,
,
f
3
C
C
A
A
v
p
v
p

C
C
B
B
A
A
v
p
v
p
v
p
,
,
,
3
2
1
W celu zmierzenia temperatury należy doprowadzić do
równowagi termometru i danego ciała. Jednocześnie przyjmuje
się dla wzorcowej substancji termometrycznej funkcję , dla
rtęci
Dla każdego ciała istnieje jednoznaczna funkcja ciśnienia i
objętości
właściwej, przy czym dla ciał w stanie równowagi wartości
tej funkcji są sobie równe.
b
at
v
temperatura
empiryczna
temperatura
empiryczna
t
Różne substancje i funkcje oznaczają różne skale
termometryczne.
Bezwzględna skala
15
.
273
t
T
2.3. Termiczne równanie stanu
2.3. Termiczne równanie stanu
Każda substancja ma swoje własne
równanie stanu. Termodynamika
zajmuje się głównie gazami oraz
cieczami.
v
p
t
,
v
p
t
,
Z zerowej zasady termodynamiki
wynika nie tylko istnienie temperatury,
ale również istnienie zależności
pomiędzy parametrami stanu.
0
,
,
F
T
v
p
0
,
,
F
T
v
p
dwa stopnie
swobody

2.4. Termiczne równanie stanu
2.4. Termiczne równanie stanu
gazu
gazu
doskonałego i
doskonałego i
półdoskonałego
półdoskonałego
cząsteczki gazu są punktami materialnymi (nie
posiadają objętości własnej)
cząsteczki gazu nie oddziałują na siebie
cząsteczki poruszają się ruchem postępowym i
obrotowym
W
celu
uproszczenia
rozważań
termodynamika
stosuje
model
gazu
doskonałego
i
półdoskonałego
(odpowiedniki
modelu punktu materialnego i bryły sztywnej
w mechanice)
Gaz doskonały
Gaz doskonały

cząsteczki gazu są punktami
materialnymi
(nie posiadają
objętości własnej)
cząsteczki gazu nie oddziałują na
siebie
cząsteczki poruszają się ruchem
postępowym,
obrotowym i
drgającym
Gaz półdoskonały
Gaz
doskonały
Gaz
doskonały
ma
stałą
pojemność
cieplną
właściwą
(ciepło właściwe), podczas gdy
pojemność cieplna właściwa
gazu
gazu
półdoskonałego
półdoskonałego
zależy
od
temperatury.

Kiedy gaz można traktować jak doskonały i/lub
półdoskonały?
Gaz rzeczywisty tym bardziej zbliża się do
modelu gazu doskonałego im ma:
• mniejsze ciśnienie
• wyższą temperaturę
Wymagania te są tym ostrzejsze im
większe są cząsteczki.
• 1-atomowe - gazy doskonałe
• 2-atomowe - do temp. ok 100
o
C gazy doskonałe,
dla wyższych półdoskonałe
• 3-atomowe - gazy półdoskonałe lub rzeczywiste

Równanie
Równanie
Clapeyron’a
Clapeyron’a
RT
pv
RT
pv
p - ciśnienie
v - objętość właściwa
T - temperatura bezwzględna
R - indywidualna stała
gazowa
R=idem
RT
pv
RT
pv
(MR) = 8314.4 kJ/kmol K = const
uniwersalna stała gazowa
RT
p
RT
p
MRT
pMv
MRT
pMv
T
MR
Mv
p
T
MR
Mv
p
RT
pv
RT
pv
mRT
pV
nM
m
T
MR
n
pV
T
MR
n
V
p
RT
m
V
p

2.5. Termiczne równanie stanu
2.5. Termiczne równanie stanu
gazu
gazu
rzeczywistego
rzeczywistego
RT
v
v
p
p
RT
v
v
p
p
RT
b
v
v
a
p
2
RT
b
v
v
a
p
2
RT
b
v
b
v
v
T
a
p
RT
b
v
b
v
v
T
a
p
Równanie Van der Waalsa
Równanie Redlich - Kwonga

Z
Z
RT
pv
1
...
1
2
v
C(T)
v
B(T)
RT
pv
Równania wirialne
...
)
(
)
(
1
2
p
T
C
p
T
B
RT
pv
2.6. Roztwory gazów doskonałych i
2.6. Roztwory gazów doskonałych i
półdoskonałych
półdoskonałych
Udział masowy (gramowy, wagowy)
Informacją podstawową o roztworze
jest jego skład
m
m
g
i
i
1
m
m
g
i
i
i
i
Udział molowy
i
i
i
i
n
n
n
n
z
1
n
n
z
i
i
i
i
i
i
i
i
i
i
i
i
M
z
M
n
n
M
n
m
n
m
M

Np. powietrze:
84
.
28
28
79
.
0
32
21
.
0
2
2
2
2
N
N
O
O
a
M
z
M
z
M
Udział objętościowy
V
V
r
i
i
V
V
r
i
i
p
V
T
p
i
V
T
p
V
i
T
ciśnienie
cząstkowe
objętość
cząstkowa
i
i
p
p
i
i
p
p
Prawo
Daltona
i
i
pV
V
p
i
i
pV
V
p
p
r
V
V
p
p
i
i
i
1
i
i
r
T
MR
n
V
p
i
i
T
MR
n
V
p
i
i
Dla pojedynczego
składnika
Sumując dla wszystkich składników otrzymujemy
T
MR
n
V
p
i
i
i
i
T
MR
n
V
p
i
i
i
i
T
MR
n
pV
T
MR
n
pV
T
R
m
V
p
i
i
i
T
R
m
V
p
i
i
i
Dla pojedynczego
składnika
Sumując dla wszystkich składników otrzymujemy
mRT
pV
mRT
pV
T
R
m
m
m
T
R
m
V
p
i
i
i
i
i
i
i
i
i
i
i
R
g
R
i
i
i
R
g
R
zastępcza stała
gazowa
T
MR
n
V
p
i
i
T
MR
n
V
p
i
i
Dla pojedynczego
składnika
Sumując dla wszystkich składników otrzymujemy
n
n
p
p
i
i
n
n
p
p
i
i
T
MR
n
pV
T
MR
n
pV
i
i
z
r
i
i
z
r
T
R
m
V
p
i
i
i
Dla pojedynczego
składnika
Sumując dla wszystkich składników otrzymujemy
R
R
m
m
p
p
i
i
i
mRT
pV
R
R
g
r
i
i
i

i
i
i
i
i
i
i
M
M
g
MR
M
M
MR
g
R
R
g
r
i
i
i
i
i
i
i
M
M
g
MR
M
M
MR
g
R
R
g
r
M
M
r
g
i
i
i
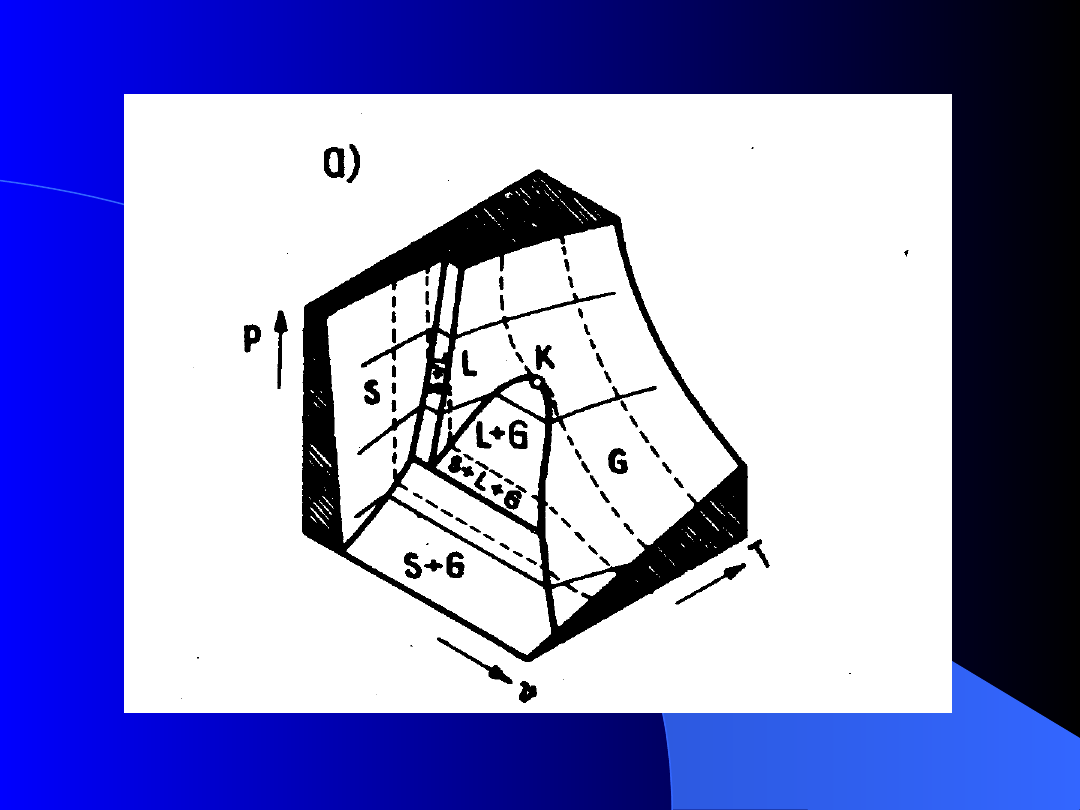
2.7. Przemiana termodynamiczna
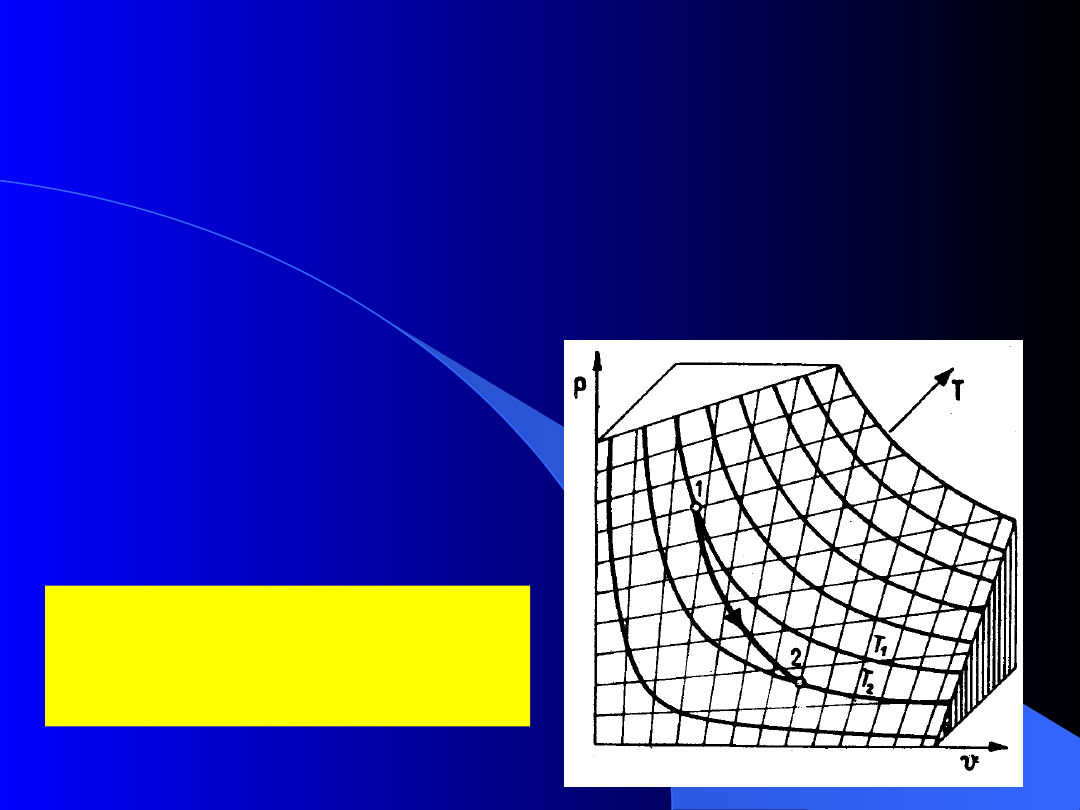
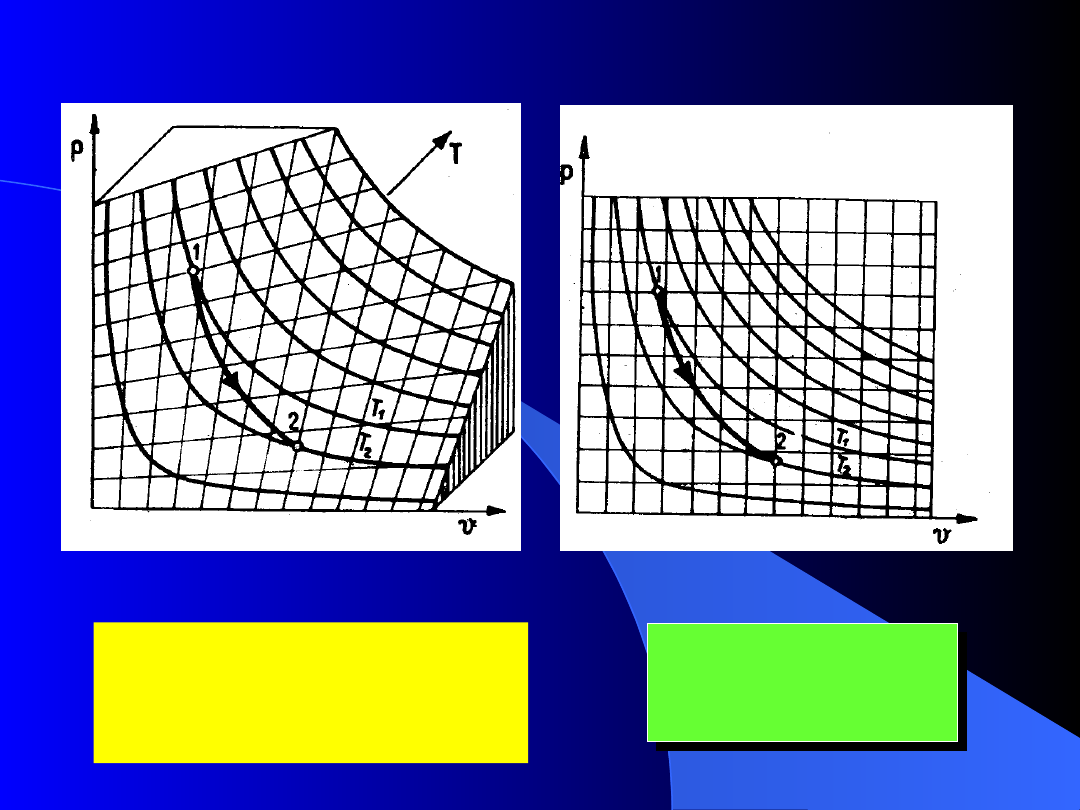
2.7. Przemiana termodynamiczna
Obrazem przemiany jest
linia na powierzchni
stanów
Przemiana termodynamiczna
to
zmiana stanu termicznego czynnika
(od stanu początkowego do
końcowego) przez kontinuum stanów
pośrednich.
v
p h
Równanie przemiany
ma jeden stopień
swobody

Równanie
przemiany
termodynamicznej
to
dodatkowe
równanie więzów na parametry
stanu, np. w przypadku izotermy
gazu doskonałego mamy:
idem
T
idem
idem
R
pv
RT
pv

sprężanie
rozpręża
nie
izobara
Przebieg ciśnienia w układzie:
Zmiany objętości właściwej w układzie:
dv > 0
dv < 0
dv = 0
dp >
0
dp <
0
dp =
0
ekspansja
kompresja
izochora
Przemiany mogą przebiegać jako:
nieodwracalne
odwracalne
pseudoodwracalne
p
v
0
d
dp
v

Przy opisie matematycznym przemian musimy
korzystać z następujących praw:
zasada zachowania ilości
substancji
I zasada termodynamiki
(zasada zachowania energii)
II zasada termodynamiki
związki
ilościowe
związki
jakościowe
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
Wyszukiwarka
Podobne podstrony:
rownanie stanu
Przemiany termodynam
Przemiany termodynamiczne sprawozdanie
Przemiany termodynamiczne lab n Nieznany
Przemiany termodynamiczne powietrza wilgotnego popr
Przemiany termodynamiczne, Prof.nadzw.dr hab.in˙. W˙adys˙aw Brzozowski
Równanie Bernoulliego ---przemiana adiabatyczna, mechanika plynów
Równanie Bernouliego-przemiana izotermiczna
Równanie Bernoulliego ---przemiana adiabatyczna
Równanie Bernouliego-przemiana izotermiczna, mechanika plynów
równanie stanu gazu, roztwory
Przemiany termodynamiczne powietrza wilgotnego, entalpia powietrza wilgotnego, mieszanie strumieni p
Sygn&Sys sem3 C2-Rownanie stanu, Studia, Semestr 1, Sygnały i Systemy, Sprawozdania
Równania stanu, Politechnika Łódzka Elektrotechnika, magisterskie, 1 sem
6i8 Badanie podstawowych przemian termodynamicznych Wyznaczanie wielkości kappa Wyznaczanie ciepła p
2 Rownania stanu gazuid 20716 Nieznany (2)
Referaty, Stała gazowa R, Równanie stanu gazów doskonałych ( równanie Clapeyrona )
Równanie Clapeyrona to równanie stanu opisujące związek pomiędzy temperaturą
więcej podobnych podstron