
Leczenie zakażenia HIV
ANITA WNUK

Cele terapii
• kliniczne
• wirusologiczne
• immunologiczne
• terapeutyczne
• epidemiologiczne

Cel kliniczny leczenia HIV
• Przedłużenie życia oraz poprawa
jakości życia

Cel kliniczny leczenia HIV
CD4 cell count
(baseline)
Probability of AIDS or
death (3-years risk)
<50/mm3
22%
50-100/mm3
16%
100-200/mm3
10%
200-350/mm3
4%
>350/mm3
3%

Cel kliniczny leczenia HIV
Viral load
Probability of AIDS or
death (3-years risk)
<1000 c/mL
4%
1000-10,000 c/mL
6%
10,000-100,000 c/mL 6%
>100,000 c/mL
13%

Wirusologiczny cel terapii
• *Osiągnięcie redukcji wiremii (<20-50 HIV-
RNA copies/ml) tak szybko jak to możliwe i na
jak najdłużej:
• *zatrzymanie progresji choroby
• *zapobieganie lub odsunięcie w czasie
lekooporności
• !uwaga: nawet redukcja wiremi doVL<5000
c/ml zmniejsza znacznie ryzyko rozwoju infekcji
oportunistycznych

Immunologiczny cel
terapii
• Rekonstrukcja immunologiczna
jest dwojaka:
• * ilościowa = prawidłowa liczba
limfocytów CD4
• * jakościowa = prawidłowa czyli
specyficzna odpowiedź na
patogeny

Terapeutyczny cel
leczenia
• Terapia „celowana”, czyli racjonalny
dobór leków ARV daje możliwość
realizacji celów klinicznych,
wirusologicznych i immunologicznych
poprzez:
• * utrzymanie opcji terapeutycznej
• **zminimalizowanie efektów
ubocznych i toksyczności
• ***zmaksymalizowanie „adherencji”

Epidemiologiczny cel
terapii
• Redukcja transmisji HIV

Jak działają leki ARV?
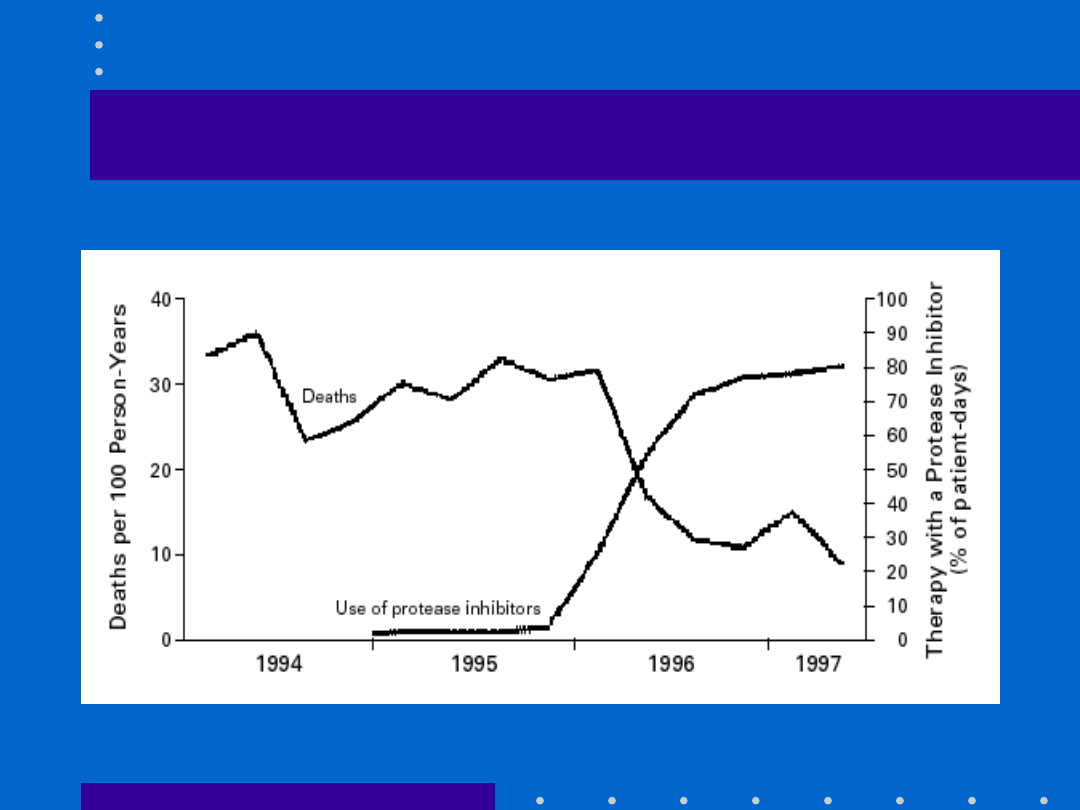
Zgony na AIDS a stosowanie
inhibitorów proteazy: Palella F.J.
i wsp., NEJM, 1998,338,853
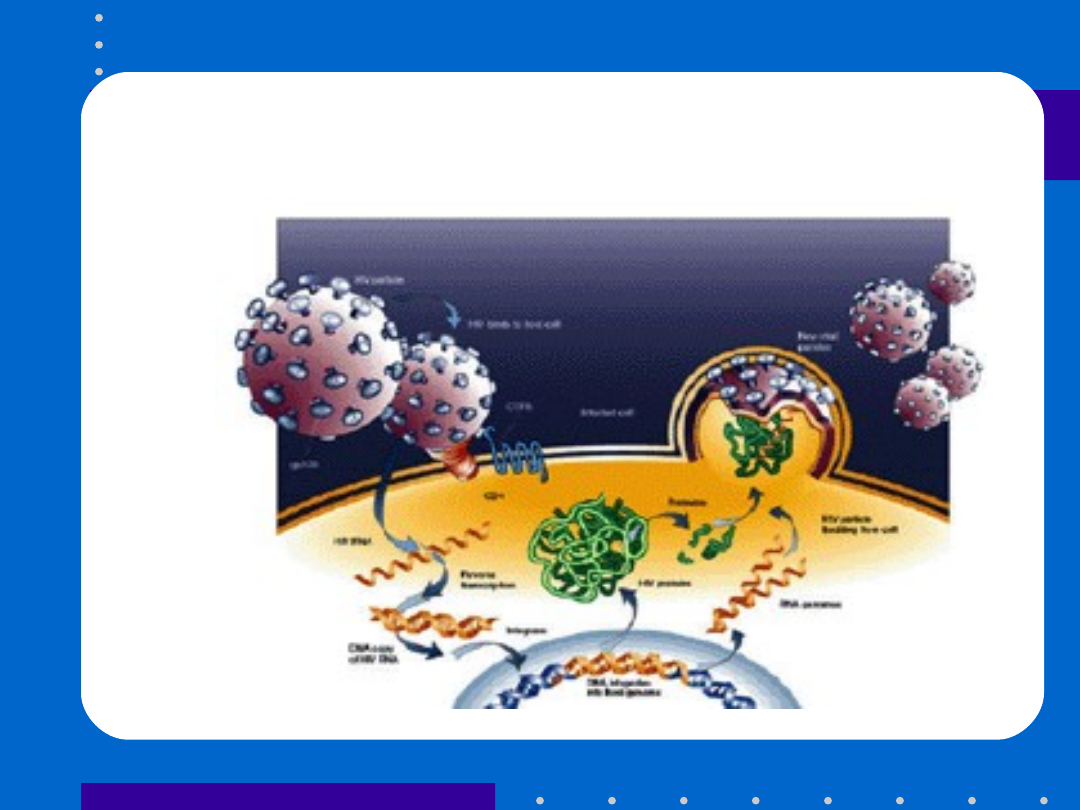
HIV life cycle
HIV life cycle

Używane skróty
• ARV = antyretrowirusowe/y
• ART. = leczenie antyretrowirusowe
• HAART = high active antiretroviral treatment
=wysoce aktywna terapia antyretrowirusowa
• PI`s = protease inhibitors=inhibitory proteazy
• NRTI`s = nucleoside reverse transcriptase
inhibitors = nukleozydowe inhibitory odwrotnej
transkryptazy
• NNRTI`s = non-nucleoside reverse transcriptase
inhibitors=nienukleozydowe inhibitory RT

Wskazania do leczenia
ARV
Clinical
category
CD4 cell
count
HIV-
RNA
recommendation
Symptomatic
(cat.A,B,C)
Any value Any
value
treat
asymptomatic
(AIDS)
<200
cell/mm3
Any
value
treat
asymptomatic 200 to
350
cell/mm3
Any
value
Treatment should be
offered
asymptomatic >350
>55,000
c/mL
Treat or defer therapy

Kiedy zacząć ART.?
Status
Recommendations
Symptomatic HIV
Treatment recommended
Asymptomatic with
CD4 < 200 cells/mm3
Treatment recommended
Asymptomatic with
CD4 > 200 cells/mm3
Treatment individualized based on:
*CD4 count
*CD4 rate of decline>100/mm3/year
*VL>50,000 c/mL
*risk of toxicity and drug-drug
interactions

Czynniki wpływające na
długotrwałą supresję
wirusologiczną
• Adherencja
• Wyjściowe VL
• Poprzednio stosowane leczenie ARV
• Najniższa VL
• Szybkość odpowiedzi
wirusologicznej(VL poniżej detekcji)
• Wybór schematy leczniczego

Korelacja pomiędzy
„przyleganiem do terapii”
a odpowiedzią
wirusologiczną
• Adherence to HAART VL <400 c/mL at
6 months
• >95% adherence 78%
• 90 to 95% adherence 45%
• 80 to 90% adherence 33%
• 70 to 80% adherence 29%
• <70% adherence 18%

Wyjściowe VL
• Most studies demonstrate a direct
correlation between baseline VL
and probability of achieving viral
suppresion to <400 c/mL
• The baseline VL also predict time
required to reach undetectable
virus

Poprzednio stosowane leki
ARV
• Wśród pacjentów, którzy uzyskali
VL poniżej detekcji,
prawdopodobieństwo
utrzymaniaVL<400 c/mL przez 2
lata jest 80% dla treatment-naive
pts w porównaniu z 62% dla
treatment-experienced.

Szybkość odpowiedzi
wirusologicznej
• Optymalny i skuteczny czas uzyskania odpowiedzi
wirusologicznej u pts otrzymujących HAART :
• * decrease to <5,000 c/mL at 4 weeks
• * decrease to <400 c/mL at 8 to 16 weeks and
<50 at 16 to 24 weeks
• Niepowodzenie w osiągnięciu tego celu sugeruje:
zbyt słaby potencjał antywirusowy leków, „non-
adherence”, oporność lub nieprawidłowy poziom
leków, złe wchłanianie, etc.

Wybór schematu
leczniczego
• „FIRST CHOICE IS THE BEST
CHOICE”
• „FIRST CHOICE AS LONG AS
POSSIBLE”

Czynniki sprzyjające
progresji (AIDS lub zgon)
po rozpoczęciu HAART
• wyjściowa VL > 100,000 c/mL
• wiek > 50 lat
• narkotyki dożylnie
• hemoglobina <14% (M) i <12% (K)

Wybór schematu
(jeden z kolumny A i jeden z
kolumny B)

Leczenie inicjujące (wg IAS-
USA)
• 2 NRTI`s + 1 PI ± low dose RTV
• 2 NRTI`s +1 NNRTI
• 3 NRTI`s

Monitorowanie leczenia ARV
test
when
comment
Viral load
baseline
After starting
or changing
therapy
4 weeks, 8 to
12 weeks, 16
to 24 weeks
Expect viral suppression with goal
of<400 c/mL at 8 weeks and continued
with goal<50 c/mL at 16 to 24 weeks
Chronic
therapy
Every 3 to 4
month
CD4 count
Baseline
After starting
or changing
therapy
4 weeks, 8 to
12 weeks, 16
to 24 weeks
Expect increase by>50 cells/mm3 at 4 to
8 weeks
Chronic
therapy
Every 3 to 4
months
Expect additional increase of 50-100
cells/mm3/year

Efekty uboczne leczenia
ARV
• Kwasica mleczanowa/stłuszczenie wątroby
• hepatotoksyczność
• Hyperglikemia/insulinooporność
• Zaburzenia dystrybucji tkanki tłuszczowej
(lipodystrfia)
• hyperlipidemia (=>CVD)
• osteonekroza, osteopenia i osteoporoza
• wysypki
• Zaburzenia mentalne

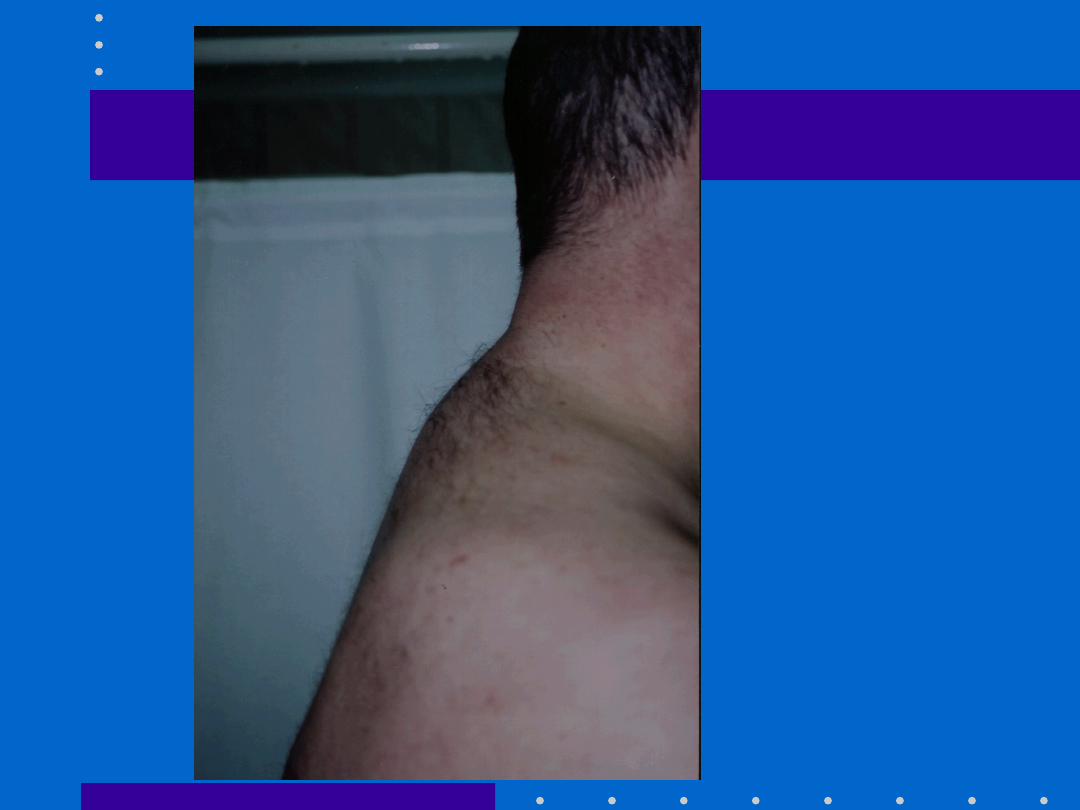
Zaburzenia dystrybucji
tkanki tłuszczowej
(lipodystrofia)
*Nieprawidłowe gromadzenie i rozmieszczenie
tkanki tłuszczowej jest pierwotnie związane z
zastosowaniem PI`s
• Pacjent prezentuje ubytek tkanki tłuszczowej
na kończynach i/lub na twarzy(„lipoatrophy”)
i/lub akumulację na brzuchu (”Crix-belly” or
„protease paunch”), karku („buffalo hump”),
piersiach (gynecomastia) oraz tkance
podskórnej (peripheral lipomatosis)

Zaburzenia dystrybucji
tkanki tłuszczowej
• Leczenie:
• * dieta niskotłuszczowa i
niskowęglowodanowa, aktywność fizyczna
• *testosteron (przyrost masy mięśniowej)
• *hormon wzrostu (redukuje akumulację
tłuszczu)
• *chirurgia plastyczna
• *zmiana schematu leczniczego (?)


Kwasica
mleczanowa/stłuszczenie
wątroby
• Poziom mleczanów w surowicy>2mmol/l.
Objawy kwasicy mleczanowej:
*asymptomatyczna, *objawy zagrażające życiu
( m.in. niewydolność oddechowa),*objawy
niespecyficzne: osłabienie, bóle mięśniowe,
nudności, wymioty, biegunka, bóle brzucha,
utrata wagi ciała, duszność.
• Diagnoza na podstawie wzrostu mleczanów,
poziomu CPK, LDH, amylazy lub AST i KT lub
biopsji wątroby z obrazem jej stłuszczenia.

Kwasica mleczanowa
• Leczenie
• * poziom<5 mmol/l nie wymaga leczenia i
modyfikacji terapii ARV
• * pacjenci objawowi>5mmol/l wymagają
odstawienia NRTI`s
• * poziom mleczanów>10 mmol/l
powinien być monitorowany w OIOM
(leczenie podtrzymujące=wlewy i.v,
mechaniczna wentylacja, i/lub dializa)

Hepatotoksyczność
• Wszystkie ARV są potencjalnie
hepatotoksyczne
• Najczęściej hepatotoksyczność
ARV ujawnia się u pacjentów z
koinfekcją HCV - lub HBV

Hyperglikemia/insulinoop
orność
• Screening: poziom glukozy na
czczo i HgA1c
• Leczenie jak w cukrzycy typu II

Hyperlipidemia
• Zmiany poziomu lipidów
(hyperlipidemia ze wzrostem LDL
cholesterolu, trójglicerydów,
cholesterolu całkowitego i lipidów)
• Leczenie: dieta, aktywność
fizyczna i redukcja wagi ciała, leki
obniżające stężenie lipidów,
odstawienie PI`s

Pierwotna i wtórna
profilaktyka zakażeń
oportunistycznych
• Profilaktyka pierwotna=prewencja
pierwszego epizodu OI; typ
profilaktyki zależy od liczby
limfocytów CD4
• wtórna=prewencja następnego
epizod OI; stop profilaktyka, gdy
CD4>200/mm3

Profilaktyka pierwotna i
wtórna infekcji
oportunistycznych
CD4 cells count pathogen primary secondary
all patients regardless Mycobacterium INH no
of CD4 level tuberculosis
CD4<200 Pneumocistis carini Trimethoprim/sulfamethoxazole
CD4<100 Toxoplasma gondii TMP/SMX TMP/SMX
CD4<50 MAC Claritromycin Claritromycin
Cytomegalovirus Valgancycloviv Valgancyclovir
candida species,
cryptococcus flukonazole flukonazole

Immune reconstitiution
syndrome (IRIS) – zespół
odbudowy immunologicznej
• Pacjent otrzymujący HAART w
ciągu pierwszych kilku miesięcy
rozwija „choroby” definiujące
AIDS.
• Ta „paradoksalna reakcja” jest
objawem odbudowy układu
immunologicznego (dobra
odpowiedź na leczenie)

Manifestacje kliniczne
zespołu odbudowy
immunologicznej
Opportunistic infection common clinical presentation after HAART
manifestation
Parvovirus B-19 anemia, AIDS-wasting syndrome anemia
Cryptoccocus neoformans meningitis overt meningitis
Chronic hepatitis B asymptomatic acute hepatitis
Cytomegalovirus retinitis uveitis
Chronic hepatitis C asymptomatic acute hepatitis
Herpes zoster typical zoster typical zoster
Pulmonary tuberculosis tbc worsening of tbc

Transmisja wertykalna
zakażenia HIV
(Mother-to-child
transmission=MTCT)

Pryncypia
• Nie jest znany wpływ ciąży na
zakażenie HIV i odwrotnie
• Prawdopodobieństwo transmisji
wertykalnej wzrasta gdy:
• *VL oznaczalna w czasie rozwiązania
• *użycie narkotyków w ciąży
• *pęknięcie błon płodowych
• *HCV koinfekcja (z 5% do 15%)
• *poród przewczesny

Pryncypia
• Prawdopodobieństwo MTCT:
• * bez leczenia od 20% do 28% (w
krajach rozwijających się: 30% -
60%)
• *z monoterapią AZT: 8% - 11%
• *z HAART: 1% - 2%

Pryncypia
• HAART jest rekomendowane jako
profilaktyka u każdej ciężarnej HIV(+) z
VL > 1000 c/mL.
• Z VL < 1000 c/mL (bez leczenia ARV)
rozważyć AZT w monoterapii
• Elektywne cięcie cesarskie (ecc) redukuje
ryzyko transmisji wertykalnej i powinno
być oferowane każdej ciężarnej HIV(+) w
38 tyg. ciąży (4-krotna redukcja ryzyka
transmisji)

Czynniki redukujące
transmisję wertykalną
• VL: wprost proporcjonalna
korelacja pomiędzy matczynym VL
a prawdopodobieństwem
transmisji wertykalnej: gdy
VL>100,000 c/mL to MTCT 41%;
gdy VL 1,000 - 10,000 to 17%; gdy
VL <1000 c/mL to 0%

Czynniki wpływające na
redukcję transmisji
wertykalnej
• Transmission rate
• study format treatment c-section vaginal delivery
• observational *no AZT 10,4% 19%
• *AZT 2% 7,3%
• randomized trial *no AZT 4% 20%
• *AZT 1% 4%

Czynniki wpływające na
redukcję transmisji
wertykalnej
• Elektywne cięcie cesarskie w 38
tygodniu ciąży zmniejsza ryzyko
transmisji wertykalnej 4-krotnie
• Karmienie piersią: ryzyko
transmisji to 16%; jest zabronione,
ale tylko w krajach rozwiniętych

Protokół ACTG 076
• Antepartum: AZT 300 mg bid from
week 14 to delivery
• intrapartum: AZT i.v. 2 mg/kg first
hour, then 1 mg/kg/hour until delivery
• postpartum: AZT syrup, 2 mg/kg q6h
for 6 weeks for the infant
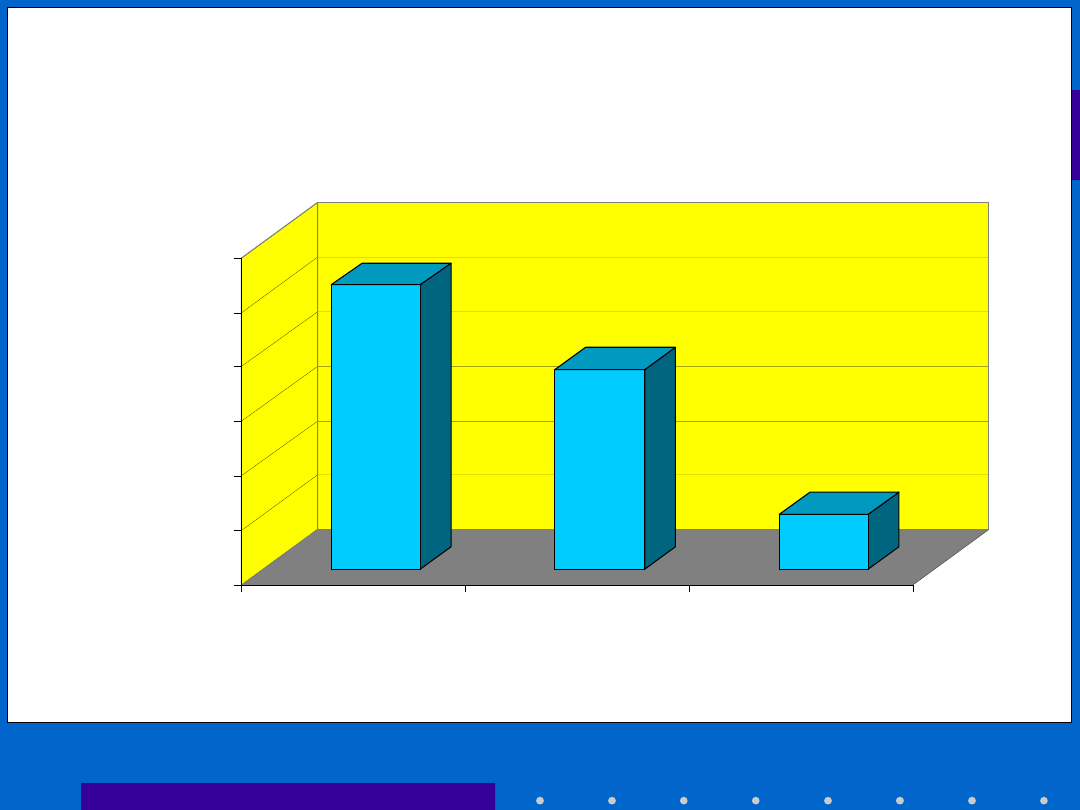
10.40%
7.30%
2.00%
0.00%
2.00%
4.00%
6.00%
8.00%
10.00%
12.00%
E.C.C.
AZT
E.C.C. +
AZT
RYZYKO Z.O. HIV -
MOŻLIWOŚCI INTERWENCJ I
International Perinatal HIV Group, NEJM,
1999, 340, 977

ACTG 076 - modyfikacje
• VL>1,000 c/mL: HAART w zależności
od liczby CD4; unikać EFV
(teratogenic), d4T + ddI (lactic
acidosis), d4T +AZT (pharmacologic
antagonism)
• VL<1,000 c/mL i liczba CD4 >350
cells/mm3: AZT w monoterapii zgodnie
z protokołem ACTG 076
• Poród tylko przez ecc !!

Profilaktyka po ekspozycji
zawodowej na HIV, HCV i
HBV
Anita Wnuk
Klinika Chorób Zakaźnych i
Hepatologii PAM

ZAKAŻENIE HIV NALEŻY DO
ZAKAŻEŃ szerzących się
drogą naruszenia ciągłości
tkanek:
• Przetoczenie krwi i preparatów
krwiopochodnych
• Przeszczepy, zapłodnienie
zakażonym nasieniem
• Iniekcje, zabiegi inwazyjne
medyczne i niemedyczne
• Kontakt seksualny = STD
• Z matki na dziecko

Pracownik medyczny, który
może ulec ekspozycji
zawodowej to osoba:
• Pracująca z pacjentem
• Z jego materiałem
biologicznym
• W laboratorium
• Przy utylizacji materiałów
biologicznych

EKSPOZYCJA ZAWODOWA
NA ZAKAŻENIE HIV, HBV,
HCV
(
naruszenie ciągłości tkanek)
• Zakłucie igłą lub zacięcie ostrym
narzędziem zanieczyszczonym
„zakaźnym” materiałem biologicznym
• Pochlapanie błon śluzowych
„zakaźnym” materiałem biologicznym
• Kontakt skóry uszkodzonej z
„zakaźnym” materiałem biologicznym

„ZAKAŹNY” MATERIAŁ
BIOLOGICZNY
• KREW I PREPARATY KRWIOPOCHODNE
• NASIENIE
• WYDZIELINA POCHWOWA
• PŁYN MÓZGOWO-RDZENIOWY
• PŁYN OWODNIOWY
• PŁYN Z OPŁUCNEJ, OTRZEWNEJ, OSIERDZIA,
STAWOWY
• MLEKO
• NIEUTRWALONE TKANKI I NARZĄDY
POCHODZĄCE OD CZŁOWIEKA ŻYWEGO LUB ZE
ZWŁOK
• KOMÓRKI LUB HODOWLE TKANKOWE
• KAŻDA WYDZIELINA I WYDALINA ZAWIERAJĄCA
WIDOCZNĄ KREW

„
NIEZAKAŹNY” MATERIAŁ
BIOLOGICZNY
• STOLEC
• MOCZ
• ŁZY
• ŚLINA
• POT
• WYMIOTY
• WYDZIELINA
NOSOWO-
GARDŁOWA
• AEROZOLE

Ekspozycja zawodowa –
ryzyko transmisji
• Ryzyko transmisji HIV:
• zakłucie igłą - 0,33%
• ekspozycja na błony śluzowe - 0,09%
• ekspozycja na uszkodzoną skórę -
0%
• (uszkodzona skóra=dermatitis,
otarcie naskórka, rany)

Ekspozycja zawodowa na
ostre narzędzia od
zakażonego „źródła”
• Źródło ryzyko
• HBV (pracownik sł.zdr.nieszczepiony):
• źródło HBeAg(+) 37% - 62%
• źródłoHBeAg(-) 23% - 37%
• HCV 1,8%
• HIV 0,3%

UŻYCIE ŚRODKÓW OCHRONY
OSOBISTEJ
• „Omnia homini,
dum vivit,
speranda sunt”
(Dopóki człowiek
żyje, powinien
spodziewać się
wszystkiego)

PRZY ZAKŁUCIU PRZEZ
RĘKAWICZKĘ LATEKSOWĄ:
* igłą pełną - usunięciu
ulega
86% krwi
*igłą wydrążoną – usunięciu
ulega
od 46% do 63% krwi

Monitorowanie ekspozycji
zawodowej
• Test na HIV: w momencie zakłucia, w
6 tyg., po 3 m-cach i po 6 m-cach
• Uwaga: abstynencja seksualna lub
seks bezpieczny do 6 m-cy od
ekspozycji oraz zakaz oddawania krwi
• Czas podania leków ARV: tak szybko
jak to możliwe, optymalnie w ciągu 1-
2 godzin do 24 godzin po ekspozycji

Profilaktyka po ekspozycji
na HIV
Status of source
exposure
Source
HIV+ and
low risk
Source HIV+
and high risk
HIV status of source
is unknown
Not severe: solid needle,
superficial
2 drug
PEP
3 drug PEP
Usually none
Severe: large bore, deep
injury, visible blood in
device, needle in
patient artery/vein
3 drug
PEP
3 drug PEP
Consider 2 drug PEP

Postępowanie po ekspozycji
na błony śluzowe i skórę
uszkodzoną
exposure
Source
HIV+ and
low risk
Status of
source
Source
HIV+and
high risk
unknown
Small
volume
(drops)
Large
volume
(major
blood
splash)
Consider 2
drug PEP
2 drug
PEP
2 drug
PEP
3 drug
PEP
No PEP
No PEP

Ekspozycja na HBV
• Pracownik sł.zdrowia
HBsAg(+) źródło nieznane
• nieszczepiony HBIG+szczepienie pełne szczepienie
pełne
• szczepiony
*responder nic nic
* non responder jak u nieszczepionego
• Status serologiczny szczepionego=test na p/ciała anty-
HBs;
*anty-HBs>10 mlU/mL - nic
*anty-HBs<10 mlU/mL - HBIG + 1 dawka szczepienia
*anty-HBs = 0 mlU/mL (non-responder): HBIG +
szczepienie pełne
Schematy szczepień
Podstawowy
0-1-6 m
Jeśli pożądane jest szybkie uzyskanie
optymalnej odpowiedzi immunologicznej
0-1-2-12 m
W wyjątkowych przypadkach u dorosłych
gdy wymagane jest szybkie przeprowadzenie
szczepienia pierwotnego
0-7-21dni-12
m
W przypadkach bezpośredniego ryzyka
zakażenia
( np. ukłucie skażoną igłą ), pierwszą dawkę
szczepionki należy podać równocześnie z
HBIG, jednak iniekcje te muszą być
wykonane w dwa różne miejsca.
0-1-2-12 m
Dla osób z zaburzeniami odporności ( np.
dla osób dializowanych ) – szczepienia
dawką 40 mcg. Schemat może być
zmieniony tak, aby miano przeciwciał anty
HBs pozostawało powyżej minimalnego
ochronnego poziomu 10 j.m./l
0-1-2-6 m

Profilaktyka po ekspozycji na
HCV
• Ryzyko: 1,8% po zakłuciu ostrym
narzędziem
• Źródło : test na anty-HCV; nie wykonuje się
testu na HCV-RNA
• Pracownik sł.zdr.:test na anty-HCV i ALT w
momencie ekspozycji oraz w 6 tyg. 3, 6 i 12
m-cu po ekspozycji
• HCV RNA u pracownika, gdy ALT↑ i/lub
anty-HCV (+)
• Nie ma profilaktyki!

PROTOKÓŁ POSTĘPOWANIA
PROTOKÓŁ POSTĘPOWANIA
POEKSPOZYCYJNEGO
POEKSPOZYCYJNEGO
1.
Data ekspozycji
2.
Rodzaj procedury i użytego narzędzia
3.
Rodzaj ekspozycji
4.
STOSOWANE ŚRODKI OCHRONY
OSOBISTEJ?
5.
„źródło” HCV, HBV, HIV ?
6.
Eksponowany HCV ? Szczepienie HBV
? HIV?
7.
POTWIERDZENIE PRZEZ
SZEFA/ŚWIADKA

HIV
HBV
• Dawka krwi
0,1 ml 0,00004
ml
• Odporność na temperaturę
56
0
C 120
0
C
• Wrażliwość na związki TAK NIE
chemiczne
• Przeżycie wirusa
poza organizmem kilka h ~7 dni
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
Wyszukiwarka
Podobne podstrony:
PROFILAKTYKA I LECZENIE HIV
Hulda Regehr Clark Kuracja życia rozdział 10 Leczenie HIV i AIDS
Leczenie zakażeń wirusem HIV Leczenie AIDS prezentacja pracy
AIDS, AIDS - leczenie, Leczenie zakażeń HIV
Leczenie zakażeń wirusem HIV Leczenie AIDS prezentacja pracy
Oparzenia Zasady Leczenia krĂłtkie
OGÓLNE ZASADY LECZENIA OSTRYCH ZATRUĆ
Inhibitory aromatazy w leczeniu uzupełniającym raka piersi
Leczenie bólu i opieka paliatywna w chorobach nowotworowych
LECZENIE STANÓW NAGLĄCYCH W DIABETOLOGII WYNIKAJĄCYCH Z NIEDOBORU INSULINY
IV lek leczenie wspomagające w onkologii Żywienie
Leczenie uzależnień
8a Nadcisnienie leczenie
Diagnostyka i leczenie kaszlu
Wspo¦ü éczesne metody zabiegowego leczenia kamicy moczowej
więcej podobnych podstron