
Pobieranie i transport
Pobieranie i transport
materiałów do badań
materiałów do badań
mikrobiologicznych
mikrobiologicznych

Ogólne zasady
Materiał należy pobrać:
z
miejsca zmienionego chorobowo
przed rozpoczęciem antybiotykoterapii
(wyjątkowo - jeżeli pacjent jest w
trakcie antybiotykoterapii - przed
kolejną dawką leku)

Ogólne zasady
W zależności od rodzaju materiał jest
pobierany:
do jałowego pojemnika (mocz, kał, plwocina)
na wymazówkę
na zestaw transportowy ogrzany do
temperatury pokojowej (posiew w kierunku
beztlenowców)
na podłoże hodowlane ogrzane do
temperatury ciała ludzkiego (krew, płyny)

Pojemniki do pobierania
materiałów

Wymazówki i zestawy
transportowe

Ogólne zasady
Pobrany materiał należy opisać
podając:
–
imię i nazwisko pacjenta, oddział
–
rodzaj materiału
–
datę i godzinę jego pobrania
W skierowaniu należy ponadto podać:
–
kierunek badania
–
wstępne rozpoznanie i ewentualne leczenie
(stosowane antybiotyki).

Ogólne zasady
Możliwie szybki transport do
laboratorium
Wyjątkiem od tej zasady są:
materiały pobrane na podłoża transportowe:
2-3 dni (kilka godzin w zakażeniach
beztlenowcowych);
materiały pobrane na podłoża hodowlane
mocze: 2-4 godzin w temp. 4
0
C (lodówka!)

Ogólne zasady
Wstępne wyniki badań
mikrobiologicznych:
po 24-48 godzinach
Wyniki ostateczne wraz z
antybiogramem
po 3-4 dniach
Badania w kierunku beztlenowców:
do 10 dni

Wskazania do pobrania krwi na
Wskazania do pobrania krwi na
posiew
posiew
Wystąpienie gorączki z objawami SIRS
Zakażenia narządowe lub układowe z
towarzyszącym złym stanem ogólnym
(zapalenie płuc, zakażenie układu moczowego,
zakażenie pooperacyjne)
Zapalenie wsierdzia
Obecność linii naczyniowej z towarzyszącą
infekcją w miejscu wkłucia i/lub złym stanem
ogólnym

Zasady pobierania krwi na posiew
Zasady pobierania krwi na posiew
Warunki aseptyczne
Warunki aseptyczne (jałowe rękawiczki,
dezynfekcja miejsca wkłucia)
Czas: najlepiej
około 30 min
około 30 min. przed spodziewanym
szczytem gorączki
Podłoże do hodowli bakterii tlenowych i
beztlenowych
(dwa oddzielne podłoża lub
jedno wspólne)
ogrzane do
ogrzane do
temp. 37
temp. 37
0
0
C
C
Odpowiednia
proporcja objętości
proporcja objętości próbki do
objętości
odłoża

Podłoża do posiewu krwi
Pobieranie próbek krwi
Pobieranie próbek krwi
Sepsa; gorączka
o
prawdopodobny
m tle
infekcyjnym
Gorączka o
nieustalonej
etiologii
2-3 próbki z różnych wkłuć,
co 10-15 min.; przy
podejrzeniu zak. grzybiczych 3
próbki co 30 minut
2 próbki z różnych wkłuć w
ciągu 1h; powtórzyć po 24
godzinach (jeżeli wynik
ujemny)
Zapalenie
wsierdzia
Ostre: 2-3 próbki z różnych
wkłuć w ciągu 1-2h
Podostre: 2 próbki z
różnych wkłuć w ciągu
doby

Diagnostyka odcewnikowych
Diagnostyka odcewnikowych
zakażeń krwi
zakażeń krwi
Badanie cewnika
Badanie cewnika
Pobranie materiału:
usunąć aseptycznie
cewnik
odciąć końcówkę (3-5 cm)
Metody badania:
–
półilościowa (metoda rolowania);
cewniki
założone < tygodnia; istotny wynik 15 CFU
–
ilościowa;
cewniki utrzymywane > tygodnia;
istotny wynik 10
2
CFU
Uwaga:
interpretacja wyników nie dotyczy
cewników pokrytych substancjami antybakteryjnymi!

Diagnostyka odcewnikowych
Diagnostyka odcewnikowych
zakażeń krwi
zakażeń krwi
Badanie parzystych próbek krwi:
Badanie parzystych próbek krwi:
Pobranie materiału:
próbka pobrana przez cewnik centralny
próbka pobrana ze świeżego wkłucia
Metody badania:
–
ilościowa;
istotny wynik 5:1 CFU (CVC vs.
obwód)
–
jakościowa;
różny czas uzyskania dodatnich
wyników; istotny wynik >2 h (CVC vs. obwód)
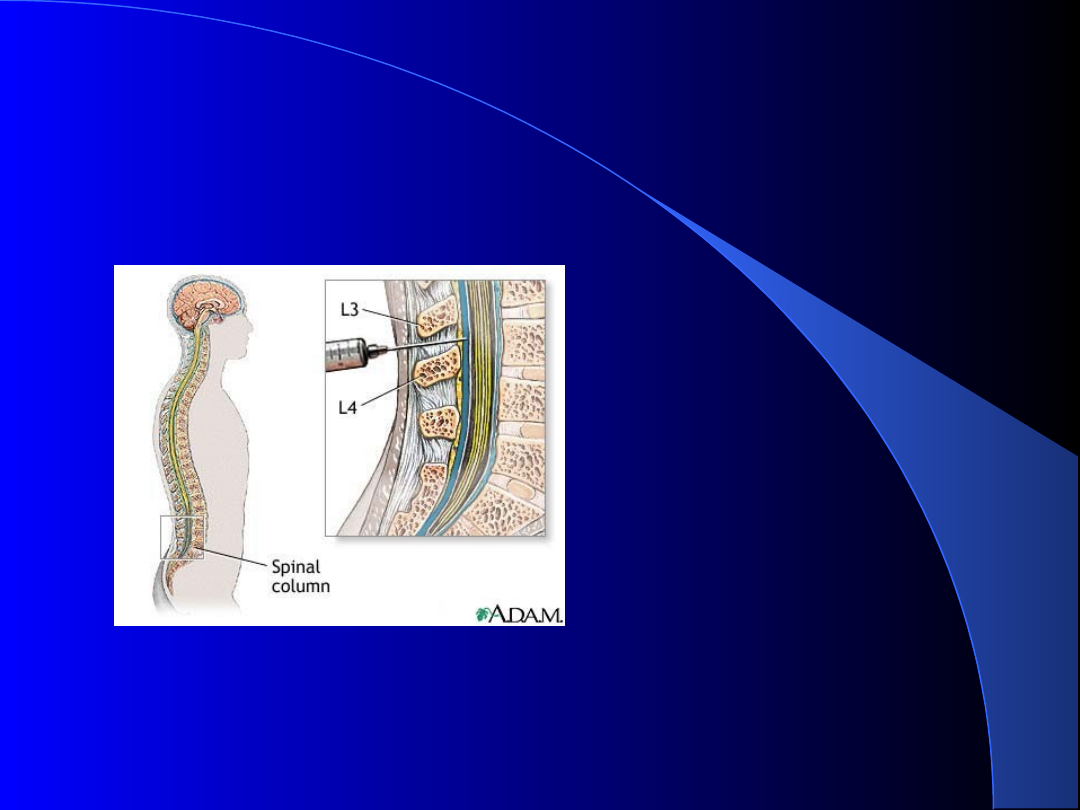
Pobranie płynu mózgowo-
rdzeniowego
Meningomediu
m
+ „pilotka”
w celu
wykonania: -
preparatu
bezpośr. -
szybkich testów
serologicznych

Płyny wysiękowe, wydzieliny
z drenów
Materiały te należy pobrać
:
:
–
na podłoża do tlenowego i beztlenowego
posiewu krwi;
–
do jałowej probówki
Płyny punkcyjne - z zachowaniem zasad aseptyki
Treść z drenu - przez punkcję układu drenującego
w pobliżu wyjścia drenu z powłok ciała; zmienić
igłę i wprowadzić zawartość strzykawki do podłóż

Wydzieliny ropne
Zmiany powierzchniowe -
badanie
w kierunku bakterii tlenowych
Sposób pobrania:
na wymazówkę
Zmiany głębokie -
badanie w
kierunku bakterii tlenowych i
beztlenowych
Sposób pobrania:
na podłoże
transportowe

Układ pokarmowy
Kał:
pobrany do jałowego pojemnika
Przechowywanie i transport:
temp. pokojowa - badanie bakteriologiczne
temp. - 20
0
C lub + 4
0
C - badanie
wirusologiczne
Wymaz z odbytu
Bioptaty z żołądka (Helicobacter pylori)

Górne drogi oddechowe
Wymaz z przedsionka nosa:
nosicielstwo S.
aureus
Wymaz z migdałków:
ropnie, anginy
Wymaz z tylnej ściany gardła
Wymaz spod nagłośni: Mycoplasma, Chlamydia
Wymaz z jamy ustnej

Dolne drogi oddechowe
Plwocina -
odkrztuszona do jałowego
pojemnika rano, po wykonaniu toalety jamy
ustnej i przepłukaniu jej przegotowaną wodą
Wydzielina oskrzelowa
odsysana u
pacjentów zaintubowanych, pobrana do
jałowego pojemnika
Inne:
–
bronchoaspirat
–
popłuczyny pęcherzykowo-oskrzelowe (BAL)
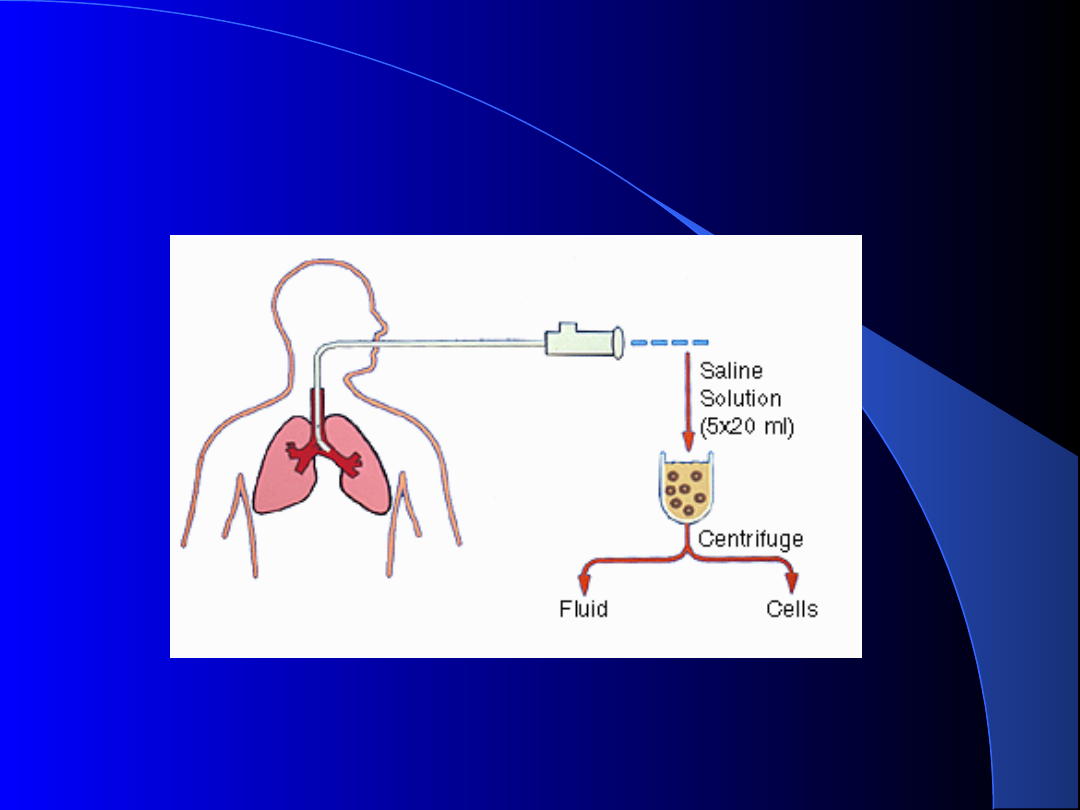
Pobranie popłuczyn oskrzelowych -
BAL

Mocz
Metoda pobrania:
ze środkowego strumienia
przez punkcję układu drenującego
przez nakłucie nad spojeniem łonowym
Sposób pobrania:
do jałowego pojemnika
na podłoże transportowo-hodowlane
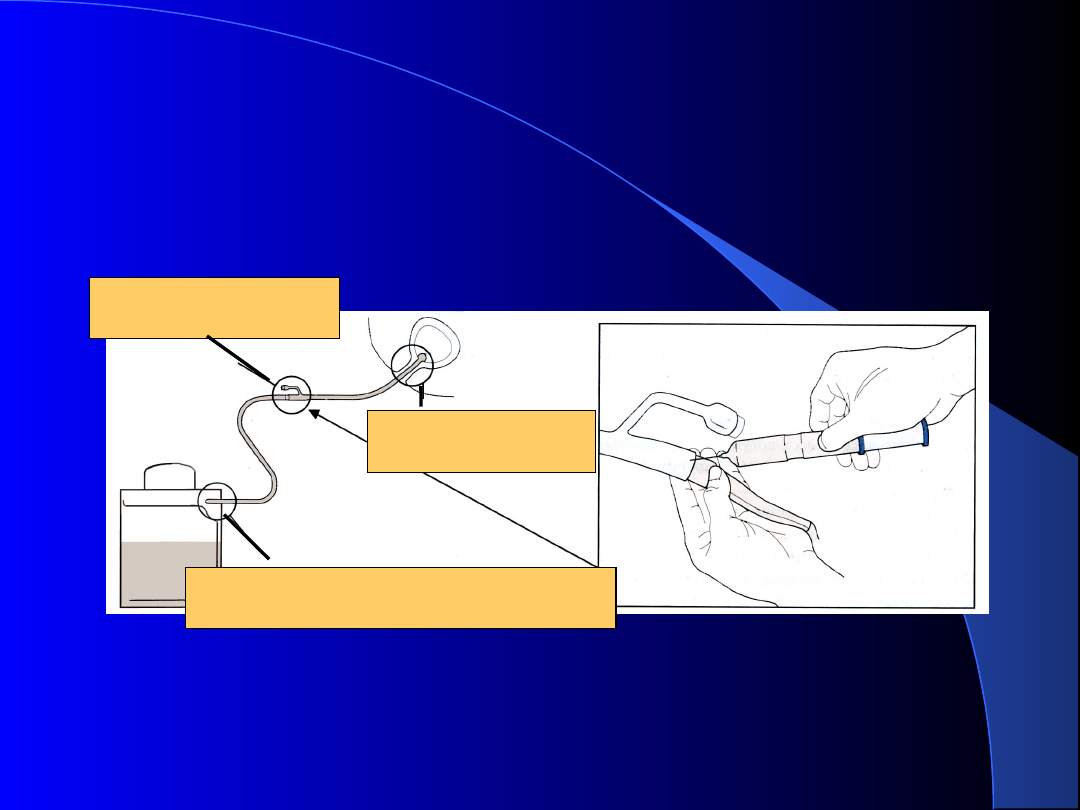
Pacjent cewnikowany
Pacjent cewnikowany
Miejsca wniknięcia
bakterii
Połączenie cewnika
z workiem
Połączenie z workiem zbierającym,
reflux moczu z worka do cewnika
Wejście do cewki,
okolice cewnika
Sposób pobierania moczu, z cewnika,
do badań laboratoryjnych

Biofilm na powierzchni cewnika
moczowego
stan po 3
godzinach od
kolonizacji
stan po 100
godzinach od
kolonizacji

Pobranie moczu na podłoże
transportowe

Badania środowiska
Badania środowiska
Tylko jako element dochodzenia
Tylko jako element dochodzenia
epidemiologicznego !
epidemiologicznego !
Kontrola powietrza
Kontrola powietrza
metoda sedymentacji
metoda zderzeniowa
Kontrola powierzchni
Kontrola powierzchni
metoda odcisków
metoda wymazów

Metoda odcisków
Metoda odcisków
Count-Tact -
kontrola czystości
powierzchni

Badania środowiska
Badania środowiska
Kontrola personelu
Kontrola personelu
kontrola nosicielstwa
kontrola czystości mikrobiologicznej rąk
Kontrola procesów sterylizacji
Kontrola procesów sterylizacji
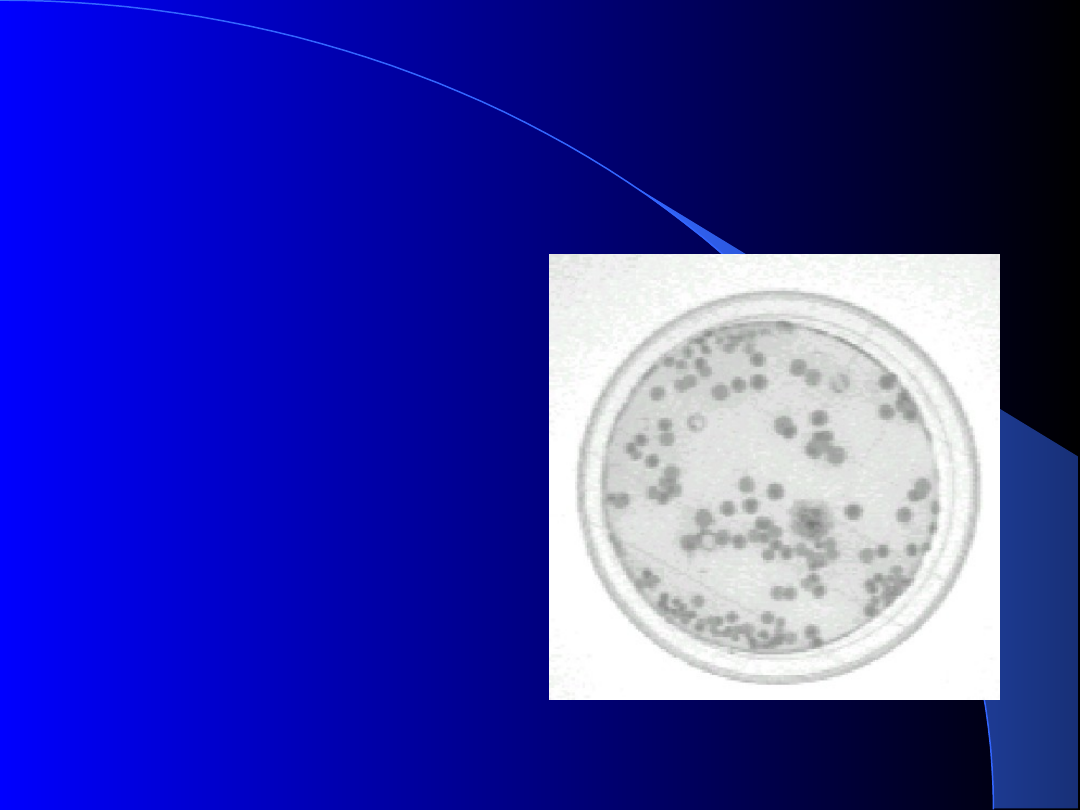
Mikrobiologiczna kontrola
Mikrobiologiczna kontrola
rąk
rąk
Odcisk po
chirurgicznym
myciu rąk:
chirurg J.K.
VI. 2001.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
Wyszukiwarka
Podobne podstrony:
Pobieranie materiałów do badań
POBIERANIE MATERIALOW DO BADAN MIKROBIOLOGICZNYCH ppt
pobieranie materiału d do badań
technika pobierania materiału do badań
Pobieranie materiału do badań biologicznych, Ratownicto Medyczne, MIKROBIOLOGIA
pobieranie materialu do badań morfologicznych wyklady
Pobieranie materiałów do badań
POBIERANIE MATERIALOW DO BADAN MIKROBIOLOGICZNYCH ppt
Pobieranie materiałów do badań
Pobieranie materiału do badań laboratoryjnych
POBIERANIE I PRZECHOWYWANIE MATERIAŁÓW DO BADAŃ wiRUSOLOGICZNYCH prezentacja
pobieranie i przesyłanie materiałów do badań mikrobiologicznych, mikrobiologia
Pobieranie i przesyłanie materiału do badań, UM Wrocław - Stomatologia, Mikrobiologia i mikrobiolog
POBIERANIE I PRZECHOWYWANIE MATERIAŁÓW DO BADAŃ wiRUSOLOGICZNYCH prezentacja
Badanie cytologiczne i histopatologiczne Zasady prawidłowego pobierania, opisywania i przesyłania ma
genetyka cw 9 materiał do badan
więcej podobnych podstron