CO
2
CO
NH
3

N
N
M
ethylenediamine
H
2
N-CH
2
-CH
2
-NH
2
H
2
H
2
CHELATY
O
H
2
O
H
2
N
O
M
N
O
glycine
H
2
N-CH
2
-COOH
O
O
O
O
M
O
O
O
O
O
O
OH
OH
tartrate
HOOC-CH-CH-COOH
OH
OH
O
O
HO
OH
OH
OH
=
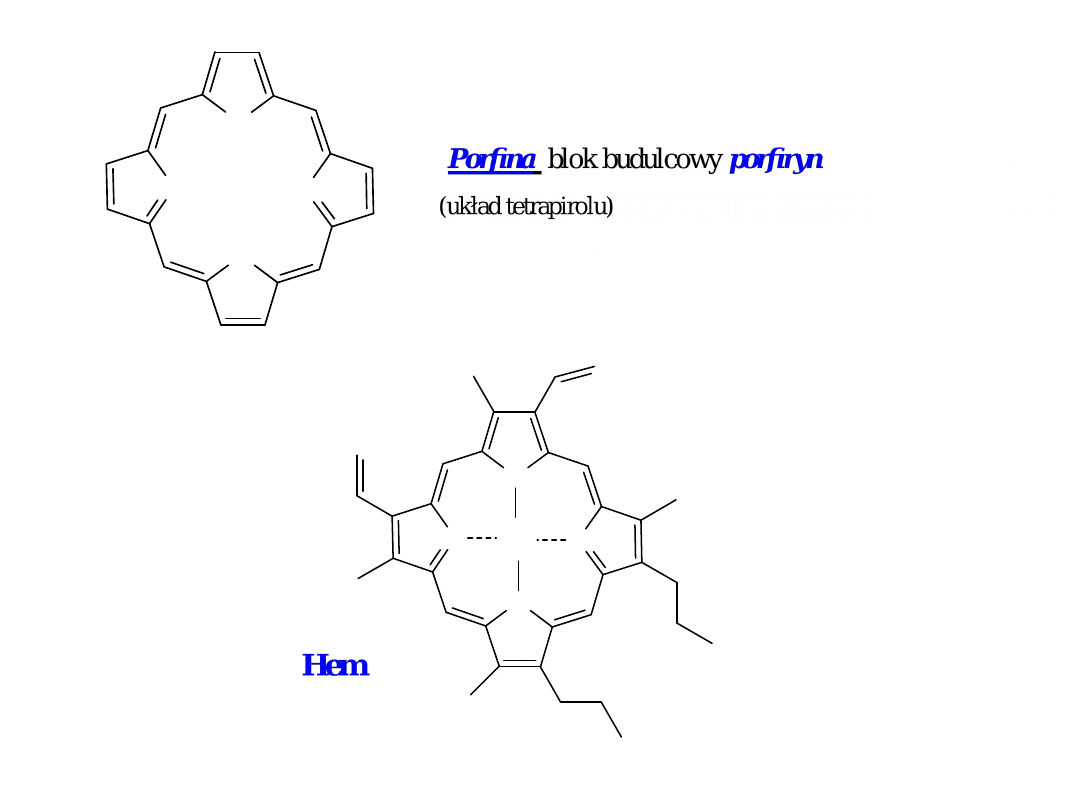
N
H
N
H
N
N
N
N
N
N
Fe
COOH
COOH

N
O
O
O
H
N
N
N
N
N
N
N
N
O
S
O
N
H
7
quinoline
isoquinoline
1
2
3
3
4
5
6
7
8
2
4
3
5
7
6
indole
4
6
8
5
4H-pyran
(THP)
tetrahydropyran
2H-pyran
4
5
8
7
6
purine
2
pyridazine
pyrazine
pyrimidine
piperidyne
pyridyne
isooxazole
1
isothiazole
2
1
1
3
oxazole
O
N
thiazole
pyrazole
imidazole
S
N
N
N
N
H
N
N
N
H
1
(epoxide)
oxiran
(THF)
tetrahydrotiophene
tiophene
tetrahydrofuran
furan
pyrrolidine
pyrrole
S
O
N
H
N
N
piperazine
N
N
N
H
1
9
N
1
3
N
H
1
N
1
1
4
2
2
S
1
3
2
3
O
1
2
1
3
1
2
1
2
Wybrane, biologicznie ważne układy heterocykliczne
Acid
pK
a
Conjugate base
hexane
45
C
6
H
11
–
NH
3
/liquid
34
NH
2
–
HC
CH
25
HC
C
–
CH
3
CH
2
OH
18
CH
3
CH
2
O
–
H
2
O
14
HO
–
HPO
4
2–
12.32
PO
4
3–
HCO
3
–
10.33
CO
3
2–
Phenol
10
phenolate
NH
4
+
9.25
NH
3
H
2
PO
4
–
7.2
HPO
4
2–
H
2
S
7.04
HS
–
H
2
CO
3
6.3
HCO
3
–
CH
3
COOH
4.7
CH
3
COO
–
Ascorbic acid
4.1
ascorbate
HF
3.2
F
–
H
3
PO
4
2.12
H
2
PO
4
–
HNO
3
-1.0
NO
3
–
H
3
O
+
0
H
2
O
HCl
-7
Cl
–
H
2
SO
4
-9
HSO
4
–
HI , HClO
4
-10
I
–
, HClO
4
–
SbF
5
.
FSO
3
H
-12
SbF
5
.
FSO
3
–
Scale of acidities and basicities
increasing acidity
increasing basicity

Half- Reaction
E
o'
(V)
1
/
2
O
2
+ 2H
+
+ 2e
-
=> H
2
O
+0.816
Fe
3+
+ e
–
-
=> Fe
2+
+0.771
Fumarate + 2H
+
+2e
-
=> succinate
+0.30
Cytochrome c
3+
+ e
-
=> cytochrome c
2+
+0.230
Cu
2+
+ 2e
-
=> Cu
+
+0.15
Ubiquinone + 2H
+
+ 2e
-
=> ubichinon-H2 (ubiquinol)
+0.10
Dehydroascorbinate + 2H
+
+ 2e
-
=> ascorbinate
+0.06
Pyruvate + NH
3
+ 2H
+
+ 2e
-
=> alanine
–0.13
Oxaloacetate + 2H
+
+ 2e
-
=> malate
–0.166
FAD + 2H
+
+ 2e
-
=> FADH
2
–0.18
Pyruvate+ 2H
+
+ 2e
-
=> lactate
–0.190
Acetaldehyde + 2H
+
+ 2e
-
=> ethanol
–0.197
GSSG + 2H
+
+ 2e
-
=> 2GSH (Glutathione)
–0.23
NAD
+
+ H
+
+ 2e
-
=> NADH
–0.315
Acetoacetate + 2H
+
+ 2e
-
=>
-hydroxybutyrate
–0.346
Oxoglutarate + CO
2
+ 2H
+
+ 2e
-
=> isocitrate
–0.380
2H
+
+ 2e
-
=> H
2
–0.420
Standard Reduction Potentials of Some Biochemically Important
Half-Reactions (at pH=7.0)
Source: P.A. Loach, In Handbook of Biochemistry and Molecular Biology (3
rd
ed.), Physical and Chemical Data, CRC Press, 1976
Me
Me
H
C
C
C
C
C
C
H
Me
Me
sp
2
sp sp
2
1,3-dimetyloallen H
3
C-CH=C=CH-CH
3
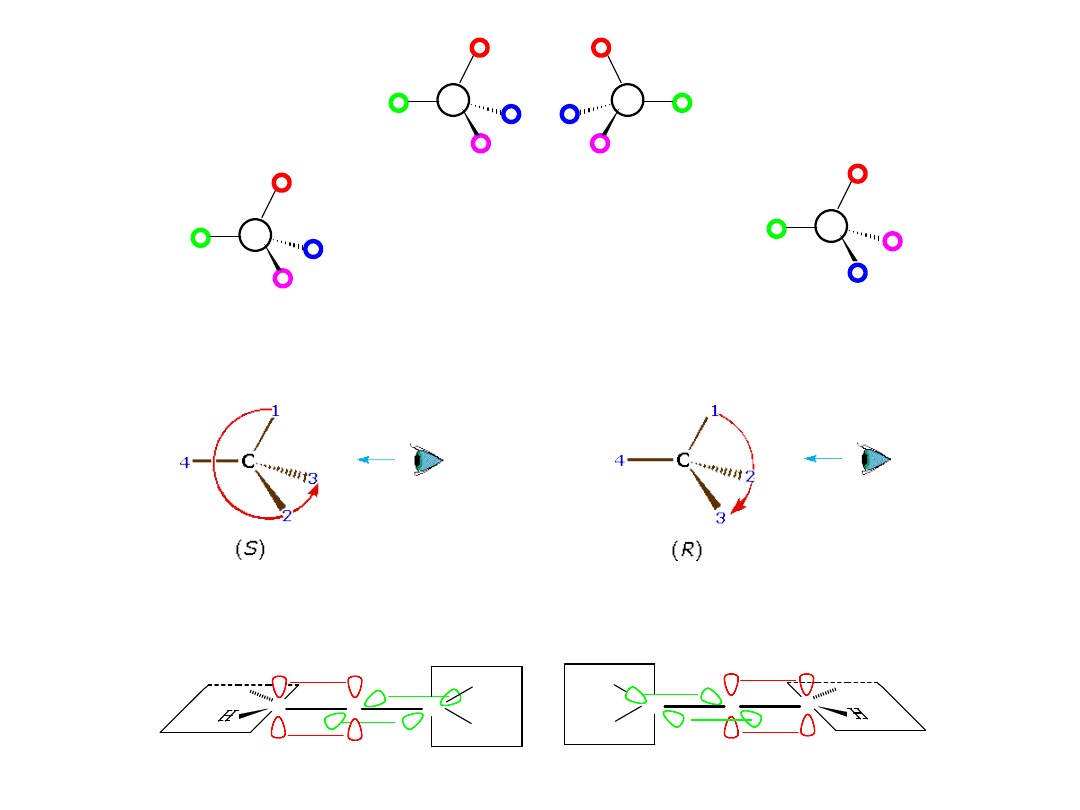
Po ustaleniu pierwszeństwa podstawników zgodnie z regułami
Cahna-Ingolda-Preloga określamy konfigurację absolutną:

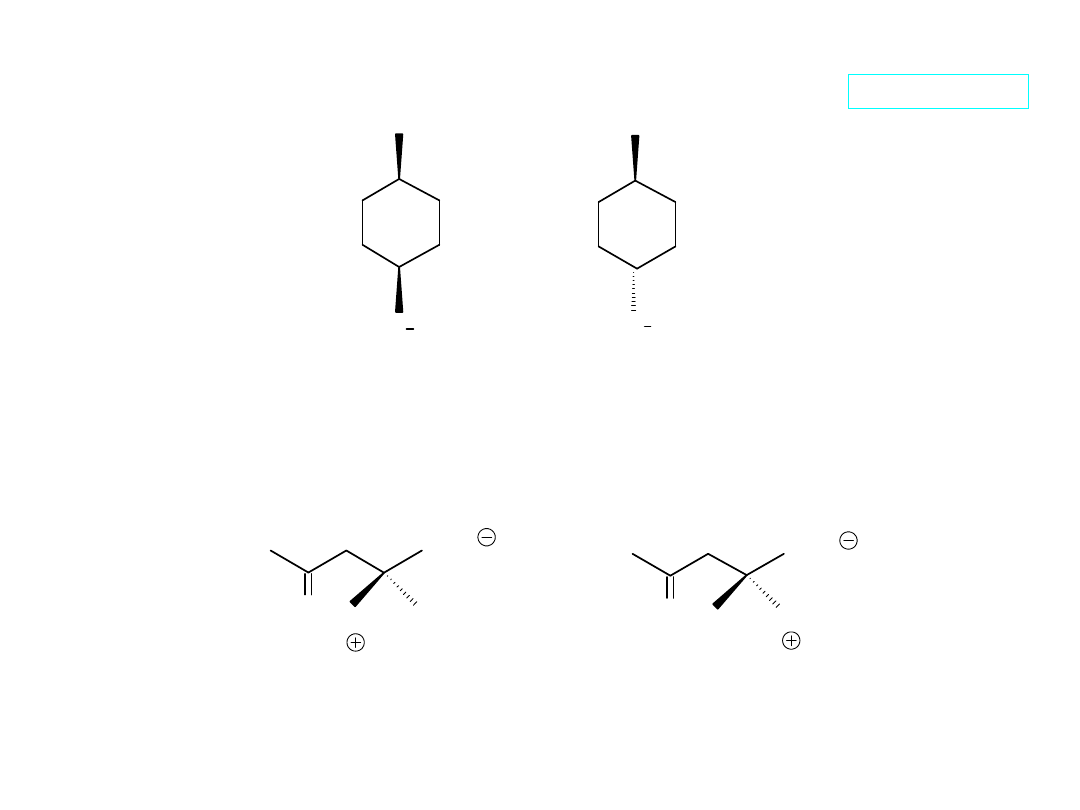
Diastereoizomery
(w tym izomery geometryczne)
wykazują różne właściwości:
(Z)-2-buten (E)-2-buten
t.w. +4°C +1°C
t.t. –139°C –106°C
>0.0 0.0 D
(Z)-1,2-dichloroeten (E)-1,2- dichloroeten
t.w. +60°C +48°C
t.t. –80°C –50°C
2.85 D 0.0 D

(R)-2-butanol (S)-2-butanol
t.w. +99.5°C +99.5°C
t.t. –115°C –115°C
1.397 1.397
d 0.808 g/cm
3
0.808 g/cm
3
[]
D
–13.52°
+13.52°
(R)-(+)-2-metylo-1-butanol (S)-(–)-2-metylo-1-butanol
t.w. +128.9°C +128.9°C
t.t. –70°C –70°C
1.4107 1.4107
d 0.8193 g/cm
3
0.8193 g/cm
3
[]
D
+5.756°
–5.756°
Konkluzja:
enancjomery
mają
identyczne (!) właściwości fizyczne.
Pytanie:
czy
wykazują
one identyczne właściwości?
CHO
(CH
3
)
2
C OH
CHO
przyjemny zapach bez zapachu
lilii
cis- trans-
(CH
3
)
2
C OH
H
2
N
O
NH
3
H
COO
H
2
N
O
NH
3
H
COO
L
-asparagina
D
-asparagina
smak gorzki smak słodki
Stereoizomery mogą wykazywać zróżnicowane działanie
Copyright P.Bukowski
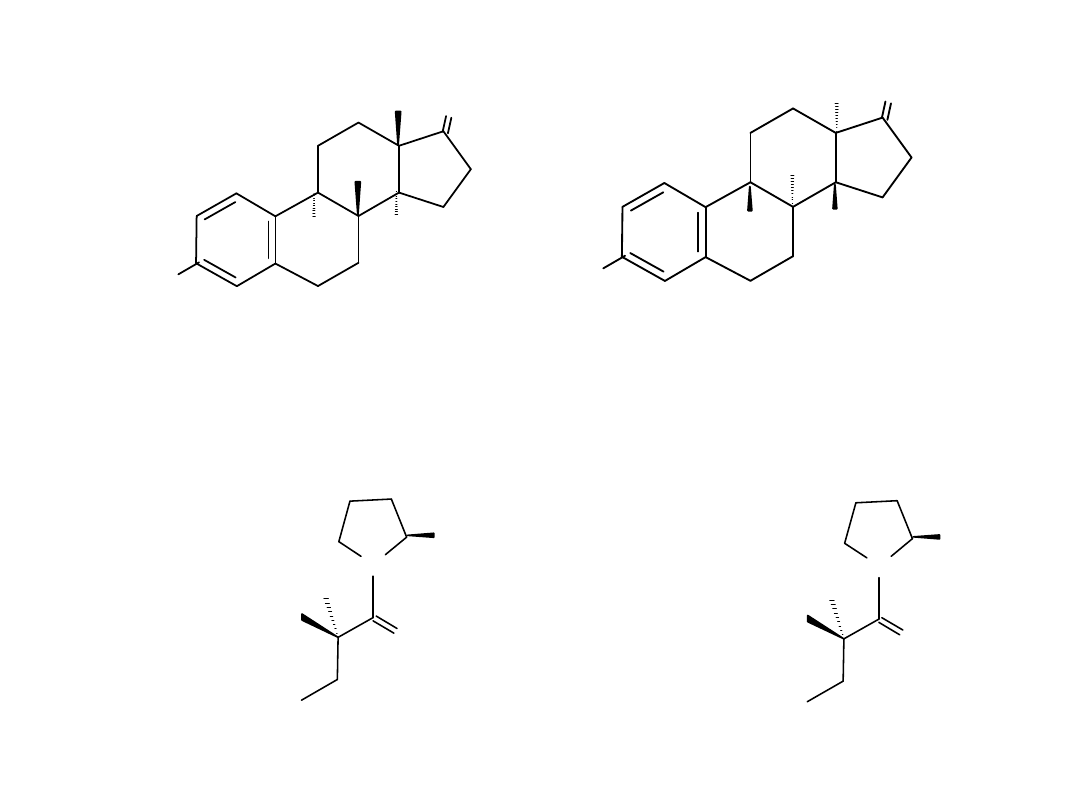
O
H
H
H
CH
3
HO
( ) estron
+
O
H
H
H
CH
3
HO
( ) estron
_
aktywny hormon całkowicie nieaktywny
N
COOH
O
HS
H
3
C
N
COOH
O
HS
H
3
C
Captopril
lek przeciw diastereoizomer
nadciśnieniu 100 x mniej aktywny
H
H
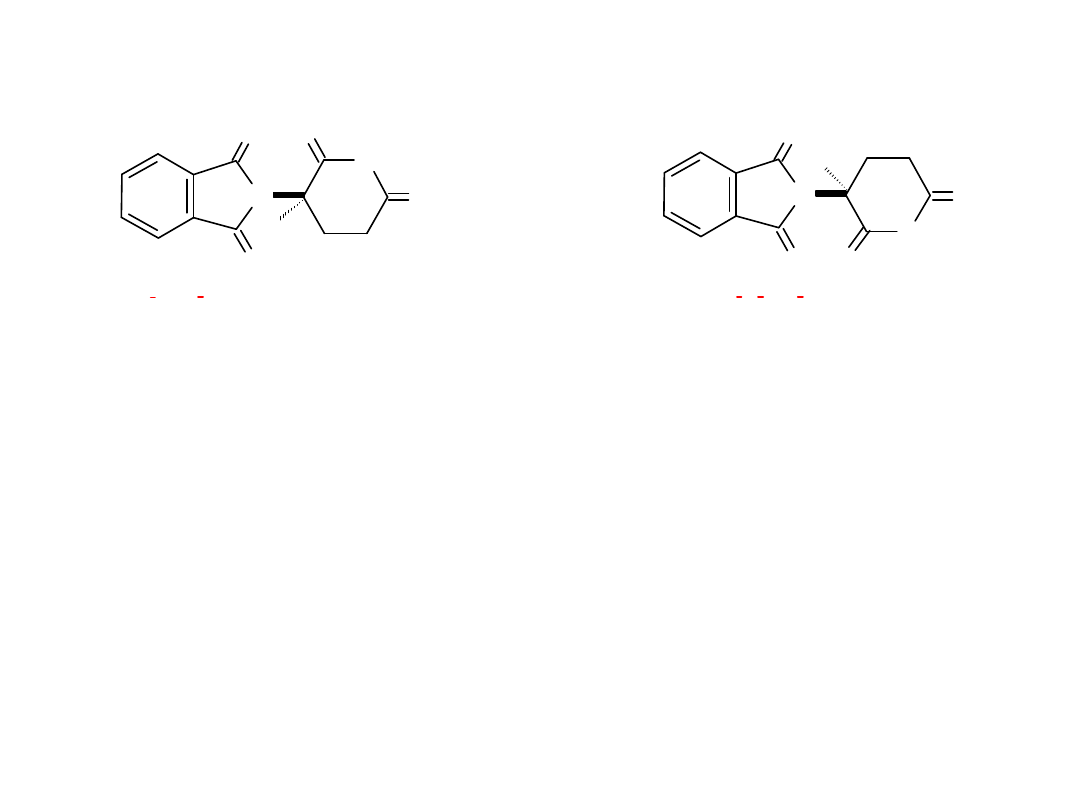
N
NH
O
O
O
O
N
NH
O
O
O
O
H
H
(R) ( ) THALIDOMIDE (S) ( ) THALIDOMIDE
_
+
_
lek o działaniu uspokajającym działanie teratogenne
i słabo nasennym
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
Wyszukiwarka
Podobne podstrony:
classes 10 12 2008
16 10 12 pierwsze ćwiczenia
W2 16 10 12
wyklad 10 12 2008
10 12 2008 cennik detaliczny
Architektura komputerów I 16 12 2008
wyklady z GONu na drugiego kolosa, WYKúAD 16.12.2008, GOSPODARKA NIERUCHOMOŚCIAMI - SEM
kola 16 12 2008
Prawo cywilne - ćwiczenia 1.12.2008, Prawo cywilne(16)
wykład 3 - 16.10.2008, FARMACJA, ROK 5, TPL 3, Zachomikowane
Notatki - PO - 10.12.2007, Filozofia UKSW 2007-2010, Rok I (2007-2008), Notatki, Semestr I, Psycholo
ZW Pol pien PP 2011 2012 odcinek 1 dla studentów slides z wykładów w dniach 02 16 10 2011
30 ROCZNICA 16 10 2008
pg 2008 10 12
Prawo cywilne - ćwiczenia 22.12.2008, Prawo cywilne(16)
2008 12 10 (12)
2008 12 10 (12)
więcej podobnych podstron