
Odczyn roztworu
Skala pH
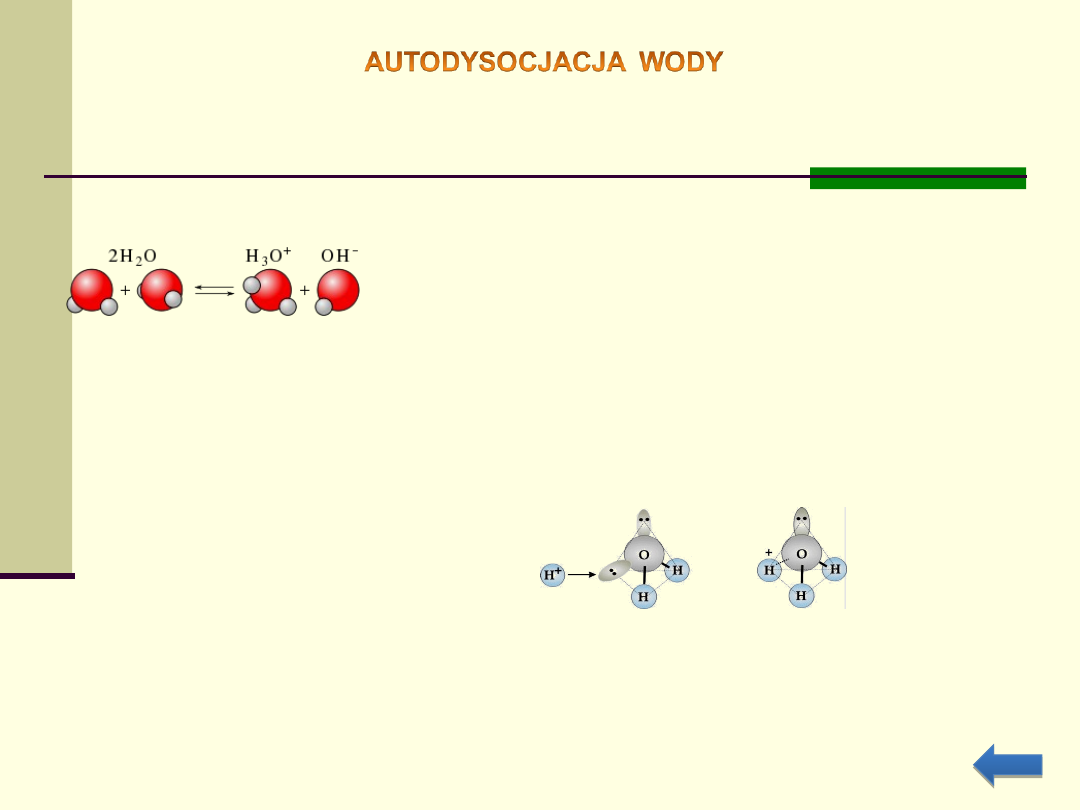
Rozpuszczalniki polarne mają zdolność do samo-jonizacji (autojonizacji).
Oznacza to, że cząsteczki tych rozpuszczalników mogą reagować ze sobą
tworząc odpowiednie kationy i aniony.
Dla wody proces autodysocjacji można opisać równaniem:
W wyniku tej reakcji powstaje
jon hydroniowy
oraz
jon hydroksylowy
(wodorotlenowy)
Jon hydroniowy można traktować jako kation wodorowy (zjonizowany
atom wodoru – proton) solwatowany jedną cząsteczką wody
Reakcję można uprościć odejmując jedną cząsteczkę
wody:
OH
O
H
O
H
O
H
3
2
2
OH
H
O
H
2
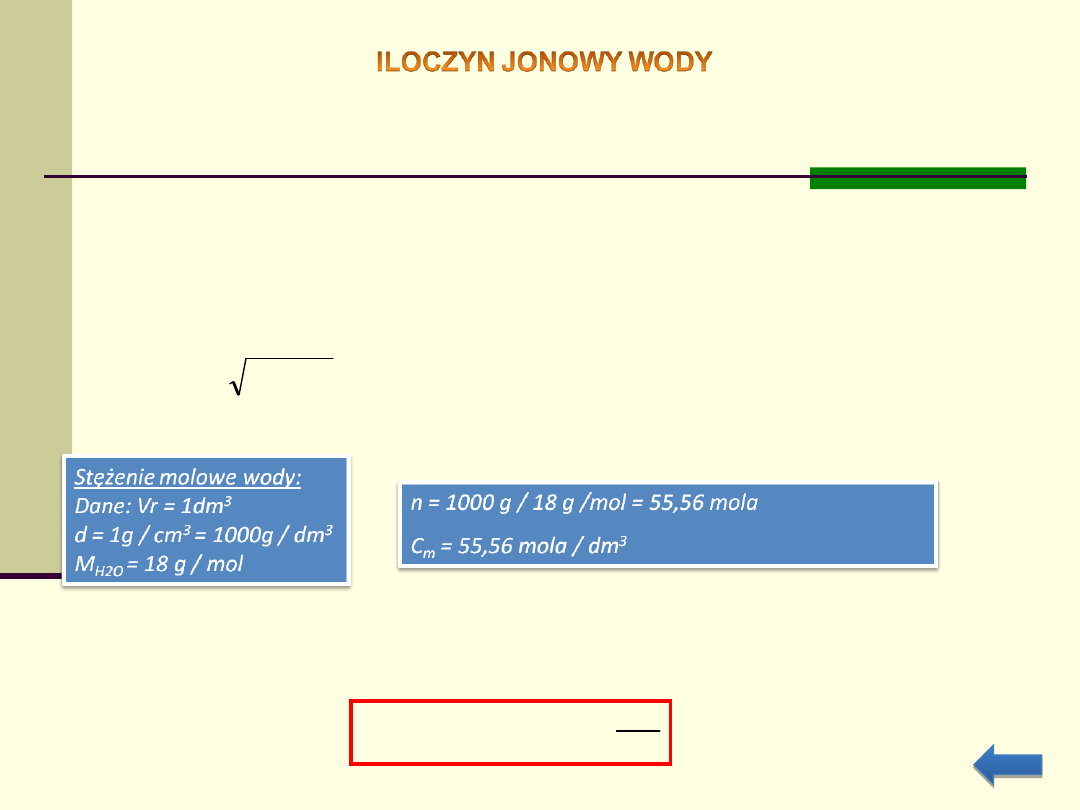
Iloczynem jonowym wody nazywamy iloczyn stężeń molowych
jonów wodorowych (hydroniowych) i jonów hydroksylowych.
W temperaturze pokojowej (20
0
C ) i pod ciśnieniem
atmosferycznym (1013 hPa)iloczyn ten wynosi 10
-14
3
7
3
14
3
14
-
3
16
-
mola/dm
10
1
mola/dm
10
1
]
[H
mola/dm
10
1
dm
55,56mola/
10
1,8
[OH
]
[H
]
O]
[H
K
]
][OH
[H
2
Dla czystej wody stężenie jonów wodorowych jest równe
stężeniu jonów hydroksylowych:
3
dm
mol
7
10
]
[OH
]
[H
Operowanie liczbami rzędu 10
-7
jest kłopotliwe, dlatego wprowadzono
tzw. wykładnik stężenia jonów wodorowych.
Wykładnik stężenia jonów wodorowych pH jest to ujemny logarytm
dziesiętny stężenia kationów wodorowych, wyrażonego w mol/dm
3
Wykładnik stężenia jonów wodorowych pH jest to ujemny logarytm
dziesiętny stężenia kationów wodorowych, wyrażonego w mol/dm
3
pH to wartość wykładnika potęgi ze znakiem ujemnym, do której należy
podnieść liczbę 10, aby uzyskać stężenie jonów wodorowych.
]
log[H
pH
]
log[OH
pOH
Logarytmując równanie iloczynu jonowego wody otrzymujemy:
14
pOH
pΗ
Roztwór obojętny to taki, który zawiera równe ilości jonów
wodorowych (hydroniowych) i wodorotlenowych (identyczne
stężenia).
[OH
-
] = [H
3
O
+
]
pH < 7
w roztworach kwaśnych
pH = 7
w roztworach obojętnych
pH >7
w roztworach zasadowych
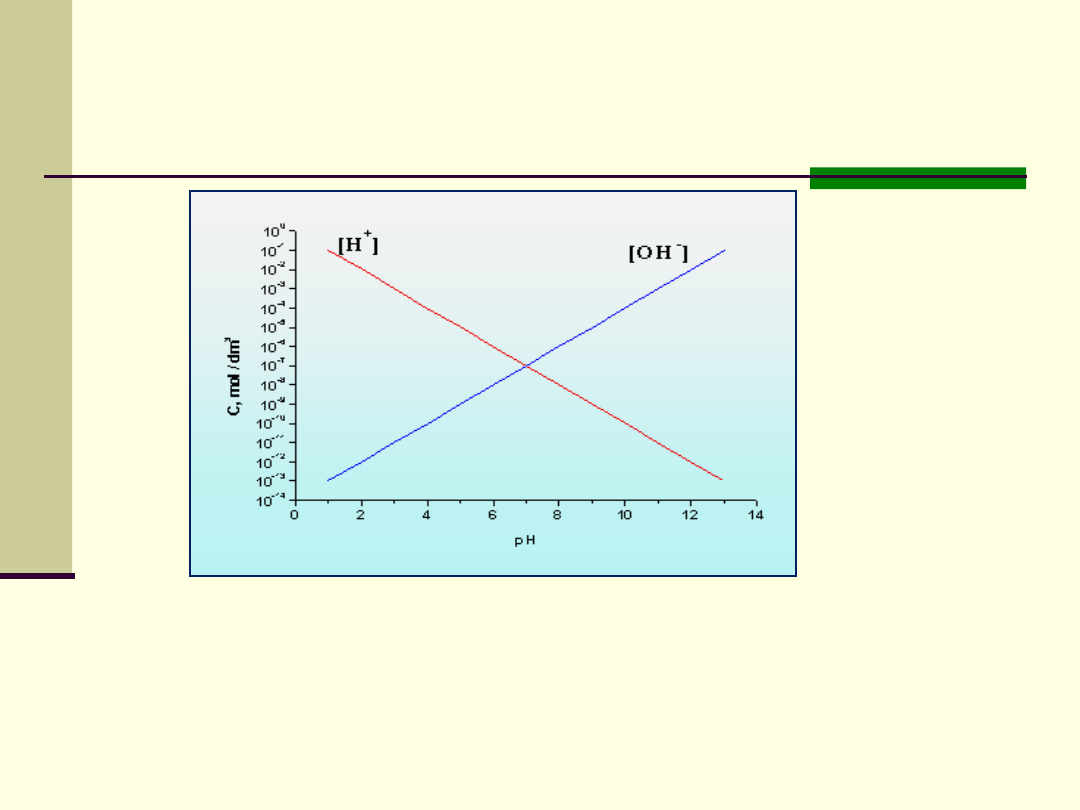
Graficzny wykres zależności między pH a stężeniem jonów
wodorowych i hydroksylowych

Przykłady
? Oblicz stężenie jonów wodorowych i wodorotlenowych w 0,001
molowym roztworze KOH. Oblicz pH roztworu
Dane:
Cm = 0,001 mol/dm
3
Dla mocnych elektrolitów, rozcieńczonych elektrolitów przyjmujemy α=1
KOH -- > K
+
+ OH
-
3
11
3
3
3
mol/dm
10
]
O
[H
11
3
14
pH
3
pOH
mol/dm
10
]
[OH
? Oblicz pH 0,01 molowego kwasu solnego
Dane:
Cm = 0,01 mol/dm
3
Cl
O
H
O
H
HCl
3
2
HCl jest mocnym kwasem, więc α=1
Cm = 10
-2
mol/dm
3
→ pH = 2

Wskaźniki ( indykatory )
substancje zmieniające barwę w
zależności od odczynu roztworu. Służą do orientacyjnego badania pH
Fenoloftaleina
Wskaźnik uniwersalny
Oranż metylowy
Błękit bromotymolowy
Lakmus
Wywar z czerwonej kapusty
Esencja herbaciana
Sok z jagód
Papierki uniwersalne są nasączone mieszaniną różnych wskaźników.
Każdej wartości pH odpowiada inne zabarwienie papierka. Dołączony
jest wzorzec z zabarwieniem dla każdej wartości pH.
Odczyn roztworu jest cechą roztworu określającą,
czy w roztworze znajduje się nadmiar
kationów wodorowych (odczyn jest kwaśny),
nadmiar anionów wodorotlenkowych oznacza, że
odczyn jest zasadowy, czy są one w równowadze,
wówczas odczyn jest obojętny.
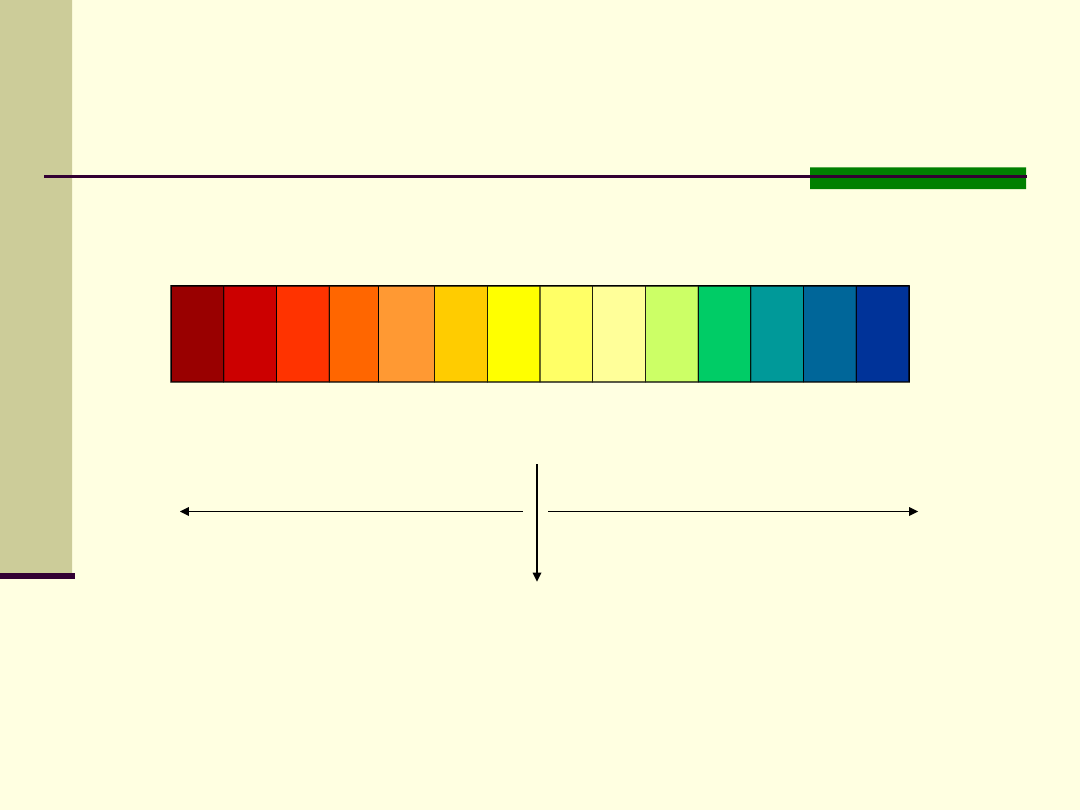
pH 0 1 2 3 4 5 6 7 8 9
10 11 12 13 14
Odczyn kwaśny
Odczyn
zasadowy
Odczyn
obojętny
Zmiany zabarwienia wskaźnika uniwersalnego
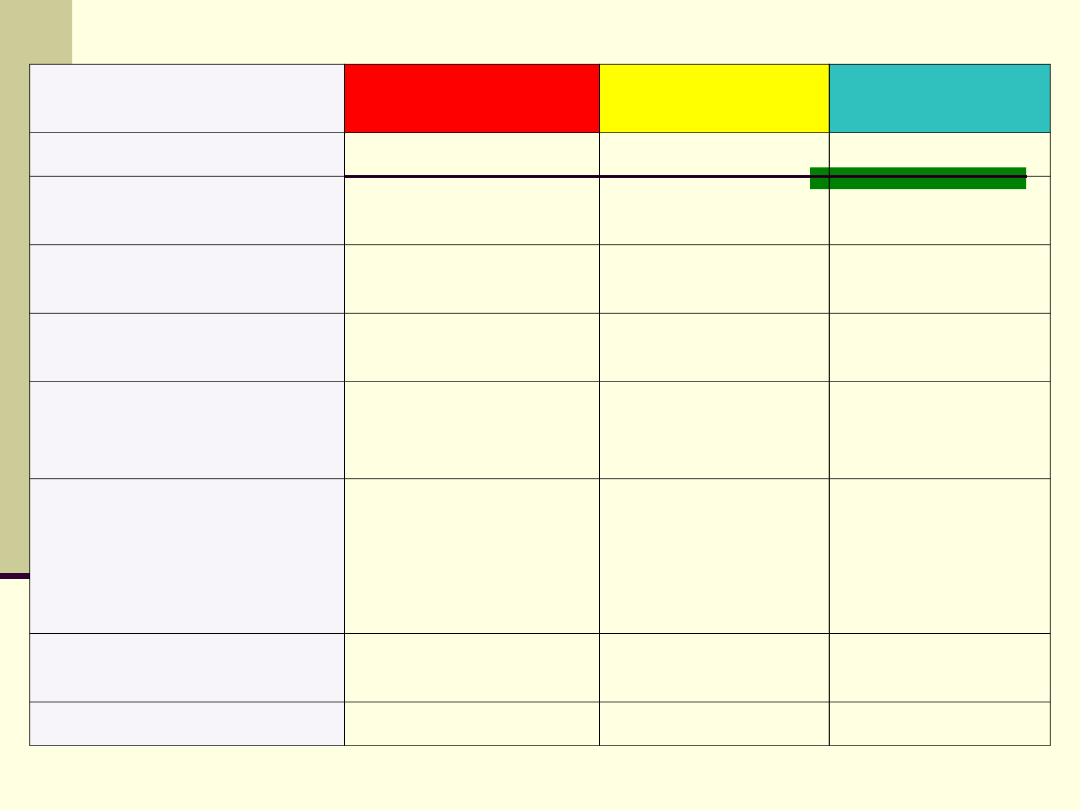
Wskaźnik
Śr . kwasowe
Śr obojętne
Śr zasadowe
fenoloftaleina
bezbarwna
bezbarwna
malinowa pH> 8,3
Wskaźnik uniwersalny
Czerwień -
pomarańcz
żółty
Zielony - niebieski
Oranż metylowy
czerwona
jasno-
pomarańczowa
żółta
Błękit bromotymolowy
( 6 – 7,6 PH)
czerwona
żółta
niebieska
Lakmus
(Zakres zmiany barwy pH
5-8)
czerwona
fioletowa
niebieska
Wywar z czerwonej kapusty czerwona
fioletowo -
niebieska
Słabo zasadowy -
barwa zielona
Silnie zasadowy -
barwa żółta
Esencja herbaciana
barwę jasno - żółta
pH< 5,5
jasno - brązowa
Ciemno - brązowa
pH> 7,5
Sok z jagód
czerwona
bez zmian
ciemno - zielona
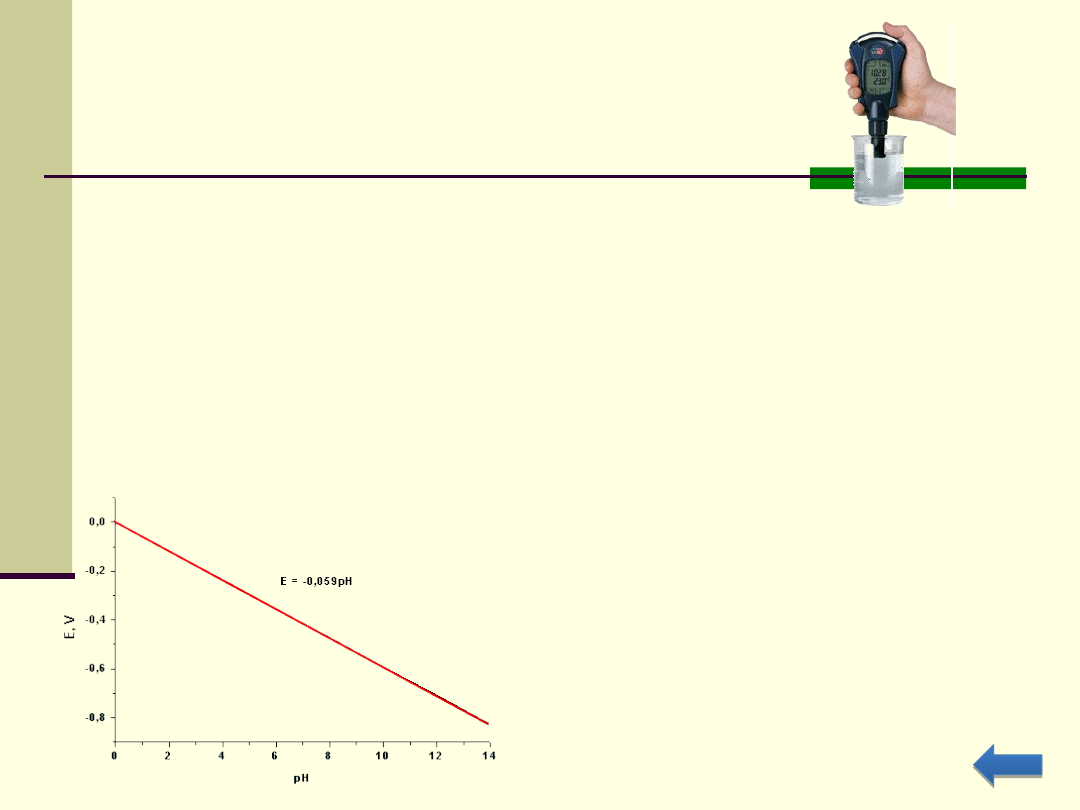
Elektrochemiczny pomiar pH – pH-metry
Większość pH-metrów to w istocie mierniki potencjału, w których pH
ustala się na podstawie pomiaru siły elektromotorycznej (SEM) ogniwa
utworzonego z elektrody wskaźnikowej (zanurzonej w roztworze
badanym) i elektrody porównawczej (zanurzonej w roztworze wzorcowym
o znanym pH).
Ogniwa te są zwykle połączone z elektronicznym woltomierzem o dużej
czułości, który automatycznie przelicza zmierzony SEM ogniwa na skalę
pH
W pomiarze tym wykorzystuje się liniową zależność potencjału
niektórych elektrod, od pH roztworu. Zależność ta wynika z równania
Nernsta
Zależność potencjału elektrody wodorowej
od pH.

Odczyn
to cecha roztworu zależna od
stężenia jonów wodorowych.
[H
+
] > [OH
-
] odczyn kwaśny
[H
+
] = [OH
-
] odczyn obojętny
[H
+
] < [OH
-
] odczyn zasadowy
Odczyn
kwaśny
Odczyn
obojętny
Odczyn
zasadowy

Wskaźniki ( indykatory )
substancje zmieniające barwę w zależności
od odczynu
Błękit bromotymolowy
Wywar z czerwonej kapusty
Esencja herbaciana
Sok z jagód
dalej
Barwa fenoloftaleiny w
zależności od odczynu
Odczyn
kwaśny
Odczyn
obojętn
y
Odczyn
zasadowy
powrót
Barwa wskaźnika
uniwersalnego
w zależności od odczynu
powrót
Odczyn
kwaśny
Odczyn
obojętny
Odczyn
zasadowy
Barwa oranżu metylowego w
zależności od odczynu
0dczy
n
kwaśn
y
Odczyn
obojętny
Odczyn
zasadowy
powrót
Barwa błękitu tymolowego w
zależności od odczynu
Odczyn
kwaśny
Odczyn
obojętny
Odczyn
zasadowy
powrót
Barwa lakmusu w zależności
od odczynu
Odczyn
kwaśny
Odczyn
obojętny
Odczyn
zasadowy
powrót
Barwa wywaru z czerwonej
kapusty w zależności od
odczynu
Odczyn
kwaśny
Odczyn
obojętny
Odczyn
zasadow
y
powrót
Barwa herbaty w zależności od
odczynu roztworu
Odczyn
kwaśny
Odczyn
obojętny
Odczyn
zasadowy
powrót
Barwa soku z jagód w
zależności od odczynu
roztworu
Odczyn
kwaśny
Odczyn
obojętny
Odczyn
zasadowy
powrót

PLAN PREZENTACJI
Odczyn roztworów, barwa wskaźników
Skala pH
Zależność między skalą pH, a odczynem
roztworu
Znaczenie skali pH
Wykładnikiem stężenia jonów wodorowych jest
skala pH
0
1
2
3
4
5
6
7
8
9
10 11 12 13 14
Na skali
zaznaczono
wartości pH
Wprowadzona w 1909 roku przez duńskiego
fizykochemika Petera Soerensena. Przyjmuje wartości
od 0-14.
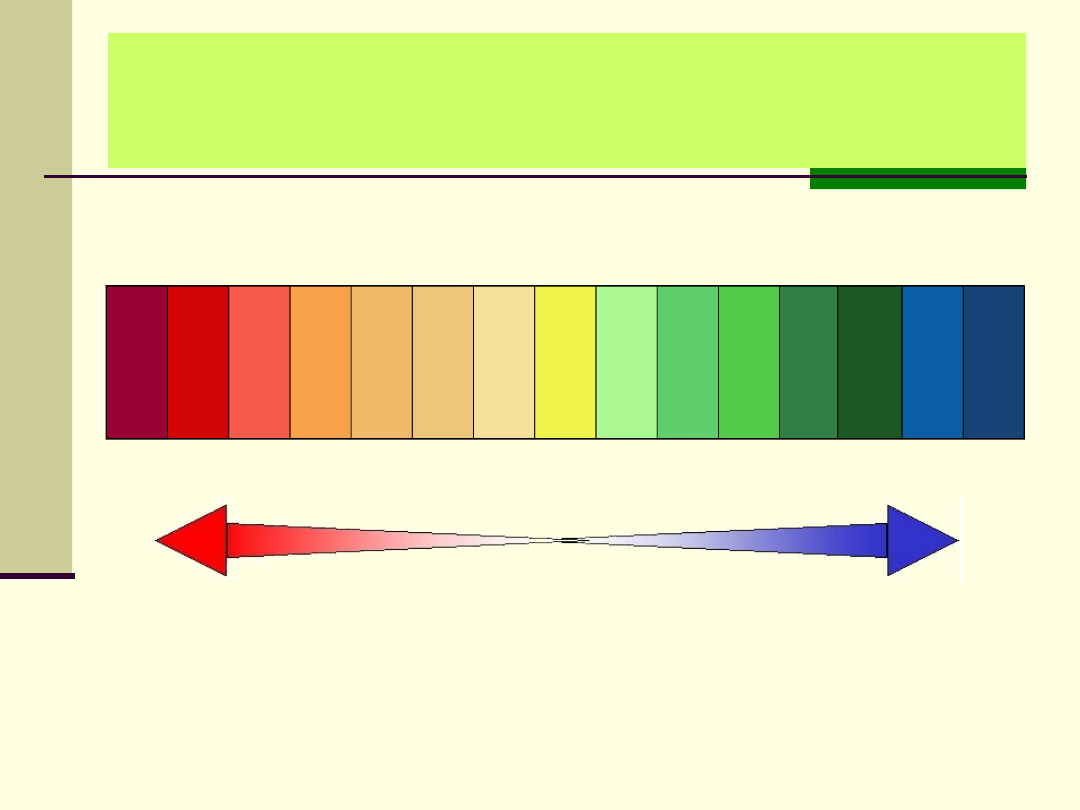
Zależność między skalą pH,
a odczynem roztworu
0
1
2
3
4
5
6
7
8
9
10 1
1
12 13 14
Odczyn kwaśny
Odczyn
obojętny
Odczyn
zasadowy

Znaczenie skali pH
w medycynie (pH krwi zdrowego człowieka
wynosi 7,4 spadek poniżej 6,8 lub wzrost
powyżej 8 powoduje skutki śmiertelne)
W rolnictwie (pH gleby przy uprawie
ziemniaków wynosi 4,5 - 6, ogórków 5,5 - 6,5)
W ogrodnictwie (pH gleby dla drzew
owocowych wynosi 6,5 - 7,7)
W hodowli ryb(większość gatunków pH 6,4 - 7)

Podsumowanie
Odczyn to cecha roztworu zależna od stężenia
jonów wodorowych
Skala pH jest ściśle związana z odczynem
roztworu
pH 0-7 – odczyn kwaśny
pH=7 – odczyn obojętny
pH 7-14 - odczyn zasadowy
Do określenia pH służą wskaźniki chemiczne
Znajomość pH wykorzystywana jest w
medycynie, rolnictwie, ogrodnictwie i hodowli
ryb.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
Wyszukiwarka
Podobne podstrony:
skala pH, laborki chemia nieorganiczna
Skala pH, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Cw1 Skala pH, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
SKALA PH, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Skala PH
SPRAWOZDANIE CHEMIA OGÓLNA skala pH
Skala pH
ćw 1 - skala PH SPRAWOZDANIE, Chemia ogólna i nieorganiczna
CHEMIA- skala pH, CHEMIA
Skala pH
Prezentacja multimedialna skala pH
Cw1 Skala pH 2
pH gęst lepk
8 I GEOGR skala S
PH UżytPublicznej
Bilirubin metabolism Applied ph Nieznany (2)
więcej podobnych podstron