1
RJC
Aromatyczne
Aromatyczne
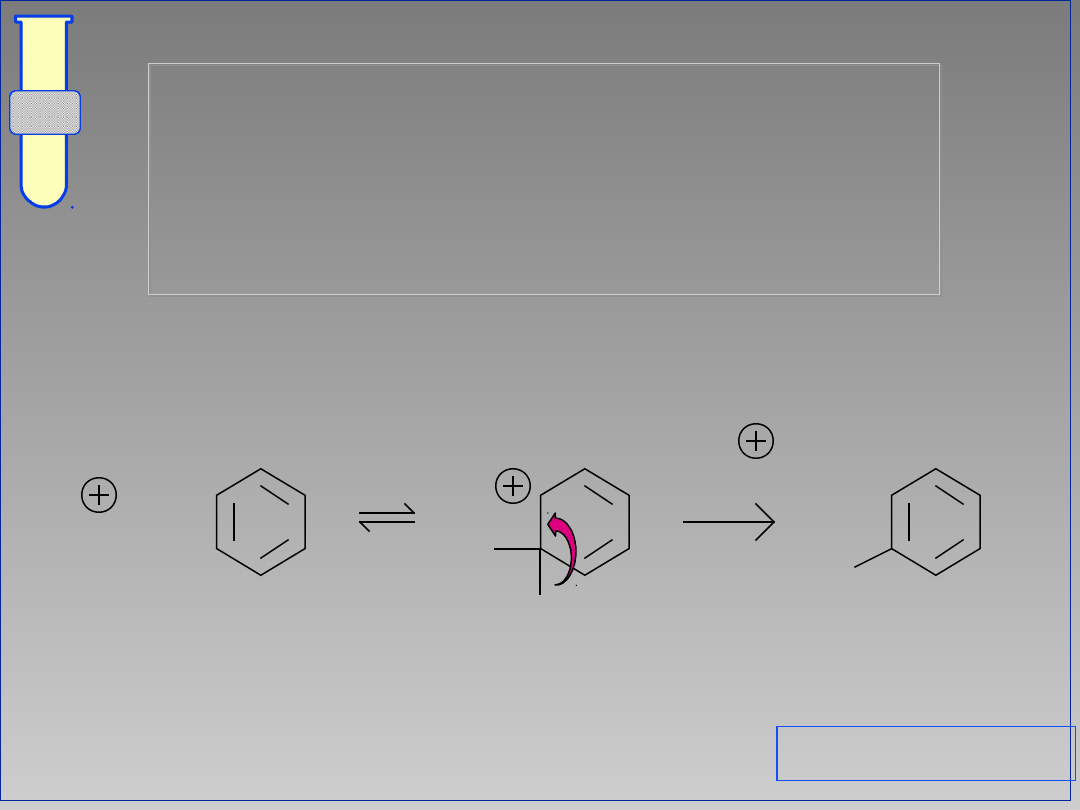
Substytucje Elektrofilowe
Substytucje Elektrofilowe
Aromatyczne
Aromatyczne
Substytucje Elektrofilowe
Substytucje Elektrofilowe
Slides 1 to 41
E
H
E
+
E
-H
2
RJC
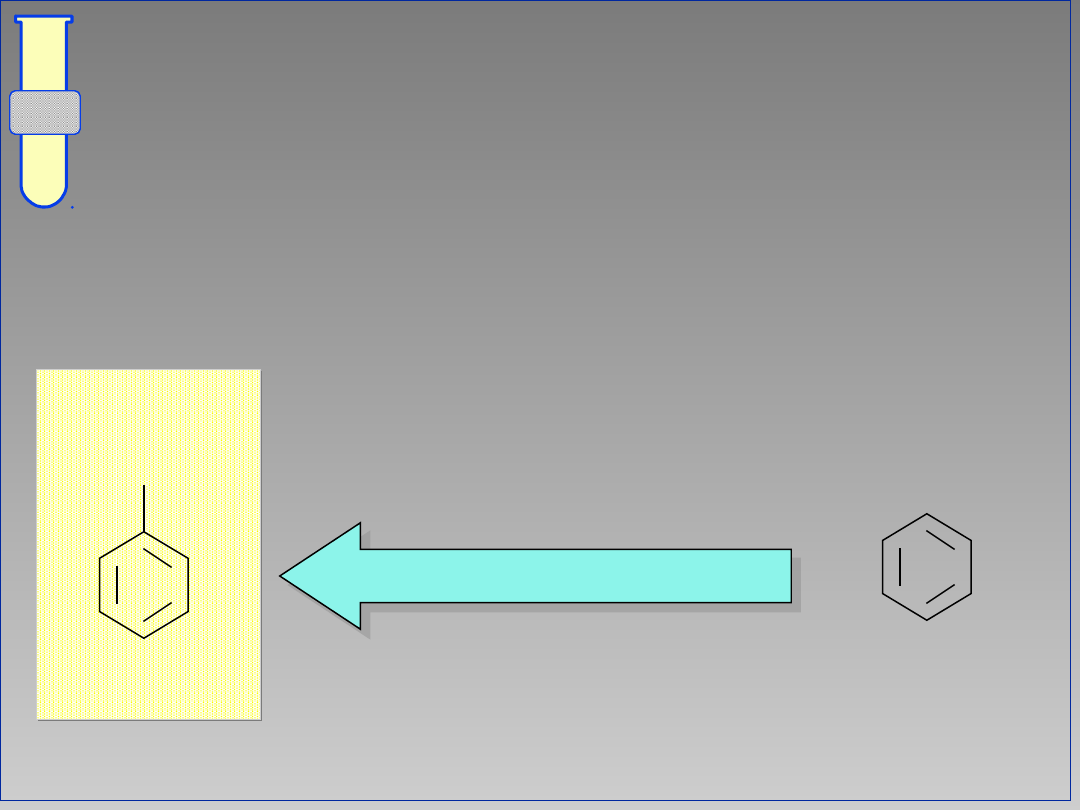
Aromatyczne
Aromatyczne
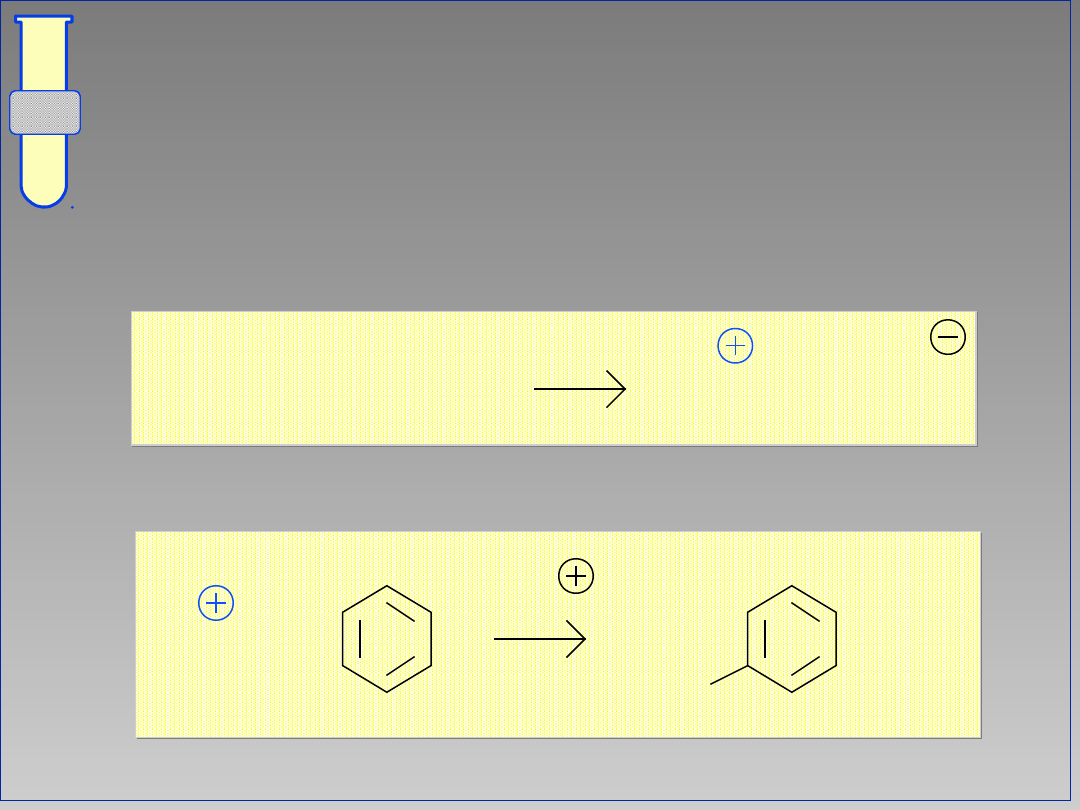
Addycje Elektrofilowe
Addycje Elektrofilowe
...do pierścienia aromatycznego
...do pierścienia aromatycznego
przerywa sprzężenie elektronów
przerywa sprzężenie elektronów
i
i
powoduje utratę stabilizacji poprzez
powoduje utratę stabilizacji poprzez
rezonans.
rezonans.
E
X
+
X
E
3
RJC
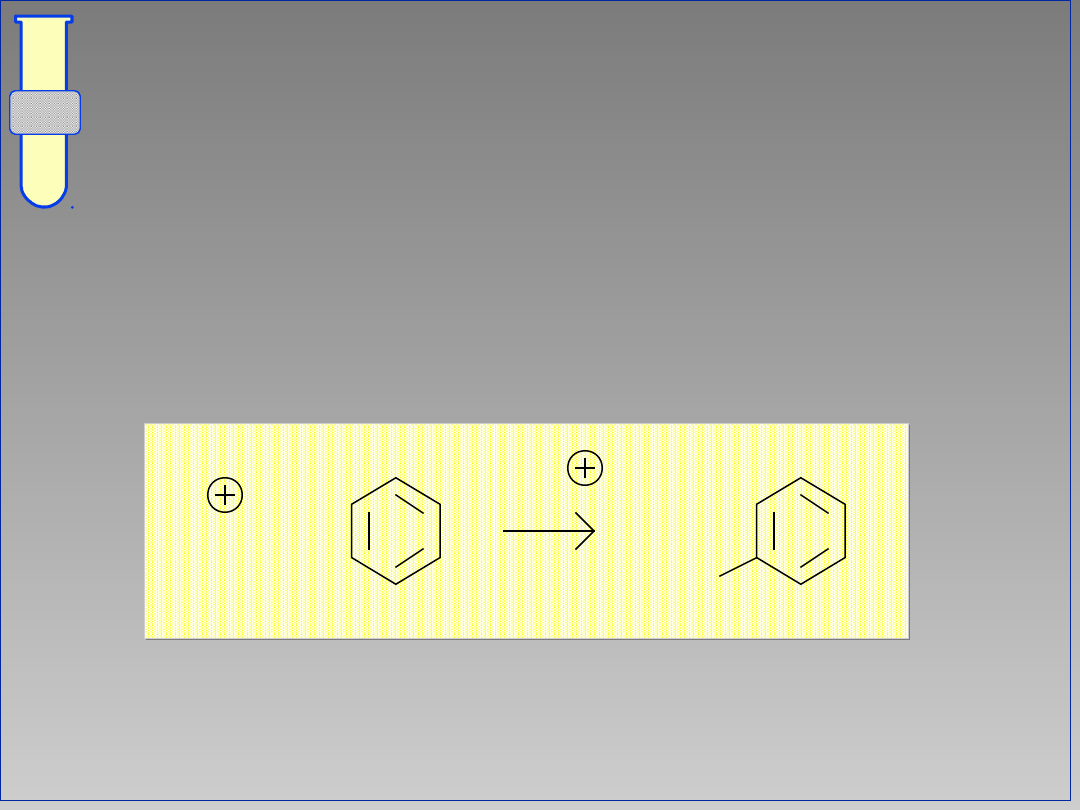
Aromatyczna Substytucja
Aromatyczna Substytucja
Eltrofilowa
Eltrofilowa
...nie zakłóca aromatycznego
...nie zakłóca aromatycznego
charakteru cząsteczki (jej
charakteru cząsteczki (jej
aromatyczności).
aromatyczności).
E
+
E
-H
4
RJC
E
H
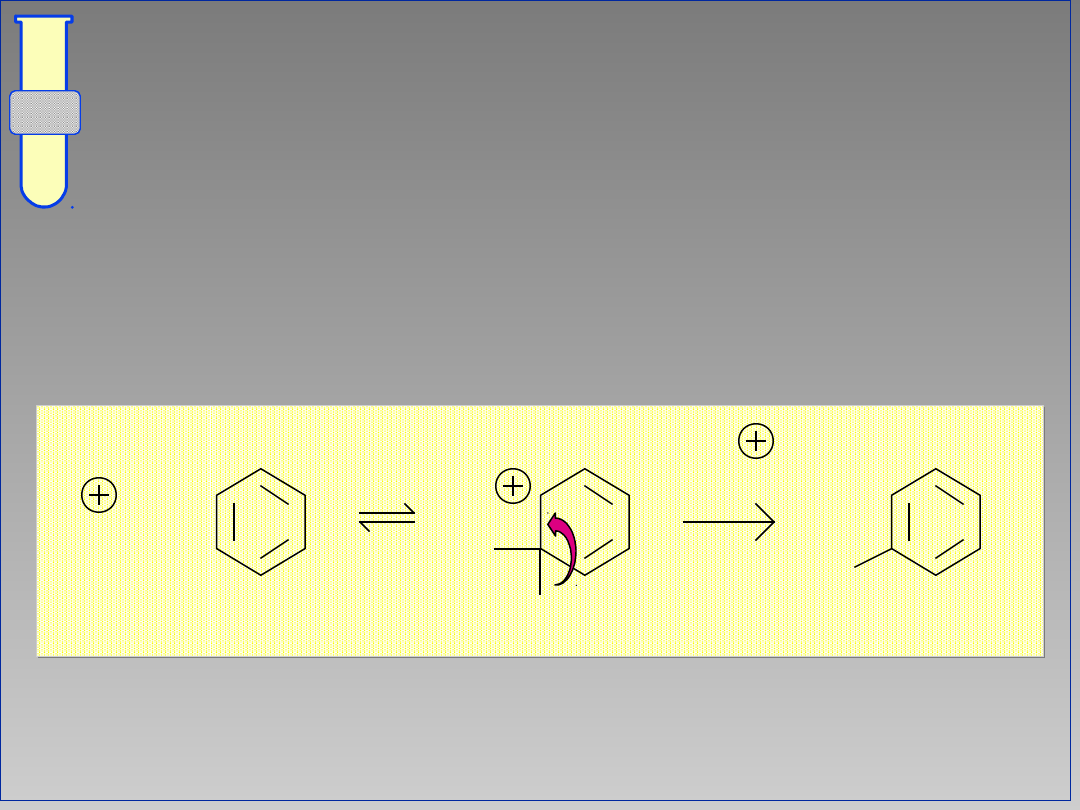
Mechanizm Substytucji
Mechanizm Substytucji
Elektrofilowej
Elektrofilowej
Addycja cząsteczki elektrofila (E
Addycja cząsteczki elektrofila (E
+
+
)
)
prowadzi do powstania karbokationu,
prowadzi do powstania karbokationu,
który następnie eliminuje H
który następnie eliminuje H
+
+
co
co
powoduje, że główny pierścień
powoduje, że główny pierścień
odzyskuje charakter aromatyczny.
odzyskuje charakter aromatyczny.
E
+
E
-H
5
RJC
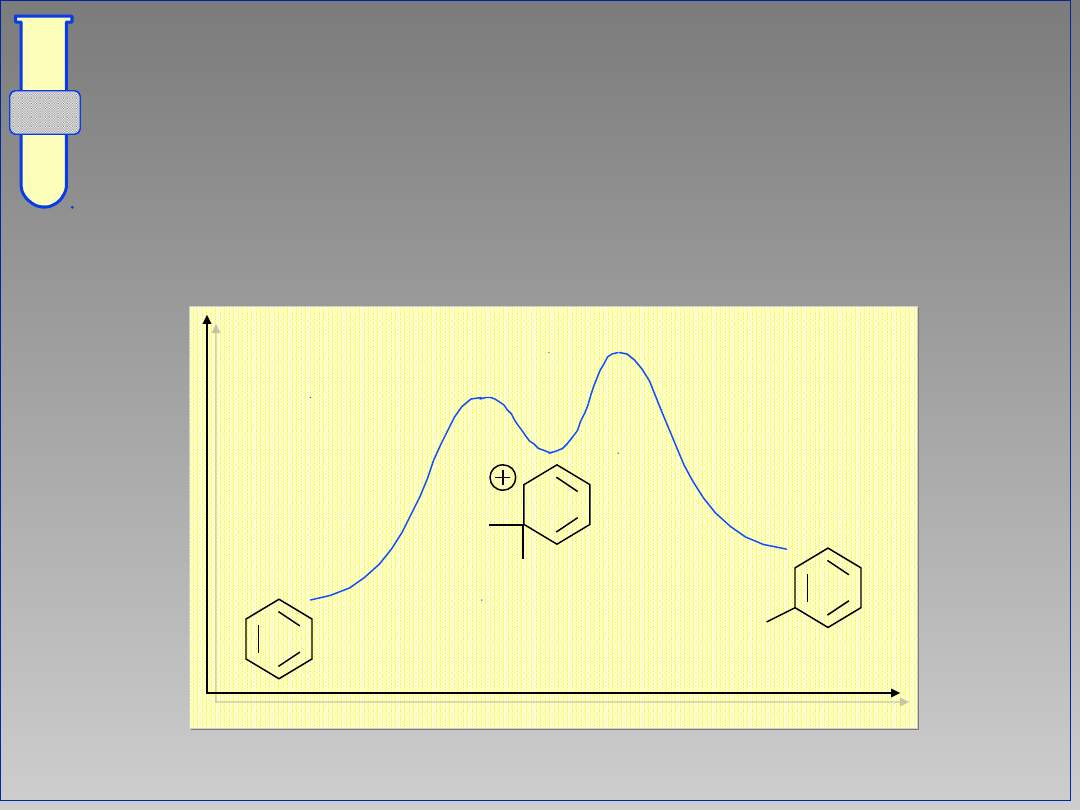
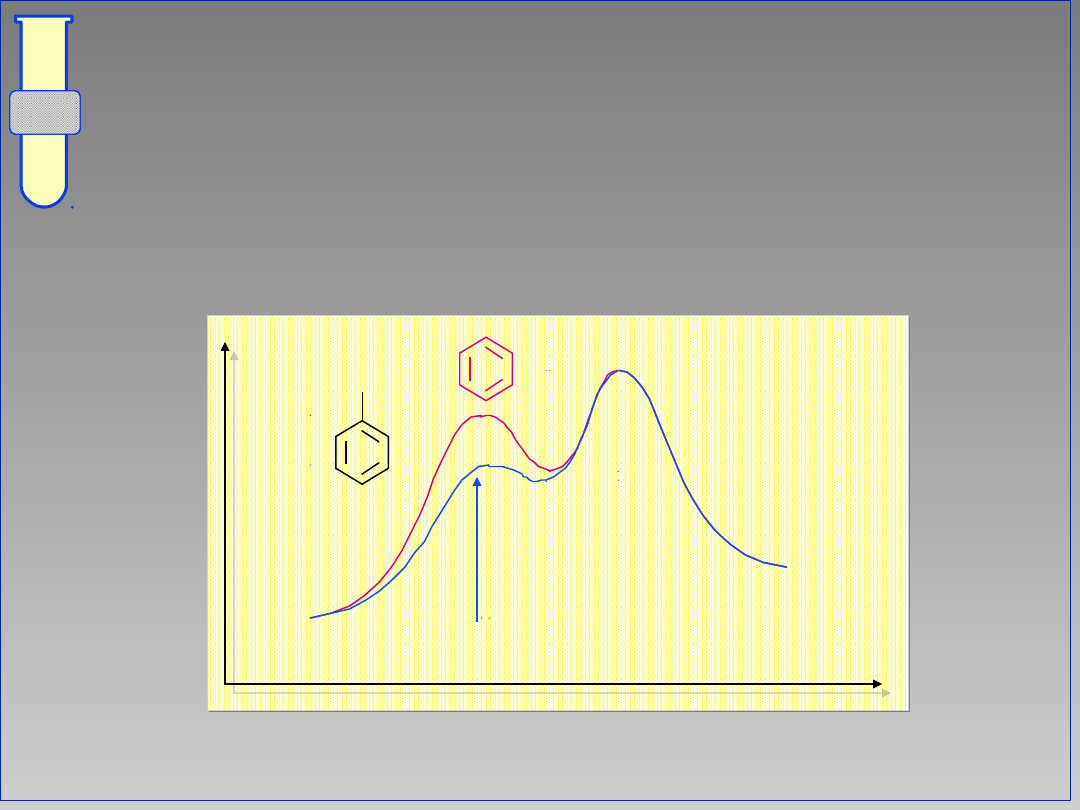
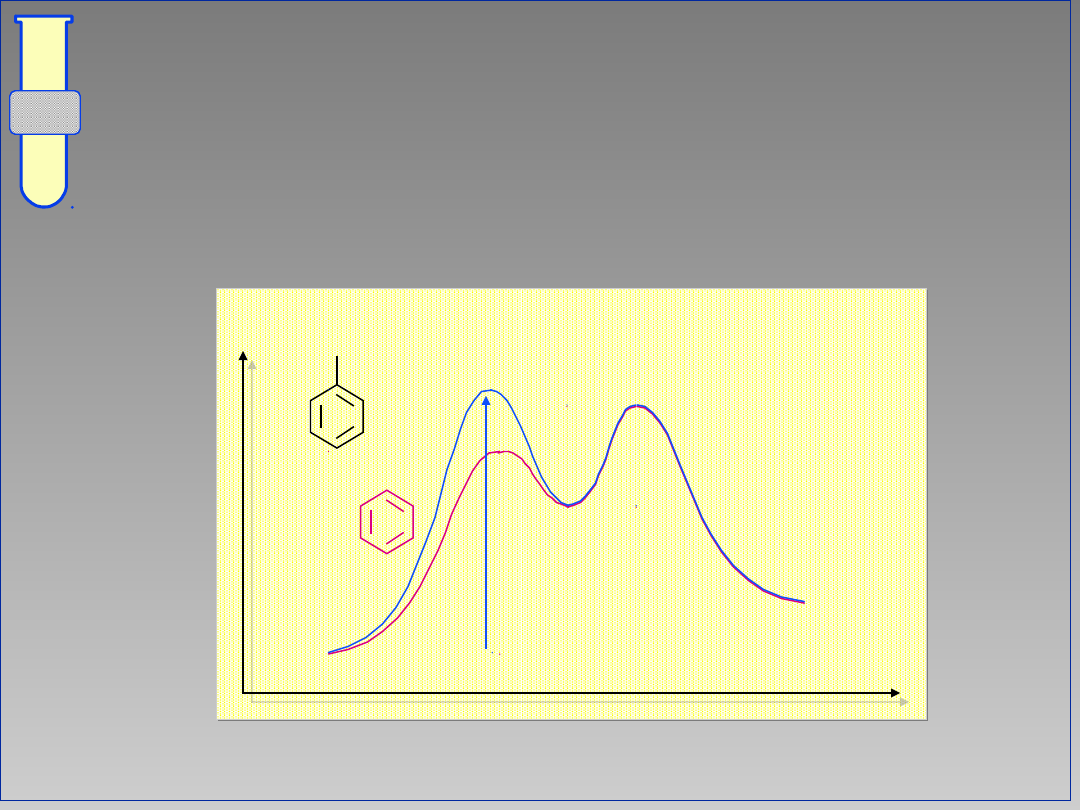
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Aromatyczna substytucja elektrofilowa
Aromatyczna substytucja elektrofilowa
jest procesem dwuetapowym; na profilu
jest procesem dwuetapowym; na profilu
energii występuje więc minimum.
energii występuje więc minimum.
Energia
Postęp reakcji
E
E
H
6
RJC
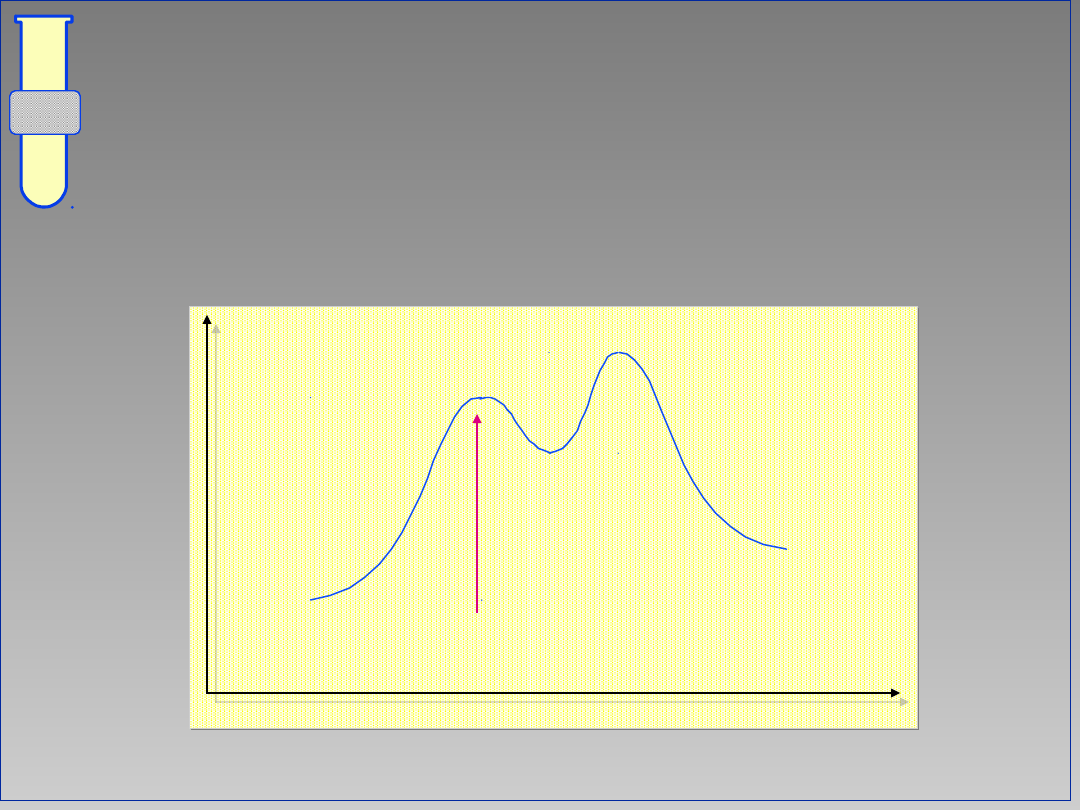
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Szybkość całej reakcji jest określona
Szybkość całej reakcji jest określona
przez energię swobodną
przez energię swobodną
G
G
‡
‡
pierwszego (first step).
pierwszego (first step).
Energia
Postęp reakcji
G
‡
7
RJC
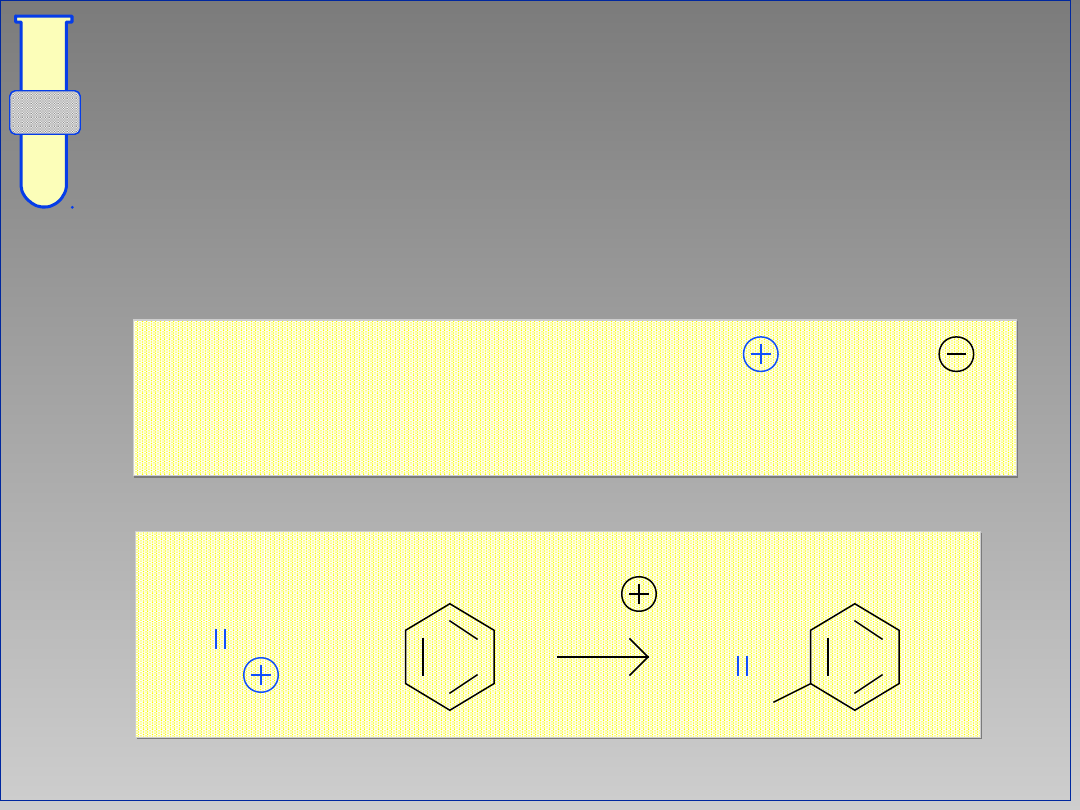
Odczynniki Elektrofilowe
Odczynniki Elektrofilowe
(Elektrofile)
(Elektrofile)
Pierścienie aromatyczne są mniej
Pierścienie aromatyczne są mniej
podatne na reakcje z elektrofilami niż
podatne na reakcje z elektrofilami niż
alkeny i dlatego wymagana jest
alkeny i dlatego wymagana jest
‘aktywacja’ elektrofila.
‘aktywacja’ elektrofila.
CH
2
=CH
2
Br
2
Br
2
Br
CH
2
CH
2
Br
8
RJC
Słaby odczynnik elektrofilowy jakim jest brom Br
Słaby odczynnik elektrofilowy jakim jest brom Br
2
2
jest
jest
aktywowany przez kwas Lewisa, np. chlorek żelaza (III) FeBr
aktywowany przez kwas Lewisa, np. chlorek żelaza (III) FeBr
3
3
.
.
Br
2
+
FeBr
3
Br
+ (FeBr
4
)
Bromowanie
Bromowanie
Br
+
Br
-H
9
RJC
Chlorowanie
Chlorowanie
W podobny sposób następuje aktywacja
W podobny sposób następuje aktywacja
elektrofilowej cząsteczki chloru Cl
elektrofilowej cząsteczki chloru Cl
2
2
(dodatek FeCl
(dodatek FeCl
3
3
).
).
Cl
2
+
FeCl
3
Cl
+ (FeCl
4
)
Cl
+
Cl
-H
10
RJC
Jodowanie
Jodowanie
Bardzo słaby elektrofil jakim jest
Bardzo słaby elektrofil jakim jest
cząsteczka jodu I
cząsteczka jodu I
2
2
jest aktywowany
jest aktywowany
przez dodatek soli Cu
przez dodatek soli Cu
2+
2+
.
.
I
2
+ 2Cu
2+
2
I
+ 2Cu
+
I
+
I
-H
11
RJC
Nitrowanie
Nitrowanie
Kation nitroniowy NO
Kation nitroniowy NO
2
2
+
+
jest
jest
reaktywnym odczynnikiem
reaktywnym odczynnikiem
elektrofilowym.
elektrofilowym.
HNO
3
+ H
2
SO
4
NO
2
+ HSO
4
+
H
2
O
NO
2
+
NO
2
-H
12
RJC
Sulfonowanie
Sulfonowanie
Dymiący kwas siarkowy (VI) jest
Dymiący kwas siarkowy (VI) jest
źródłem reaktywnego odczynnika (SO
źródłem reaktywnego odczynnika (SO
3
3
lub HSO
lub HSO
3
3
+
+
).
).
HSO
3
+
+
HO
3
S
-H
SO
3
+ H
2
SO
4
HSO
3
+ HSO
4
13
RJC
Alkilowanie Friedla-Craftsa
Alkilowanie Friedla-Craftsa
Aktywacja halogenków alkilowych przy
Aktywacja halogenków alkilowych przy
użyciu chlorku glinu AlCl
użyciu chlorku glinu AlCl
3
3
prowadzi do
prowadzi do
powstawania reaktywnego elektrofila w
powstawania reaktywnego elektrofila w
postaci karbokationu (R
postaci karbokationu (R
+
+
).
).
R-Cl
+
AlCl
3
R
+
(AlCl
4
)
R
+
R
-H
-H

14
RJC
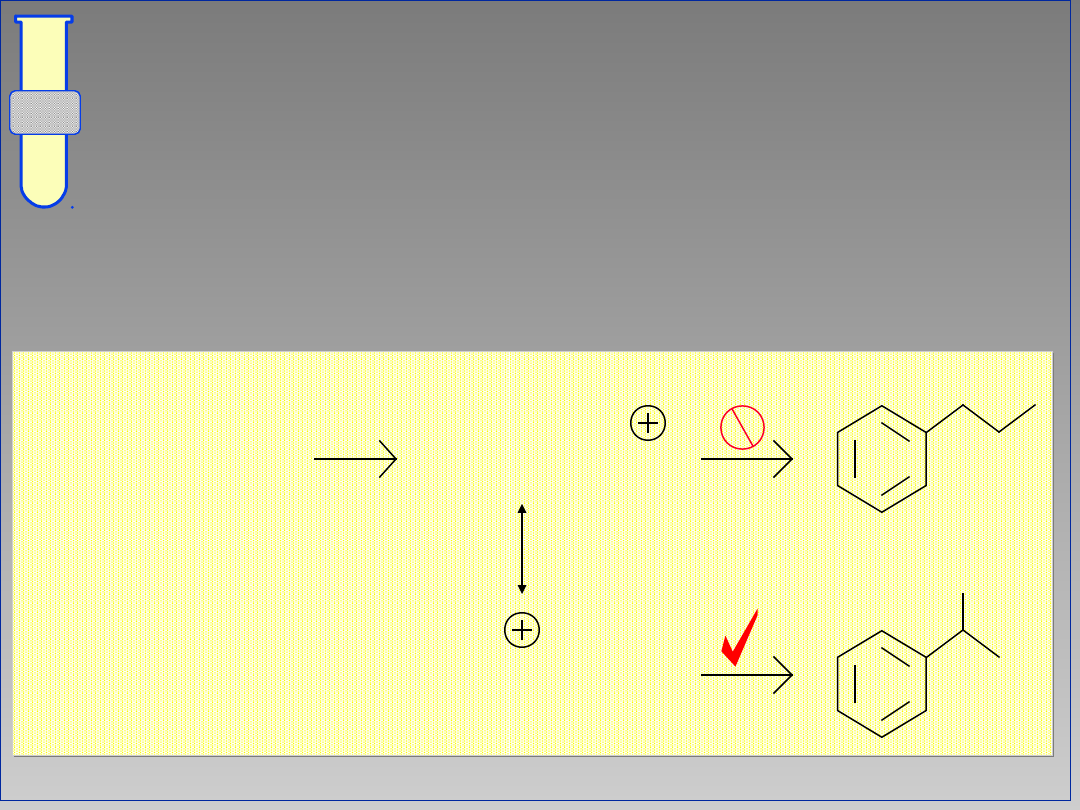
Ograniczenia i utrudnienia w reakcji
Ograniczenia i utrudnienia w reakcji
alkilowania;
alkilowania;
Nie nadają się halogenki arylowe oraz
allilowe.
Polialkilowanie
Przegrupowania karbokationów
Ograniczenia w Reakcji
Ograniczenia w Reakcji
Alkilowania Metodą Friedla-
Alkilowania Metodą Friedla-
Craftsa
Craftsa
15
RJC
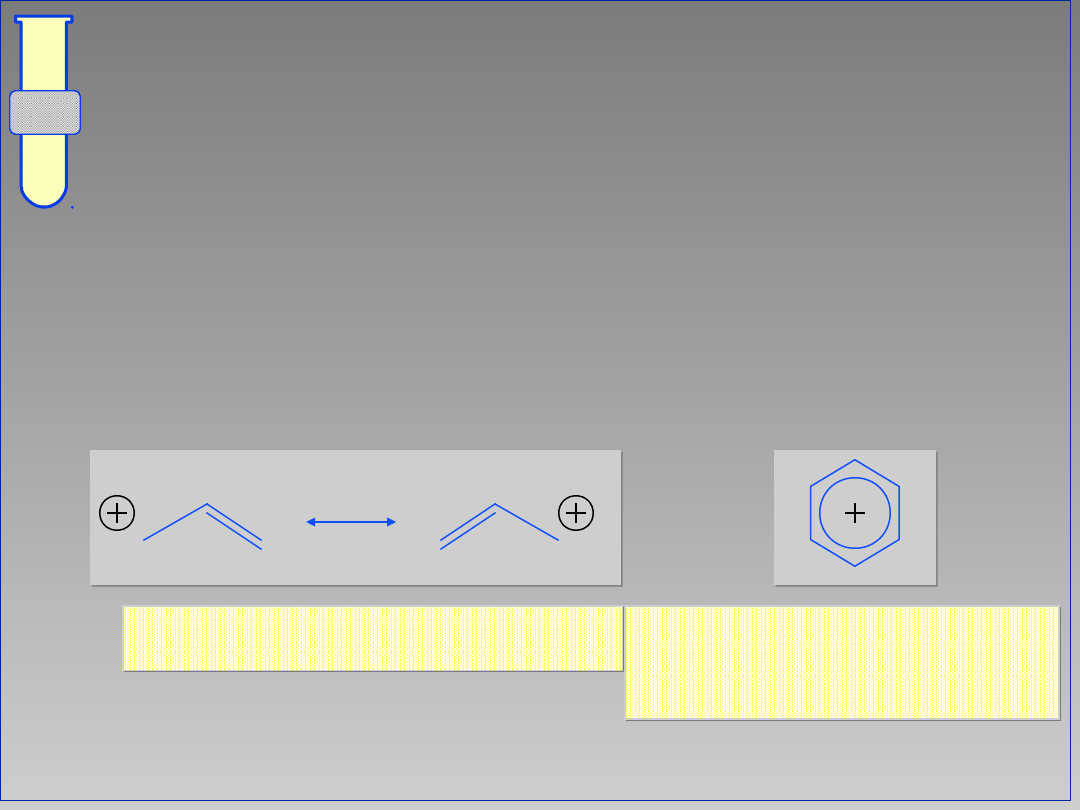
Halogenki Allilowe oraz Arylowe
Halogenki Allilowe oraz Arylowe
...karbokationy pochodzące od
...karbokationy pochodzące od
halogenków arylowych oraz allilowych
halogenków arylowych oraz allilowych
są stabilizowane rezonansem
są stabilizowane rezonansem
elektronowym i dlatego są b. mało
elektronowym i dlatego są b. mało
reaktywnymi elektrofilami.
reaktywnymi elektrofilami.
karbokation allilowy
karbokation allilowy
karbokation
arylowy
karbokation
arylowy
16
RJC
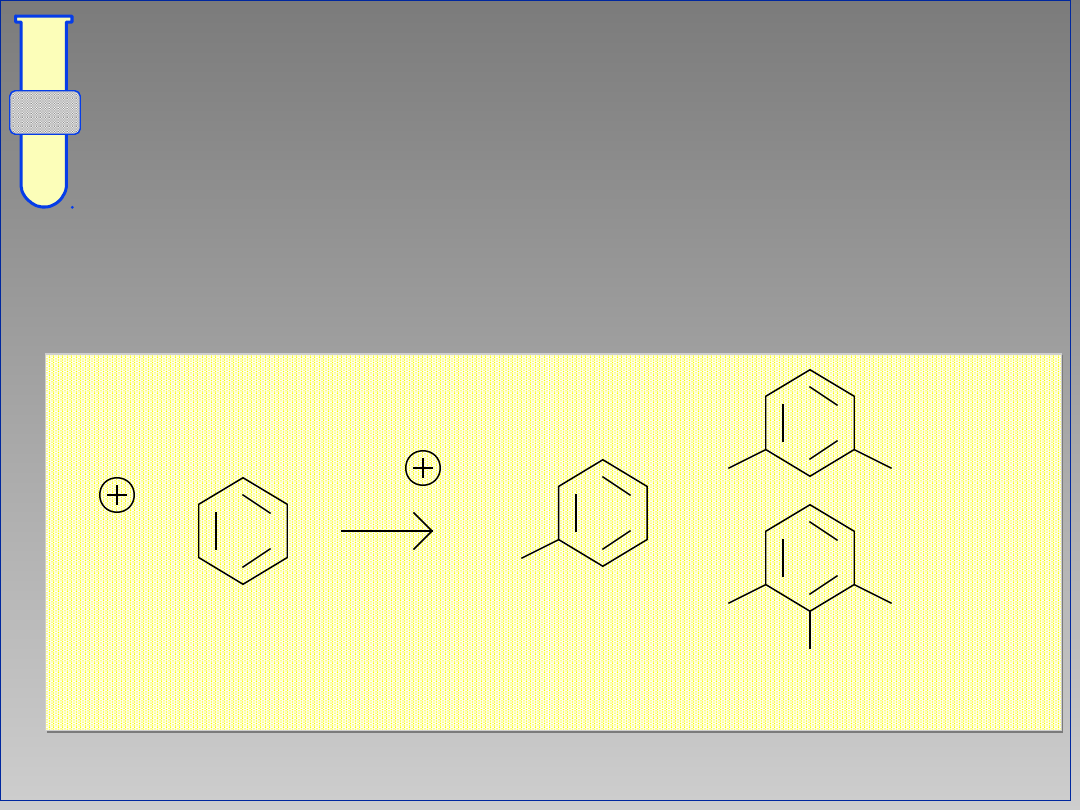
Polialkilowania
Polialkilowania
W reakcjach Friedla-Craftsa możliwe są
W reakcjach Friedla-Craftsa możliwe są
poli-alkilowania, ponieważ powstający
poli-alkilowania, ponieważ powstający
produkt jest bardziej reaktywny od nie
produkt jest bardziej reaktywny od nie
podstawionego substratu.
podstawionego substratu.
R
+
-H
R
etc...
etc...
R
R
R
R
R
17
RJC
Przegrupowania Karbokationów
Przegrupowania Karbokationów
Pierwszorzędowy karbokation ulega
Pierwszorzędowy karbokation ulega
przegrupowaniu do innego
przegrupowaniu do innego
karbokationu o wyższej rzędowości
karbokationu o wyższej rzędowości
(migracja protonu).
(migracja protonu).
CH
3
CH
2
CH
2
Cl
CH
3
CH
2
CH
2
CH
3
CHCH
3
18
RJC
Acylowanie Friedla-Craftsa
Acylowanie Friedla-Craftsa
Aktywacja chlorku kwasowego przy
Aktywacja chlorku kwasowego przy
użyciu AlCl
użyciu AlCl
3
3
prowadzi do powstawania
prowadzi do powstawania
jonu acyliowego, który jest aktywnym
jonu acyliowego, który jest aktywnym
elektrofilem.
elektrofilem.
RCOCl
+
AlCl
3
RCO
+
(AlCl
4
)
RC
RC
-H
-H
O
O
+
+
19
RJC
Wpływ Podstawników na
Wpływ Podstawników na
Aromatyczne Substytucje
Aromatyczne Substytucje
Elektrofilowe
Elektrofilowe
Podstawniki obecne w pierścieniu
Podstawniki obecne w pierścieniu
aromatycznym działają jako grupy
aromatycznym działają jako grupy
elektrono-donorowe lub elektrono-
elektrono-donorowe lub elektrono-
akceptorowe.
akceptorowe.
G
G
G
G
wpływ elektrono-
donorowy
wpływ elektrono-
donorowy
wpływ elektrono-
akceptorowy
wpływ elektrono-
akceptorowy
20
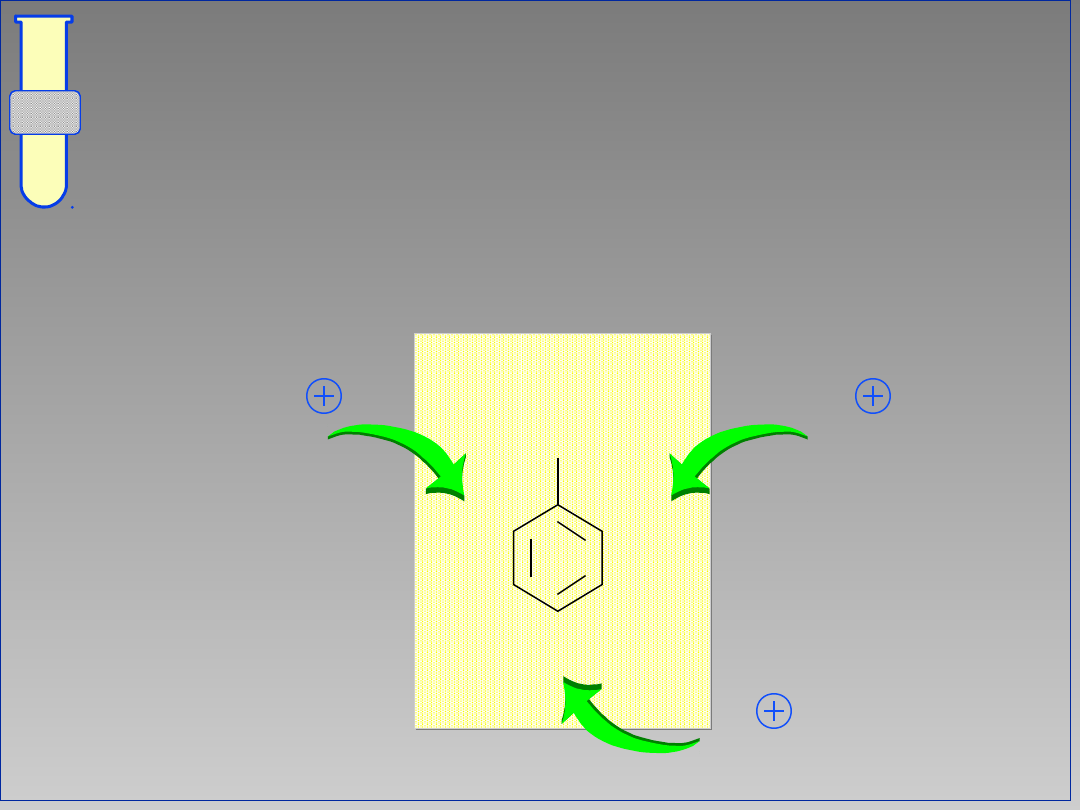
RJC
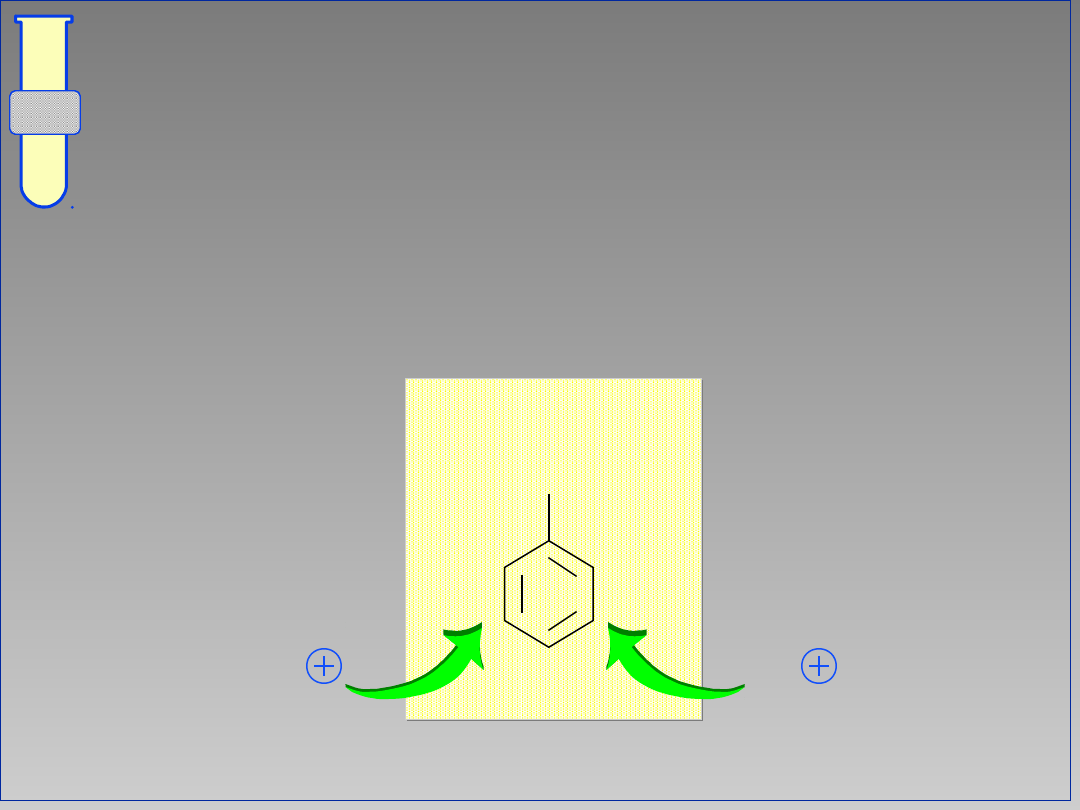
Podstawniki (Grupy) Elektrono-
Podstawniki (Grupy) Elektrono-
Donorowe
Donorowe
Zwiększają gęstość elektronową, czyli
Zwiększają gęstość elektronową, czyli
aktywują pierścień aromatyczny
aktywują pierścień aromatyczny
G
+
-
-
-
wzrost gęstości elektronowej
wzrost gęstości elektronowej
21
RJC
Diagram Energetyczny
Diagram Energetyczny
Reakcji
Reakcji
Obniżenie wartości
Obniżenie wartości
G
G
‡
‡
oznacza wzrost
oznacza wzrost
szybkości reakcji.
szybkości reakcji.
energia
postęp reakcji
G
+
-
-
-
G
‡
22
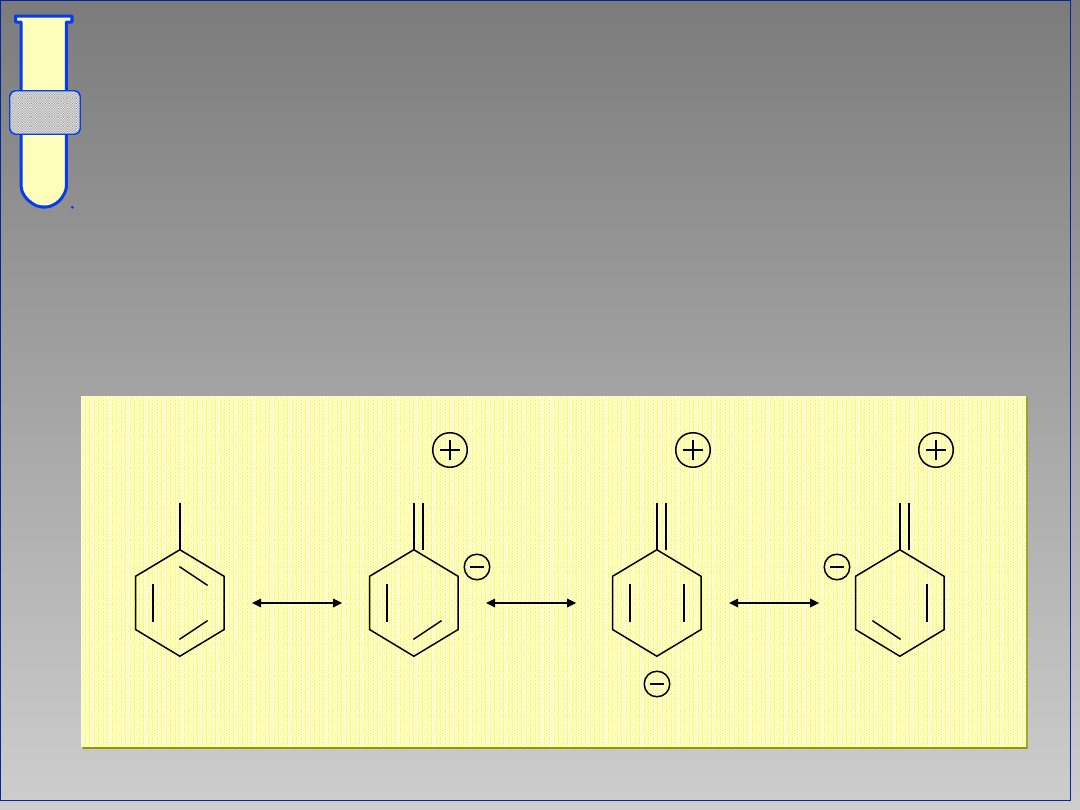
RJC
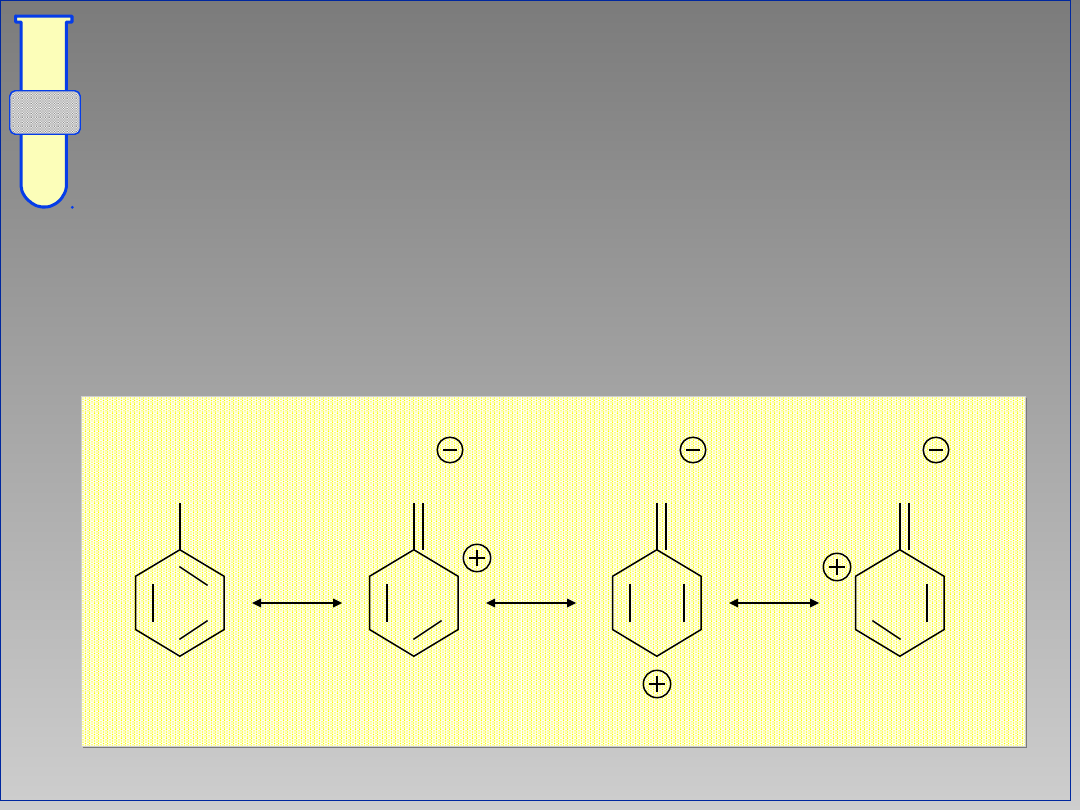
Struktury Rezonansowe
Struktury Rezonansowe
... ilustrują fakt delokalizacji
... ilustrują fakt delokalizacji
zwiększonej gęstości elektronowej w
zwiększonej gęstości elektronowej w
obrębie pierścienia aromatycznego.
obrębie pierścienia aromatycznego.
G
G
G
G
23
RJC
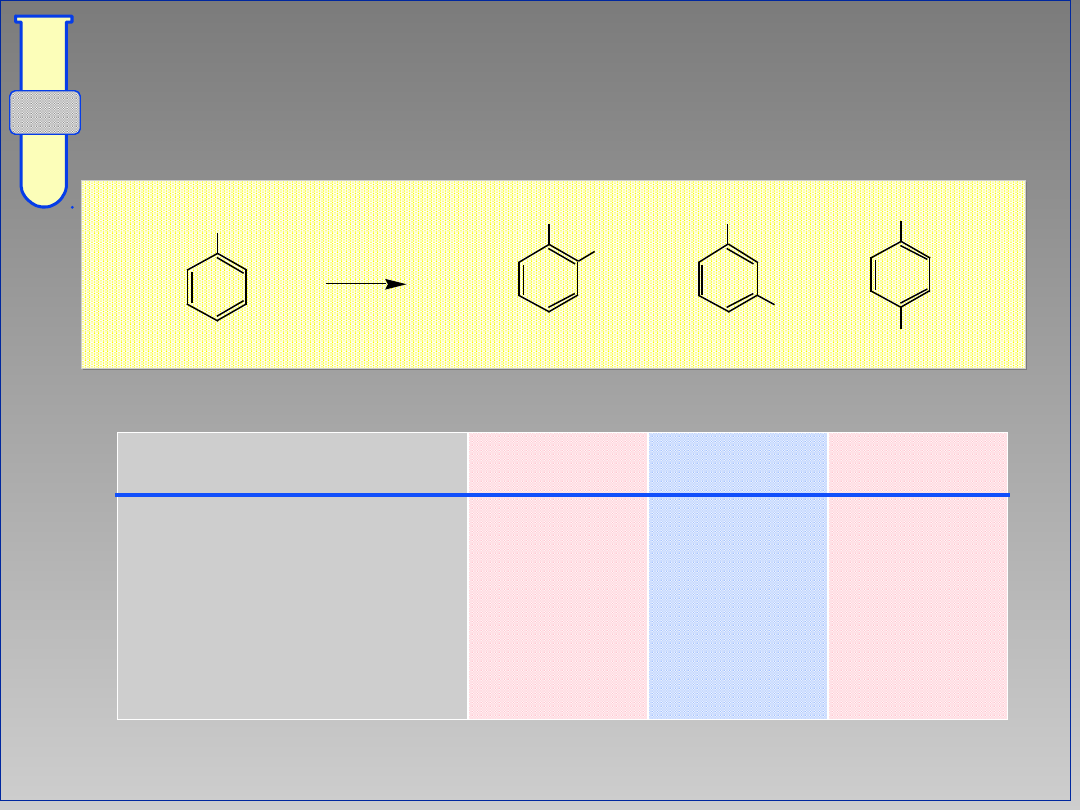
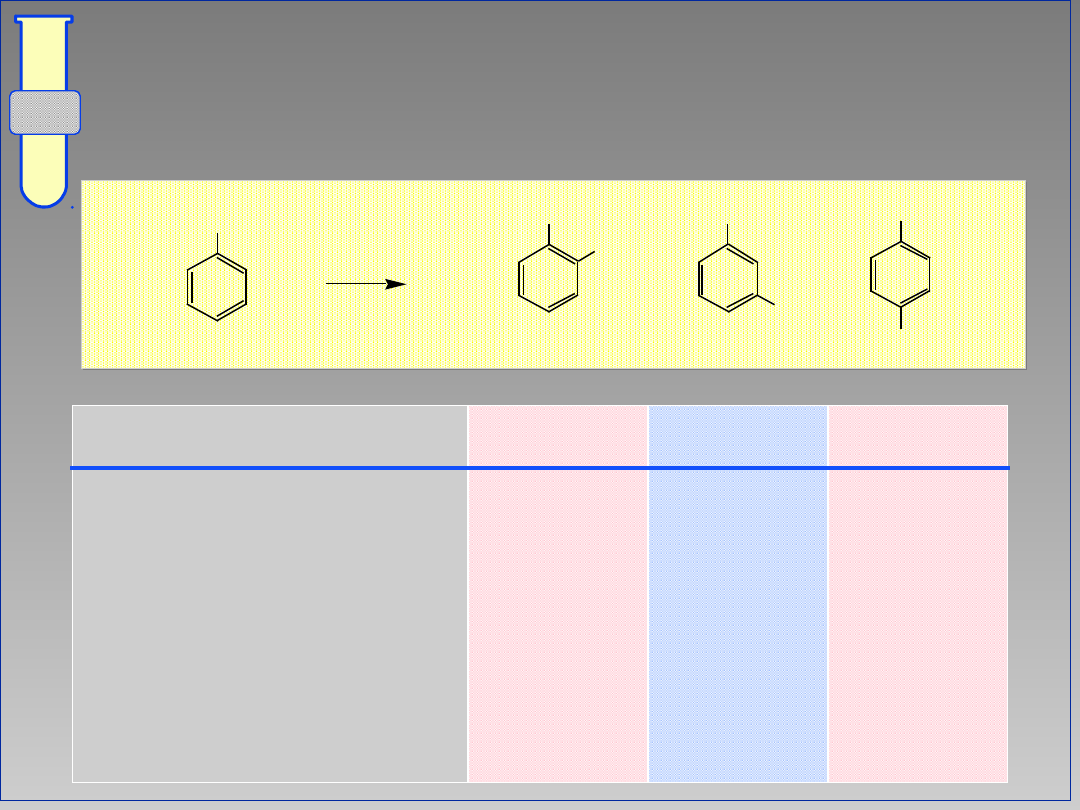
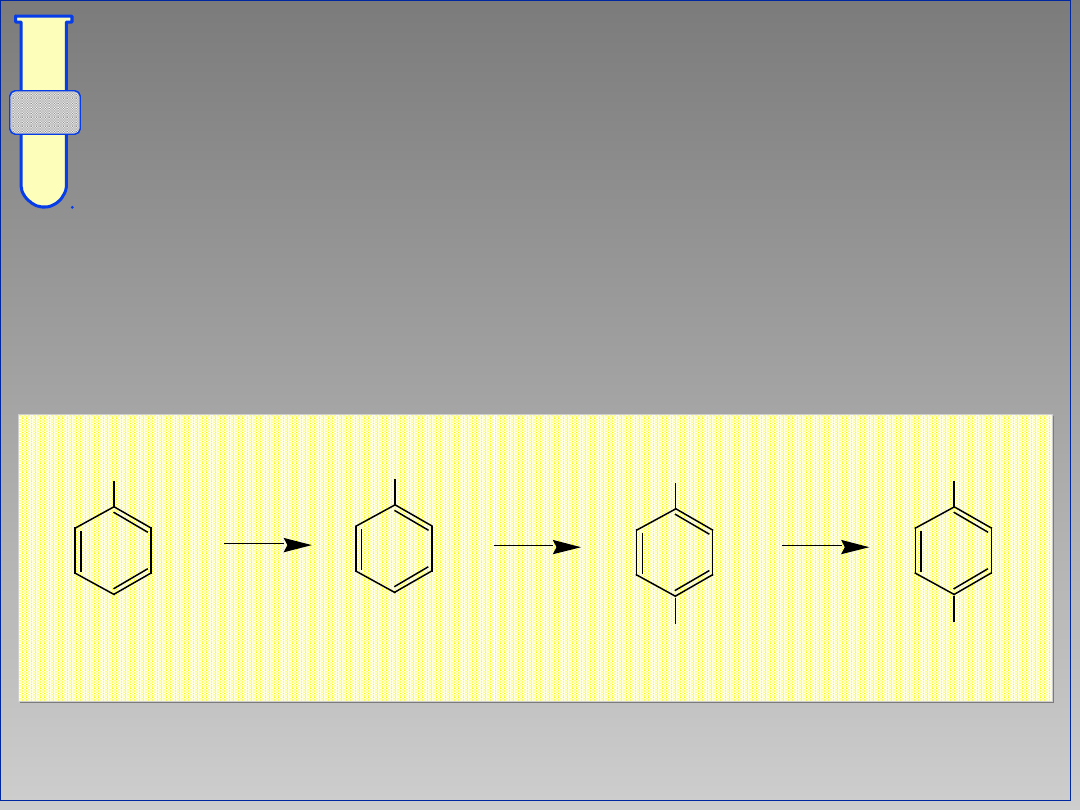
Wpływ Kierujący Orto & Para
Wpływ Kierujący Orto & Para
Zwiększona gęstość elektronowa w
Zwiększona gęstość elektronowa w
pozycjach orto i para wpływa na
pozycjach orto i para wpływa na
dominujący kierunek substytucji.
dominujący kierunek substytucji.
G
+
-
-
-
E
E
E
24
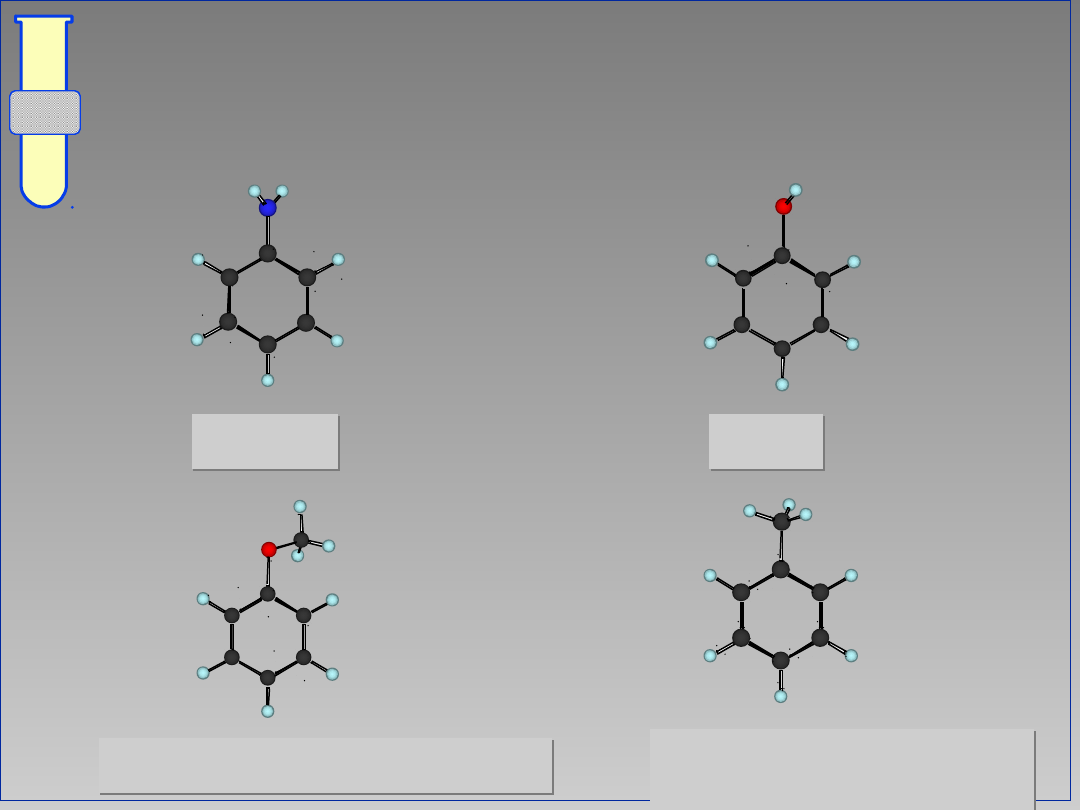
RJC
Podstawniki Aktywujące i
Podstawniki Aktywujące i
Kierujące w Pozycje orto & para
Kierujące w Pozycje orto & para
anilina
anilina
fenol
fenol
metoksybenzen (anizol)
metoksybenzen (anizol)
toluen
(metylobenzen)
toluen
(metylobenzen)
25
RJC
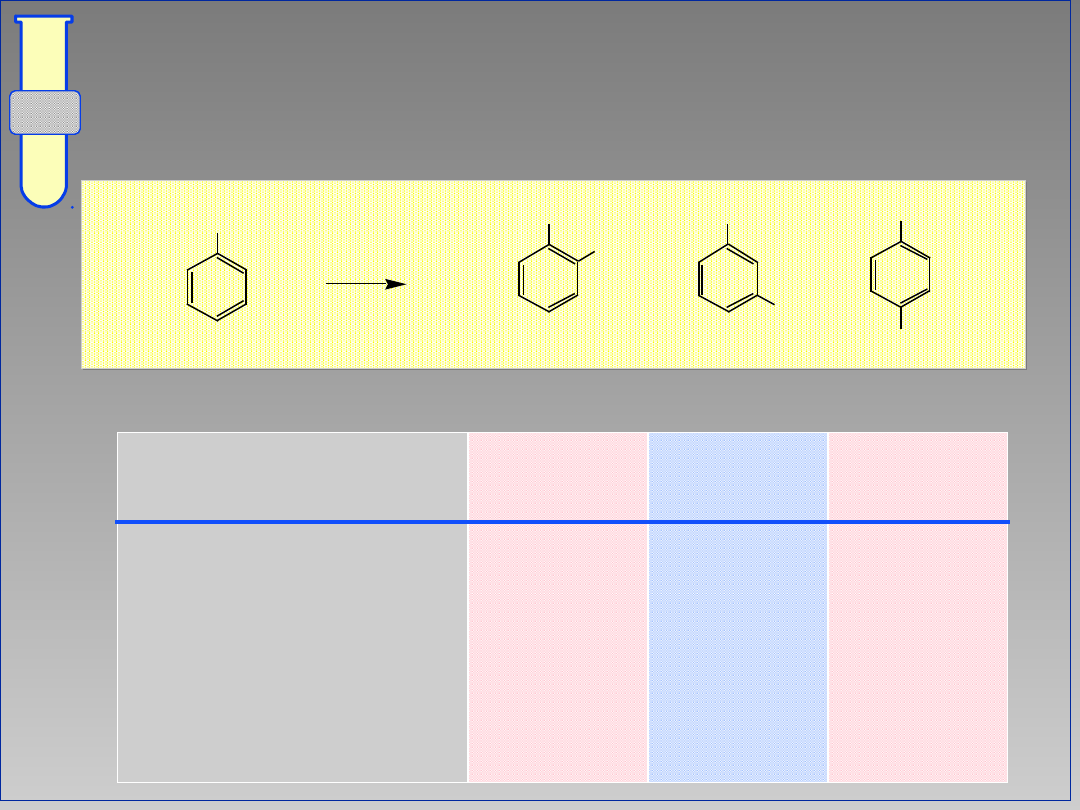
Dystrybucja Produktów Nitowania
Dystrybucja Produktów Nitowania
Benzenu
Benzenu
Podstawnik (G) Orto Meta Para
CH
3
63
3
34
OH
50
0
50
NHAc(NHCOMe) 19
2
79
G
H
NO
3
/H
2
SO
4
G
G
G
NO
2
NO
2
NO
2
26
RJC
Podstawniki Elektrono-
Podstawniki Elektrono-
Akceptorowe
Akceptorowe
Powodują obniżenie gęstości
Powodują obniżenie gęstości
elektronowej, czyli dezaktywację,
elektronowej, czyli dezaktywację,
pierścienia aromatycznego.
pierścienia aromatycznego.
obniżenie gęstości elektronowej
obniżenie gęstości elektronowej
G
-
+
+
+
27
RJC
Diagram Energetyczny Reakcji
Diagram Energetyczny Reakcji
Wzrost wartości
Wzrost wartości
G
G
‡
‡
oznacza
oznacza
zmniejszenie szybkości reakcji.
zmniejszenie szybkości reakcji.
energia
postęp reakcji
G
‡
G
+
-
+
+
28
RJC
Struktury Rezonansowe
Struktury Rezonansowe
...ilustrują delokalizację obniżonej
...ilustrują delokalizację obniżonej
gęstości elektronowej w pierścieniu
gęstości elektronowej w pierścieniu
aromatycznym.
aromatycznym.
G
G
G
G
29
RJC
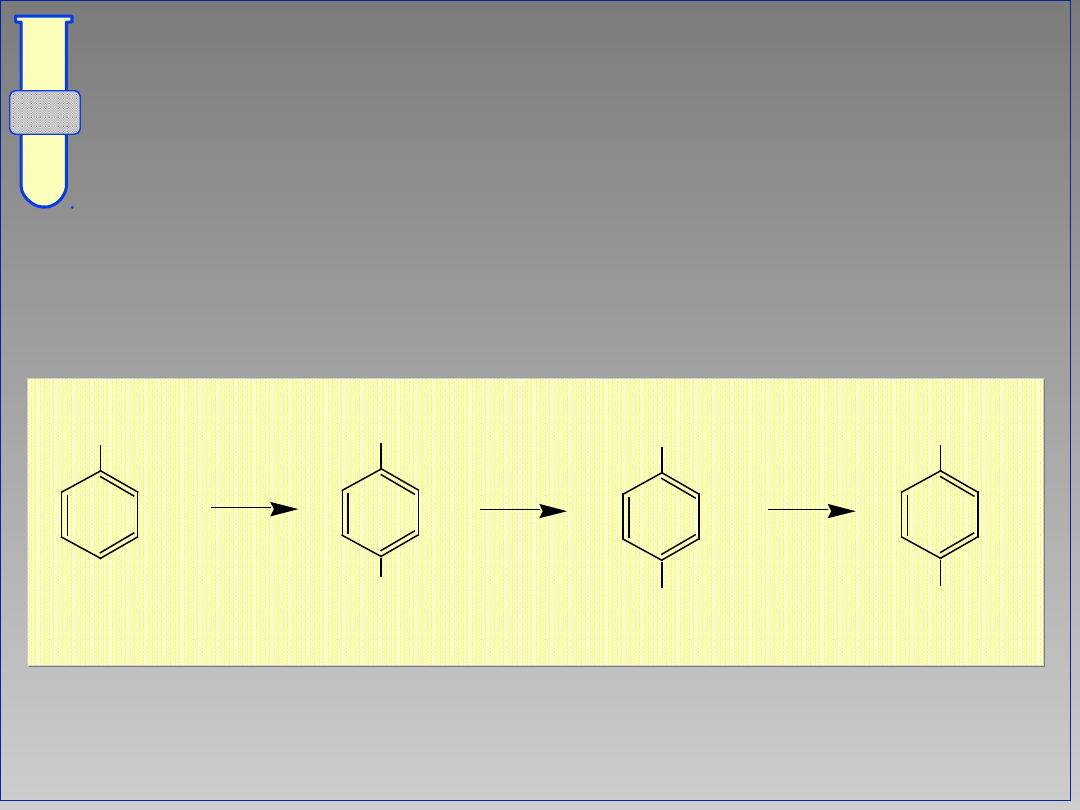
Wpływ Kierujący Meta
Wpływ Kierujący Meta
Obniżenie gęstości elektronowej w
Obniżenie gęstości elektronowej w
pozycjach orto i para powoduje, że
pozycjach orto i para powoduje, że
podstawienie elektrofilowe zachodzi
podstawienie elektrofilowe zachodzi
głównie w pozycji meta.
głównie w pozycji meta.
E
G
+
-
+
+
E
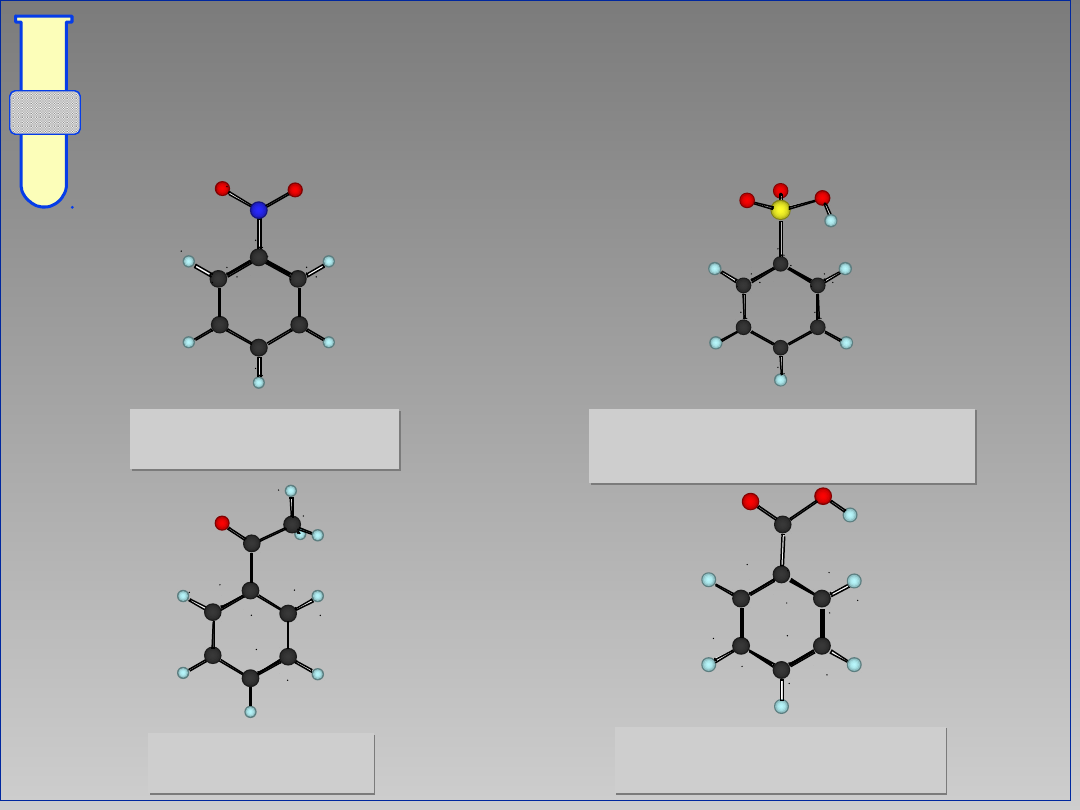
30
RJC
Podstawniki Kierujące w Pozycję
Podstawniki Kierujące w Pozycję
meta; Podstawniki
meta; Podstawniki
Dezaktywujące
Dezaktywujące
nitrobenzen
nitrobenzen
kwas benzenosulfonowy
kwas benzenosulfonowy
kwas benzoesowy
kwas benzoesowy
acetofenon
acetofenon
31
RJC
Podstawnik (G)
Orto Meta Para
Dystrybucja Produktów
Dystrybucja Produktów
Nitrowania
Nitrowania
NO
2
7
91
2
CO
2
H
22
77
1
CN
17
81
2
COCH
3
26
72
3
CHO
19
72
9
G
H
NO
3
/H
2
SO
4
G
G
G
NO
2
NO
2
NO
2
32
RJC
Atomy Fluorowców : Przypadek
Atomy Fluorowców : Przypadek
Szczególny
Szczególny
...atomy X (F, Cl, Br, I), które są
...atomy X (F, Cl, Br, I), które są
elektrono-akceptorowe i dezaktywujące,
elektrono-akceptorowe i dezaktywujące,
kierują nowe grupy w pozycje orto &
kierują nowe grupy w pozycje orto &
para. W tym przypadku konkurują dwa,
para. W tym przypadku konkurują dwa,
przeciwstawne efekty;
przeciwstawne efekty;
dodatni efekt rezonansowy
ujemny efekt indukcyjny
33
RJC
(+) Efekt Rezonansowy
(+) Efekt Rezonansowy
(wpływ kierujący orto & para)
(wpływ kierujący orto & para)
...powoduje on korzystne ulokowanie
...powoduje on korzystne ulokowanie
(wzrost) gęstości elektronowej w
(wzrost) gęstości elektronowej w
pozycjach orto & para.
pozycjach orto & para.
Cl
+
-
-
-
E
E
E
••
••
•
•
•
•
•
•
•
•
34
RJC
(-) Efekt Indukcyjny
(-) Efekt Indukcyjny
(dezaktywujący)
(dezaktywujący)
Duża elektroujemność atomów typu X
Duża elektroujemność atomów typu X
(F, Cl, Br, I) powoduje sumarycznie
(F, Cl, Br, I) powoduje sumarycznie
obniżenie gęstości elektronowej w
obniżenie gęstości elektronowej w
pierścieniu aromatycznym.
pierścieniu aromatycznym.
+
-
Cl
35
RJC
Dystrybucja Produktów
Dystrybucja Produktów
Nitrowania
Nitrowania
Podstawnik (G)
Orto Meta
Para
F
13
1
86
Cl
35
1
64
Br
43
1
56
I
45
1
54
G
G
G
NO
2
NO
2
NO
2
G
H
NO
3
/H
2
SO
4
36
RJC
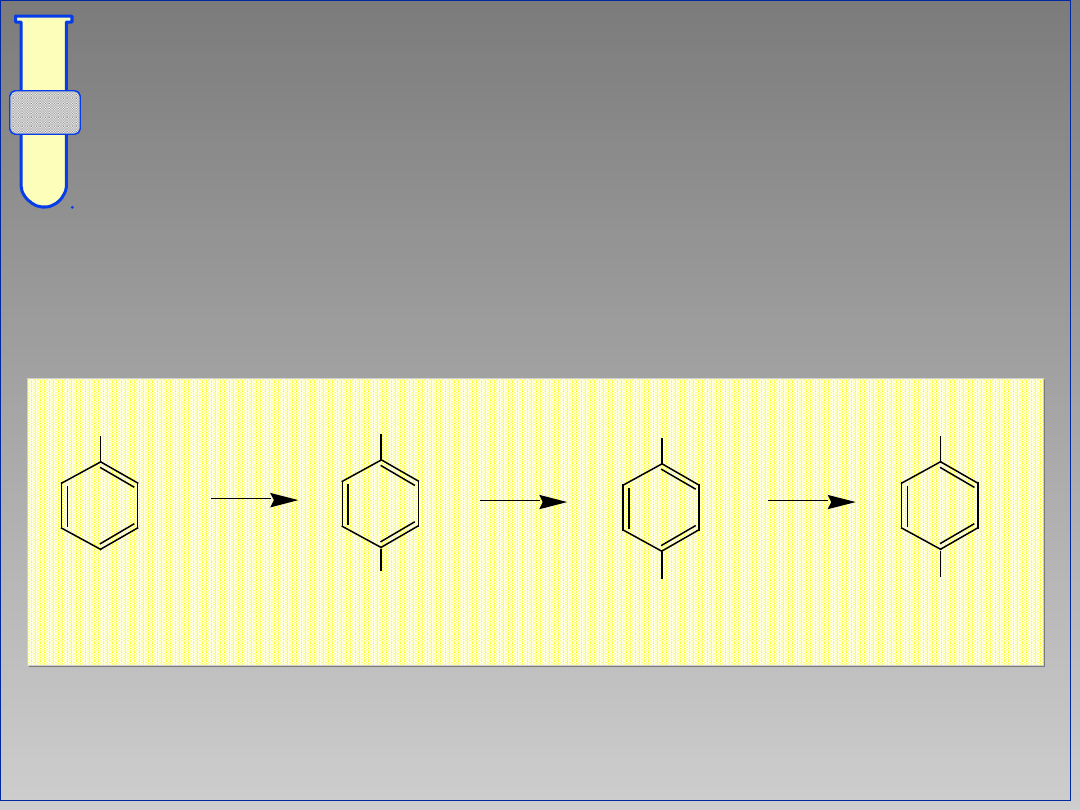
Planowanie Syntezy...Przykład # 1
Planowanie Syntezy...Przykład # 1
...odpowiedni dobór podstawników
...odpowiedni dobór podstawników
umożliwia kontrolę reaktywności oraz
umożliwia kontrolę reaktywności oraz
regiochemii reakcji podstawienia...
regiochemii reakcji podstawienia...
NH
2
NH
Ac
NH
Ac
NO
2
NH
2
NO
2
Ac
2
O
HNO
3
H
2
SO
4
H
2
SO
4
37
RJC
Planowanie Syntezy...Przykład #
Planowanie Syntezy...Przykład #
3
3
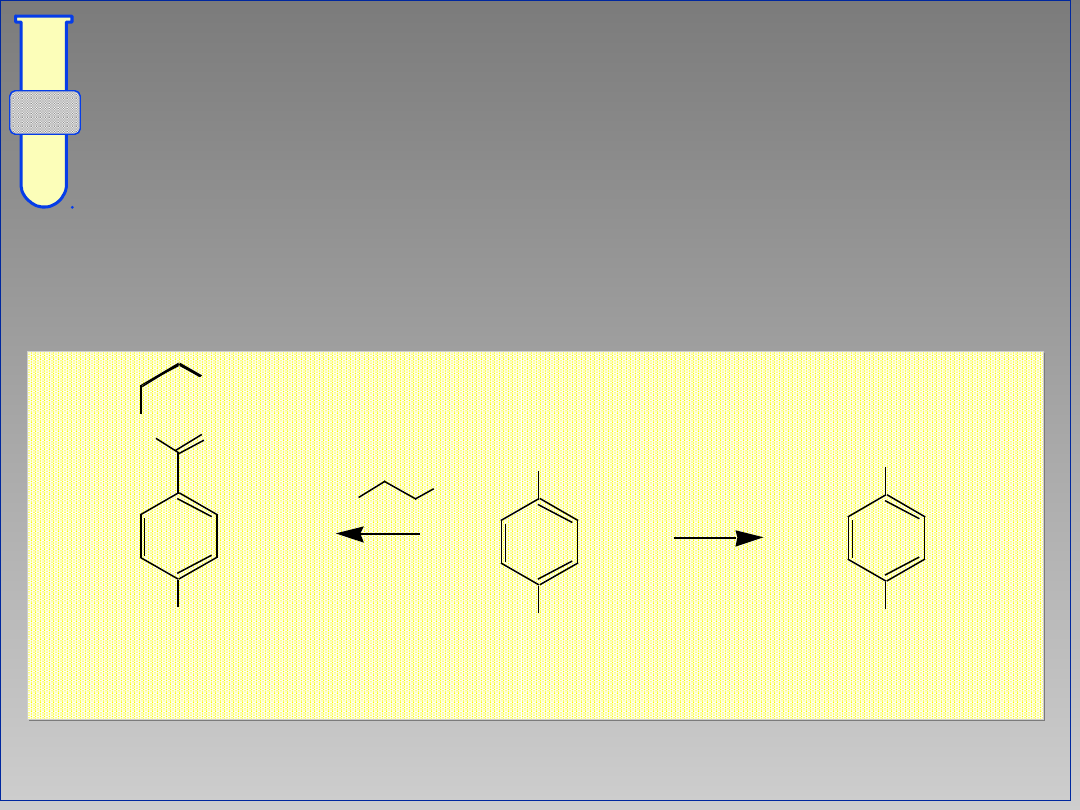
Synteza kwasu p-aminobenzoesowego
Synteza kwasu p-aminobenzoesowego
CH
3
CH
3
CO
2
H
NO
2
CO
2
H
NH
2
O
2
HNO
3
H
2
SO
4
Zn/HCl
NO
2
38
RJC
Planowanie Syntezy...Przykład #
Planowanie Syntezy...Przykład #
3
3
Synteza anastetyków (benzokaina &
Synteza anastetyków (benzokaina &
novokaina)
novokaina)
CO
2
H
NH
2
CO
2
Et
NH
2
NH
2
EtOH
benzokaina
N(Et)
2
OH
O
O
N(Et)
2
. HCl
HCl
novokaina
39
RJC
Planowanie Syntezy...Przykład #
Planowanie Syntezy...Przykład #
4
4
Synteza analgestyku (paracetamol)
Synteza analgestyku (paracetamol)
OH
OAc
OAc
NH
2
OAc
NH
Ac
1. Ac
2
O
2. HNO
3
/H
2
SO
4
Zn/HCl
NO
2
AcOH/H
2
O
40
RJC
Podsumowanie
Podsumowanie
Aromatyczna substytucja elektrofilowa
Stabilizacja rezonansowa
Elektrofilowe bromowanie, chlorowanie,
jodowanie, nitrowanie oraz sulfonowanie
Alkilowanie i acylowanie Friedla-Craftsa
Podstawniki elektrono-donorowe i
elektrono-akceptorowe
Wpływ kierujący o & p, podstawniki
aktywujące i dezaktywujące
Wpływ kierujący m, podstawniki
dezaktywujące
Planowanie syntezy organicznej
Aromatyczna substytucja elektrofilowa
Stabilizacja rezonansowa
Elektrofilowe bromowanie, chlorowanie,
jodowanie, nitrowanie oraz sulfonowanie
Alkilowanie i acylowanie Friedla-Craftsa
Podstawniki elektrono-donorowe i
elektrono-akceptorowe
Wpływ kierujący o & p, podstawniki
aktywujące i dezaktywujące
Wpływ kierujący m, podstawniki
dezaktywujące
Planowanie syntezy organicznej
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
Wyszukiwarka
Podobne podstrony:
reakcje aromatycznej substytucji elektrofilowej
Substytucja elektrofilowa w związkach aromatycznych(1), ++pomoc w nauce rózne przedmioty++
substytucja elektrofilowa, ochrona środowiska UJ, IV semestr, chemia ograniczna, sprawozdania
substytucja elektrofilowa
substytucja elektrofilowa 3
WYKLAD3.DOC, Mechanizm reakcji nitrowania. Nitrowanie jako elektrofilowa substytucja w pierścieniu a
kl 2, kartkowka-benzen, Benzen - C6H6 Wzór Elektronowy - 6¬¬C KL 1H K Węglowodory Aromatyc
Olejki a częstotliwość elektromagnetyczna, Aromaterapia
Napęd Elektryczny wykład
Inhibitory aromatazy w leczeniu uzupełniającym raka piersi
Podstawy elektroniki i miernictwa2
elektryczna implementacja systemu binarnego
urządzenia elektrotermiczn
Podstawy elektroniki i energoelektroniki prezentacja ppt
Elektryczne pojazdy trakcyjne
elektrofizjologia serca
więcej podobnych podstron